斜带石斑鱼种苗转饵模式研究
2016-12-20孙坤刚
周 晖,陈 刚,孙坤刚
( 1.广东海洋大学 水产学院,广东 湛江 524025;2.广东省普通高校南海水产经济动物增养殖重点实验室,广东 湛江 524025 )
斜带石斑鱼种苗转饵模式研究
周 晖1,2,陈 刚1,2,孙坤刚1
( 1.广东海洋大学 水产学院,广东 湛江 524025;2.广东省普通高校南海水产经济动物增养殖重点实验室,广东 湛江 524025 )
对36日龄平均体质量(0.21±0.01) g的斜带石斑鱼种苗的转饵模式进行研究。设计5种转饵模式:转饵1组前10 d投喂生物饵料,然后转投配合饲料;转饵2、转饵3和 转饵4组前10 d进行联合投喂(转饵2:25%配合饲料+75%生物饵料;转饵3:50%配合饲料 +50%生物饵料;转饵4:75%配合饲料 +25%生物饵料),然后转投配合饲料;转饵5组直接投喂配合饲料;转饵试验至种苗60日龄结束。试验结果表明,由于鱼体长度变异系数显著高于其他各组(P<0.05),转饵4组试验鱼死亡率最高,而其他各组之间差异不显著(P>0.05);试验结束时,转饵1组试验鱼体质量和质量增加率最低,显著低于其他各组(P<0.05),而转饵2组又显著低于转饵4和转饵5组(P<0.05);转饵1组种苗36—45日龄的特定生长率显著低于其他各组(P<0.05),而46—60日龄的特定生长率显著高于其他各组(P<0.05)。转饵试验结束后,各组种苗全鱼水分和粗蛋白含量差异不显著(P>0.05),转饵5组种苗全鱼粗脂肪含量显著低于其他各组(P<0.05)。综合比较各项指标,转饵3的模式种苗质量增加率较高而死亡率较低,是本研究中效果较好的转饵模式。
斜带石斑鱼;联合投喂;生物饵料;配合饲料
斜带石斑鱼(Epinpheluscoioides)是我国南方沿海养殖的主要名贵海水鱼之一,生长快、适应性强、肉质鲜美、营养丰富,深受消费者欢迎。虽然斜带石斑鱼人工繁育和苗种培育技术已有研究报道[1-4],但其种苗从开口至变态完成均需要使用生物饵料喂养,育苗成本较高。Person等[5]曾估算,在龄舌齿鲈(Dicenntrarchuslabrax)种苗培育的前3个月,生物饵料占育苗总成本的50%;而在种苗培育的前45 d,生物饵料占培育成本的79%。Rosenlund等[6]研究发现,由于生物饵料含水率约为90%,其营养含量较低;海水鱼种苗对生物饵料的摄食率会随其生长而逐渐降低,若未在适当时机进行转饵,则难以获得较高的生长率和存活率。与生物饵料相比,配合饲料具有性价比高、使用方便、营养均衡、成分可人为调控等优点[7],在海水鱼类育苗过程中往往会选择一个合适的时期投喂配合饲料来逐渐替代生物饵料,以降低育苗成本并减少生物饵料可能带来的病害风险。已有很多研究者对各种鱼类种苗的转饵模式开展了研究,并且在配合饲料的制备、使用和转饵模式等方面取得了一定的进展,促进了这些鱼类育苗技术的进步[5-15],但有关斜带石斑鱼种苗转饵模式的研究尚未见报道。本试验通过5种模式对36日龄斜带石斑鱼种苗进行转饵,测定了各种转饵模式下试验鱼的死亡率、特定生长率、质量增加率、鱼体长度变异系数和鱼体成分等指标,分析了各种转饵模式的优缺点。
1 材料与方法
1.1 斜带石斑鱼种苗和饵料
斜带石斑鱼种苗在室外水泥池中培育,3-10日龄投喂室外水泥池培养的轮虫,11-16日龄投喂室外水泥池培养的桡足类幼体,17-33日龄投喂人工孵化后以强化剂强化4 h或12 h的卤虫无节幼体,投喂至饱食。育苗池水温27~29 ℃,盐度29~31,pH 8.0~8.4,溶氧>6 mg/L。种苗培育至33日龄开始进行分苗处理,筛选规格一致的种苗移至试验水槽中暂养2 d,36日龄试验种苗平均全长(2.23±0.04) cm,体长(1.72±0.04) cm,湿质量(0.21±0.01) g。
生物饵料:经海帅虾片(湛江市海神生物科技发展有限公司)强化10 d以上的鲜活大卤虫(Artemiasp.),体长0.9~1.2 mm。
配合饲料:日清海水鱼配合饲料(日清丸红饲料株式会社-知多工场)。36—45日龄投喂C1(0.6~0.9 mm),46—52日龄投喂S1(1.0 mm),53—60日龄投喂S2(1.4 mm)。
1.2 转饵试验
转饵试验在流水式养殖系统中进行,养殖试验过程均采用饱食投喂,转饵方式参考文献[15],转饵1组种苗在前10 d投喂生物饵料,46日龄后投喂配合饲料;转饵2组~转饵4组种苗在前10 d进行联合投喂(转饵2:25%配合饲料+75%生物饵料;转饵3:50%配合饲料+50%生物饵料;转饵4:75%配合饲料+25%生物饵料),46日龄后投喂配合饲料;转饵5组种苗自33日龄起直接投喂配合饲料,转饵试验至种苗60日龄结束。每个转饵组有3个70 cm×60 cm×50 cm水族箱,每箱试验开始时投放种苗200尾。每日上午和下午投饵后及时清污,发现死鱼及时清理。流水式养殖系统配有专门的蓄水池,天然海水经双层沙滤和过滤袋过滤后进入蓄水池。试验期间每个水族箱的水量约150 L,日交换量为100%~120%。每桶放2个气石,每日持续充气,自然光照。试验期间水温28~30 ℃,盐度29~31,pH 7.9~8.2,溶解氧>6 mg/L。
1.3 采样与分析
试验开始时随机取10尾种苗,取其均值作为初始体质量。45日龄和60日龄各采样一次,每箱随机取10尾鱼测定体质量。饵料和鱼体常规生化分析样品均在105 ℃烘干至恒定质量,粗蛋白采用Foss kjeltecTM定氮仪测定,粗脂肪采用索氏提取法测定[16]。生物饵料和配合饲料脂肪酸分析参考文献[17]的方法。
1.4 参数计算
死亡率/% =Nd/Ni×100%
特定生长率/%·d-1=(lnmt-lnm0)/t×100%
质量增加率/%=(mt-m0)/m0×100%
鱼体长度变异系数按Folkvord[18]的方法计算:
变异系数/% =L/mt×100%
式中,Ni:试验鱼初始数量(尾),Nd:试验鱼死亡数量(尾),m0:初始鱼体平均质量(g),mt:试验t日后鱼体平均质量(g),t:试验天数(d),L:试验结束时平均鱼体长(cm)。
1.5 数据统计分析
试验结果用SPSS 17.0 进行单因素方差分析及Duncan多重比较,以P<0.05为显著差异。
2 结果与分析
2.1 生物饵料和配合饲料粗蛋白和粗脂肪含量比较
配合饲料的粗蛋白和粗脂肪含量均显著高于生物饵料(P<0.05)(表1)。

表1 生物饵料与配合饲料粗蛋白、粗脂肪含量比较(干质量)
注:表中数据为5次测量结果的平均值±标准差,同一行数据上标有相同字母表示差异不显著(P>0.05),上标无相同字母则表示差异显著(P<0.05).表2同.
配合饲料的饱和脂肪酸、ω-3多不饱和脂肪酸、二十碳五烯酸、二十二碳六烯酸含量显著高于生物饵料(P<0.05),单不饱和脂肪酸和ω-6多不饱和脂肪酸含量显著低于生物饵料(P<0.05),多不饱和脂肪酸含量则无显著差异(P>0.05)(表2)。
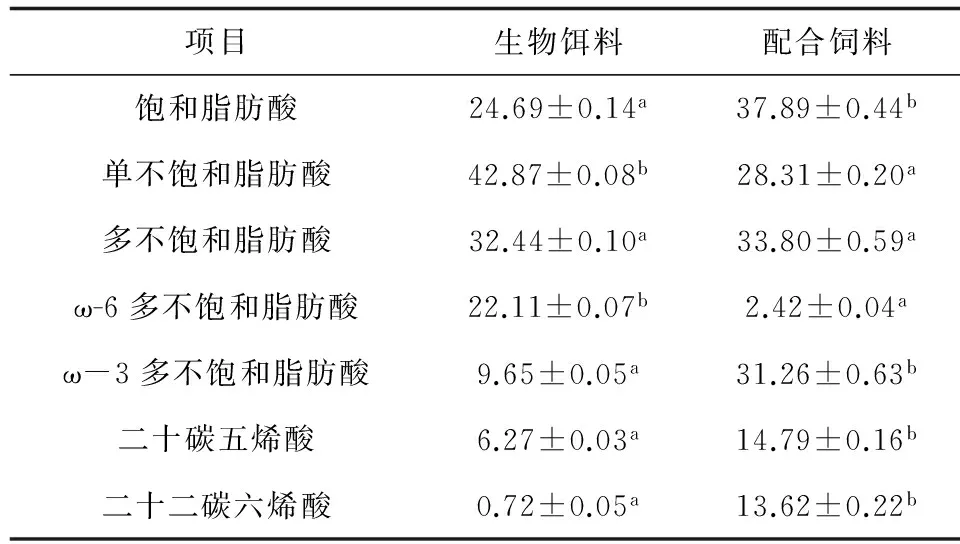
表2 鲜活大卤虫与日清配合饲料脂肪酸组成比较 %
2.2 不同转饵组种苗生长情况
试验结束时,转饵4组种苗变异系数显著大于其他各组(P<0.05),其他各组变异系数差异不显著(P>0.05)(表3)。转饵4组死亡率亦显著大于转饵1组和转饵5组(P<0.05),而其他各组死亡率差异不显著(P>0.05)。36—45日龄转饵1组种苗特定生长率显著小于其他各组(P<0.05),其他各组差异不显著(P>0.05); 46—60日龄转饵1组种苗特定生长率显著大于其他各组(P<0.05),其他各组差异不显著(P>0.05)。试验结束时,转饵1组种苗体质量和质量增加率最低,显著低于其他各组(P<0.05),而转饵2组又显著低于转饵4组和转饵5组(P<0.05)。
2.3 不同转饵模式对种苗体成分的影响
各转饵组种苗水分和粗蛋白含量差异不显著(P>0.05),转饵5组种苗粗脂肪含显著低于其他转饵组(P<0.05)(表4)。

表3 不同转饵模式组种苗生长情况
注:表中数据为3个平行组测定结果的平均值±标准差,同一行数据上标有相同字母表示差异不显著(P>0.05),上标无相同字母则表示差异显著(P<0.05).表4同.

表4 不同转饵模式对60日龄种苗体成分的影响 %
3 讨论
3.1 转饵模式对种苗特定生长率的影响
在5个转饵组中,转饵1组种苗死亡率最低,但60日龄时种苗的体质量亦最小,这可能是由于生物饵料存在营养缺陷,无法满足种苗生长需要。由表2可见,生物饵料ω-3多不饱和脂肪酸、二十二碳六烯酸和二十碳五烯酸含量显著低于配合饲料,而ω-3多不饱和脂肪酸是海水种苗的必需脂肪酸,其中以二十二碳六烯酸和二十碳五烯酸尤为重要[19],因此转饵1组种苗在36—45日龄的特定生长率显著低于投喂配合饲料的其他各组。在转投配合饲料之后,转饵1组种苗的特定生长率显著高于其他转饵组,这主要是由于转饵1组种苗在46日龄时的体质量最小,因此特定生长率相对较高。
3.2 转饵模式对种苗死亡率的影响
肉食性鱼类常会发生相互残食[20],尤其是在其种苗阶段[21]。试验中笔者观察到较大斜带石斑鱼种苗会用嘴咬住其他较小个体的头部并来回甩动,这种攻击性行为常出现在每天第一次投饵前,与黑线鳕(Melanogrammusaeglefinus)[22]相互残食行为相似。Hseu等[23]研究发现,个体大小差异超过30%时,斜带石斑鱼种苗就可能相互残食,因此鱼体长度变异系数[18]可作为海水鱼种苗发生相互残食的一个重要指标。试验中转饵4组的种苗变异系数显著大于其他各组,导致组内相互残食增加,使该组种苗存活率显著低于其他各组。
3.3 斜带石斑鱼种苗不经过渡直接转饵的可行性
对于36日龄种苗不经过渡直接进行配合饲料转饵,观察到种苗在前2 d的摄食较少,这可能是因为石斑鱼喜食运动的食物,而配合饲料下沉速度相对较快,导致种苗在刚接触时未能及时摄食[24]。自第3 d开始,种苗的摄食量逐渐增加,至第5 d,已经能迅速摄食刚投入的配合饲料。诸多学者认为,由于仔鱼的消化器官尚未发育完善,消化酶分泌不足,导致其无法很好地消化和利用配合饲料[6,8,10,25],因此只要消化器官发育完善,对变态期或变态后种苗(0.5~0.75 g)直接进行转饵亦可获得成功[5,26-27]。Segner等[27]研究发现,与幼鱼相比,仔鱼是由于没有胃而无法有效地消化、吸收配合饲料;而Hart等[28]对未进入变态期,但胃已完全分化的23日龄绿背鲽(Rhombosoleatapirina)进行转饵,获得了82.2%的成活率;因此Hart等[28]认为种苗转饵的恰当时机应为胃完全分化时。吴金英等[29]对斜带石斑鱼种苗消化系统发育的观察发现,4日龄仔鱼消化系统已明显分化成食道、胃和直肠等,而45—60日龄幼鱼的胃已经很发达。笔者在试验开始前曾采集36日龄斜带石斑鱼种苗消化道进行消化酶类检测,发现此时种苗已经具有较高的消化酶活力,因此本试验设计的直接转饵从36日龄开始投喂配合饲料。试验结果也显示,36日龄斜带石斑鱼种苗从摄食生物饵料直接转为摄食配合饲料,对其生长和存活未产生显著影响。
3.4 转饵模式对种苗体成分的影响
转饵5组60日龄种苗粗脂肪含量显著低于其他转饵组,这可能与转饵过程中鱼体吸收的脂肪酸种类有关,摄食过两种饲料(生物饵料和配合饲料)的种苗脂肪酸种类比较全面,而转饵5组种苗仅吸收配合饲料中的脂肪酸,所以试验鱼体粗脂肪含量较低。Kolkovski等[30]的研究也表明,欧洲舌齿鲈 (D.labrax)仔鱼在同时摄食配合饲料和丰年虫无节幼体时鱼体粗脂肪含量较高。
3.5 转饵模式优缺点比较
本研究所采取的5种转饵模式均能成功实现斜带石斑种苗的转饵,5种模式各有优缺点。转饵1模式种苗死亡率最低,但种苗的质量增加率也最低;转饵5模式种苗死亡率较低,种苗的质量增加率较高,但试验鱼粗脂肪含量显著低于其他投喂组;转饵4模式种苗的质量增加率最高,但种苗死亡率也最高;综合比较各项指标,转饵3模式的种苗质量增加率较高而种苗死亡率较低,是本研究中总体效果较好的转饵模式。
[1] 周仁杰,林涛.斜带石斑鱼人工育苗技术试验[J].台湾海峡,2002,21(1):57-62.
[2] 王云新,黄国光,刘付永忠,等.斜带石斑鱼人工育苗试验[J].渔业现代化,2003,30(6):14-15.
[3] 史海东,辛俭,毛国民,等.斜带石斑鱼人工育苗技术的初步研究[J].浙江海洋学院学报:自然科学版,2004,23(1):19-23.
[4] 张海发.斜带石斑鱼早期生活史及种苗繁育技术研究[D].广州:中山大学,2005.
[5] Jeannine P L R, Jean C A,Laurence T,et al.Marine fish larvae feeding:formulated diets or live prey [J].Journal of the World Aquaculture Society,1993,24(2):211-224.
[6] Rosenlund G,Stoss J,Talbot C.Co-feeding marine fish larvae with inert and live diets [J].Aquaculture,1997,155(1/4):183-191.
[7] Engrola S,Figueira L,Conceição L E C,et al.Co-feeding in Senegalese sole larvae with inert diet from mouth opening promotes growth at weaning [J].Aquaculture,2009,288(3/4):264-272.
[8] Cahu C L,Zambonino Infante J L.Substitution of live food by formulated diets in marine fish larvae [J].Aquaculture,2001,200(1/2):161-180.
[9] Alves T T,Cerqueira V R,Brown J A.Early weaning of fat snook (CentropomusparallelusPoey 1864) larvae [J].Aquaculture,2006,253(1/4):334-342.
[10] Kolkovski S.Digestive enzymes in fish larvae and juveniles-implications and applications to formulated diets [J].Aquaculture,2001,200(1/2):181-201.
[11] Barnabé G,Guissi A.Adaptations of the feeding behaviour of larvae of the sea bass,Dicentrarchuslabrax(L.),to an alternating live-food/compound-food feeding regime [J].Aquaculture Research,1994,25(5):537-546.
[12] Curnow J,King J,Bosmans J,et al.The effect of reducedArtemiaand rotifer use facilitated by a new microdiet in the rearing of barramundiLatescalcarifer(BLOCH) larvae [J].Aquaculture,2006,257(1/4):204-213.
[13] Nhu V C,Dierckens K,Nguyen H T,et al.Effect of early co-feeding and different weaning diets on the performance of cobia (Rachycentroncanadum) larvae and juveniles [J].Aquaculture,2010,305(1):52-58.
[14] Bonaldo A,Parma L,Badiani A,et al.Very early weaning of common sole (SoleasoleaL.) larvae by means of different feeding regimes and three commercial microdiets:influence on performances,metamorphosis development and tank hygiene [J].Aquaculture, 2011,321 (3/4):237-244.
[15] 赵金柱,艾庆辉,麦康森,等.微粒饲料替代生物饵料对大黄鱼稚鱼生长,存活和消化酶活力的影响 [J].水产学报,2008,32(1):91-97.
[16] 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2002:49-59.
[17] 胡述楫,胡人卫.尼罗罗非鱼鱼脂中脂肪酸的鉴定与评价[J].西南农业学报,1997,10(1):115-118.
[18] Folkvord A,Otterå H.Effects of initial size distribution,day length,and feeding frequency on growth,survival,and cannibalism in juvenile Atlantic cod (GadusmorhuL.) [J].Aquaculture,1993,114(3):243-260.
[19] Watanabe T,Izquierdo M S,Takeuchi T,et al.Comparison between eicosapentaenoic and docosahexaenoic acids in terms of essential fatty acid efficacy in larval red seabream [J].Nippon Suisan Gakkaishi,1989,55(9):1635-1640.
[20] Smith C,Reay P.Cannibalism in teleost fish [J].Reviews in Fish Biology and Fisheries,1991,1(1):41-64.
[21] Hecht T,Pienaar A G.A review of cannibalism and its implications in fish larviculture [J].Journal of the World Aquaculture Society,1993,24(2):246-261.
[22] Hamlin H,Kling L.The culture and early weaning of larval haddock (Melanogrammusaeglefinus) using a microparticulate diet [J].Aquaculture,2001,201(1/2):61-72.
[23] Hseu J R,Chang H F,Ting Y Y.Morphometric prediction of cannibalism in larviculture of orange-spotted grouper,Epinepheluscoioides[J].Aquaculture,2003,218(1/4):203-207.
[25] Lee G W Y,Litvak M K.Weaning of metamorphosed winter flounder (Pleuronectesamericanus) reared in the laboratory:comparison of two commercial artificial diets on growth,survival and conversion efficiency [J].Aquaculture,1996,144(1/3):251-263.
[26] Daniels H V,Hodson R G.Weaning success of southern flounder juveniles:effect of change over period and diet type on growth and survival [J].North American Journal of Aquaculture,1999,61(1):47-50.
[27] Segner H,Roesch R,Verreth J,et al.Larval nutritional physiology:studies with Ckzrius gariepinus,CoregonuslauaretusandScophthalmusmaximus[J].J World Aquaculture Society,1993,24(2):121-134.
[28] Hart P R, Purser G J.Weaning of hatchery-reared greenback flounder (RhombosoleatapirinaGünther) from live to artificial diets:effects of age and duration of the change over period [J].Aquaculture,1996,145(1/4):171-181.
[29] 吴金英,林浩然.斜带石斑鱼消化系统胚后发育的组织学研究 [J].水产学报,2003,27(1):7-12.
[30] Kolkovski S,Tandler A,Izquierdo M S.Effects of live food and dietary digestive enzymes on the efficiency of microdiets for seabass (Dicentrarchuslabrax) larvae [J].Aquaculture,1997,148(4):313-322.
WeaningofOrange-spottedGrouper(Epinepheluscoioides)LarvaebyMeansofDifferentFeedingRegimes
ZHOU Hui1,2,CHEN Gang1,2,SUN Kungang1
( 1.College of Fisheries,Guangdong Ocean University,Zhanjiang 524025,China; 2.Guangdong Provincial Key Lab of Pathogenic Biology and Epidemiology for Aquatic Animals,Zhanjiang 524025,China )
The suitable feeding regime was studied for weaning of orange-spotted grouper (Epinepheluscoioides) larvae 36 days after hatch (DAH) with average body weight of (0.21±0.01) g.The larvae were fed by five feeding regimes as following:in regime R1,the larvae fed live food (LP) in the first ten days,and then weaned onto inert diet (ID); in regimes R2,R3 and R4,the larvae fed the mixed diet in the first ten days (R2:25% ID +75% LP; R3:50% ID +50% LP; R4:75% ID +25% LP),and then weaned onto ID; in regime R5,the larvae fed ID in 36 DAH (at the end of the weaning experiment).The results showed that there was the maximal mortality (DR) in the larvae in regime R4 due to significantly higher coefficient of variance (CV) of body length (P<0.05),significantly higher than those in other regimes (P<0.05),and there were no significant differences in CV and DR among other regimes (P>0.05).The minimal final body weight and weight gain rate (WGR) were observed in the larvae in regime R1 at the end of the experiment,significantly lower than in other regimes (P<0.05),and significantly lower in regime R2 than regimes R4 and R5 (P<0.05).The larvae in regime R1 had significantly lower specific growth rate than the larvae in other regimes did during 36—45 DAH (P<0.05),and significantly higher than in other regimes during 46—60 DAH (P<0.05).After the experiment,there were no significant differences in moisture and crude protein content in the larvae among all feeding regimes (P>0.05). However,the larvae in regime R5 had significantly lower crude lipid content than the larvae in other regimes did (P<0.05).It is concluded that feeding regime R3 is the optimal feeding regime for the larvae which showed higher WGR and lower DR.
Epinepheluscoioides;co-feeding;live prey;formulated feed
10.16378/j.cnki.1003-1111.2016.02.010
S965.334
A
1003-1111(2016)02-0152-05
2015-07-31;
2015-10-08.
国家海洋局海洋公益性行业科研专项项目(201205028);广东省科技厅省部产学研结合项目(2013B090700010);广东省海洋经济创新发展区域示范专项经费(GD2012-A02-003).
周晖(1978-),男,博士;研究方向:鱼类生理生态学.E-mail:346005548@qq.com.通讯作者:陈刚(1961-),男,教授,博士生导师;研究方向:水产经济动物生物学及种苗工程.E-mail:cheng@gdou.edu.cn.
