间接酶联免疫吸附法测定大鲵凝集素
2016-12-20王晓龙佟长青
王晓龙, 佟长青, 李 伟
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
Note: * stands for significant difference at 0.05 level between body and head,tail.Sample quality is 20 g.
间接酶联免疫吸附法测定大鲵凝集素
王晓龙, 佟长青, 李 伟*
(大连海洋大学食品科学与工程学院,辽宁大连 116023)
[目的]建立基于大鲵凝集素多克隆抗体酶联免疫定量分析的方法。[方法]以大鲵凝集素为抗原,免疫新西兰白兔获得多克隆抗体,建立间接非竞争酶联免疫检测方法,并对该方法的精密度及准确度进行了测试。[结果]获得的抗血清效价为1∶16 000,多克隆抗体血清的最佳稀释度为1∶3 000,辣根过氧化物酶(HRP)标记的羊抗兔二抗最佳稀释度为1∶30 000,抗原浓度在31.25~1 000.00 ng/mL范围内呈良好的线性关系,相关系数R2>0.99,板内及板间变异系数范围分别为2.50%~9.88%和2.69%~11.59%,回收率为91.5%~109.5%。分布结果显示,大鲵凝集素在躯干部肌肉组织中的含量较高。[结论]成功建立了大鲵凝集素间接非竞争酶联免疫检测方法,该方法灵敏度高,重复性好,可用于实际检测大鲵肌肉组织中的凝集素含量。
大鲵;凝集素;酶联免疫;多克隆抗体
大鲵(Andriasdavidianus)俗称“娃娃鱼”,属两栖纲有尾目隐鳃鲵科,是世界上现存最大的两栖动物,也是国家二级保护动物,主要分布于我国的长江、黄河、珠江中上游支流的山涧溪流[1]。经人工养殖的子二代大鲵在医药保健、美食及观赏等方面都具有非常高的开发应用前景[2]。经过30余年的发展,我国大鲵养殖已积累了一定的经验,但对于大鲵病害的发生及大鲵自身免疫系统的研究相对滞后[3]。大鲵在生长过程中出现腹胀、腐皮病、烂尾病和皮肤溃烂等与自身免疫功能下降相关的疾病给大鲵养殖业带来了巨大的经济损失[4-6]。因此,对于大鲵免疫系统中免疫因子的表达水平与大鲵健康状况的研究显得尤为重要。
凝集素作为天然免疫因子中重要的一环,在生物体微生物感染、病原识别、调理、吞噬,机体防御等方面具有极为重要的作用[7-9],其含量与生物体自身的健康状态密切相关。生物体受到外来致病微生物的入侵时,机体启动免疫应答,第1步是病原与宿主免疫因子间的识别,脊椎动物的凝集素途径是补体激活途径中重要的一部分[10]。已有研究表明,生物体在大量细菌感染后的急性应答期,巨噬细胞经诱导产生IL-6,进而促使肝细胞合成包括甘露糖结合凝集素(MBL),此时血清中MBL含量明显增加,因此MBL在血清中含量的高低将直接影响生物体免疫防御功能的发挥,可以作为衡量生物体健康状况的一个有效指标[11]。因此,笔者利用大鲵凝集素(ADL)免疫新西兰白兔,制备大鲵凝集素蛋白多克隆抗血清,建立大鲵凝集素间接ELISA检测方法,证实该ELISA方法的可行性,并对大鲵样本中的头部、躯干和尾部肌肉组织中的ADL含量进行测定,了解其在大鲵体内3个不同部位表达的情况,为后续进一步研究ADL的表达水平与大鲵患病状况之间的关系奠定基础。
1 材料与方法
1.1 材料 大鲵凝集素ADL参照Qu等[12]的方法制备。主要试剂:弗氏完全佐剂及弗式不完全佐剂,Sigma;牛血清白蛋白及卵清蛋白,Solarbio;BCA法蛋白定量试剂盒,青岛捷世康生物科技有限公司;封闭液和TMB显色液,北京梅科万德生物科技有限公司;辣根过氧化物酶标记的羊抗兔二抗,北京康成生物工程公司。包被液:0.05 mol/L、pH 9.6的碳酸钠-碳酸氢钠缓冲液;稀释液:0.01 mol/L磷酸盐缓冲液;洗涤液:含0.05%吐温-20的磷酸盐缓冲液;终止液:2 mol/L的H2SO4溶液。
1.2 方法
1.2.1 兔多克隆血清的制备。该试验以雄性新西兰大白兔为免疫对象,月龄3个月,体重1.5 kg,购于大连医科大学动物实验中心。免疫前于耳缘静脉采血制备免疫前血清,即阴性血清。取0.5 mg大鲵凝集素溶于0.5 mL生理盐水,加入等体积弗氏完全佐剂后充分混合,制成0.5 mg/mL的抗原乳化液,待乳化完全后于兔颈背部皮下多点注射,此后将弗氏完全佐剂更换为弗氏不完全佐剂,以同样剂量及免疫方式每14 d免疫1次,共免疫4次,末次免疫后7 d大量采血,采集到的血液于4 ℃冰箱中过夜,3 000 r/min离心15 min,取上清,分装后于-20 ℃保存备用[13]。
1.2.2 凝集素ADL多克隆抗体效价测定。用包被液将凝集素ADL按100 μL/孔,4 ℃过夜包被酶标板;包被结束后洗涤液洗板3次,200 μL/孔;加入封闭液封闭酶标板,200 μl/孔,37 ℃封闭1 h;封闭结束后洗涤液洗板3次,将兔多克隆血清从1∶100倍开始倍比稀释,100 μL/孔,37 ℃反应1 h,同时做阴性对照;反应结束后重复洗板3次,加入1∶20 000倍稀释的HRP标记的羊抗兔二抗,37 ℃反应1 h;反应结束后加入TMB显色液,100 μL/孔,37 ℃避光反应20 min;最后按50 μL/孔加入终止液,在波长450 nm下使用酶标仪读取吸光度。以阳性血清/阴性对照(P/N)≤2.1,且OD450≥0.1,此时的抗体稀释倍数即是该抗血清的效价。
1.2.3 方阵法测定抗原抗体的最适稀释度。为了获得最佳的测定条件及节约试剂用量,该试验采用方阵法对ADL的包被量及血清多抗稀释倍数进行优化,横列将凝集素抗原溶液用包被液从1∶1 600到1∶51 200倍比稀释,稀释成6个不同浓度的稀释液,包被酶标板;纵列将血清多抗按照1∶400倍到1∶12 800倍倍比稀释,二抗用稀释液按1∶30 000倍稀释,进行间接非竞争酶联免疫检测,
1.2.4 间接非竞争酶联免疫程序。在酶标板内包被ADL,100 μL/孔加入96孔酶标板,4 ℃包被过夜;包被结束后倒去包被液,洗涤液洗板3次,200 μL/孔;加入封闭液封闭酶标板,200 μL/孔,37 ℃封闭1 h;封闭结束后洗涤液洗板3次,加入1∶3 000倍稀释的抗血清,37 ℃反应1 h;反应结束后重复洗板3次,加入1∶30 000倍稀释的HRP标记的羊抗兔二抗,37 ℃反应1 h;反应结束后加入TMB显色液,100 μL/孔,37 ℃避光反应20 min;最后按50 μl/孔加入终止液,在波长450 nm下使用酶标仪读取OD值。
1.2.5 重复性试验。该试验以板内差异和板间差异来确定该方法的重复性。在线性范围内取7个浓度(1 000.000~15.625 ng/mL)的抗原溶液包被酶标板,每板设置6个反应孔,按步骤“1.2.2”进行ELISA测定,由OD450 nm值计算出OD平均值及标准差(SD),由公式CV%=(SD/OD平均值)×100%计算板内变异系数,用同样的方法在另外3块酶标板上重复试验,根据OD450 nm计算板间变异系数。
1.2.6 添加回收率测定。在PBS缓冲液中分别加入 1 000.00、500.00、250.00、125.00、62.50 μg/mL ADL,用PBS缓冲液适当稀释后每个样品取6个平行, ELISA法测定其回收量,计算回收率。
1.2.7 大鲵样本ADL测定。分别取9只大鲵,编号1~9,取大鲵头部、躯干、尾部肌肉组织,均质后取20 g加生理盐水100 mL,4 ℃下抽提过夜,抽提液9 000 r/min离心10 min,取上清液用于测定。取1 mL上清液稀释10倍后使用BCA蛋白定量试剂盒测定蛋白质浓度,根据标准曲线计算蛋白质质量;将上清液稀释1 000倍后取100 μL包被酶标板,进行ELISA测定,由标准曲线计算ADL浓度,最终得出样品中ADL的质量。每个样本重复测定3次,结果取平均值。
2 结果与分析
2.1 凝集素ADL多克隆抗体效价 以纯化好的凝集素为免疫原,0.5 mg/只颈背部皮下多点注射免疫新西兰兔,于末次免疫7 d后大量采血,获得抗血清。以ADL为包被抗原,采用间接ELISA法对抗血清效价进行检测,测得抗血清效价为1∶16 000。
2.2 抗原抗体最适稀释度 适当的血清稀释度能够降低血清中的干扰物质,增加方法的灵敏度,较高的抗原稀释倍数可以节约试剂。从表1中可以看出,在抗原稀释度为1∶6 400,抗血清稀释倍数为1∶3 200时,吸光度值为1.161,符合棋盘滴定法中吸光度值在1附近为宜的原则,因此可以确定为最佳的稀释度。
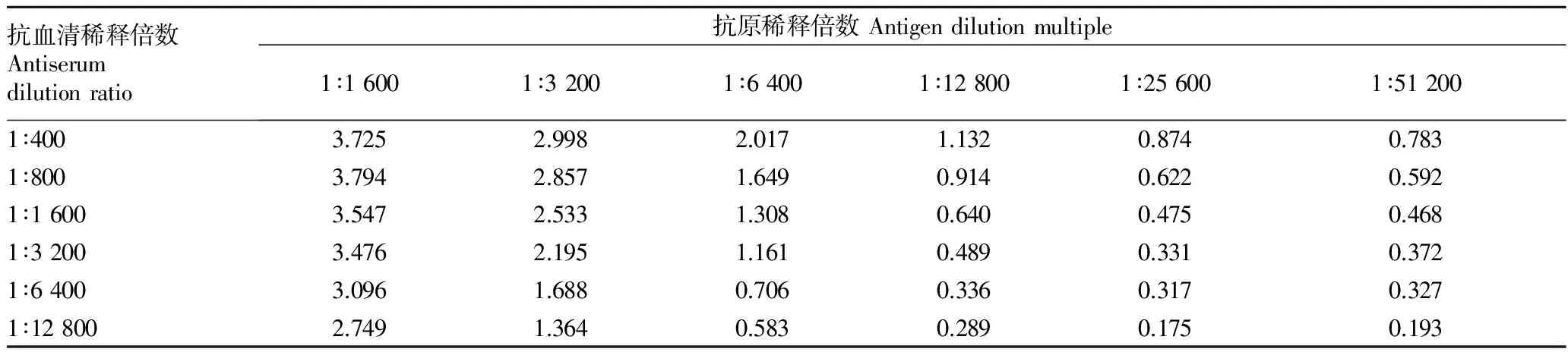
表1 大鲵凝集素ADL ELISA检测中抗血清与包被抗原的稀释度
2.3 间接ELISA标准曲线的建立 将配制的400 μg/mL ADL抗原溶液,从1∶400倍比稀释至1∶25 600,包被96孔酶标板,按步骤“1.2.2”的酶联免疫程序进行试验,以浓度的对数为横坐标,吸光度值OD450为纵坐标,得到间接非竞争酶联免疫测凝集素的标准曲线,结果见图1。由图1可见,在31.25~1 000.00 ng/mL蛋白浓度范围内,凝集素浓度的对数值和吸光度之间具有较好的线性关系。
2.4 重复性 从表2可以看出,该方法重复性较好,板内变异系数为0.92%~9.68%,板间变异系数为1.57%~12.35%,均小于15.00%,达到ELISA测定方法的质量控制要求。
2.5 回收率 由表3可见,在6次试验中,5个添加量的回收率误差均在15%的范围内,满足了ELISA方法的测定要求。

图1 间接非竞争ELISA的标准曲线Fig.1 Indirect non-competitive ELISA standard curve
2.6 大鲵样本测定结果 ELISA测定的结果显示(表4),大鲵凝集素在大鲵的头部、躯干及尾部的肌肉组织中均有分布,在躯干部的含量相对较高,不同大鲵之间相同部位的ADL含量分布范围较小。方法检测到ADL占抽提总蛋白的质量分数分别为头部(2.12±0.11)%,躯干(2.09±0.12)%,尾部(2.05±0.08)%,总体相差不大;9只大鲵不同身体部位中ADL质量分布范围分别为头部(19.51±0.81)~(22.86±0.84) mg,躯干(24.24±0.57)~(27.72±0.58) mg,尾部(17.33±1.30)~(19.86±0.51)mg(取不同部位样品质量均为20 g),含量为躯干>头部>尾部,头部和尾部中ADL含量不具有差异性(P>0.05),在躯干部的表达含量明显高于头部及尾部,具有显著性差异(P<0.05)。该结果可

表2 ELISA检测ADL含量板内及板间变异系数(n=6)
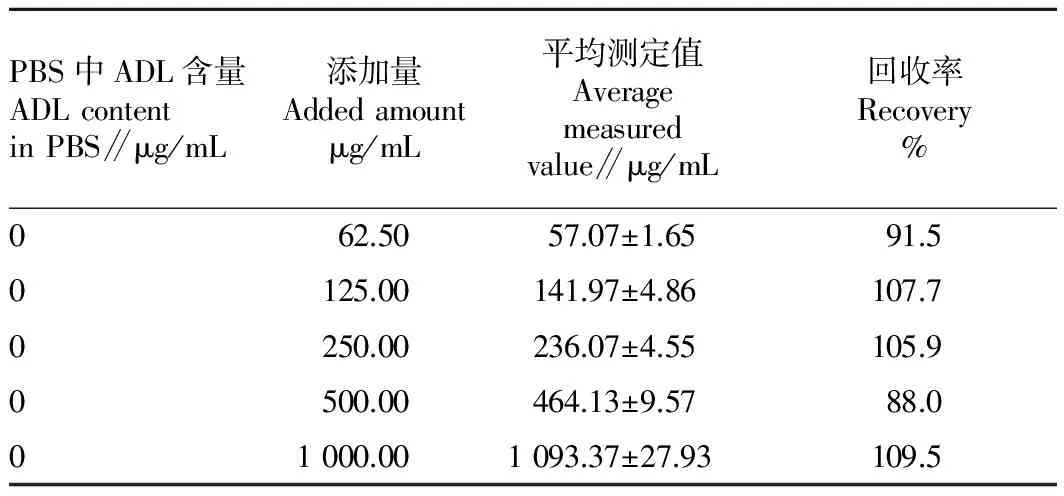
表3 回收率测定结果(n=6)
能是因为两栖动物躯干部占整体的比例较大,拥有更大的体表面积,且内部包含胸腺、骨髓、脾脏等其他主要免疫器官以及分布于相关组织器官的淋巴组织,因此在相近的肌肉组织中会有较高的含量。周旋等[14]在研究了两栖动物中的东北林蛙在受到彩虹病毒胁迫下,参与先天免疫的模式识别分子NF-κB和I-κB在其皮肤、肝脏和脾脏中的表达情况,结果表明东北林蛙的皮肤能够分泌出抑制微生物活性的物质,成为抵抗病原微生物入侵的第1层屏障,并在病毒刺激的后期,该模式识别分子NF-κB在皮肤和肝脏中的表达上调,表明在两栖动物的先天性免疫中,皮肤中的模式识别分子会在致病微生物感染的初期起到抵制作用,而在刺激的后期,脾脏则担负起了主要的免疫调控作用。凝集素同样作为先天性免疫中的一种重要模式识别受体,在机体生长发育的过程中可能也会起到相似的免疫调节作用。
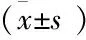
Table 4 The distribution of ADL in the head,trunk and tail ofAndriasdavidianus
mg
注:表中“*”表示躯干部与头部、尾部相比,在0.05水平差异显著,取样品质量均为20 g。
Note: * stands for significant difference at 0.05 level between body and head,tail.Sample quality is 20 g.
3 结论与讨论
目前,大鲵已经实现了人工养殖,且养殖规模也在逐年扩大,一些养殖企业对于大鲵在养殖过程中出现的病害问题,也只是采用改善机体营养和养殖条件的方式去应对,并未对大鲵自身免疫分子进行深入的研究,无法科学有效地避免大鲵非正常死亡,因此最终会造成经济损失。
凝集素作为一大类对特定多糖具有亲和力的多价糖蛋白,广泛分布于皮肤黏液、血液及组织器官中,在抵御致病微生物入侵的第1阶段即“自己”和“非己”识别阶段发挥重要作用。因此从大鲵自身免疫系统着手,对其中具有的免疫活性物质进行研究,开发基于酶联免疫反应的大鲵凝集素检测试剂盒,对于研究大鲵凝集素在其体内不同组织中的分布特征及表达水平与大鲵健康状况之间的关系,将具有一定的实际意义。该试验使用从大鲵体表黏液中分离纯化的大鲵凝集素(ADL)作为为完全抗原,免疫新西兰白兔,成功制备出高效价的多克隆抗体,确定了抗原抗体的最佳稀释倍数,建立了检测ADL含量的间接ELISA标准曲线,并对该方法的重复性及添加回收率作出评价,证实该方法的可行性,最后通过建立的ELISA检测方法对大鲵样本进行检测,确定其在生物体内不同部位的分布。在今后的研究中,人们可结合单克隆抗体制备及免疫组化技术,扩大检测样本的选取范围,如血液样本及更容易采集到的体表黏液等,确定健康大鲵中ADL的分布范围,对低于正常值下限的大鲵及时采用合理的治疗手段,降低大鲵的非正常原因死亡数量,减少养殖企业的经济损失。参考文献
[1] 李莉,王锡昌,刘源.中国养殖大鲵的食用、药用价值及其开发利用研究进展[J].食品工业科技,2012,33(9):454-458.
[2] 熊铧龙,姚俊杰,蒋左玉,等.贵州人工养殖子二代大鲵骨骼、肌肉中10种元素的测定[J].食品工业科技,2014,35(18):71-73,79.
[3] 杨星,刘文枝,肖汉兵,等.嗜水气单胞菌灭活疫苗免疫后大鲵外周血免疫指标的变化[J].中国水产科学,2014,21(3):621-628.
[3] 于喆,江辉,钟蕾,等.大鲵细菌性感染综合征的病原分离与药敏试验分析[J].湖南师范大学自然科学学报,2012,35(6):74-79.
[4] 高正勇,曾令兵,孟彦,等.患病大鲵中弗氏柠檬酸杆菌的分离与鉴定 [J].微生物学报,2012,52(2):169-176.
[5] 贺路,刘鉴毅.大鲵的病害及其防治[J].水利渔业,1999,19(1):31-32.
[6] 耿毅,汪开毓,李成伟,等.蛙病毒感染致养殖大鲵大规模死亡的电镜观察及PCR检测[J].中国兽医科学,2010,40(8):817-821.
[7] 王春玲,夏焱,张士娇,等.家蝇蛹甘露糖结合凝集素的结构及免疫调节作用[J].生物工程学报,2013,29(5):601-611.
[8] 陈政良.C型凝集素的免疫功能[J].细胞与分子免疫学杂志,1997,13(S2):34-37.
[9] 郑珍,薛壮,逄越,等.Galectins/intelectins凝集素家族——固有免疫中重要的模式识别分子[J].免疫学杂志,2014,30(1):75-78.
[10] 陈政良.补体激活第三途径——凝集素途径[J].国外医学(分子生物学分册),1999,21(5):295-298.
[11] 田群.甘露聚糖结合凝集素与疾病相关性研究进展[J].现代农业科技,2012(24):272,276.
[12] QU M,TONG C Q,KONG L,et al.Purification of a secreted lectin from Andrias davidianus skin and its antibacterial activity[J].Comparative biochemistry and physiology part C: Toxicology & Pharmacology,2015,167:140-146.
[13] 林清华.免疫学实验[M].武汉:武汉大学出版社,1999:254-260.
[14] 周旋,肖向红,张晶钰,等.虹彩病毒胁迫下东北林蛙NF-κB和I-κB的差异表达[J].东北林业大学学报,2013,41(10):108-111.
An Indirect Non-competitive Enzyme-linked Immunosorbent Assay for Determination ofAndriasdavidianusLectin
WANG Xiao-long,TONG Chang-qing,LI Wei*
(College of Food Science and Engineering,Dalian Ocean University,Dalian,Liaoning 116023)
[Objective] To prepare polyclonal antibody against the content of lectin in skin mucous ofAndriasdavidianusand develop an indirect non-competitive enzyme-linked immunosorbent assay (ELISA).[Method]Andriasdavidianuslectin was used as complete antigen.The New Zealand white rabbits were immunized according to the immunization procedure.Finally through the optimization of coating amount of lectin and antibody dilution,an indirect non-competitive enzyme-linked immunosorbent assay was developed.[Result] The titer of the antiserum determined by ELISA was up to 1∶16 000.Determined polyclonal antibody diluted was 1∶3 000.The best working dilution of horseradish peroxidase-conjugated affinipure goat anti rabbit IgG was 1∶30 000.The linear range of the method was 31.25-1 000.00 ng/mL (R2>0.99).The variation coefficients of intra-assay and inter-assay were 2.50%-9.88% and 2.69%-11.59%,respectively.Recoveries ranged from 91.5% to 109.5%.[Conclusion] A rapid,sensitive and repeatable indirect non-competitive ELISA detection method forAndriasdavidianuslectin allergens was established successfully.This method is suitable for qualitative determination ofAndriasdavidianuslectin.
Andriasdavidianus; Lectin; Enzyme-linked immunosorbent assay; Polyclonal antibody
国家自然基金项目(31571916);大连海洋大学引进人才及在职培养博士启动项目(100914262)。
王晓龙(1989- ),男,甘肃白银人,硕士研究生,研究方向:水产品加工与贮藏。*通讯作者,教授,博士,从事食品科学研究。
2016-09-30
S 966.6
A
0517-6611(2016)33-0074-03
