实验性兔根尖周炎模型的建立
2016-12-20李永峰李鹏博
雷 涛,李永峰,李鹏博
(1.西北民族大学 甘肃省口腔疾病研究重点实验室培育基地 西北民族大学口腔医学院,甘肃 兰州730030;2.西安长安医院口腔科,陕西西安710100)
实验性兔根尖周炎模型的建立
雷 涛1,李永峰2,李鹏博2
(1.西北民族大学 甘肃省口腔疾病研究重点实验室培育基地 西北民族大学口腔医学院,甘肃 兰州730030;2.西安长安医院口腔科,陕西西安710100)
目的:运用内毒素诱导实验性兔根尖周炎模型的建立,探讨建立实验性兔根尖周炎模型的方法.方法:选用6只新西兰大白兔,采用全麻后在其双侧上颌第一、第二磨牙及下颌第一磨牙咬合面开髓,置入内毒素脂多糖后,分别于术后1周、2周、3周各处死2只,制作组织学切片,经HE染色后观察并分析根尖周组织变化的过程.结果:1周后,实验性兔根尖周组织见较明显的炎症细胞浸润;2周后,炎症细胞浸润明显加重;3周后进入慢性炎症期.结论:将内毒素脂多糖封入实验性兔根管后,可成功建立根尖周炎模型,为根尖周病变的研究奠定了基础.
根尖周炎;兔;内毒素
根尖周炎是指发生在根尖周围组织的炎症性疾病,其致病机制是众多研究者关心的问题,常见的建模方法有:自然暴露法建模或变形链球菌建模等,运用不同方法建立根尖周炎的结果存在一定差异[1-5].本实验目的是运用内毒素诱导实验性兔根尖周炎模型的建立,探讨建立实验性兔根尖周炎模型的具体方法及遇到的问题,为深入研究其发病机理及根管治疗奠定基础.
1 材料与方法
1.1 实验动物
成年新西兰大白兔6只‘雄性,体重2.0~2.5kg(由兰州大学动物实验中心提供).
1.2 主要试剂和药物
1)内毒素脂多糖(LPS,Sigma公司,美国),用无菌生理盐水将LPS稀释至5mg/mL,过滤除菌后备用.
2)速眠新Ⅱ(吉林省华牧动物保健品有限公司).
3)氧化锌丁香油水门汀(上海医疗器械股份有限公司).
1.3 实验方法
1.3.1 手术方法
选6只成年新西兰大白兔,每只兔选用6颗牙齿作为实验牙,分别为双侧上颌第一磨牙、第二磨牙及下颌第一磨牙.用速眠新Ⅱ肌注给药(0.1mL/kg)麻醉实验兔,固定四肢后,75%酒精口周消毒,1%碘酊消毒术区.用12号球钻在兔磨牙咬合面开髓,暴露穿髓点,在露髓孔处放置饱蘸LPS液的棉球.随后氧化锌丁香油水门汀暂封,待动物清醒后送回实验室继续正常饲养.
1.3.2 组织学切片制作
分别于术后1周、2周、3周处死2只实验兔,立即切取上下颌骨,剔除软组织,置于40g/L甲醛溶液中固定,经脱钙、流动水冲洗、乙醇梯度脱水、二甲苯透明、石蜡浸泡及包埋,进行连续切片,经HE染色后在光镜下观察.
2 结果
标本切片经HE染色,在光镜下观察.术后1周,实验兔根尖周组织见炎症细胞浸润,其中以中性粒细胞和淋巴细胞为主,同时可见极少量巨噬细胞.术后2周,炎症细胞浸润明显加重,中性粒细胞、淋巴细胞、巨噬细胞多见,其中以中性粒细胞和巨噬细胞为主,并伴少量牙槽骨吸收,偶见小脓肿存在;术后3周,进入慢性炎症期,显示出炎症进入相对稳定期及修复阶段.
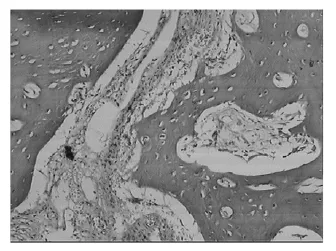
图1 标本切片术后1周(HE×100)图
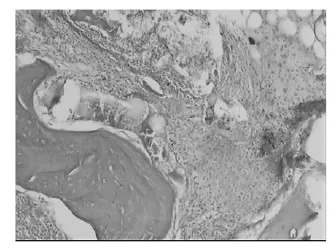
图2 标本切片术后2周(HE×100)图
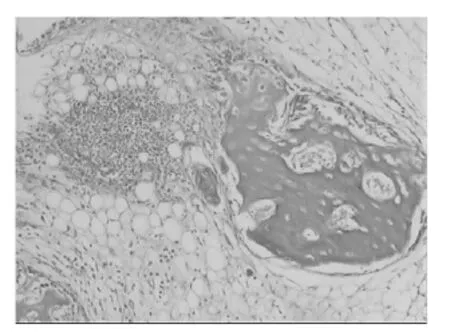
图3 标本切片术后3周(HE×100)图
3 讨论
慢性根尖周炎是口腔科临床中常见疾病之一,其致病机制是众多研究者关心的问题.近年来,国内外学者运用建立根尖周炎动物模型,研究其发病机制[6-9],评价根管治疗药物和根充材料的疗效.
在实验过程中发现,兔上下颌前牙呈大“C”型,髓腔较细,开髓时很容易侧穿,不适宜用作实验牙,而磨牙牙体较直且相对粗大,便于操作.出于经济及操作方面的便利问题,本实验采用新西兰大白兔作为研究对象.
细菌内毒素是革兰氏阴性菌细胞壁外膜上具有高度活性的大分子物质,其主要成分为LPS[10].Fouad[11]等发现:LPS可诱导局部体液免疫反应参与炎症形成.本实验在兔全麻妥后,磨牙咬合面开髓,封入LPS棉球感染牙髓,引起牙髓炎及根尖周炎症的发生.病理学结果显示:术后2周内,随时间的推移,病变持续加重,3周后,炎症进入相对稳定期及修复阶段.此结果与Graunaite、Lin[12-13]等学者的研究结果相似.
本实验采用此方法建立的根尖周炎模型,兔牙髓出现的炎症反应随时间推延炎症逐渐加重而造成根尖周组织的破坏,随后炎症进入相对稳定期及修复阶段.可以在短期内观察到根尖周炎病变从急性到慢性炎症的发展过程,是简单易行且周期较短的研究方法,可用于慢性根尖周炎病变的进一步研究,同时为临床治疗慢性根尖周炎提供参考.
[1]陈兴兴,谷苗,吕海鹏等.不同方法建立实验性狗根尖周炎模型的比较[J].口腔医学研究,2009,25(4):416-419.
[2]李晓杰,董明,袁璐等.大鼠实验性根尖周炎中TLR2表达的研究[J].中国微生态学杂志,2016,28(7):767-769.
[3]Cleaton-Jones P,Duggal M,Parak R,et al.Pulpitis induction in baboon primary tooth using using carious dentine or Streptococcus mutans.[J].See comment in PubMed Commons belowSAS SADJ,2004,Apr;59(3):119-122.
[4]张鹰,杨富生等.实验性犬乳牙根尖周炎组织病理学观察[J].牙体牙髓牙周病学杂志,2006,16(4):192-194.
[5]陈佳婧,吴补领,徐稳安等.小鼠下颌第一磨牙根尖周炎及牙髓血运重建模型的建立[J].牙体牙髓牙周病学杂志,2016,26(1):12-16.
[6]Grecca FS,MR,da Silva LA,et al.Radiographic evaluation of periradicular repair after endodontic treatment of dog's teeth with induced periradicular periodontitis[J].J Endod J,2001,27(10):610-612.
[7]郭晓霞,王燕煌,黄晓晶等.粪肠球菌再感染根尖周炎病程进展分析[J].第二军医大学学报,2013,34(8):914-918.
[8]Tanomaru JM,?Leonardo MR,?Tanomaru Filho M,et al.Effect?of?differentirrigation?solutions?and?calcium?hydroxide on bacterial LPS[J].Int Endod J,2003,36(11):733-739.
[9]Wan C,Yuan G,Yang J,et al.MMP9deficiency increased the size of experimentally induced apical periodontitis[J].J Endod,2014,40(5):658-664.
[10]Bishop RE.Fundamentals of endotoxin structure and function[J].Contrib Microbiol,2005,12:1-27.
[11]Fouad AF,Acosta AW.periapical lesion progression and cytokine expression in an LPS hyporesponsive model[J].Int Endod J,2001,34(7)506-513.
[12]Graunaite I,Lodiene G,Maciulskiene V.Pathogenesis of apical periodontitis:a literature review[J].J Oral Maxillofac Res,2012,2(4):e1.doi:10.5037/jomr.2011-2401.
[13]Lin SK,Hong CY,Chang HH,et al.Immunolocalization of macrophages and transforming growth factor-betal in induced rat periapical lesions[J].J Endod,2000,26(6):335-340.
R781.34
A
1009-2102(2016)04-0080-03
2016-08-20
雷涛(1966—),女,甘肃临夏人,主任医师,硕士,主要从事口腔临床医疗方面的研究.
