纳米二氧化硅对人张氏肝细胞毒性作用研究
2016-12-20钟建斌马建秀
钟建斌,马 影,聂 聪,张 丹,马建秀
(西北民族大学医学院,甘肃兰州730030)
纳米二氧化硅对人张氏肝细胞毒性作用研究
钟建斌,马 影,聂 聪,张 丹,马建秀*
(西北民族大学医学院,甘肃兰州730030)
目的:以纳米二氧化硅(SiO2)为研究对象,探讨其对人张氏肝细胞(Chang liver cells)的毒性作用.方法:透射电子显微镜观察纳米SiO2粒径、形态及分散性.体外培养人张氏肝细胞,将细胞分为对照组及纳米SiO2暴露组.纳米SiO2暴露浓度分别为12.5、25、50、100、200(mg·L-1),作用外周全血细胞和张氏肝细胞24h后,倒置显微镜下观察细胞形态及结构;四甲基偶氮唑盐(MTT)法检测细胞生存率;DAPI染色观察细胞核形态;TRITC-Phalloidin染色观察细胞骨架微丝结构.结果:与正常对照组相比,纳米SiO2引起人张氏肝细胞存活率明显降低(P<0.01);细胞胞体产生皱缩、变圆,细胞核固缩并出现空泡化,细胞骨架微丝结构破坏.结论:纳米SiO2作用于人张氏肝细胞会抑制细胞增殖,造成细胞形态改变,并呈现剂量依赖性.
纳米二氧化硅;人张氏肝细胞;细胞骨架;细胞毒性
0 前言
近年来,随着纳米技术的飞速发展,纳米材料在涂料、催化剂、食品添加剂、药物载体、医学成像等领域得到了越来越广泛的应用[1,2].纳米二氧化硅(silica nanoparticle)作为纳米材料的重要一员,其在生产生活的应用中不可避免地向周围环境排放[3].纳米SiO2具有空气动力学直径小,较微米级颗粒具有更高的表面活性,生物相容性和载体量等特性[4],故纳米SiO2更易通过呼吸、消化、皮肤等粘膜途径进入机体,经过胞吞、内化等各类转运机制进入潜在的致敏靶点,对机体造成毒性反应[5-7].研究表明,纳米SiO2会造成巨噬细胞(RAW264.7)生长抑制、形态异常、超微结构改变和细胞膜损伤[8].另有研究发现,纳米颗粒会明显抑制卵巢细胞(CHO-K1),并造成胞体皱缩、变圆,细胞骨架微丝破坏等毒性反应[9].肝脏作为人体最重要的解毒器官,其在纳米颗粒进入人体过程中发挥了重要的识别和转运作用.但是目前国内外对纳米SiO2造成人正常肝脏细胞毒性的研究较少,本研究选择人张氏肝细胞(Chang liver cells)为研究对象,通过体外细胞培养观察纳米SiO2对细胞增殖、细胞形态改变、细胞核变化和细胞微丝结构的影响,旨在从细胞水平研究不同浓度纳米SiO2对人张氏肝细胞的毒性作用和可能的作用机制,为探讨纳米SiO2浓度效应及生物毒性提供安全指导.
1 材料和方法
1.1 主要试剂和仪器
人张氏肝细胞由西北民族大学医学院机能实验室提供.
纳米SiO2(10nm)购自中国基材科技有限公司;6孔板购自美国Costar公司;1640培养基购自美国Gibco公司;胎牛血清(fetal bovine serum,FBS),购自杭州四季青生物工程材料有限公司;胰蛋白酶购自美国Sigma公司;噻唑蓝(methyl thiazolyl tetrazolium,MTT),购自美国Sigma公司;DAPI染液购自美国Molecular probes公司;TRITC-Phalloidin罗丹明标记鬼比环肽购自上海翊圣生物科技有限公司;其他本实验所用的试剂均为分析纯.酶标仪为美国Thermo产品,IX51荧光显微镜为日本O-lympus公司产品.
1.2 透射电子显微镜观察纳米SiO2的粒径及分布情况
将纳米SiO2溶液用无血清RPMI-1640培养液配制,终浓度为50mg·L-1,使用超声振荡器超声10min,将其滴到铜网中,在室温下风干.使用透射电子显微镜(TEM)观察粒子直径、分布情况以及形态,并用Image-Pro plus软件随机测定300个粒子并计算得到颗粒平均粒径.
1.3 细胞培养
人张氏肝细胞株使用含10%FBS的1640培养液常规培养,细胞接种于6孔板24h后用于实验.加入10nm SiO2悬液,调整终浓度为12.5、25、50、100、200(mg·L-1),正常对照组加入相同体积的1640培养基.将培养板置入37℃、5%CO2培养箱中培养到目标时间.
1.4 人张氏肝细胞形态观察
倒置显微镜下观察各组细胞形态及生长状况.
1.5 MTT法检测细胞抑制率
取对倍生长期的人张氏肝细胞,用胰酶消化后,调整细胞密度为1×108·L-1种植于96孔板,每孔100μL.培养24h后,更换培养基并添加纳米SiO2悬液,按实验方法1.3的要求设定正常对照组及5个纳米SiO2暴露组,每组设6个复孔.培养24h后取出培养板,每孔加入MTT(终浓度为0.5mg/mL),再培养4h,移去培养基,每孔加入150μL DMSO,置摇床避光摇动10min.待结晶完全溶解,490nm下用酶标仪测定各孔吸光度(OD),计算细胞抑制率.
细胞抑制率=(1-各组OD值÷对照组OD值)×100%
1.6 DAPI染色观察细胞核结构
调整PBMC浓度1×109·L-1后接种于6孔板中,每孔1mL.按实验方法1.3的要求设定正常对照组及5个纳米SiO2暴露组,置37℃,5%CO2培养箱内培养24h.按试剂盒说明书要求对人张氏肝细胞进行细胞核染色,染色结束后置于Olympus IX51荧光显微镜下观察,与正常对照组进行比较.
1.7 TRITC-Phalloidin染色观察PBMC微丝
调整PBMC浓度1×109·L-1后接种于6孔板中,每孔1mL.按实验方法1.3的要求设定正常对照组及5个纳米SiO2暴露组,置37℃,5%CO2培养箱内培养24h.按试剂盒说明书要求对人张氏肝细胞进行细胞微丝染色,染色结束后置于Olympus IX51荧光显微镜下观察,与正常对照组进行比较.
1.8 统计学分析
2 结果
2.1 纳米SiO2的形貌及分散性
图1结果显示,纳米SiO2分布存在轻度聚集,大小较均匀,颗粒形态呈球形,分散性较好,使用Image–Pro plus软件分析得到颗粒粒径为(10.42±1.65)nm.

图1 透射电子显微镜观察纳米SiO2的粒径及分布情况
2.2 纳米SiO2对人张氏肝细胞形态的影响
图2结果显示,与正常对照组相比(图2A),当纳米SiO2暴露浓度为12.5mg·L-1和25mg·L-1时对人张氏肝细胞形态并不产生明显影响(图2B、图2C).而当暴露浓度增加至50mg·L-1、100mg·L-1和200mg·L-1时,细胞形态发生明显改变,胞体皱缩、变圆,并产生不同程度的细胞碎片,细胞密度明显降低并脱落(图2D、图2E、图2F).
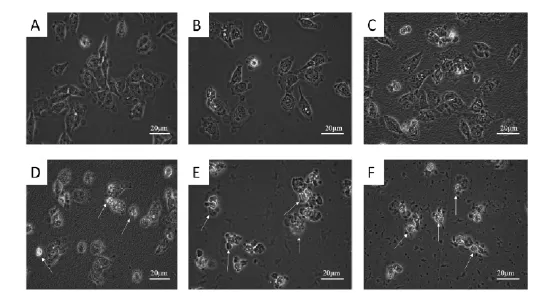
图2 倒置显微镜下观察纳米SiO2对人张氏肝细胞形态的影响
2.3 纳米SiO2对人张氏肝细胞增殖抑制率的影响
表1 MTT法检测纳米SiO2对人张氏肝细胞增殖抑制率的影响(±s,n=6)

表1 MTT法检测纳米SiO2对人张氏肝细胞增殖抑制率的影响(±s,n=6)
注:与正常对照组比较,⋆P<0.05,⋆⋆P<0.01.
Group Dose(mg·L-1) Inhibitionrates(24h)(%) Inhibitionrates(48h)(%)Control 0 0 0 12.5 39.9±4.1** 43.2±1.8** 25 55.8±4.4** 64.7±1.3** 50 64.6±2.7** 79.2±1.4** 100 68.3±2.1** 81.7±1.6** 200 71.1±0.7** 82.6±1.1** Silica nanoparticle
表1和图3结果显示,与正常对照组相比,各浓度的纳米SiO2暴露组均可对人张氏肝细胞活性产生明显的抑制现象.尤其暴露浓度为200mg·L-1,作用细胞24h和48h后,其对细胞的抑制率可分别达到(71.1±0.7)%和(82.6±1.1)%,与正常对照组相比具有显著统计学意义(P<0.01).
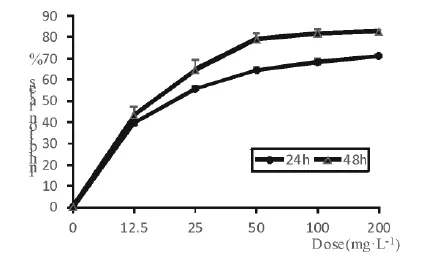
图3 MTT法检测纳米SiO2对人张氏肝细胞增殖抑制率的影响(±s,n=6)
2.4 纳米SiO2对人张氏肝细胞核的影响
图4结果所示,与正常对照组相比(图4A),当纳米SiO2暴露浓度为12.5mg·L-1和25mg·L-1时对人张氏肝细胞微丝结构无明显影响(图4B、图4C).而当暴露浓度增加至50mg·L-1、100mg·L-1和200mg·L-1时,人张氏肝细胞细胞核明显发生固缩,并出现空泡化,呈现明显凋亡核现象(图4D、图4E、图4F).

图4 DAPI染色观察纳米SiO2对人张氏肝细胞核形态的影响
2.5 纳米SiO2对人张氏肝细胞微丝结构的影响
图5结果所示,与正常对照组相比(图5A),当纳米SiO2暴露浓度为12.5mg·L-1和25mg·L-1时对人张氏肝细胞微丝结构无明显影响(图5B、图5C).而当暴露浓度增加至50mg·L-1、100mg·L-1和200mg·L-1时,人张氏肝细胞骨架微丝结构被明显破坏(图5D、图5E、图5F).
3 讨论
肝脏是纳米SiO2的主要靶器官,当纳米SiO2进入机体后可通过血液循环或淋巴液循环到达肝脏系统,进而造成肝细胞的毒性损伤[10].纳米SiO2的生物学效应与其粒径和暴露浓度密切相关,粒径越小,颗粒表面能和比表面积则越大,从而使纳米SiO2具有很高的反应活性[11,12].投射电子显微镜结果显示,本次研究纳米SiO2在细胞培养基中存在轻微的团聚现象.这种现象的产生可能与纳米SiO2存在极高的表面能以及培养过程中细胞释放的蛋白质或培养基中存在的其他成分有关,但相关研究表明纳米SiO2进入细胞内之后,团聚现象即会消失[13].研究表明,纳米SiO2会导致RAW264.7巨噬细胞贴壁数量减少,细胞周围有纳米粒子黏附,并造成细胞崩解现象[8].本研究结果同样发现,不同浓度的纳米SiO2作用于人张氏肝细胞后,细胞形态发生了明显的变化,细胞胞体皱缩变圆,细胞密度明显降低、脱落,并产生不同程度的细胞碎片.提示纳米SiO2作用于人张氏肝细胞后对细胞会造成严重的损伤.本研究运用MTT法测定纳米SiO2对人张氏肝细胞增殖抑制率时我们发现,纳米SiO2作用于人张氏肝细胞后会明显抑制细胞的生长,并呈现时间—剂量依赖关系.相类似的研究也同样表明,纳米SiO2作用于人肺腺癌A549细胞后会明显导致细胞存活率下降,同时呈现时间依赖性[14].细胞凋亡在组织形态学上会表现为形成球形或卵球形细胞质并出现胞浆碎片细胞核固缩和空泡化[15].在本次研究中我们观察到,当纳米SiO2暴露浓度为50mg·L-1、100mg·L-1和200mg·L-1时作用于人张氏肝细胞24h后,其细胞核发生了明显的固缩和空泡化现象,提示纳米SiO2可能诱导了人张氏肝细胞凋亡现象的发生.在人张氏肝细胞骨架的微丝结构研究中我们也同样发现,在高浓度组处理后,人张氏肝细胞骨架微丝发生断裂,骨架结构被明显破坏.相关研究也表明纳米颗粒会造成细胞微丝结构的破坏,从而诱导细胞发生毒性损伤[9].

图5 TRITC-Phalloidin染色观察纳米SiO2对人张氏肝细胞微丝结构的影响
本研究主要针对纳米SiO2对细胞活性和细胞形态学的影响,选择体外细胞培养方法初步探讨了纳米SiO2对人张氏肝细胞的毒性损伤作用,但其作用的分子生物学机制尚不清晰,需要进一步深入研究.参考文献:
[1]Hembury M,Chiappini C,Bertazzo S,et al.Gold-silica quantum rattles for multimodal imaging and therapy[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(7):1959-1964.
[2]Fucikova A,Valenta J,Pelant I,et al.Silicon nanocrystals and nanodiamonds in live cells:photoluminescence characteristics,cytotoxicity and interaction with cell cytoskeleton[J].RSC Adv,2014,4(20):10334-10342.
[3]郭玉婷,刘明学,董发勤.纳米二氧化硅细胞毒性效应研究进展[J].环境与职业医学,2014,(05):405-408.
[4]Passagne I,Morille M,Rousset M,et al.Implication of oxidative stress in size-dependent toxicity of silica nanoparticles in kidney cells[J].Toxicology,2012,299(2-3):112-124.
[5]Oberd RG,Oberd RE,Oberd RJ.Nanotoxicology:An Emerging Discipline Evolving from Studies of Ultrafine Particles[J].Environmental Health Perspectives,2005,113(7):823-839.
[6]Ye Y,Liu J,Xu J,et al.Nano-SiO2induces apoptosis via activation of p53and Bax mediated by oxidative stress in human hepatic cell line[J].Toxicology in vitro,2010,24(3):751-758.
[7]Kim HW,Ahn EK,Jee BK,et al.Nanoparticulate-induced toxicity and related mechanism in?vitro and in?vivo[J].Journal of Nanoparticle Research,2008,11(1):55-65.
[8]吴秋云,唐萌,谢彦昕等.不同粒径纳米二氧化硅的体外细胞膜毒性作用[J].中国生物医学工程学报,2010,29(03):437-445.
[9]李武珊,陈丽君.金纳米粒子对CHO-K1细胞毒性的谷胱甘肽作用机制[J].中国药理学与毒理学杂志,2013,27(02):234-239.
[10]Oberdorster G,Maynard A,Donaldson K,et al.Principles for characterizing the potential human health effects from exposure to nanomaterials:elements of a screening strategy[J].Particle and fibre toxicology,2005,2:8.
[11]Mendoza A,Torres-hernandez JA,Ault JG,et al.Silica nanoparticles induce oxidative stress and inflammation of human peripheral blood mononuclear cells[J].Cell stress &chaperones,2014,19(6):777-790.
[12]Buzea C,Pacheco,Robbie K.Nanomaterials and nanoparticles:Sources and toxicity[J].Biointerphases,2007,2(4):MR17-MR71.
[13]Wang S,Lu W,Tovmachenko O,et al.Challenge in Understanding Size and Shape Dependent Toxicity of Gold Nanomaterials in Human Skin Keratinocytes[J].Chemical physics letters,2008,463(1-3):145-149.
[14]焦常平,叶亚婧,张渊,等.纳米二氧化硅诱导A549细胞损伤及其氧化应激机制[J].中国药理学与毒理学杂志,2013,27(06):995-999.
[15]Elmore S.Apoptosis:a review of programmed cell death[J].Toxicologic pathology,2007,35(4):495-516.
R114
A
1009-2102(2016)04-0071-06
2016-08-02
西北民族大学2016年本科生科研项目(URIP16318,UPIP16317);西北民族大学2016年国家级大学生创新创业训练计划项目(201610742002).
*
钟建斌(1994—),男(畲族),浙江丽水人.
