特医食品又出新规:业内关注“临床试验”小步推进
2016-12-20中国食品药品网舆情监测中心
文 | 中国食品药品网舆情监测中心
10月底至11月初,通过对官方主流媒体、门户网站、微博、微信等舆论平台的监测,聚焦食品药品行业最具代表性的事件,结果显示,“特医食品临床试验新规发布”的相关报道量高于其他热点词汇。
舆情概述
自从被纳入新修订《食品安全法》,继而推出注册管理办法,特殊医学用途配方食品在中国结束了没有标准、缺乏规范的尴尬地位。行业蓄势待发,而有关配套措施、行业生产规范等仍存在大量问题亟待解决。11月1日,国家食品药品监管总局发布《特殊医学用途配方食品临床试验质量管理规范(试行)》(以下简称《规范》),引起业内人士的关注。主流媒体、食品行业媒体纷纷报道、转载国家总局的官方解读文章。
此前的3月10日,《特殊医学用途配方食品注册管理办法》的颁布对新《食品安全法》中“特医食品”条款进行了细化。此次《规范》包括总则、临床试验实施条件、职责要求、受试者权益保障、临床试验方案内容、试样用产品管理、质量保障和风险管理、数据管理与统计分析、临床试验总结报告内容、其他、附则共十一章五十二条内容。根据《规范》,开展特殊医学用途配方食品的临床试验无须食品药品监管部门批准。国家总局相关核查机构可对临床试验的真实性、完整性、准确性等情况进行现场核查等规定受到食品行业人士注目。
舆情走势
从相关舆情发展走势看,关于“特医食品临床试验新规发布”的媒体关注度呈现“波浪式”的特征。
从图1可以看出:10月30日之前,相关舆情数量较低。尽管起步晚,但中国特医食品行业早已储备力量,蓄势待发。特医食品在中国常常处于“不食不药、又食又药”的尴尬境地,相关产业尚未被真正激活,有关政策的一举一动都受到业内关注。
11月1日,国家总局发布公告,新华社、凤凰网、新浪网等主流媒体和门户网站跟进报道,《中华工商时报》、《中国医药报》等财经类、行业类媒体关注政策颁布。上世纪80年代末以来,基于临床需要,特医食品以肠内营养制剂形式进入中国,按照药品进行监管,经药品注册后上市销售。由于新药注册门槛高、成本高昂、审批时间长,更多的特医食品是作为普通食品在销售,屡屡遭遇尴尬;部分企业的“特医食品”技术和质量控制水平不可控,也制约了特医食品行业有序成长。业内专家表示,特医食品的配套政策、实施标准应该尽快明晰,不能像保健食品一样成为“带病前行的巨人”。特医食品生产管理相关的配套文件将直接影响后续监管工作的开展。因此,《规范》的出台受到业内关注。
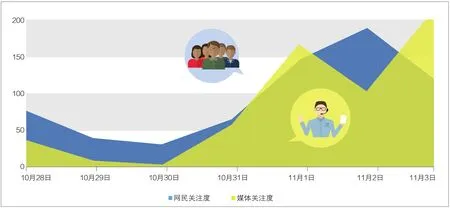
图1 媒体与网民舆情关注走势。
酝酿期:10月28日~10月31日,舆情低迷。据中国营养保健食品协会统计,一方面是全球每年特医食品消费达560亿~640亿美元规模,但中国只占全球市场1%的现实,产业尚处萌芽期;另一方面是临床患者对营养有迫切需求,现有的医院及家庭自制食物却无法满足。业内推动产业发展的呼声一直不断。
爆发期:11月1日~11月2日,国家总局发布《规范》后,新华社同时发布消息,报道量井喷。国家总局制定颁布的该《规范》,规范了特殊医学用途配方食品临床试验研究过程,保证临床研究结果的科学性、可靠性,保护受试者的权益并保障其安全。
衰退期:11月3日起,舆情有所回落。由于国家总局与文件配套公布的解读文章传播率高、效果好,几乎没有引起什么争议(见图1)。
不同媒体平台对比分析
以10月28日~11月3日为监测时间段,统计不同媒体平台上有关“特医食品临床试验新规发布”相关的信息量。从图2可以看出,相关报道数量最多的媒介为新闻媒体,占总体舆情来源的45.4%,其次为微信和微博。
据统计,在新闻媒体的报道中,新华社所受关注较多;在微信公众号中,“驭时临床试验信息”、“医药人俱乐部”等公众号受到较多关注;而在互动媒体里,亳州论坛的舆情较热。
报道内容分析
以10月28日~11月3日为监测时间段,按转载量排序,统计本周新闻网站有关“特医食品临床试验新规发布”报道的热点文章,如表1所示。
(一)媒体报道内容分类
通过对转载量较大的热点文章进行内容分析和事件聚类,可见有关报道的内容主要分为以下几个方面。
第一,报道国家总局发布的《特殊医学用途配方食品临床试验质量管理规范(试行)》,传播新规内容。如新华社11月1日发布的《食药监总局:开展特殊医学用途配方食品的临床试验无须食品药品监管部门批准》,又如《中华工商时报》刊登的《医用配方食品临床试验规范发布》等。此类消息转发次数最多,传播最广。
第二,解读新规的意义,对食品行业产生的影响。由于国家总局官网公布了官方解读,11月1日发布《〈特殊医学用途配方食品临床试验质量管理规范(试行)〉解读》传播最广,影响最大。
(二)“特医食品临床试验新规发布”事件背景
特殊医学用途配方食品在国内的处境一直很尴尬。据悉,特医食品曾有数种不同身份和销售渠道:第一种以食品身份进口,在超市货架和网络上销售;第二种是没有注册成药品,但走医院渠道的医用食品,通过给医生患者讲课,科普的同时推进产品销售;第三种注册为药品,有口服营养粉,有静脉滴注的肠外营养液,销售渠道主要在医院药房,且多数已纳入医保报销范畴。
由于缺乏规范,这些产品如果不注册为药品,就必须以普通食品的身份销售。过去,新药注册门槛太高,每引进一个产品便会有高昂的费用和漫长的审批时间;而通过食品注册的产品又无法标明功能、适应人群,无法进入药房销售。更有一些产品上市后,因其特定的术语被相关部门认定是虚假广告,夸大宣传。随着新《食品安全法》颁布并实施,特医食品与保健食品、婴幼儿配方食品一起纳入了“特殊食品”,业内一直呼吁特医食品的各类配套政策、实施标准尽快明晰。2016年7月1日,我国特医食品终于获得“正式身份”—《特殊医学用途配方食品注册管理办法》正式实施。目前,政府在逐步完善特医食品行业规范,并逐步重视特医食品的市场化应用。
(三)“特医食品临床试验新规发布”事件的媒体热评
据业内人士介绍,由于经济发展水平等原因,特医食品上世纪80年代才进入中国,当时我国没有此类产品的标准,其生产、销售与管理缺乏法律法规依据,故采取了按药品注册的做法。由于药品注册难度高、注册成功率低、配方更换困难,因此我国特医食品市场在很长一段时间里由少数几家跨国企业占据,并且配方陈旧,不符合中国人的营养特点。
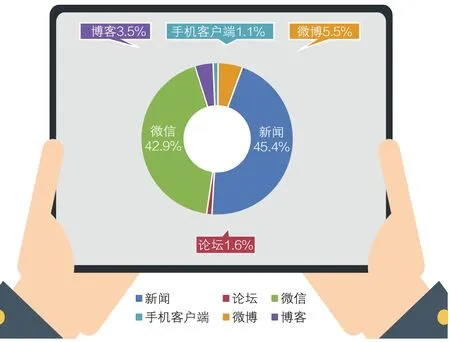
图2 媒体信息来源比例。
据了解,特医食品产业在国外非常成熟,每年有数千亿的市场份额,营养诊断和营养治疗是欧美等发达国家的一种普遍医疗行为。而我国住院和门诊患者的营养诊断和营养治疗率十分低下。有统计显示,2009年,在中国1.4亿住院患者中约有40%~50%,即5600万~7000万患者需要临床营养诊断与治疗,而接受临床营养系统诊断的患者不足万人,接受临床营养干预和治疗的患者不足200万;院外数以亿计慢性非传染性疾病患者的营养治疗尚处无人管理状态。
我国特医食品行业也面临一些挑战,由于国内企业进入特医食品产业较晚、技术较落后、投资规模较小、没有品牌影响力等诸多原因,市场份额占有率较低;再加上国内特医食品大部分是仿制国外产品,产品自主知识、技术含量少,在产品研发方面缺乏创新,对功能配料的甄选不够严谨。在目前注册细则尚未出台的情况下,一些不具备条件的企业也意欲进入市场,未来产品是否出现同质化现象可想而知。
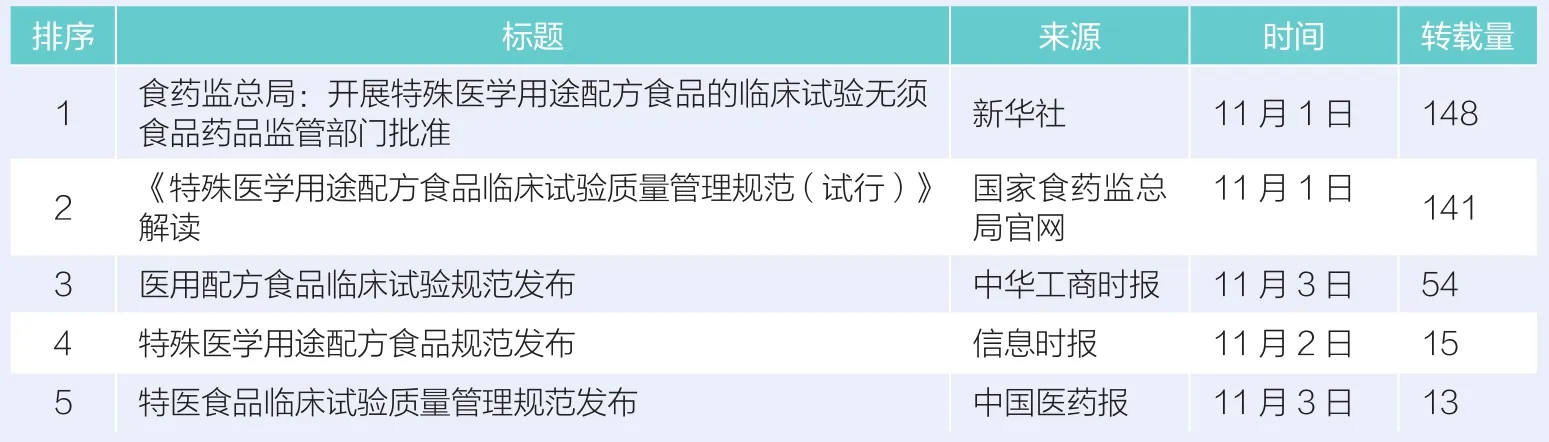
表1一周新闻转载量

表2一周以来热门微博排行榜

表3一周以来热门微信排行榜
对特医食品的应用,除少数大医院外,多数医疗机构缺乏经验,需要在医疗系统内开展专业培训,才能做到合理使用。另外,各级食品监管机构在执法方面尚缺少监管经验,对这类产品的认识也还不统一,需要开展相应的培训。
亚宝药业集团大健康市场总监朱玉洁、广州金酮医疗科技有限公司董事长张洪润都认为,无论如何,随着国家对健康产业的一系列利好政策,特医食品市场都将迎来暴发。他们建议进一步规范市场、规范产品;培训医生和营养师,推广营养诊断与营养治疗,将此类食品纳入医院处方管理乃至纳入医保报销范围,改善需要特殊营养支持的病患的营养状况。
—《特医食品蓄势待发》,摘自《中国医药报》
微博与微信分析
以10月28日~11月3日为监测时间段,新浪微博上有关“特医食品临床试验新规发布”的舆情关注度较低,主要是食品药品领域行业账号发布相关新闻。由于特医食品尚未被广大消费者了解,多数网友对此缺乏兴趣。
按照转发数量排序,热门微博如表2所示。
以10月28日~11月3日为监测时间段,按转载量排序,统计有关“特医食品临床试验新规发布”的微信文章共有496篇,总阅读数量约3千人次。其中,医药食品行业专业类微信公众号的新闻发布、阅读量较大。
据统计,热门微信文章如表3所示。
对此话题,留言评论的网友数量较少,总体呈现出较为淡漠的态度,多数业内人士期待配套法规尽快到位,政府部门给予更多明确的指向,为行业发展打下基础,给后续监管工作指明道路,避免让食品安全监管处于空白状态。
网友酷评
春风得意:总算得到国家政策的重视了。
Pharmabc:特殊医学用途配方食品应该是在为社区医疗、家庭病床做铺垫的吧。
巡山使者:对于特医食品的规定有多种,一是《食品安全法》,规定应当注册;二是总局的公告,给了过渡期;三是各地方性的法规。地方食药监执法时会参照什么法律法规?
舆情点评
11月1日,《特殊医学用途配方食品临床试验质量管理规范(试行)》发布。应当说,业界对该《规范》是翘首以待。自新修订《食品安全法》明确特医食品实施注册管理以来,中外企业早已摩拳擦掌。今年3月,国家食药监管总局发布《特殊医学用途配方食品注册管理办法》,并确定了2016年7月1日起施行,打响了企业注册的发令枪。由于配套法规迟迟未能出台,欲注册企业内心已经非常焦急。该条消息在业界第一时间被广泛转载,既反映了企业的急切,又反映了业界对特医食品的期望之高。
特殊医学用途配方食品在我国可以说是一个不新的“新鲜事物”。一方面特医食品在国外早有概念和品类,2013年国家卫计委出台了有关特医食品的两个通则,我国首次明确特医食品概念;另一方面,上世纪80年代,一些特医食品为满足临床需要,以“药品”身份已进入临床。而新修订《食品安全法》首次以国家法律的形式确定了其食品身份,并明确为“特殊食品”,实施注册管理。
对这样一个复杂的新鲜事物,舆论引导需要做好四方面的工作。第一,加强对行业的法规宣贯,避免不符合条件的产品和企业进入注册流程,挤占审批资源。第二,加强企业对特医食品管理法规的认识,特别是对其在生产、销售方面特殊性的认识,避免特医食品像保健食品一样“带病前行”。第三,加强临床医生对特医食品应用的引导,以促进其被更好、更合理地应用,有效改善不重视临床营养和滥用临床营养的情况。第四,加强对公众的科普宣传,让医学营养知识深入人心,提高公众的科学素养。
从市场角度来看,业界对特医食品一片叫好之声,然而风险仍然存在。虽然国家总局出台的法规、规范显示对特医食品的审批既保证质量又简化程序,但较高门槛仍然不是所有企业都能企及。受限于价格、医保、医患观念等因素,且一批研发能力强、公众形象好的跨国企业抢先分羹,新晋企业的市场拓展恐怕并不简单。
在特医食品产业起航过程中,政府部门在舆情防控方面有两个风险点:其一,注意内外企之争。由于特医食品是未来几年甚至十几年可以预见的蓝海,因此业界关注度极高。考虑到跨国企业早已进入市场,且在政府公关方面着手较早,外企和本土企业之争可能会在一段时间内长期存在,并成为舆情风险点。其二,因配套法规迟迟未出台,业界存在一定的情绪,应避免由意外事件引发舆情风险。
