8:2氟调聚醇(8:2FTOH)厌氧生物降解特性
2016-12-20陈轶丹杨志敏黄华山周真明苑宝玲华侨大学土木工程学院福建厦门361021
李 飞,陈轶丹,杨志敏,黄华山,周真明,苑宝玲(华侨大学土木工程学院,福建 厦门 361021)
8:2氟调聚醇(8:2FTOH)厌氧生物降解特性
李 飞,陈轶丹,杨志敏,黄华山,周真明,苑宝玲*(华侨大学土木工程学院,福建 厦门 361021)
为了阐明厌氧环境下全氟羧酸(PFCAs)等全氟化合物的迁移归趋,研究了 8:2氟调聚醇(8:2FTOH)的厌氧降解性能.结果表明,取自市政污水处理厂的污泥在厌氧条件下可还原降解 8:2FTOH,并生成氟离子、全氟类和多氟类降解产物,且降解过程可采用双指数衰减模型拟合.在为期 120d的培养中, 8:2FTOH的摩尔降解率高达(93.2±0.9)%;摩尔回收率则随着培养时间的增加有下降的趋势,由培养初期(1d)的(97.5±5.1)%下降至末期(120d)的(68.9±4.0)%,这说明在培养后期可能产生了未知的降解产物或生成了未知的挥发性产物.8:2不饱和氟调聚酸(8:2FTUA)和全氟辛酸(PFOA)分别是摩尔产率最高的多氟类和全氟类降解产物,分别介于(6.94±0.10)% ~ (24.2±1.5)%和(2.67± 0.22)% ~ (14.9±1.0)%的范围内.多氟类降解产物的摩尔产率随培养时间的增加先增加后降低,而全氟类降解产物的摩尔产率则随培养时间的增加持续增加,这说明其可能分别为中间降解产物和最终降解产物.
8:2FTOH;厌氧生物降解;降解产物;变化趋势
氟调聚醇(F(CF2)xCH2CH2OH,x=6,8,10;x:2FTOH)是一类具有独特理化性质的人工合成物质,主要用作生产具有疏水疏油抗污性的表面活性剂和聚合材料等工业产品的中间体[1],在某些个人消费品中也有较高的残留[2].与同链长全氟羧酸(PFCAs)相比,FTOH蒸汽压较高,因此具有较强的挥发性,可通过大气长距离迁移,但在水中溶解度却较低[3-4].FTOHs属于内分泌干扰物质,且具有遗传毒性、生殖毒性和发育毒性,可导致急性和亚慢性中毒[4-7].其中,8:2FTOH是生产和使用最多的 FTOH之一[8],当其以各种途径进入生态环境后,可被好氧微生物转化为备受关注的持久性有机污染物,如全氟辛酸(PFOA)等PFCAs
和其他多氟化合物,这已得到充分的研究证实[9-12].然而,有关8:2FTOH厌氧生物降解的研究较少,目前的两篇报道得出了相反的结论.Sáez等
[13]认为 8:2FTOH并不能被厌氧生物降解;而Zhang等[14]则认为8:2FTOH可被厌氧生物降解,并主要生成8:2氟调聚酸(8:2FTCA)、8:2不饱和氟调聚酸(8:2FTUA)和 7:3氟调聚酸(7:3acid)等降解产物.
尽管8:2FTOH的厌氧生物可降解性存在较大争议,但是依然有研究者认为,FTOH类物质的厌氧生物降解可能是厌氧消化污泥[15]和垃圾渗滤液[16-18]中 PFOA等 PFCAs的重要来源之一.由此可见,目前亟需确定8:2FTOH的厌氧生物降解特性,以为进一步的研究提供理论依据.
本研究在确认8:2FTOH厌氧生物可降解性的基础上,通过分析降解产物随时间的变化趋势,以确认其最终降解产物和中间降解产物.
1 实验部分
1.1 标准与试剂
8:2FTOH及其可能的降解产物标准试剂见表 1.BioXtra级氟化钠(≥99%)、HPLC级甲醇(≥99.9%)和乙腈(≥99.9%)购自 Sigma-Aldrich公司;HPLC级醋酸铵(≥99.0%)购自 Fluka公司;EnviCarb分散石墨碳吸附剂购自Supelco公司;其他无机化合物均为AR级,购自国药集团.
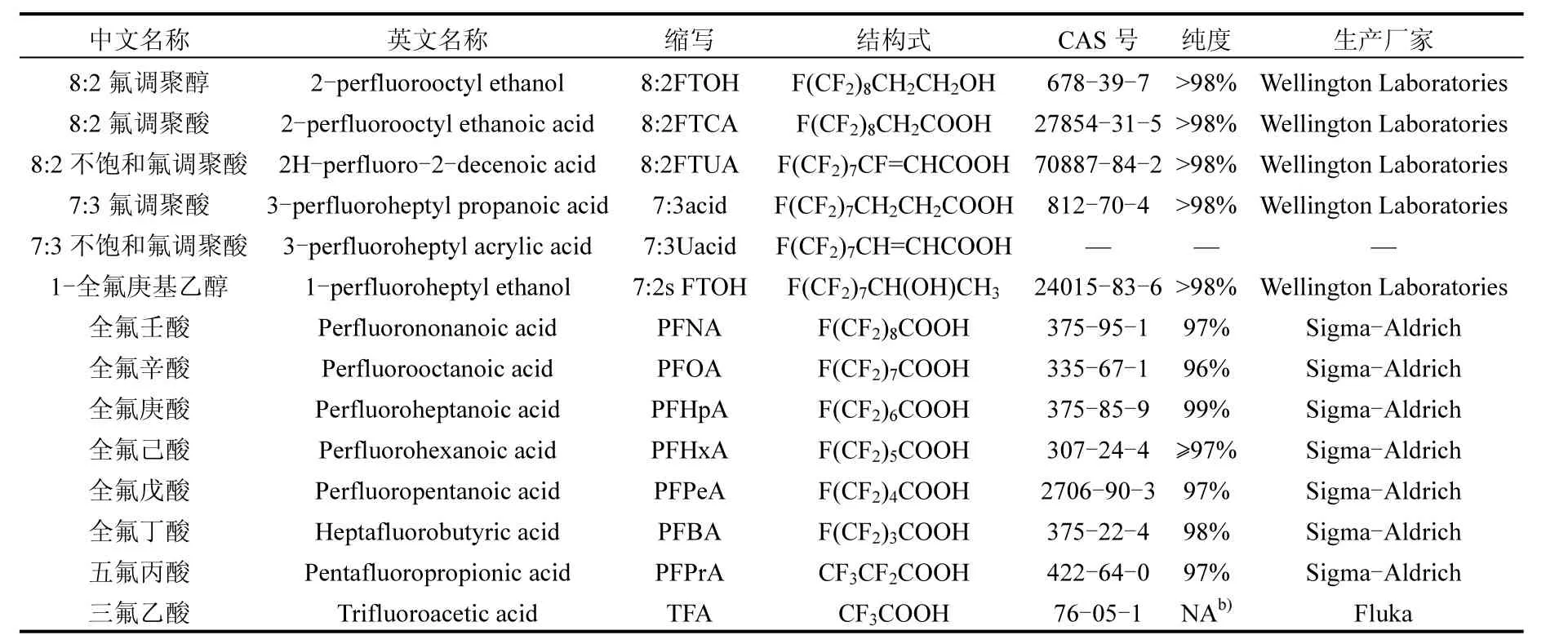
表1 含氟有机化合物标准品详细信息一览表a)Table 1 Detailed information of standard of fluoro-containing organic compounds
1.2 厌氧污泥采集与预处理
实验用厌氧活性污泥取自厦门某市政污水处理厂的2号厌氧池,该污水处理厂采用A2/O工艺,设计处理能力为 4.5×104m3/d,生活污水和工业废水比例约为 6:4.污泥沉降比(SV)为 33%,污泥沉降指数(SVI)为 127mL/g,悬浮固体浓度(SS)约为 2600mg/L,挥发性悬浮固体浓度(VSS)约为2000mg/L,pH值约为7.5,电导率约为1250µS/cm,氧化还原电位(ORP)介于-157 ~ -211mV之间.
在厌氧手套箱内,先将取回的污泥自然沉降30min,弃去上清液后,再用定性滤纸过滤.将滤后污泥从滤纸上用无氧超纯水冲洗下来,涡流搅拌30s(Lab Dancer, IKA,德国)混匀后过滤,该过程再重复2次,以尽量去除污泥中的杂质和干扰物质.最后,将洗涤后的污泥混匀,称取2.0g于50mL聚丙烯(PP)离心管中备用.
1.3 实验方法与步骤
实验用营养液参照Zhang等[14]的方法配制,并添加5.0mg/L的维生素B12(VB12)作为催化剂.将配制好的营养液先超声脱气,再用氮气曝气脱
氧后密封,在4℃下保存备用.
在厌氧手套箱内,分别移取 30mL脱氧营养液至盛有2.0g洗涤污泥的离心管内,再分别准确添加600µL 1.00g/L和7.50mg/L的8:2FTOH甲醇储备液,使其最终浓度约为20mg/L和150µg/L,分别用于研究8:2FTOH的厌氧可降解性及降解产物变化趋势.添加8:2FTOH后将离心管迅速密封,并涡流搅拌30s,然后移出厌氧手套箱,置于温度为35℃,转速为90r/min的水浴摇床上培养.定期取样,检测8:2FTOH、氟离子和其它降解产物的浓度,以评估 8:2FTOH的降解特性,称为活菌降解样.
为了保证实验结果的可信度,同时设置活菌对照样和灭活对照样.活菌对照样的实验方法类似于活菌降解样,仅用 600µL纯甲醇代替8:2FTOH甲醇储备液;而灭活对照样的处理方法也类似于活菌对照样,仅将污泥先在 121℃下高温灭活30min,且其它步骤需在紫外消毒24h的厌氧手套箱内操作.每组试样在每个采样时间点均同时设置3组平行样.
1.4 样品预处理与仪器分析
确认8:2FTOH厌氧生物可降解性时,将各组离心管在6000rpm的转速下离心15min,准确移取0.70mL上清液到盛有0.70mL甲醇的1.5mL PP离心管内,再添加25mg Envi-Carb分散石墨碳吸附剂(Supelco,美国),涡流搅拌 30s,以消除杂质引起的基质效应.然后,在15000r/min的转速下离心 15min,移取一定量的上清液,根据其浓度用甲醇水溶液(V/V =50:50)稀释一定倍数后进行液质分析.
研究8:2FTOH厌氧降解产物随时间变化趋势时,将各实验组离心管在6000rpm的转速下离心15min,将上清液移入100mL PP容量瓶内.向离心污泥内添加10mL甲醇,涡流搅拌30s后超声萃取15min,再在6000rpm的转速下离心15min,将上清液移入上述 100mL PP容量瓶,再重复该超声萃取步骤2次.最终,用甲醇水(V/V = 50:50)溶液定容至100mL后,移取1.0mL至1.5mL PP离心管内,并添加25mg分散石墨碳吸附剂,涡流搅拌30s后,在15000r/min的转速下离心15min,移取一定量的上清液至1mL PP自动进样小瓶内,以进行液质分析.
8:2FTOH及其降解产物的分离采用日本岛津公司生产的LC-20A型高效液相色谱,液相色谱柱采用美国 Agilent公司生产的 ZORBAX Eclipse Plus C18柱(2.1mm×150mm,填充粒径3.5µm),进样量10µL,流动相为乙腈和10mmol/L醋酸铵溶液,流速为 300µL/min.乙腈初始比例为10%并保持1min,到第2min时升高至50%并保持1min,到 7.5min时升高至 95%并保持至 12min,并在第13min回到10%,直至第18min分析结束.
FTOH及其降解产物的定性定量分析采用美国AB公司生产的API3000型三重四极杆质谱仪.采用负电喷雾电离源(ESI),离子源温度为420
℃,喷雾电压为-3200V,雾化气、帘气和辅助气均为氮气,流速分别为 10L/min、8.0L/min和5.0L/min.8:2FTOH及其降解产物的质谱参数如表 2所示;分析方法回收率介于(68.3±5.4)% ~(117±10)%的范围内.
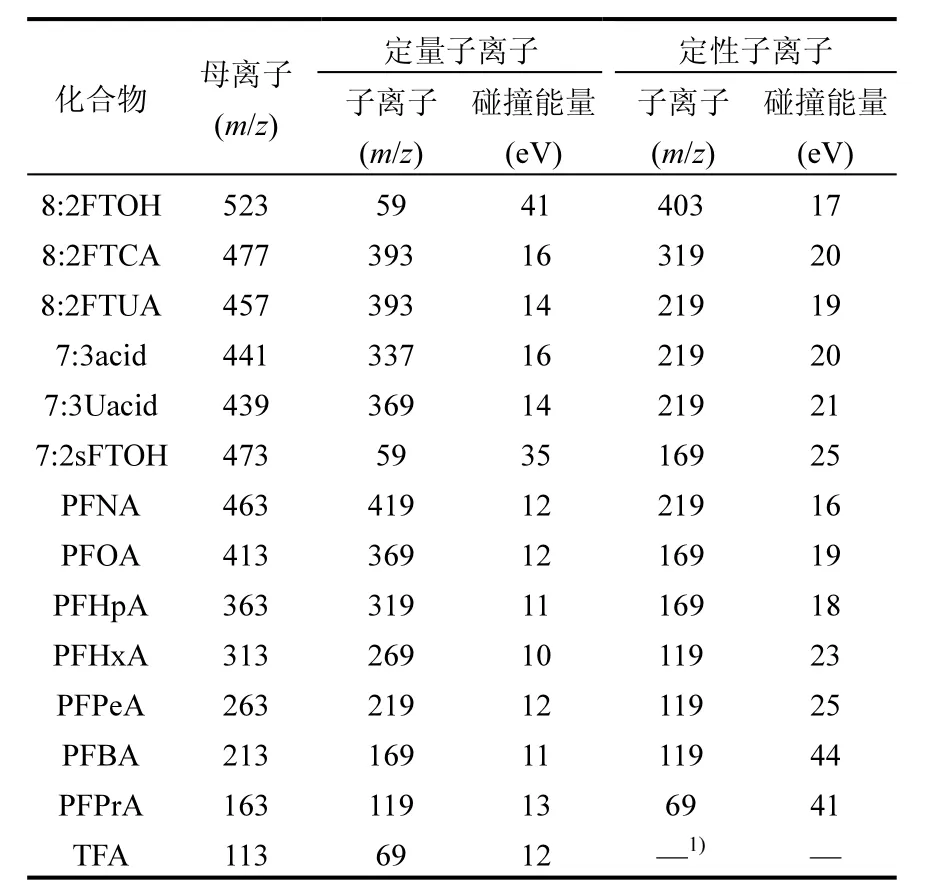
表2 8:2 FTOH及其降解产物的质谱参数Table 2 Mass spectrometric parameters of 8:2 FTOH and its degradation products
氟离子的定性定量分析采用瑞士万通公司生产的Metrohm 930型离子色谱.移取2mL在
6000r/min转速下离心15min的上清液于5mL PP离心管内,再在10000r/min的转速下离心20min后,检测氟离子浓度.质量控制与保证及数据统计分析详见文献[19],回归分析采用SigmaPlot 9.0.
2 结果与讨论
2.1 8:2 FTOH厌氧生物可降解性
尽管 8:2 FTOH 在水中的溶解度仅为0.194mg/L[20],但是在研究其厌氧降解性能时仍采用了远高于其溶解度的过饱和浓度(约为20mg/L),以便追踪其降解产物.在为期120d的培养中,活菌降解样、灭活对照样和活菌对照样的氟离子浓度变化趋势如图1所示.
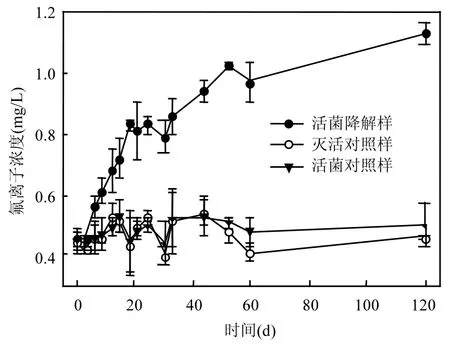
图1 氟离子浓度变化趋势Fig.1 Trends of fluorideconcentration
由图1可知,氟离子浓度在活菌降解样中显著增加(P<0.05),且随着时间的增加,均显著高于灭活对照样和活菌对照样(P<0.05).而对灭活对照样和活菌对照样而言,氟离子浓度均没有显著变化(P>0.05),且尽管在某些时间点活菌对照样的浓度略大于灭活对照样,但却不存在统计意义上的差异性(P>0.05).由此可见,活菌降解样中氟离子浓度的增加,既不是污泥释放导致的,也不是生物降解污泥中含有的其他可降解含氟化合物导致的,而应该源自8:2FTOH的厌氧生物降解.
为了进一步确认8:2FTOH的厌氧生物可降解性,将3组样品培养14d的上清液预处理后分别进行液质分析,根据前人的好氧[9-11]及厌氧[14,18]生物降解研究成果[12],检测其可能的降解产物,结果如图2所示.
由图2可知,在灭活对照样中仅检出了添加的 8:2FTOH 和较低浓度的 PFOA[(11.87± 0.21)ng/L],而在活菌对照样中则仅检出了 PFOA [(11.66±0.29)ng/L],其他物质的信噪比(S/N)均低于仪器检出限(MDL, S/N≥3).虽然活菌对照样中PFOA浓度略高于灭活对照样,但是 2者之间不存在统计意义上的差异性(p> 0.05),由此可见,在2组对照样中检出的PFOA可能来自厌氧活性污泥本身,而不是其前体物的厌氧降解,否则活菌对照样的浓度应该显著高于灭活对照样.
由图2可知,在活菌降解样中检出的PFOA浓度则远高于活菌对照样和灭活对照样,且可能是8:2FTOH的主要厌氧降解产物,这和其好氧降解的研究结果类似[12],但和Zhang等[14]的厌氧降解研究结果并不一致.除了PFOA外,在活菌降解样中还检出了PFHpA、PFHxA、PFPeA和PFBA等更短链长的全氟羧酸(PFCAs,见图2),而在2组对照样中均没有检出,说明这些PFCAs应该是由8:2FTOH厌氧生物降解生成的,这和8:2FTOH在动物体内的降解[12]和好氧降解结果类似[11,12],但是却和厌氧降解结果并不一致[14],因为在厌氧生物降解中,仅检出了略高于活菌对照样浓度的PFOA,而没有报道更短链长的 PFCAs[14].由图 2可知,本研究在活菌降解样中并没有检出 PFNA,这和8:2FTOH在动物体内的降解和好氧生物降解结果并不一致[12],而和其厌氧降解结果一致[14],即在厌氧降解 8:2FTOH的过程中并不会生成PFNA.
尽管在活菌降解样中检出了 PFBA等短链PFCAs,但是却没有检出更短链长的 PFPrA和TFA(图2),这可能是因为厌氧降解8:2FTOH不能生成PFPrA和TFA,也可能因为进行液质检测时培养时间过短(仅为 14d),还没有来得及生成PFPrA和TFA,但有待进一步确认.
在活菌降解样中除了检出PFCAs等全氟化合物外,还检出了8:2FTUA、8:2FTCA、7:3acid、7:3Uacid和 7:2sFTOH等一系列的多氟化合物(详见图2,其中7:3Uacid尽管因相对丰度较低在
图中并没有体现出来,但其 S/N>>3),这和前人的厌氧降解[12-14]和好氧降解[12]产物均不完全一致.7:2sFTOH仅在8:2FTOH好氧降解或动物体内降解时才可检出[10,12],而在厌氧降解时却没有检出[14];8:2FTUA和8:2FTCA虽然能在厌氧降解时检出[14],但在好氧降解时则不一定能够检出
[10,12];7:3Uacid在厌氧降解时没有检出[14],但在好氧降解时则有可能检出[12].

图2 8:2 FTOH厌氧生物降解特性及其降解产物(培养时间t=14d,化合物下的数字表示该物质的峰面积)Fig.2 Anaerobic biodegradation characteristics of 8:2 FTOH and its degradation products(incubation time t = 14d )
综上所述,在本研究中,不仅检出了其他研究者已报道的厌氧降解产物[14],还检出了部分好氧降解产物(如7:2sFTOH、PFHxA等,详见图2)[12].因此,为了验证该实验是否是在厌氧条件下进行的,在不同采样时间点监测其 ORP值.结果表明,在整个实验过程中ORP介于-203~-279mV之间,中位数为-244mV,即该实验是在严格的厌氧条件下进行的.由此可见,尽管已确认在厌氧条件下8:2FTOH可生物降解,但是目前亟需进一步确认其厌氧降解产物和降解途径.
2.2 8:2FTOH厌氧降解趋势分析
为了尽可能降低检测方法对实验结果的影响,采用方法回收率对液质检测获得目标分析物浓度进行修正.8:2FTOH的摩尔回收率(R)可采用式1计算:
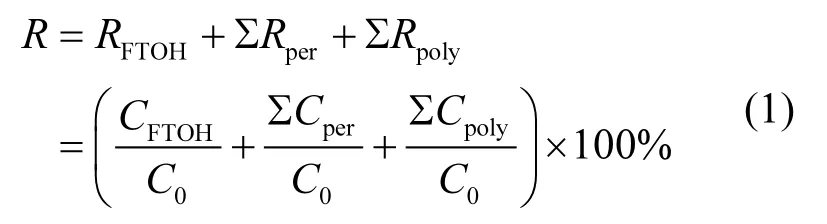
式中:RFTOH表示残留 8:2FTOH摩尔分数,%;Rper和Rpoly分别表示生成的各种PFCAs和各种多氟化合物的摩尔产率,%;C0、CFTOH、Cper和Cpoly分别表示初始投加 8:2FTOH物质的量、残留8:2FTOH物质的量、生成的各种PFCAs和多氟
化合物物质的量,mol.在为期120d的培养中,灭活对照样中8:2FTOH的摩尔回收率变化趋势如图3A所示;活菌降解样中8:2FTOH的摩尔回收率及其降解残留摩尔分数变化趋势如图 3B所示,多氟类和全氟类降解产物的摩尔产率变化趋势分别如图 3C和 3D所示.其中,因没有获得7:3Uacid的标准试剂,故使用7:3acid的标准曲线对其进行定量.
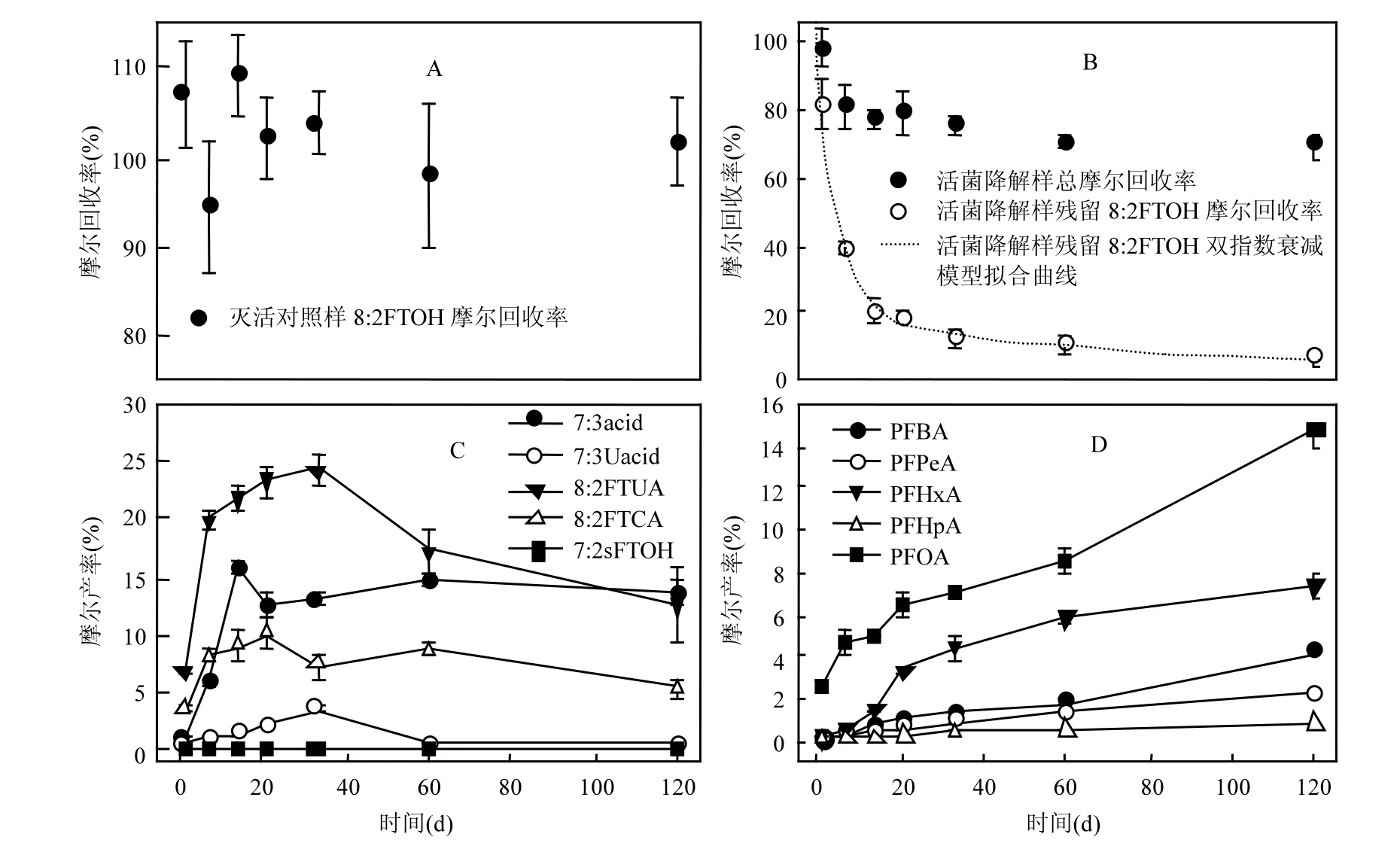
图3 8:2FTOH厌氧降解变化趋势Fig.3 Trends of anaerobic degradation of 8:2FTOH
由图3A可知,灭活对照样中8:2FTOH的摩尔回收率(即残留 8:2FTOH摩尔分数)介于(94.5 ±7.1)% ~ (109±5)%的范围内,且除个别点外,该组数据一般不存在统计意义上的差异性(P>0.05),这说明8:2FTOH的挥发损失及污泥吸附不会对其摩尔回收率产生显著影响.
由图3B可知,实验初期残留8:2FTOH的摩尔分数快速下降,导致这种现象的原因可能包括3个方面,即:污泥吸附、挥发损失和生物降解.由灭活对照样可知,污泥吸附与8:2FTOH挥发损失几乎可忽略不计(见图 3A),因此导致残留8:2FTOH摩尔分数下降的主要原因应该是生物降解.
在第1d 8:2FTOH降解了18.5%,到第7天增加至61.0%,在第7~ 14d的培养中降解率又增加了19.0%;随后,8:2FTOH的降解速率则显著下降,在剩下的106d中,降解率也仅增加了14.1%.然而,在120d的培养中,8:2FTOH的摩尔降解率却高达(93.2 ± 0.9)%(见图 3B),远大于前人报道的厌氧降解率[8],甚至也高于好氧降解率[9,12],这可能缘于投加了生物催化剂VB12[21].
VB12具有含钴原子的咕啉环结构,其中Co(I)是一种非常强的亲核试剂,可通过进攻卤碳键加速首个卤素原子的脱除速率,从而催化卤代有机污染物生物脱卤[22].有研究表明,VB12可催化生物厌氧还原降解三氯乙烷[23]、四氯化碳[24-27]、氯仿[27-28]、全氯乙烯[24]、四溴双酚 A[29-30]等卤代化合物的脱卤反应[27].而氟作为电负性最强
的卤素,决定了8:2FTOH也易受亲核试剂VB12攻击而被生物还原降解,从而使本研究获得了优于好氧生物降解的降解率[9,12].Shan等[27]的研究结果表明,在厌氧产甲烷条件下 VB12可催化三氯氟甲烷的生物还原降解脱氟,这也在某种程度上证明VB12对8:2FTOH的厌氧生物降解具有催化作用.
采用双指数衰减模型拟合厌氧降解8:2FTOH的变化趋势(见图3B),拟合公式见式2,回归分析获得的拟合参数详见表3.
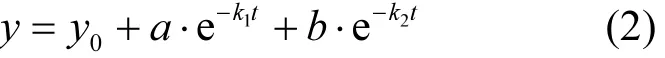
式中:y表示残留8:2FTOH摩尔分数,%;t表示培养时间,d;y0、a、b、k1和k2为双指数衰减模型参数.
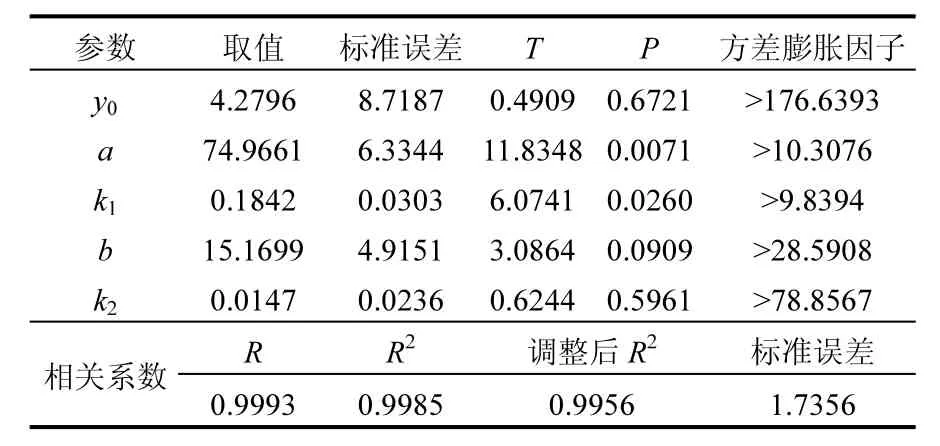
表3 双指数衰减模型拟合参数Table 3 Fitting parameters of double exponential decay model
由图 3B和表 3可知,拟合相关系数 R达0.9993,说明双指数衰减模型可以很好的拟合厌氧降解8:2FTOH时其残留摩尔分数的变化趋势,这类似于土壤中溶解性有机物(DOM)的生物降解过程[31-32].然而,导致土壤中DOM生物降解过程符合双指数衰减模型的原因是其包含快速降解部分和慢速降解部分[31-32],但导致厌氧生物降解8:2FTOH符合双指数衰减模型的原因并不明确,可能缘于其降解过程决定于某两个未知的限速步骤的叠加,且其中一个步骤较快,而另一个步骤较慢,但这有待进一步研究.
由图3B可知,8:2FTOH的摩尔回收率随着培养时间的增加有下降的趋势,在第1d的回收率高达(97.5±5.1)%,而在第120d培养结束时则仅为(68.9±4.0)%,平均下降了近30%.造成这种现象的原因可能包含2个方面:首先,随着培养时间的延长,除了已检出的降解产物外,可能还生成了某些未知的降解产物;其次,本研究未对离心管上部气体进行检测,因此随着培养时间的延长,可能生成了挥发性更强的降解产物(如更短链长的氟调聚醇类等),并从水相中逸出,从而导致了较低的摩尔回收率.
由图3C可知,8:2FTUA是摩尔产率最高的多氟类降解产物,在培养初期的增速较快(≤7d),但随着培养时间的延长则逐渐放缓,并在第 33d时达到峰值,达(24.2±1.5)%;随后开始下降,在培养结束时仅为(12.5±3.2)%,甚至低于 7:3acid(见图3C).这和Zhang等[14]的研究结果并不一致,他们认为在为期181d的培养中,8:2FTUA的摩尔产率仅为 5.1%,并不是最主要的厌氧降解产物.在本研究中,7:3acid的摩尔产率仅次于 8:2FTUA,在实验结束时甚至比 8:2FTUA还高,但也仅为(13.7±0.9)%,这远低于污泥厌氧降解时 Zhang等[14]的报道值(27%),但却和土壤好氧降解8:2FTOH时的报道值(11%)类似[4].此外,Zhang等[14]的研究结果表明,在厌氧降解8:2FTOH的整个培养期内,7:3acid的摩尔产率一直增加,从而认为其在厌氧条件下不能被进一步转化,即7:3acid是8:2FTOH厌氧降解最终产物;然而在本研究中 7:3acid的摩尔产率却是先增加,后降低,然后趋于稳定(见图3C).8:2FTCA是8:2FTOH厌氧降解的第3大产物,摩尔产率随着培养时间的延长先增加(≤21d),随后波动降低,在实验结束时为(5.4±1.0)%(见图 3C),这均远低于采用污泥好氧[22]或厌氧[14]降解时的报道值(分别高达27%和18%),但在土壤好氧降解时却并未检出该产物[10].由图3C可知,尽管7:3Uacid的摩尔产率不高(最高仅为(3.5±0.3)%),但却可以检出且已通过质谱中性丢失扫描得到了进一步确认,并使用7:3acid的标准曲线进行定量.然而,前人的研究结果表明,污泥厌氧[14]或土壤好氧[10]降解8:2FTOH时却没有检出 7:3Uacid,并认为导致这种现象的原因是其可快速生物转化为7:3acid.尽管Zhang等[14]采用厌氧污泥降解 8:2FTOH时并没有检出7:2sFTOH,但是在本研究中却可以检出(见图 2和图 3C),不过其摩尔产率较低,最大仅为(0.31±
0.03)%,远低于其好氧产率[10,12].
由图3C可知,厌氧降解8:2FTOH时,随着培养时间的延长,多氟类降解产物的摩尔产率一般先增加后降低或波动降低.导致多氟类降解产物摩尔产率降低的原因可能包含2个方面:挥发到气相中或被进一步生物降解.首先,对8:2FTCA、8:2FTUA、7:3acid和7:3Uacid等氟调聚酸类降解产物而言,其pKa较低(< 4.0)[33],而实验实测pH值介于7.3 ~ 8.1之间,为弱碱性,因此这类物质一般以蒸汽压较低的离子形式存在,可以忽略实验过程中的挥发性损失,所以导致氟调聚酸类降解产物摩尔产率降低的原因应该是生物降解.但是对蒸汽压较高的 7:2sFTOH而言,导致其摩尔产率波动的原因则既可能是挥发损失,也可能是生物降解,这有待进一步研究确认.
由图3D可知,PFCAs类降解产物的摩尔产率均随着培养时间的增加而增加,其中PFOA的摩尔产率最高,实验结束时高达(14.9±1.0)%,然后依次是PFHxA、PFBA、PFPeA和PFHpA,实验结束时分别为(7.4±0.5)%、(4.2±0.2)%、(2.3± 0.1)%和(0.85±0.09)%.令人惊奇的是实验结束时,摩尔产率最低的不是氟碳链长最短的PFBA(C4),而是链长较长的PFHpA(C7).实际上,由图3D可知,偶数碳链长的摩尔产率一般高于奇数碳链长,目前导致这种现象的原因并不明确,可能和其降解途径有关,例如 PFOA可由降解中间产物7:2sFTOH 直接好氧转化生成[10,12],不过在厌氧条件下,该转化过程并没有得到证实.PFOA等PFCAs类降解产物的摩尔产率不仅远高于Zhang等[14]报道的厌氧降解,甚至也高于好氧降解[9-12,34].这可能是因为投加的 VB12对厌氧生物还原降解8:2FTOH具有一定的催化活性,从而更易生成 PFCAs等物质,但这有待进一步研究.由于PFCAs类降解产物具有非常高的稳定性,目前还没有证据证明可被生物转化降解,因此其应该是8:2FTOH的最终厌氧降解产物.
3 结论
3.1 8:2FTOH可被厌氧生物还原降解,且降解过程符合双指数衰减模型,生成氟离子以及8:2FTCA、8:2FTUA、7:3acid、7:3Uacid、7:2sFTOH等多氟类降解产物和PFOA、PFHpA、PFHxA、PFHpA、PFBA等全氟类降解产物;但却没有检出更短链长的PFPrA、TFA和动物体内可转化生成的PFNA等.
3.2 8:2FTUA是摩尔产率最高的多氟类降解产物,然后依次是 7:3acid、8:2FTCA、7:3Uacid和7:2sFTOH;PFOA是摩尔产率最高的全氟类降解产物,然后依次是 PFHxA、PFBA、PFPeA和PFHpA.
3.3 多氟类降解产物可被进一步生物转化,而全氟类降解产物则是 8:2FTOH最终厌氧降解产物.
[1] Kissa E. Fluorinated surfactants and repellents [M]. New York:Marcel Dekker Inc., 2001.
[2] Kotthoff M, Müller J, Jürling H, et al. Perfluoroalkyl and polyfluoroalkyl substances in consumer products [J]. Environmental Science and Pollution Research, 2015,22(19):14546-14559.
[3] Krafft M P, Riess J G. Selected physicochemical aspects of polyand perfluoroalkylated substances relevant to performance, environment and sustainability–Part one [J]. Chemosphere, 2015,129:4-19.
[4] Ding G, Peijnenburg W J G M. Physicochemical properties and aquatic toxicity of polyand perfluorinated compounds [J]. Critical Review in Environmental Science and Technology, 2013,6(43):598-678.
[5] Liu C, Deng J, Yu L, et al. Endocrine disruption and reproductive impairment in zebrafish by exposure to 8:2fluorotelomer alcohol [J]. Aquatic Toxicology, 2010,96(1):70-76.
[6] Serex T, Anand S, Munley S, et al. Toxicological evaluation of 6:2 fluorotelomer alcohol [J]. Toxicology, 2014,319:1-9.
[7] O’Connor J C, Munley S M, Serex T L, et al. Evaluation of the reproductive and developmental toxicity of 6:2fluorotelomer alcohol in rats [J]. Toxicology, 2014,317:6-16.
[8] Fasano W J. Absorption, distribution, metabolism, and elimination of 8-2fluorotelomer alcohol in the rat [J]. Toxicological Sciences, 2006,91(2):341-355.
[9] Liu J, Lee L S, Nies L F, et al. Biotransformation of 8:2fluorotelomer alcohol in soil and by soil bacteria Isolates [J]. Environmental Science & Technology, 2007,41(23):8024-8030.
[10] Wang N, Szostek B, Buck R C, et al. 8-2 Fluorotelomer alcohol aerobic soil biodegradation: Pathways, metabolites, and
metabolite yields [J]. Chemosphere, 2009,75(8):1089-1096.
[11] Kim M H, Wang N, McDonald T, et al. Biodefluorination and biotransformation of fluorotelomer alcohols by two alkanedegrading Pseudomonas strains [J]. Biotechnology and Bioengineering, 2012,109(12):3041-3048.
[12] Butt C M, Muir D C G, Mabury S A. Biotransformation pathways of fluorotelomer-based polyfluoroalkyl substances: A review [J]. Environmental Toxicology and Chemistry, 2014,33(2):243-267.
[13] Sáez M, de Voogt P, Parsons J R. Persistence of perfluoroalkylated substances in closed bottle tests with municipal sewage sludge [J]. Environmental Science and Pollution Research, 2008,15(6):472-477.
[14] Zhang S, Szostek B, Mccausland P K, et al. 6:2 and 8:2 Fluorotelomer alcohol anaerobic biotransformation in digester sludge from a WWTP under methanogenic conditions [J]. Environmental Science & Technology, 2013,47(9):4227-4235.
[15] Sun H, Gerecke A C, Giger W, et al. Long-chain perfluorinated chemicals in digested sewage sludges in Switzerland [J]. Environmental Pollution, 2011,159(2):654-662.
[16] Huset C A, Barlaz M A, Barofsky D F, et al. Quantitative determination of fluorochemicals in municipal landfill leachates [J]. Chemosphere, 2011,82(10):1380-1386.
[17] Benskin J P, Li B, Ikonomou M G, et al. Per- and polyfluoroalkyl substances in landfill leachate: Patterns, time trends, and sources [J]. Environmental Science & Technology, 2012,46(21):11532-11540.
[18] Allred B M, Lang J R, Barlaz M A, et al. Physical and biological release of poly- and perfluoroalkyl substances (PFASs) from municipal solid waste in anaerobic model landfill reactors [J]. Environmental Science & Technology, 2015,49(13):7648-7656.
[19] 李 飞,曾庆玲,张超杰,等.长江三角洲地区污水厂污泥中全氟有机酸污染特征 [J]. 中国科学:化学, 2012(6):831-843.
[20] Liu J, Lee L S. Solubility and sorption by soils of 8:2fluorotelomer alcohol in water and cosolvent systems [J]. Environmental Science & Technology, 2005,39(19):7535-7540.
[21] Costentin C, Robert M, Savéant J. Does catalysis of reductive dechlorination of tetra- and trichloroethylenes by Vitamin B12and corrinoid-based dehalogenases follow an electron transfer mechanism? [J]. Journal of the American Chemical Society, 2005, 127(35):12154-12155.
[22] Lexa D, Saveant J. The electrochemistry of Vitamin B12[J]. Account of Chemical Research, 1983,16(7):235-243.
[23] He J, Holmes V F, Lee P K H, et al. Influence of Vitamin B12and cocultures on the growth of dehalococcoides isolates in defined medium [J]. Applied and Environmental Microbiology, 2007, 73(9):2847-2853.
[24] Koenig J C, Lee M J, Manefield M. Successful microcosm demonstration of a strategy for biodegradation of a mixture of carbon tetrachloride and perchloroethene harnessing sulfate reducing and dehalorespiring bacteria [J]. Journal of Hazardous Materials, 2012,219-220:169-175.
[25] Zou S, Stensel H D, Ferguson J F. Carbon tetrachloride degradation: Effect of microbial growth substrate and Vitamin B12content [J]. Environmental Science & Technology, 2000, 34(9):1751-1757.
[26] Guerrero-Barajas C, Field J A. Enhancement of anaerobic carbon tetrachloride biotransformation in methanogenic sludge with redox active vitamins [J]. Biodegradation, 2005,16(3):215-228.
[27] Shan H, Kurtz Jr H D, Freedman D L. Evaluation of strategies for anaerobic bioremediation of high concentrations of halomethanes [J]. Water Research, 2010,44(5):1317-1328.
[28] Guerrero-Barajas C, Field J A. Enhanced anaerobic biotransformation of carbon tetrachloride with precursors of vitamin B12biosynthesis [J]. Biodegradation, 2006,17(4):317-329.
[29] Chang B, Yuan S, Ren Y. Anaerobic degradation of tetrabromobisphenol-A in river sediment [J]. Ecological Engineering, 2012,49:73-76.
[30] Wang J, Fu Z, Liu G, et al. Mediators-assisted reductive biotransformation of tetrabromobisphenol-A by Shewanella sp. XB [J]. Bioresource Technology, 2013,142:192-197.
[31] Gregorich E G, Beare M H, Stoklas U, et al. Biodegradability of soluble organic matter in maize-cropped soils [J]. Geoderma, 2003,113(3/4):237-252.
[32] Bowen S R, Gregorich E G, Hopkins D W. Biochemical properties and biodegradation of dissolved organic matter from soils [J]. Biology and Fertility of Soils, 2009,45(7):733-742.
[33] Goss K. The pKavalues of PFOA and other highly fluorinated carboxylic acids [J]. Environmental Science & Technology, 2008, 42(2):456-458.
[34] Wang N, Szostek B, Folsom P W, et al. Aerobic biotransformation of14C-labeled 8-2telomer B alcohol by activated sludge from a domestic sewage treatment plant [J]. Environmental Science & Technology, 2005,39(2):531-538.
Anaerobic biodegradability of 8:2 fluorotelomer alcohol (8:2 FTOH).
LI Fei, CHEN Yi-dan, YANG Zhi-min, HUANG Hua-shan, ZHOU Zhen-ming, YUAN Bao-ling*(College of Civil Engineering, Huaqiao University, Xiamen 361021, China). China Environmental Science, 2016,36(11):3295~3303
To elucidate the trends and fates of perfluorochemicals such as perfluorocarboxylates (PFCAs) under anaerobic environments, the anaerobic biodegradability of 8:2 fluorotemoler alcohol (8:2 FTOH) was studied. The results indicated that 8:2 FTOH could be decomposed under anaerobic conditions by sewage sludge collected from a municipal wastewater treatment plant, and produce fluoride, per- and poly-fluorinated compounds, and the decomposition data perfectly fitted a double exponential decay model. With an incubation time of 120d, the final molar degradation rate of 8:2 FTOH was up to (93.2±0.9)%, while its molar recoveries decreased with the incubation time, from (97.5±5.1)% at the beginning (1d) to (68.9±4.0)% at the end (120 d). These results indicated that some unknown or volatile products have been generated at the late of incubation. 2H-perfluoro-2-decenoic acid (8:2 FTUA) and perfluorooctanoic acid (PFOA) were the most abundant of poly- and perfluorinated products with the molar yields ranged from (6.94±0.10 )% to (24.2±1.5)% and from (2.67±0.22)% to (14.9±1.0)%, respectively. With increasement of incubation time, the molar yields of polyfluorinated products firstly increased and then decreased, while the molar yields of perfluorinated products consistently increased, indicated that they might be the intermediate and final biodegradation products, respectively.
8:2 FTOH;anaerobic biodegradation;biodegradation products;trends
X703
A
1000-6923(2016)11-3295-09
李 飞(1981-),男,山东临沂人,副教授,博士,主要研究方向为水污染控制与持久性有机污染物控制.发表论文20篇.
2016-03-11
国家自然科学基金资助项目(51278206,51378227, 51408243);福建省国际科技合作重点项目(2014I0013);福建省高等学校杰出青年科研人才培养计划(JA14014)
* 责任作者, 教授, blyuan@hqu.edu.cn
