铬胁迫对西红花叶片蛋白表达谱的影响
2016-12-20饶君凤吕伟德曹方彬
饶君凤, 吕伟德, 曹方彬
(1. 杭州职业技术学院,浙江 杭州 310018; 2. 浙江大学 农业与生物技术学院,浙江 杭州 310058)
表1 铬胁迫下西红花叶片表达下调的蛋白
表2 铬胁迫下西红花叶片表达上调的蛋白
铬胁迫对西红花叶片蛋白表达谱的影响
饶君凤1, 吕伟德1, 曹方彬2
(1. 杭州职业技术学院,浙江 杭州 310018; 2. 浙江大学 农业与生物技术学院,浙江 杭州 310058)
铬是植物的非必需元素,对植物的生长发育具有显著的抑制作用.采用双向电泳和质谱技术,研究了铬胁迫对西红花叶片蛋白表达的影响.通过质谱技术,成功鉴定出9个在铬胁迫后下调表达的蛋白,分别为细胞分裂循环蛋白48、ATP合成酶α亚基、核酮糖二磷酸羧化酶长链(2个)、未知蛋白、核酮糖二磷酸羧化加氧酶、蛋白酶体α亚基、铁蛋白和蛋白酶体β亚基;6个上调表达的蛋白,分别为蔗糖合酶、真核起始因子4A、α-1,4-葡聚糖蛋白合成酶、1-氨基环丙烷-1-羧酸氧化酶、异黄酮还原酶类似物IRL和未知蛋白.以上结果为研究植物响应铬胁迫的分子机制提供了参考.
铬;西红花;叶片;蛋白组
铬(Chromium, Cr),特别是六价铬Cr(VI)被认为是与镉、汞、铅并列的最危险、毒害最大的主要重金属污染物之一.近年来,电镀、制革、冶炼等工业活动的加快发展,使得环境中的铬含量大幅增加[1],由此带来的环境污染问题已引起广泛关注.据统计,我国每年排放铬渣近60万t,累计堆存达600万t,而经过解毒处理或回收利用的却不足17%[2].土壤中的铬不断累积,并最终通过食物链危害人类健康,甚至引发癌症[3-4].铬对植物来说同样具有较高的毒性,并对植物的生长发育具有显著的抑制作用[5].铬胁迫通过影响光合作用过程中的一些重要参数,如CO2的固定、电子链的传递、光合磷酸化和关键酶的活性,抑制植物的光合作用[5].因此,铬毒害对农业可持续发展和人类的生存质量构成了较大的威胁,铬污染治理及其作用机理研究迫在眉睫.
西红花是一种贵细中药材和常用的色素,别名番红花和藏红花,基源为鸢尾科植物番红花Crocus sativus L.的干燥柱头.西红花具有活血、凉血、解毒、解郁、安神的功效.药理研究表明,西红花具有降血脂、降血压、抗动脉粥样硬化、抗细胞凋亡、抗氧化、抗自由基、抑制肿瘤细胞增殖等作用.因其药用部位仅是柱头,产量很低,加上西红花只能靠种球培育,种球退化严重,对栽培技术要求又很高,一直处于供不应求的状态.为提高西红花的产量和品质,有必要对影响西红花生长的各因素加以研究.本研究采用双向电泳和质谱技术研究铬胁迫对西红花叶片蛋白表达谱的影响并鉴定相关蛋白.研究结果可为培育西红花铬低积累品种提供参考.
1 材料与方法
土培试验于杭州职业技术学院温室内进行,每个实验设置4个生物学重复.试验使用土壤为营养土,每盆装2 kg土(盆体积5 L、高22 cm).移栽前1个月,向土壤中添加铬溶液形成50 mg·kg-1铬处理样品,对照组中添加相同体积水.添加铬溶液后,在温室内平衡30 d.将西红花种球置于阴暗通风的架子上发芽.约60 d后,将发芽一致的西红花移栽于不同处理土壤中,每盆4株.处理30 d后采集2处理植株叶片进行蛋白组分析.叶片首先在液氮中速冻,后置于-80 ℃冰箱中保存.
2 蛋白组学分析
将4个生物学重复的叶片组成一个混样,将叶片切细后置于液氮冷冻过的研钵中,加入液氮迅速研磨至无明显颗粒粉末.加入PVPP,并将粉末转移至50 mL离心管中.叶片蛋白质的提取方法参考文献[6],并略有修改.提取出的蛋白质样品采用牛血清标准品定量.
采用双向电泳技术分离蛋白质,随即银染显色.试验中所用的试剂均为电泳级.第1维等电使用的程序:S1,500 V,1 h;S2,1 000 V,1 h;S3,8 000 V,3 h;S4,8 000 V,5 h.第2维SDS-PAGE电泳程序:S1,2 W·gel-1,1 h;S2,17 W·gel-1,约4.5 h.电泳结束即进行染色[7].染色后的凝胶使用PowerLook1100扫描仪进行扫描和标准化处理,参数设置参考文献[7].用ImageMaster 2D platinum 5.0(GE)进行分析.将选出的目标蛋白点从胶中挖出,采用胰蛋白酶进行酶解[6].首先采用双蒸水洗涤2次;加入50%甲醇洗脱至无色;每管加入ACN,震荡脱水后加入100 mmoL·L-1NH4HCO3,完全吸胀后吸出,再加入50% CAN进行吸胀;加入CAN脱水至胶粒完全干燥;于37 ℃培养箱中加入胰酶酶切12~16 h.
将酶切后的肽段进行抽提:超声处理15 min,加入成分为90%ACN和2.5%TFA的抽提液60 μL,振荡10 min,将抽提液转至新EP管中,真空干燥;加入30%ACN(含0.1%TFA)的重溶液重新溶解肽段.将肽段溶液点靶上机,当液滴挥发至原体积的1/3时,加入含5 mg·mL-1HCCA(溶于50% ACN和0.1% TFA)的基质于样品上,待完全干燥后将样品送入Ultraflex III TOF/TOF质谱仪(Bruker Dalton,德国)进行质谱分析.相关参数设置参考文献[7].使用flexAnalysis(Bruker Dalton)过滤基线峰、识别信号峰,并采用BioTools(Bruker Dalton)搜索NCBI数据库,查找匹配蛋白质,并查询相关功能,鉴定蛋白质种类,查询条件参照文献[7].检索后得分最高者为目标蛋白.
3 结 果
图1和2分别是西红花叶片对照组和铬处理组的蛋白质图谱.铬处理和对照样品中蛋白质点数分别为1 384和1 588个.当以变化超过1.5倍为基础时,与对照组相比,铬处理组分别有91和101个蛋白点上调和下调表达.其中,通过MALDI-TOF-TOF-MS成功鉴定出9个下调表达和6个上调表达的蛋白(见表1,表2,图1~3).9个下调表达的蛋白分别为细胞分裂循环蛋白48(D1)、ATP合成酶α亚基(D2)、核酮糖二磷酸羧化酶长链(D3、D4)、未知蛋白(D5)、核酮糖二磷酸羧化加氧酶(D6)、蛋白酶体α亚基(D7)、铁蛋白(D8)和蛋白酶体β亚基(D9).与对照相比,这些蛋白的表达倍数分别为-1.64,-1.99,-1.87,-2.04,-106,-106,-3.46,-1.58和-1.61.其中,有4个蛋白点(核酮糖二磷酸羧化酶长链和铁蛋白)参与了植物的光合作用.
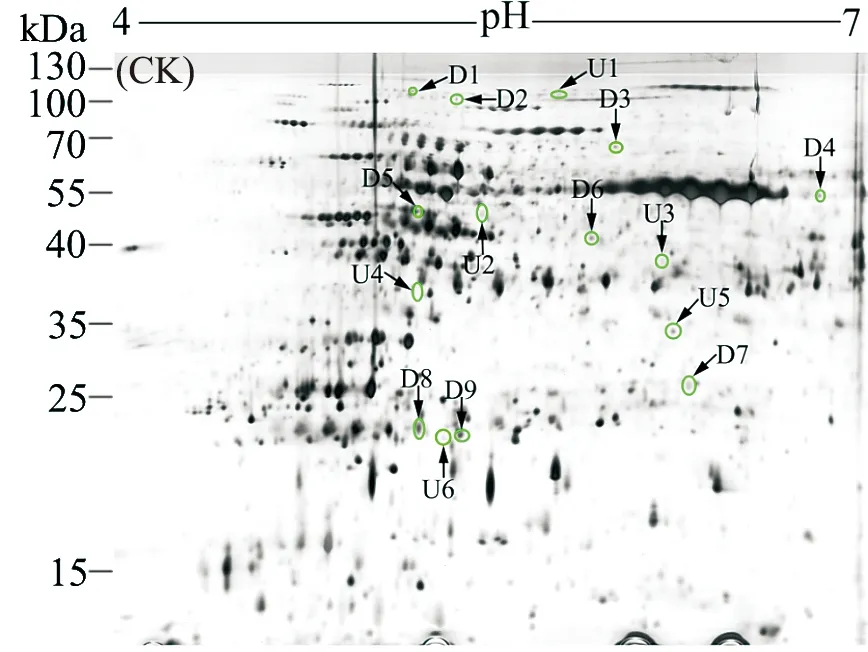
图1 对照条件下西红花叶片双向电泳图Fig.1 Representative 2-DE maps of saffron leaf proteins isolated from control conditionTotal proteins were extracted and separated by 2-DE. In IEF,100 mg proteins were loaded onto pH 4-7 IPG strips (24 cm,linear). SDS-PAGE was performed with 12.5% gels. The spots were visualized by silver staining. Differentially accumulated protein spots are indicated by green sashes. Six higher expressed spots (U) and nine suppressed (D) spots are shown in the maps.
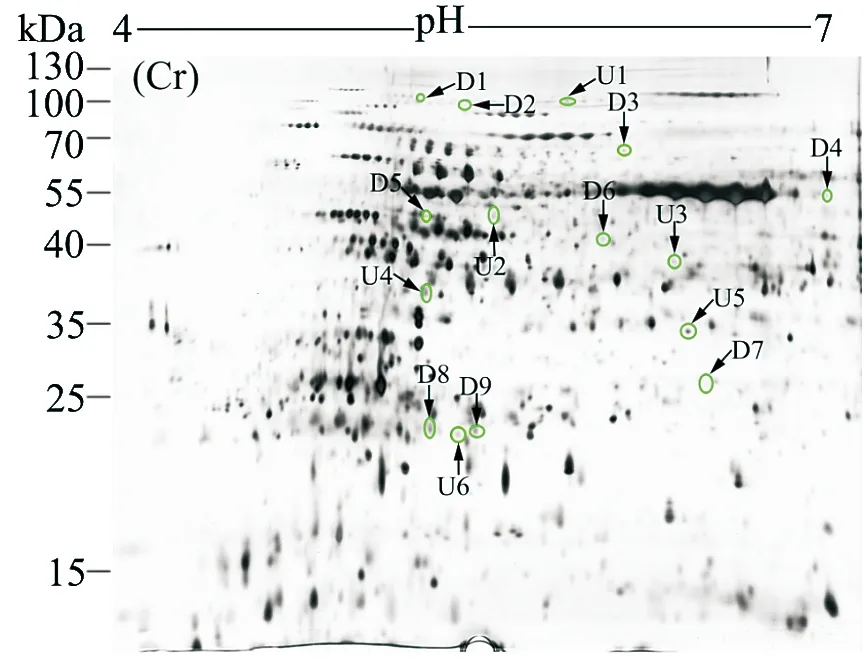
图2 50 mg·kg-1铬胁迫下西红花叶片双向电泳图Fig.2 Representative 2-DE maps of saffron leaf proteins isolated from 50 mg·kg-1 Cr treatmentTotal proteins were extracted and separated by 2-DE. In IEF,100 mg proteins were loaded onto pH 4-7 IPG strips (24 cm,linear). SDS-PAGE was performed with 12.5% gels. The spots were visualized by silver staining. Differentially accumulated protein spots are indicated by green sashes. Six higher expressed spots(U) and nine suppressed (D) spots are shown in the maps.
表1 铬胁迫下西红花叶片表达下调的蛋白

Table 1 Proteins whose expression were significantly down-accumulated in leaves of saffron under Cr stress
表2 铬胁迫下西红花叶片表达上调的蛋白
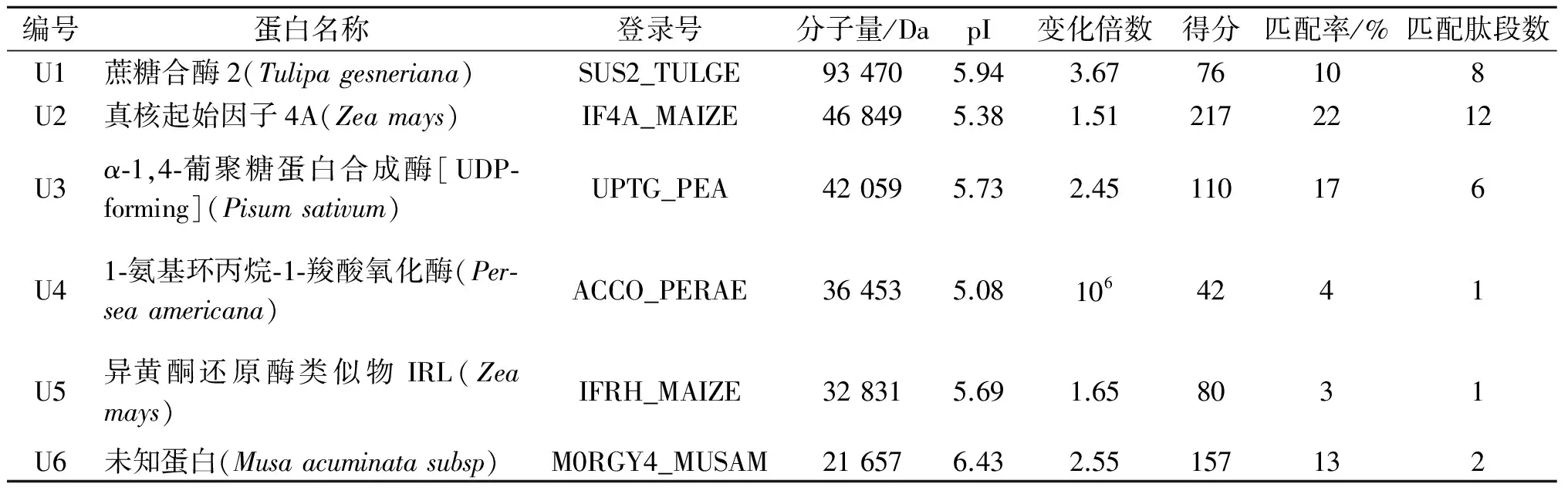
Table 2 Proteins whose expression were significantly induced in leaves of saffron under Cr stress

图3 50 mg·kg-1铬处理30 d后西红花叶片差异蛋白的点图Fig.3 Spot view of the identified proteins in leaves after 50 mg·kg-1 Cr treatment for 30 d
与对照组相比,铬处理后表达上调的蛋白分别为蔗糖合酶(U1)、真核起始因子4A(U2)、α-1,4-葡聚糖蛋白合成酶(U3)、1-氨基环丙烷-1-羧酸氧化酶(U4)、异黄酮还原酶类似物IRL(U5)和未知蛋白(U6).与对照相比,上调表达的倍数分别为3.67,1.51,2.45,106,1.65和2.55.
4 讨 论
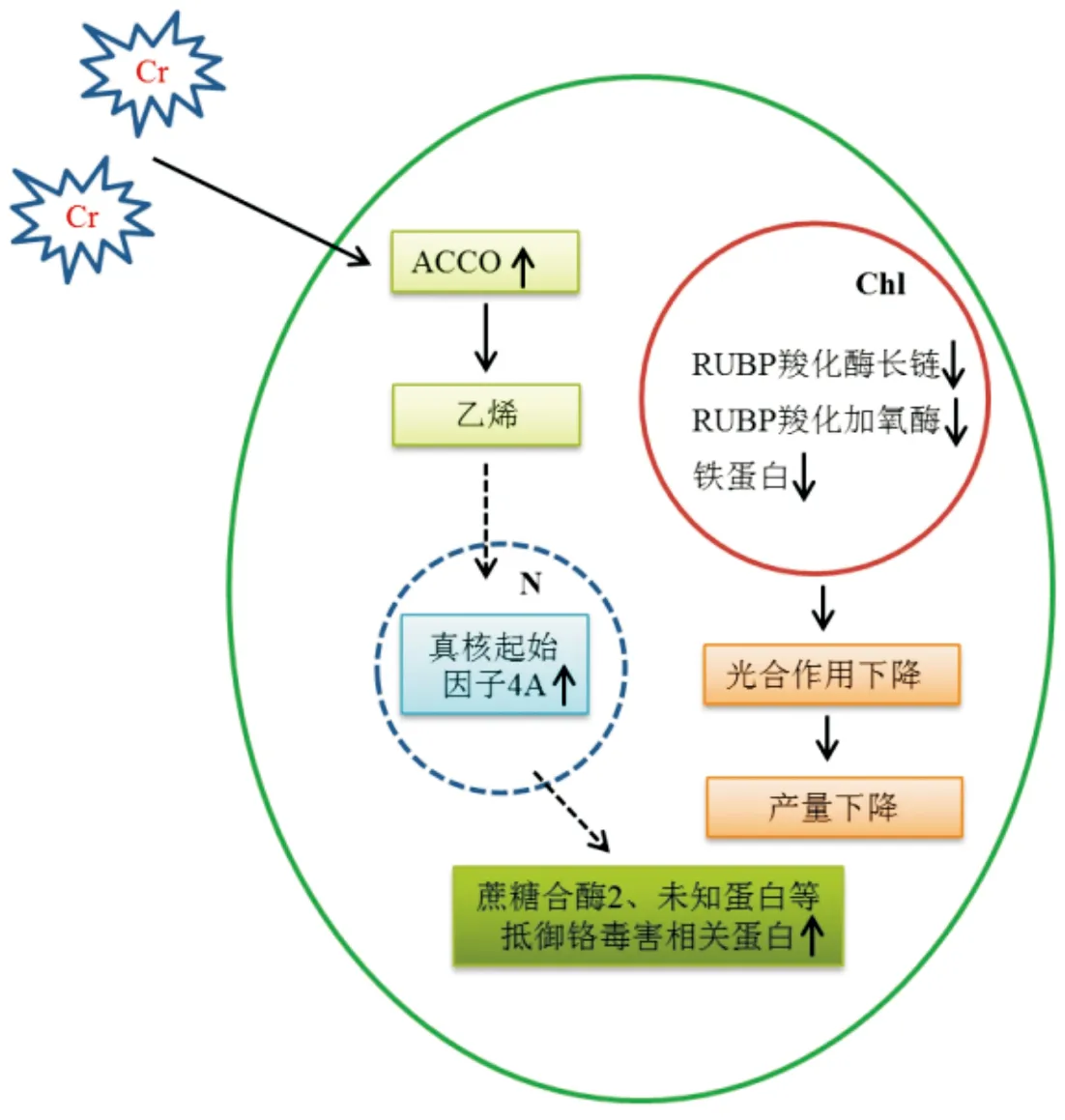
图4 基于双向电泳分析的西红花铬解毒机制及对光合作用的影响Fig.4 Detoxification mechanism of saffron under Cr stress and the effect of Cr on photosynthesis ACCO—1-氨基环丙烷-1-羧酸氧化酶;Chl—叶绿体;N—细胞核
铬对植物的毒害作用已被广泛研究.铬不仅影响植物许多重要的生理生化过程,而且会降低作物的产量和品质[8-9].本研究在9个下调表达的蛋白中,发现有4个蛋白,核酮糖二磷酸羧化酶长链(D3、D4)、核酮糖二磷酸羧化加氧酶(D6)和铁蛋白(D8)参与了植物的光合作用.表明,铬毒害对西红花的光合系统造成了损伤,进而有可能降低西红花的产量(见图4).而细胞分裂循环蛋白48(D1)的下调表达表明铬毒害抑制了西红花正常的细胞分裂.有研究发现,ATPase与植物的重金属积累和耐性密切相关.如MIYADATE等[10]发现了一种P1B型ATP酶(OsHMA3)通过介导镉向液泡的流出从而影响镉由地下部向地上部的转运.本研究中,ATPase的表达显著降低,表明铬毒害条件下,西红花的解毒能力可能受到了抑制.此外,发现了2个蛋白酶复合体,说明铬胁迫下西红花正常的蛋白质降解受到了显著的抑制,从而使大量无用蛋白累积,对西红花的正常生长造成了影响.
经过长期进化,植物具有一定的解毒机制.本研究发现蔗糖合成酶2在铬胁迫后上调表达.李运合等[11]发现外源NO通过促进蔗糖合成酶活性的提高以增强玉米幼苗对盐胁迫的抗性.本文蔗糖合成酶2的上调表达可能会提高西红花对铬胁迫的抗性.1-氨基环丙烷-1-羧酸氧化酶(ACCO,U5)催化乙烯合成路径的最后一步[12];乙烯信号转导途径在植物抵抗非生物胁迫时具有重要作用.真核起始因子的上调表达也将有助于西红花在铬胁迫下蛋白质的正常翻译.因此,在以上差异蛋白的基础上,提出了西红花铬解毒的调控示意图(见图4).
此外,在上调和下调表达蛋白中也发现了功能未知的蛋白.虽然目前功能未知,但这些蛋白可能在西红花抵御铬毒害时发挥了非常重要的作用,未来可做进一步鉴定.
[1] ZAYED A M, TERRY N. Chromium in the environment: Factors affecting biological remediation[J]. Plant and Soil,2003,249:139-156.
[2] 刘婉,李泽琴.水中铬污染治理的研究进展[J].广东微量元素科学,2008,14:5-9. LIU Wan, LI Zeqin. Development of governance of chromium pollution in water[J]. Guangzhou Trace Element Science,2008,14:5-9.
[3] PANDA S K, CHOUDHURY S. Chromium stress in plants[J]. Brazilian Journal of Plant Physiology,2005,17:95-102.
[4] 朱建华,王莉莉.不同价态铬的毒性及其对人类的影响[J].环境与开发,1997,12:46-48. ZHU Jianhua, WANG Lili. The toxicity of different valence chromium and effect on human body[J]. Environment and Exploitation, 1997,12:46-48.
[5] SHANKER A K, CERVANTES C, LOZA-TAVERA H, et al. Chromium toxicity in plants[J]. Environment International,2005,31:739-753.
[6] CAI Y, CAO F, WEI K, et al. Genotypic dependent effect of exogenous glutathione on Cd-induced changes in proteins, ultrastructure and antioxidant defense enzymes in rice seedlings[J]. Journal of Hazardous Materials, 2011,192:1056-1066.
[7] 吴德志.西藏野生大麦耐盐种质的发掘及其耐盐机制研究[D].杭州:浙江大学,2012. WU Dezhi. Exploration of Salt-Tolerant Germplasm and Its Mechanism in Tibetan Wild Barley[D]. Hangzhou: Zhejiang University, 2012.
[8] ZENG F, QIU B Y, WU X J, et al. Glutathione-mediated alleviation of chromium toxicity in rice plants[J]. Biological Trace Element Research, 2012,148:255-263.
[9] CAO F, WANG N, ZHANG M, et al. Comparative study of alleviating effects of GSH, Se and Zn under combined contamination of cadmium and chromium in rice (Oryza sativa) [J]. Biometals, 2013,26:297-308.
[10] MIYADATE H, ADACHI S, HIRAIZUMI A, et al. OsHMA3, a P1B- type of ATPase affects root- to- shoot cadmium translocation in rice by mediating efflux into vacuoles[J]. New Phytologist, 2011,189:190-199.
[11] 李运合,钱善勤,覃逸明.盐胁迫下外源NO对玉米幼苗叶片蔗糖代谢的影响[J].湖北农业科学,2010,49(7):1589-1592. LI Yunhe, QIAN Shanqin, QIN Yiming. Effect of exogenous nitric oxide on sucrose metabolism of maize seedlings leaves under salt stress[J]. Hubei Agricultural Sciences, 2010,49(7):1589-1592.
[12] HERBETTE S, TACONNAT L, HUGOUVIEUX V, et al. Genome-wide transcriptome profiling of the early cadmium response of Arabidopsis roots and shoots[J]. Biochimie, 2006,88:1751-1765.
RAO Junfeng1, LYU Weide1, CAO Fangbin2
(HangzhouVocational&TechnicalCollege,Hangzhou310018,China; 2.CollegeofAgricultureandBiotechnology,ZhejiangUniversity,Hangzhou310058,China)
Effect of chromium stress on protein profiles in saffron. Journal of Zhejiang University(Science Edition), 2016,43(6):751-755
Chromium (Cr) is a nonessential element for plants. Cr not only affects a series of physiological processes in plants, but also significantly inhibits the growth and development of plants. Under Cr stress, plants have evolved complex detoxification mechanisms. In the present study, we investigated the protein expression of leaves of saffron in response to Cr stress via 2D electrophoresis and mass spectrum analysis. Nine proteins were identified to be down-regulated under Cr stress, including cell division cycle protein 48 homolog, ATP synthase subunit alpha, ribulose bisphosphate carboxylase large chain, Proteasome subunit alpha type, etc. Six proteins were up-regulated, including sucrose synthase 2, eukaryotic initiation factor 4A, Alpha-1,4-glucan-protein synthase, 1-aminocyclopropane-1-carboxylate oxidase and Isoflavone reductase homolog IRL, etc. The results provide valuable insights towards the molecular mechanism of saffron in response to Cr toxicity.
chromium; saffron; leaf; proteomics

2015-11-02.
科技部国家星火计划项目(2015GA700053);浙江省自然科学基金资助项目(LY13B020001);浙江省科技厅公益技术研究农业项目(2015C32104).
饶君凤(1969-),ORCID:http://orcid.org/0000-0000-0002-069X,女,副教授,主要从事中药品质评价和资源应用研究,E-mail:13588867756@139.com.
10.3785/j.issn.1008-9497.2016.06.022
R 282.2
A
1008-9497(2016)06-751-05
