三七酚类成分特征图谱质量表征关联评价研究
2016-12-19孙道涵杨书娟申立峰胡少伟周德勇姜艳艳石任兵
杨 元 陈 唯 张 芳 孔 静 孙道涵 冯 朵 杨书娟 申立峰 胡少伟 周德勇 潘 婷 姜艳艳,3 石任兵,3
(1 北京中医药大学中药学院,北京,100029; 2 首都医科大学,北京,100000; 3 北京市教委中药质量控制技术工程中心,北京,100029)
中药研究
三七酚类成分特征图谱质量表征关联评价研究
杨 元1陈 唯1张 芳1孔 静1孙道涵1冯 朵1杨书娟1申立峰2胡少伟1周德勇1潘 婷1姜艳艳1,3石任兵1,3
(1 北京中医药大学中药学院,北京,100029; 2 首都医科大学,北京,100000; 3 北京市教委中药质量控制技术工程中心,北京,100029)
采用HPLC-PDA法建立三七酚类成分特征图谱,筛选9个特征峰并通过相对保留时间表征其质量关联性,同时测定对羟基苯甲酸、槲皮素、山柰酚、异鼠李素含量,以对羟基苯甲酸为对照表征酚酸类含量,采用分光光度法测定三七中总酚含量,从而对三七酚类成分含量及其相对比值进行质量表征,然后对三七中各酚类成分含量进行关联分析,从而发现各成分含量的关联性、质量分布规律性,同时将不同批次的药材与经过药效验证的参比药材进行关联度分析,结合关联度分析,筛选出质量优佳三七药材;运用本方法可全面精确的控制和评价三七的质量。
三七;特征图谱;槲皮素;山柰酚;异鼠李素;总酚;关联分析
三七为五加科植物三七Panaxnotoginseng(Burk.)F.H.Chen的干燥根和根茎。具有散瘀止血,消肿定痛的功效;用于咯血,吐血,衄血,便血,崩漏,外伤出血,胸腹刺痛,跌扑肿痛。在2015版《中国药典》中以三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1的总量对三七进行质量控制[1];文献对三七的质量表征研究贡献在皂苷类[2-3]、氨基酸类[4-12]、总黄酮[13-16]的含量测定方面,而对酚类指标性成分、总酚含量测定方面尚未见报道。
然中药的质量表征和质量评价应为其相关药物体系所导向[21]。银荷三七参方为王永炎院士拟定的临床经验方,由银杏叶、三七、人参、荷叶组成,三七为其组方主要药味。笔者在研究本方药物制备物药学-药效质量表征关联分析时发现,组方中酚类成分的含量及其相对比值的变化,对其活血止血功效有显著性影响。可见,要实现三七药物质量精准预期,需关联其药物体系进行质量表征。
因此,本文建立了三七酚类成分特征图谱及对羟基苯甲酸、槲皮素、山柰酚、异鼠李素、总酚的含量测定方法,从而对三七酚类成分含量进行测定与质量表征,然后对三七中各酚类成分含量进行关联分析,从而发现各成分含量的关联性、质量分布规律性,同时运用课题组所建立的中药药物质量表征关联评价模式[17-20],进行有效指标性成分-类型-比值质量表征关联分析评价,筛选出质量优佳三七药材,以实现三七药物质量精准控制。
1 材料与方法
1.1 仪器与试药 Waters 2695自动进样高效液相色谱仪,2996PDA检测器,Empower工作站;TU-1810型紫外-可见分光光度计(北京普析通用仪器有限公司);Sartorius-BT25S型1/100000电子分析天平、KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)。对羟基苯甲酸(批号:yy91251,纯度≥98%)、槲皮素(批号:YY90129,纯度≥98%)、山柰酚(批号:YY90129,纯度≥98%)、异鼠李素(批号:YY90190,纯度≥98%),均购自上海源叶生物科技有限公司。乙腈(色谱级,Fisher Scientific公司);甲醇(AR),购自北京化学试剂公司;娃哈哈纯净水(杭州娃哈哈集团有限公司);三氯化铁(AR),购自天津市申泰化学试剂有限公司;铁氰化钾(AR),购自广东汕头市西陇化工厂;浓盐酸(AR),购自北京化工厂;其余试剂均为分析纯。15批三七药材购自北京市各药店,经北京中医药大学刘春生教授鉴定均为Panaxnotoginseng(Burk.)F.H.Chen的干燥根与根茎。药材样品现存于北京中医药大学中药学院中药化学系。
1.2 方法
1.2.1 特征图谱方法学考察及指标性成分含量测定
1.2.1.1 对照品溶液的制备 取对羟基苯甲酸、槲皮素、山柰酚、异鼠李素对照品适量,精密称定,加甲醇制成每毫升各含对羟基苯甲酸10 μg、槲皮素71.8 μg、山柰酚40 μg、异鼠李素29.2 μg的混合溶液,即得。
1.2.1.2 供试品溶液的制备 取本品粉末(过四号筛)约10 g,置于具塞锥形瓶中,精密加入70%甲醇300 mL,密塞,称定重量,放置过夜,置80 ℃水浴保持微沸3 h,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,精密量取续滤液250 mL,回收溶剂至干,残渣加30 mL水溶解,转移至50 mL量瓶中,超声处理(功率300 W,频率50 kHz)30 min,取出,放冷,加水至刻度,摇匀,静置,精密量取上清液40 mL,加入聚酰胺柱(100~200目,5 g,内径1.5 cm,用水湿法装柱)上,用20 mL水洗除杂,然后用50 mL5%氨水-甲醇洗脱,收集洗脱液,回收溶剂至干,残渣加甲醇-25%盐酸溶液(4∶1)混合溶液5 mL,加热回流30 min,放冷,转移至10 mL量瓶中,加甲醇置刻度,摇匀,即得供试品溶液。
1.2.1.3 色谱条件 waters Atlantis色谱柱(5 μm,4.6 mm×250 mm),流动相为乙腈(A)-0.2%磷酸水(B)梯度洗脱(洗脱梯度0~12 min,12%A;12~60 min,12%~55% A),流速1.0 mL/min,柱温30 ℃,检测波长260 nm,进样量20 μL。在此色谱条件下,对羟基苯甲酸、槲皮素、山柰酚、异鼠李素与其他色谱峰分离度良好,对照品溶液和供试品溶液的HPLC图见图1。

图1 酚类成分HPLC图
1.2.1.4 特征图谱方法学考察 1)特征图谱精密度考察:按照1.2.1.2项下方法制备供试品溶液,按照1.2.1.3项下色谱条件,连续进样测定6次,计算各色谱峰与参比峰(峰5)的相对保留时间及相对峰面积,结果各特征峰相对保留时间RSD均小于0.83%,相对峰面积RSD均小于2.27%,表明精密度良好。2)特征图谱稳定性考察:按照1.2.1.2项下方法制备供试品溶液,按照1.2.1.3项下色谱条件,分别与0、2、4、6、12、24 h分别进样,计算各色谱峰与参比峰(峰5)的相对保留时间及相对峰面积,结果各特征峰相对保留时间RSD均小于0.72%,相对峰面积RSD均小于2.88%,表明样品溶液24 h内稳定。3)特征图谱重复性考察:按照1.2.1.2项下方法平行制备6份供试品溶液,按照1.2.1.3项下色谱条件进样测定,计算各色谱峰与参比峰(峰5)的相对保留时间及相对峰面积,结果各特征峰相对保留时间RSD均小于0.87%,相对峰面积RSD均小于3.78%,表明样品溶液重复性良好。
1.2.1.5 指标性成分含量测定方法 1)线性关系考察:分别精密量取1.2.1.1项下的混合对照品溶液0 mL、1 mL、2 mL、3 mL、4 mL、5 mL,置5 mL量瓶中,加甲醇至刻度,摇匀,即得不同浓度的混合对照品溶液,按照1.2.1.3项下色谱条件,分别进样测定对羟基苯甲酸、槲皮素、山柰酚、异鼠李素峰面积,以对照品的浓度(mg/mL)为横坐标、峰面积为纵坐标,绘制标准曲线,计算回归方程及相关系数为:对羟基苯甲酸:y=4×107x+4171.7,(r=0.999 7,n=6)、槲皮素:y=7×107x+52 081,(r=0.999 2,n=6);山柰酚:y=6×107x-3895 5,(r=0.999 4,n=6);异鼠李素:y=6×107x-37323,(r=0.999 5,n=6)。表明对羟基苯甲酸、槲皮素、山柰酚、异鼠李素分别在0.002~0.01 mg/mL、0.014 3~0.071 7 mg/mL、0.008 0~0.0399 9 mg/mL、0.005 8~0.029 2 mg/mL范围内呈良好的线性关系。2)精密度考察:按照1.2.1.2项下方法制备供试品溶液,按照1.2.1.3项下色谱条件,连续进样测定6次,测定对羟基苯甲酸、槲皮素、山柰酚、异鼠李素峰面积,计算RSD分别为为1.35%、0.83%、1.09%、1.27%,表明精密度良好。3)稳定性试验:按照1.2.1.2项下方法制备供试品溶液,分别于制备后0 h、2 h、4 h、6 h、12 h、24 h按照1.2.1.3项下方法测定峰面积,测得对羟基苯甲酸、槲皮素、山柰酚、异鼠李素峰面积RSD分别为1.45%、1.68%、0.74%、1.59%,表明供试品溶液在24 h内稳定。4)重复性试验:按照1.2.1.2项下方法平行制备供试品溶液6份,按照1.2.1.3项下方法测定峰面积,测得对羟基苯甲酸、槲皮素、山柰酚、异鼠李素平均含量分别为0.0004%、0.0072%、0.0025%、0.0020%,RSD分别为2.53%、1.50%、2.25%、1.51%,表明此方法重复性良好。5)加样回收率考察:精密称取三七粉末约5 g,共6份,加入对照品适量,按照1.2.1.2项下方法制备供试品溶液,按照1.2.1.3项下方法测定峰面积,计算对羟基苯甲酸、槲皮素、山柰酚、异鼠李素平均加样回收率分别为98.25%、97.93%、98.41%、98.67%,RSD分别为为2.54%、2.60%、0.91%、2.08%,表明本方法准确可靠。
1.2.2 总酚含量测定方法
1.2.2.1 供试品溶液的制备 取本品粉末(过四号筛)约0.8 g,置于具塞锥形瓶中,精密加入100 mL 70%甲醇,密塞,称定重量,放置过夜,超声(功率500 W,频率40 kHz)处理1 h,放冷,再称定重量,用70%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得供试品溶液。
1.2.2.2 对照品溶液的制备 取槲皮素对照品适量,精密称定,置棕色量瓶中,加70%甲醇制成含33 μg/mL的溶液,即得。
1.2.2.3 吸光度的测定方法 精密量取供试品溶液适量,置于25 mL棕色量瓶中,加50%甲醇至5 mL,加入0.3%十二烷基硫酸钠溶液2.6 mL,摇匀,加入新配置的0.6%三氯化铁-0.9%铁氰化钾(1:1)混合液2.0 mL,在暗处放置7 min,用0.1%的盐酸定容至25 mL,摇匀后于暗处静置40 min,以相应的试剂为空白,照紫外-可见分光光度法(中国药典通则0401)在780 nm的波长处测定吸光度。
1.2.2.4 线性关系考察 精密量取槲皮素对照品溶液0.1 mL,0.3 mL,0.5 mL,0.7 mL,0.9 mL,按照1.2.2.3项下的方法进行测定,以对照品量(mg)为横坐标,吸光度值为纵坐标绘制标准曲线,并进行线性回归分析,计算回归方程为y=31.554x-0.033 0(r=0.999 5,n=5)。结果表明,槲皮素对照品量在0.003 3~0.029 7 mg范围内与吸光度线性关系良好。
1.2.2.5 重复性试验 按照1.2.2.1项下方法平行制备供试品溶液6份,按照1.2.2.3项下的方法测定吸光度,计算总酚平均含量为1.99%,RSD为0.86%,表明此方法重复性良好。
1.2.2.6 加样回收率考察 精密称取同一三七粉末约0.4 g,共6份,置于具塞锥形瓶中,分别加入对照品适量,然后精密加入100 mL 70%甲醇,密塞,称定重量,放置过夜,超声(功率500 W,频率40 kHz)处理1 h,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得总酚加样回收率供试品溶液;按照1.2.2.3项下的方法测定吸光度,计算总酚平均加样回收率103%,RSD为1.82%,表明本方法准确可靠。
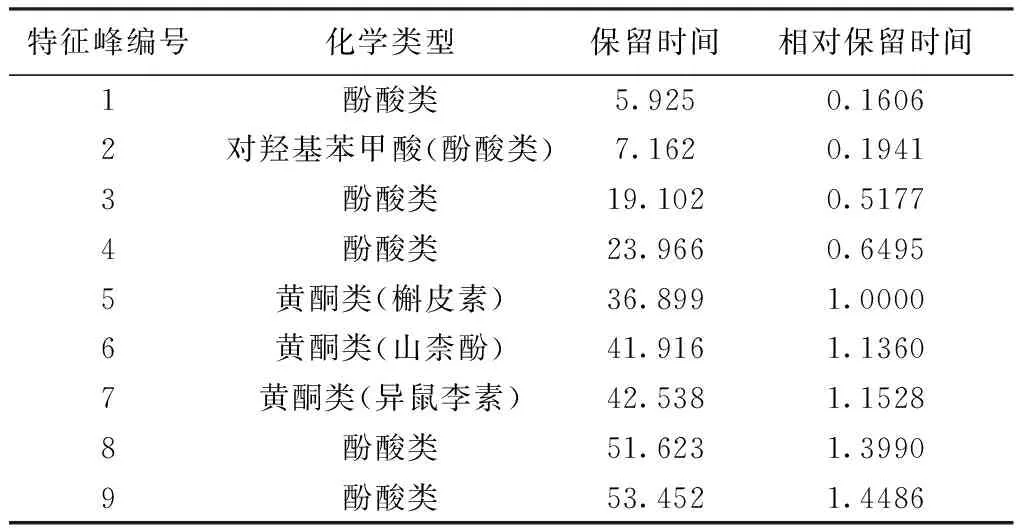
表1 三七酚类成分质的关联性
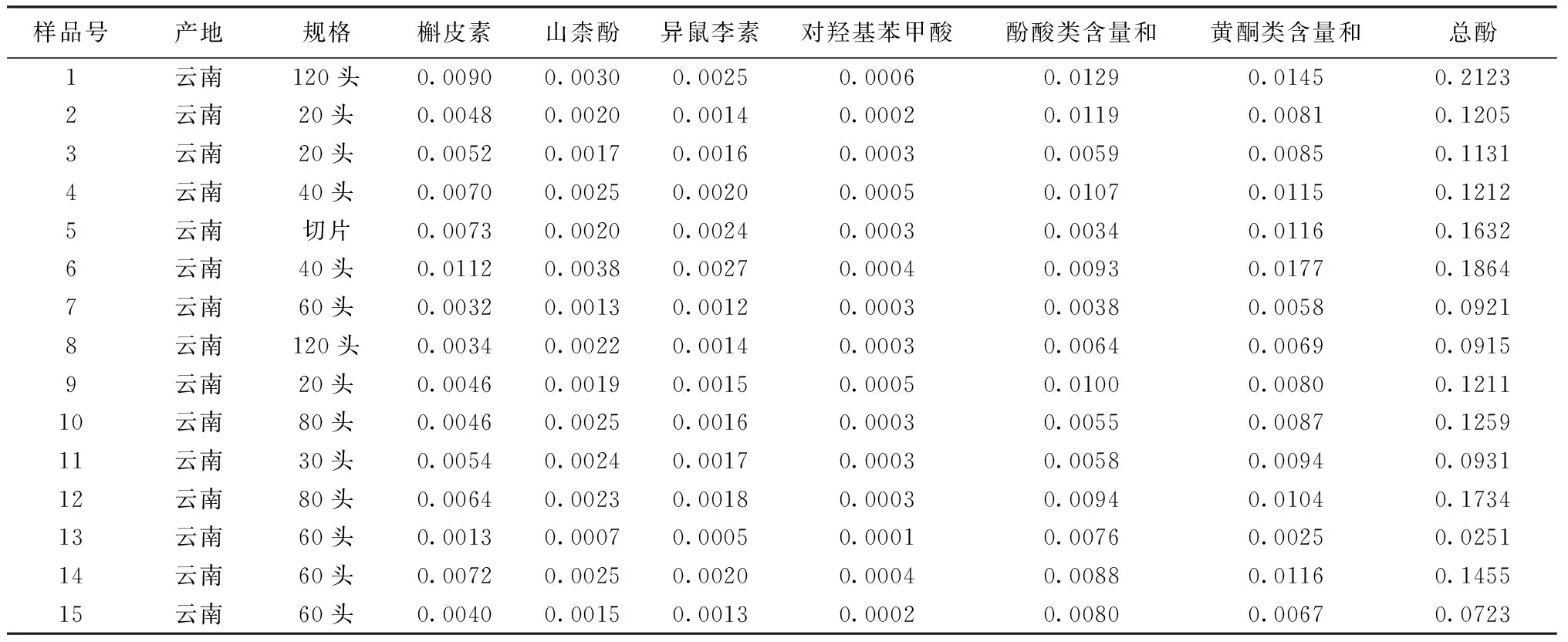
表2 基于酚类成分含量的15批三七药材样品质量表征(%,n=2)
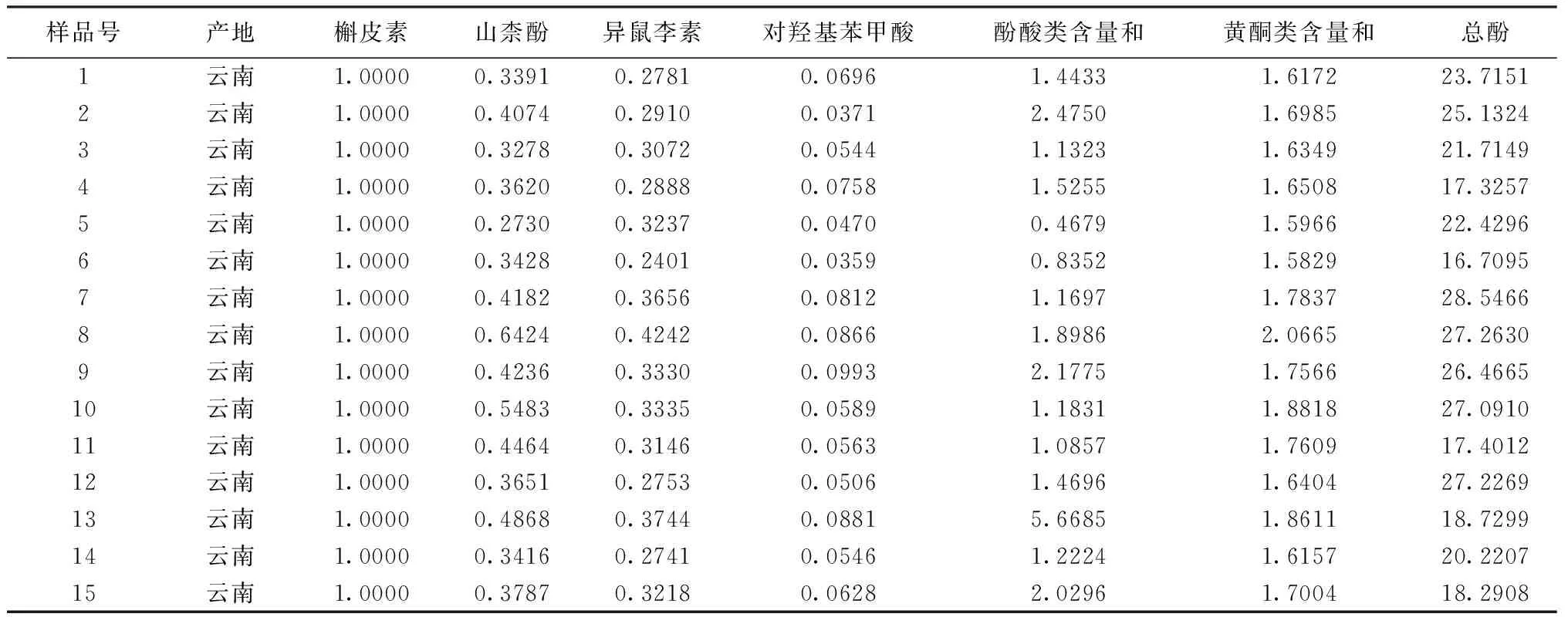
表3 基于酚类含量相对比值的15批三七药材样品质量表征
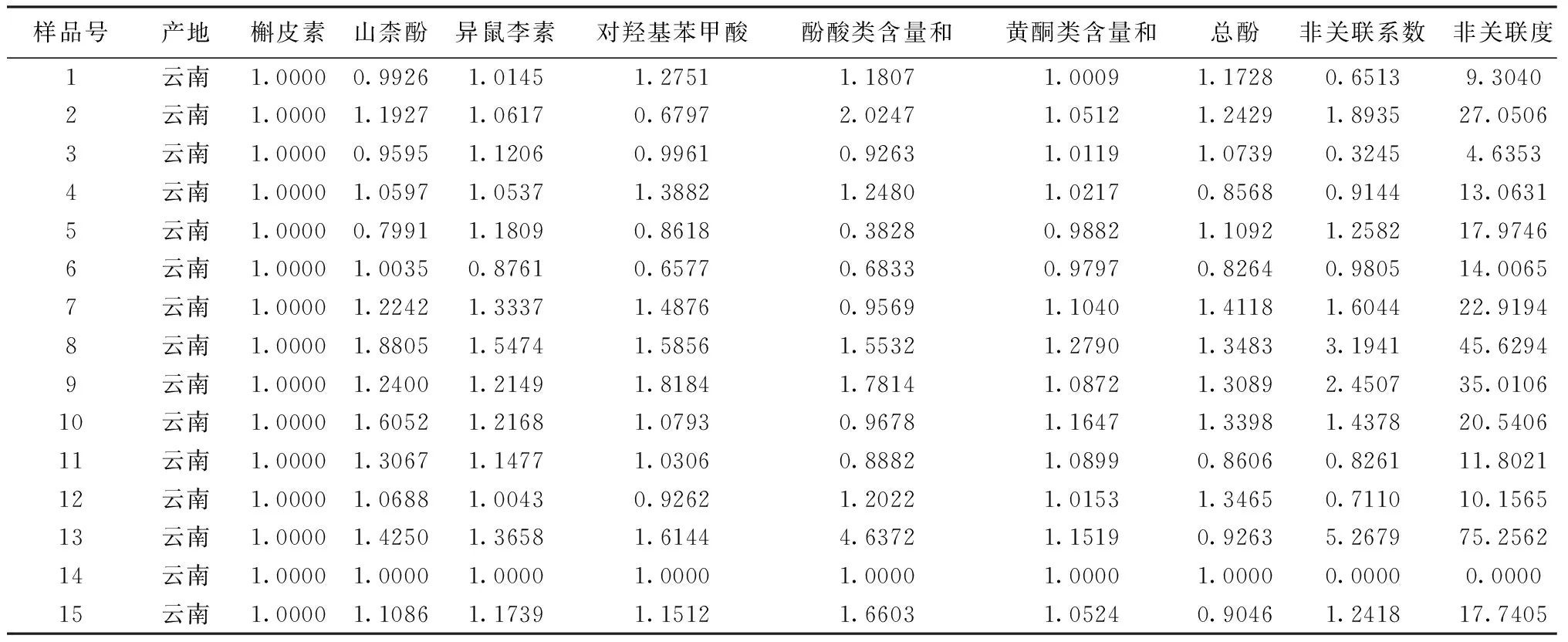
表4 15个批次三七药材样品关联度表征
2 结果
2.1 基于三七酚类成分质的表征 取15批三七药材,按照1.2.1.1项下方法制备对照品溶液,按照1.2.1.2项下方法制备供试品溶液,按照1.2.1.3项下色谱条件,分别进样,得到15批三七药材特征图谱(图1),特征图谱在260 nm下含特征峰9个,其中黄酮类特征峰3个,酚酸类特征峰6个,15批三七药材均含此9个特征峰。选择槲皮素为S峰,将其保留时间设为1,其他特征性成分的保留时间做相应转换,计算各特征峰的相对保留时间。结果见表1。
2.2 基于三七酚类成分量的表征
2.2.1 基于酚类成分含量的质量表征 取15批三七药材样品,按“1.2.1”项下方法测定对羟基苯甲酸、槲皮素、山柰酚、异鼠李素含量,以槲皮素、山柰酚、异鼠李素含量加和表征黄酮类含量和;以对羟基苯甲酸为对照品,通过主要酚酸类成分峰面积加和表征酚酸类含量和;按“1.2.2”项下方法测定总酚含量;以经过药效验证的药材(样品号14)作为参比药材;从而对三七药材中有效指标性成分与总成分的含量进行全面表征。结果见表2。
2.2.2 基于酚类成分含量相对比值的质量表征 以有效指标性成分槲皮素的含量为参比,将15个三七药材样品中各成分含量与槲皮素含量的相对比值予以表征,结果见表3。
2.2.3 三七质量表征关联分析
2.2.3.1 三七药材酚类成分含量的关联性、质量分布规律分析 根据表2含量测定结果,绘制3种黄酮苷元含量分布曲线。见图2,由图2可知,3种黄酮苷元呈现规律的分布,各成分含量大小趋势为:槲皮素>山柰酚>异鼠李素,槲皮素与山柰酚比值为(2.56±1),槲皮与异鼠李素的比值为(3.22±1)。
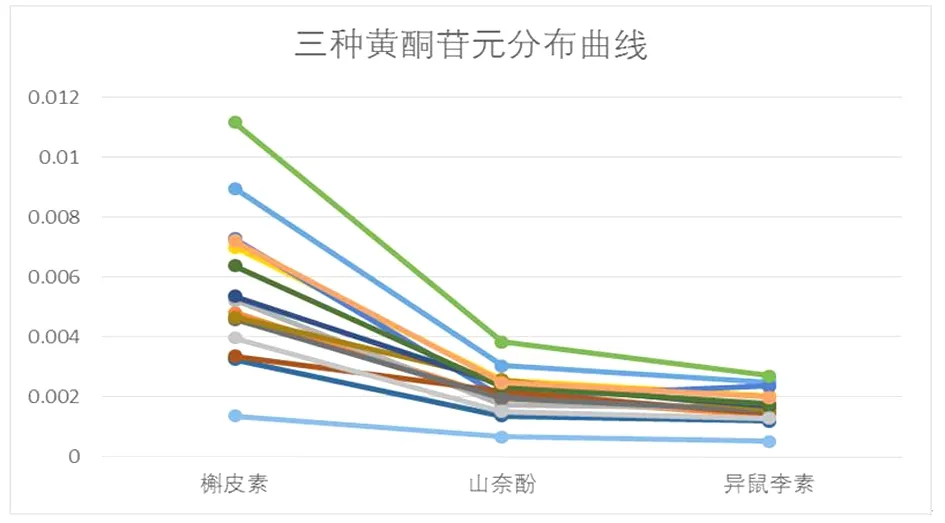
图2 3种黄酮苷元分布曲线
根据表2含量测定结果,采用SPSS 19进行分析,总黄酮含量、总酚含量之间显著相关(线性回归方程:总酚含量=总黄酮含量×11.586+0.014),而酚酸类含量、总酚含量之间不相关;即三七总酚含量随着总黄酮含量升高而升高,说明黄酮类对总酚的贡献度较大,三七中酚类成分以黄酮为主,因此,采用黄酮类含量和为指标,即可初步评价三七药材质量。由表2可知,黄酮类含量和最大相差约7.07倍,含量从高到低排序为:批次6>1>14>5>4>12>11>10>3>2>9>8>15>7>13。将黄酮类含量和最高的批次6设为100,其余批次按比例换算,得图3;由图3可知,批次6、1为前30%优质药材,其黄酮类含量和不得低于0.014%;批次14、5、4、12、11、10为30%~50%良好药材,其黄酮类含量和不得低于0.008%;批次3、2、9、8、15、7为50%~80%普通药材,其黄酮类含量和不得低于0.005%。
2.2.3.2 关联度分析 将表3中15个三七药材中酚类成分含量相对比值与参比药材样品相对比值的比值进行关联分析,得图4,表4。
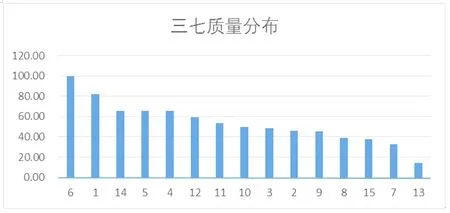
图3 三七质量分布
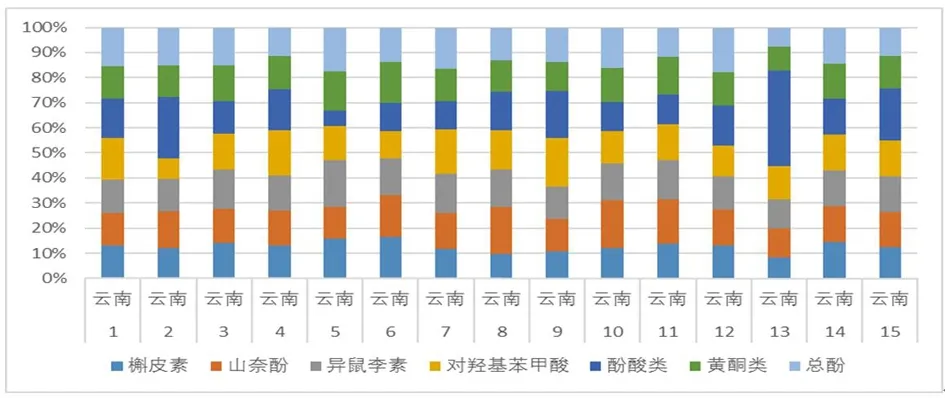
图4 15个三七药材中酚类成分含量相对比值与参比药材对应成分含量相对比值的比值
图4中不同颜色的矩形条代表各药材中有效指标性成分含量与类型成分含量相对比值与参比药材对应成分含量相对比值的比值,矩形条大小与参比药材中相同颜色的矩形条大小越相近,代表该药材有效指标性成分含量与类型成分含量比值与参比药材越接近,即质量表征关联密切。由图可知,批次3、1、12、11与参比药材质量表征关联密切。15个批次的样品与参比药材含量相对比值的比值差值的绝对值之和,即非关联系数;非关联系数与有效指标性成分的数目的比值,即非关联度,进而得到关联度,以反映药材质量之间的关联性。见表4。由表4可知,关联度由高到低排序为:14(0/100)>3(0.3245/95.36)>1(0.6513/90.7)>12(0.711/89.84)>11(0.8261/88.2)>4(0.9144/86.94)>6(0.9805/85.99)>15(1.2418/82.26)>5(1.2582/82.03)>10(1.4378/79.46)>7(1.6044/77.08)>2(1.8935/72.95)>9(2.4507/64.99)>8(3.1941/54.37)>13(5.2679/24.74)。即样品3、1、12、11、4、6与参比药材的关联度较高。
3 讨论
三七中酚类成分含量较低,富集之前无法检测,故本文采用聚酰胺对三七酚类成分进行富集,然后用HPLC法分别对酸水解前后的酚类部位进行检测,在360 nm下,仅可检测到黄酮类色谱峰,在260 nm下,酚酸类、黄酮类均有较强吸收,且色谱峰信息较多,故选用260 nm为测定波长。结果发现,酸水解前,可以检测到黄酮类、酚酸类成分色谱峰,但未检测到槲皮素、山柰酚、异鼠李素,酸水解后,原黄酮类色谱峰消失,均转化为槲皮素、山柰酚、异鼠李素3种苷元。见图5;说明三七中黄酮类成分以苷的形式存在,其苷元主要为槲皮素、山柰酚、异鼠李素,因此测定3种黄酮苷元的含量,即可表征三七中黄酮类含量。

图5 酸水解前后黄酮类成分变化
中药质量与其所含有效化学成分类型及存在的量、组成比例等有关。本文在自然药学观相关理论的指导下[28-32],运用相关中药药物质量表征关联评价模式[18-28],对15个不同批次的三七药材样品的质量进行表征,从而筛选出优质、良好、普通饮片,并以经过药效验证的药材为参比药材,进行质量关联度分析比较,确定出批次3、1、12、11、4、6与参比药材14关联度最高,综合质量表征及关联分析结果,得出批次1、6质量最佳,其次为批次3、12、11、4。本文综合精准评价出三七药材质量的优良度,即综合考量了三七应用有效性及质量关联性,从而为三七资源筛选及其药物的原料质量控制和应用提供了依据,亦为其他中药药材及其饮片的质量评价提供了研究借鉴。
[1]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015.
[2]王超群,贾秀虹,陈季,等.中药三七“一测多评”质量控制方法的系统研究[J].中国中药杂志,2012,37(22):3438-3445.
[3]朱晶晶,王智民,匡艳辉,等.一测多评法同步测定人参和三七药材中多种人参皂苷的含量[J].药学学报,2008,43(12):1211-1216.
[4]杨玲娟,高二全,焦成瑾.柱前衍生HPLC法测定三七中的三七素[J].资源开发与市场,2015,31(1):1-3,34.
[5]鞠政财,何纯勇,刘青,等.HILIC测定三七片中三七素的含量[J].中国中药杂志,2015,40(13):2594-2597.
[6]王艳艳.三七活血止血有效物质基础表征研究[D].北京:北京中医药大学,2006.
[7]崔秀明,徐珞珊,王强,等.三七中三七素的含量测定[J].中国药学杂志,2005,40(13):1017-1019.
[8]刘光,刘云江,胡炜彦.HPLC法测定三七总皂苷提取废液中三七素的含量[J].云南中医中药杂志,2010,31(2):61-62.
[9]付春梅,朱静,刘三康,等.HPLC法测定三七及其制剂中三七素[J].中草药,2006,37(1):68-69.
[10]郑萍.毛细管区带电泳法测定三七药材中的三七素[J].华西药学杂志,2012,27(4):453-454.
[11]鲁歧,李向高.三七止血成分的分离鉴定与含量测定[J].中国药学杂志,2005,40(13):1017.
[12]焦成瑾,杨玲娟,赵菲佚,等.三七素检测方法研究进展[J].氨基酸和生物资源,2015,37(3):15-20.
[13]刘英,曲媛,王承潇,等.不同产地不同部位三七中总黄酮的含量测定[J].安徽农业科学,2015,43(15):54-55,58.
[14]郑莹,李绪文,桂明玉,等.三七茎叶黄酮类成分的研究[J].中国药学杂志,2006,41(3):176-178.
[15]魏均娴,王菊芬.三七叶黄酮类成分的研究[J].中药通报,1987,12(11):61.
[16]张冰.三七花化学成分和质量控制方法的研究[D].沈阳:沈阳药科大学,2009.
[17]左胜,孙雅姝,迟蕾,等.基于药物体系的藁本质量评价研究[J].北京中医药大学学报,2014,37(7):481-485,后插1.
[18]唐雪阳,安琪,孙道涵,等.基于药物体系的紫苏子特征图谱质量表征关联分析研究?[J].北京中医药大学学报,2015,(4):241-246.
[19]李焕娟,张璐,彭平,等.基于药物体系质量评价模式的远志质量表征关联分析研究[J].北京中医药大学学报,2014,37(12):834-840,后插4.
[20]黄亚婷,潘婷,温静,等.基于药物体系的肉桂特征图谱质量表征关联分析研究[J].北京中医药大学学报,2015,38(5):344-350.
[21]石任兵,王永炎,吕松涛.中药药物质量精准预期的相关性思考[J].中国中药杂志,2015,40(17):3343-3346.
(2016-01-14收稿 责任编辑:王明)
Quality Representation of Characteristic Chromatogram and Correlation Analysis of Phenolic Components in Panax notoginseng
Yang Yuan1, Chen Wei1, Zhang Fang1, Kong Jing1, Sun Daohan1, Feng Duo1,Yang Shujuan1,Shen Lifeng2, Hu Shaowei1, Zhou Deyong1, Pan Ting1, Jiang Yanyan1,3,Shi Renbing1,3
(1SchoolofChineseMateriaMedica,BeijingUniversityofChineseMedicine,Beijing100029,China; 2CapitalMedicalUniversity,Beijing100000,China; 3ChineseMedicineQualityControlTechnologyEngineeringCenter,BeijingMunicipalEducationCommittee,Beijing100029,China)
Characteristic chromatogram of Phenolic Components in Panax notoginseng was established by HPLC-PDA method and 9 featured peaks were screened. Their quality correlation was represented by relative retention schedule. Contents of P-hydroxybenzoic acid, quercetin, kaempferol, isorhamnetin and total phenols were determined, taking p-hydroxybenzoic acid as the control content agent. The total phenolic content of Panax notoginseng was determined by spectrophotometry. Quality representation was made with the contents of phenols in Panax notoginseng and their relative ratio. Correlation analysis of content of each phenol in Panax notoginseng was performed to summarize correlation and quality distribution rules among components in Panax notoginseng. The correlation between different batches of medicinal materials and referential materials which had pharmacodynamics validation was analyzed. The optimal Panax notoginseng could be selected based on the results of correlation analysis. This method can fully and accurately control and evaluate the quality of Panax notoginseng.
Panax notoginseng; Characteristic chromatogram; Quercetin; Kaempferol; Isorhamnetin; Total phenols; Correlation analysis
十二五国家科技支撑计划项目(编号:2012BAI29B06);北京中医药大学创新团队资助项目(编号:2011-CXTD-12)
杨元(1989.01—),男,在读硕士,研究方向:中药药效物质基础及质量控制方法研究,E-mail:yangyuan501x@163.com
石任兵(1957.12—),男,博士,教授,博士研究生导师,研究方向:中药复方有效物质基础与药物创新,E-mail:shirb@126.com;姜艳艳(1980.12—),女,博士,副教授,硕士研究生导师,研究方向:中药复方有效物质基础与质量控制方法研究,E-mail:jyyjm1129@163.com
R284.1
A
10.3969/j.issn.1673-7202.2016.01.039
