超声波-微波协同萃取水芹叶总黄酮类化合物工艺的研究
2016-12-19俞坚
俞 坚
(杭州职业技术学院,杭州市绿色精细化工研究与技术转化重点实验室,浙江杭州 310018)
超声波-微波协同萃取水芹叶总黄酮类化合物工艺的研究
俞 坚
(杭州职业技术学院,杭州市绿色精细化工研究与技术转化重点实验室,浙江杭州 310018)
本文研究了用超声波-微波协同萃取水芹叶总黄酮类化合物的工艺。考察乙醇体积分数、液料比、萃取功率和时间等因素对水芹叶总黄酮类化合物萃取得率的影响。在单因素实验的基础上利用Box-Behnken实验设计方法和响应曲面分析法,确定其较优萃取工艺条件。实验结果表明,当乙醇体积分数80%、液料比22∶1 mL/g、萃取功率563 W和萃取时间4.2 min时,水芹叶总黄酮类化合物萃取得率达44.7 mg/g。
超声波-微波协同萃取,水芹叶,黄酮类化合物,响应曲面优化
水芹(OenantheJavanica),又名蜀芹、野芹菜等,是伞形科水芹属多年生湿生草本植物,资源十分丰富,广泛分布于浙江、安徽、江苏和江西等省。张俭等[1]学者研究发现,水芹中含有多种大量的黄酮类化合物、氨基酸、挥发油和水芹素等。水芹黄酮类化合物因具有独特的生物学功效,故受到许多学者关注和开发。何文兵等[2]学者利用超声波提取野生水芹总黄酮,发现水芹总黄酮对羟自由基具有较强的清除能力,且具有很好的抑制油脂氧化功效。Yang等[3]学者研究发现水芹黄酮类化合物具有抗糖尿病功效。水芹作为我国特色水生蔬菜,在加工过程中人们习惯于将其茎用于入菜,大量的水芹叶被直接丢弃而造成资源浪费和环境污染。如果能充分利用水芹叶,可产生较为可观的经济效益和社会效益,对水芹资源的深加工也具有重要意义。
近年来,关于现代萃取工艺技术研究很多,包括超临界法[4]、超声波法[5]、微波法[6]、加压溶剂法[7]、超高压法[8]、酶法[9]和超声波-微波协同萃取法[10]等。但是,目前对水芹叶中黄酮类化合物的研究较少,尚没有关于超声波-微波协同萃取水芹叶总黄酮类化合物的研究报道。超声波-微波协同萃取法在功能性成分制取上已显露出省时、节能和高效等优点。本文利用超声波-微波协同萃取水芹叶总黄酮类化合物,以期为水芹的深加工和水芹叶总黄酮类化合物的萃取工艺提供科学依据。
1 材料与方法
1.1 材料与仪器
水芹 杭州市高沙农贸市场,取水芹叶低温烘干后粉碎,过80目标准筛。芦丁标准品美国sigma公司;乙醇、亚硝酸钠、硝酸铝、氢氧化钠等试剂 分析纯,华东医药有限公司。
CW-2000超声-微波协同萃取/反应仪 上海新拓分析仪器科技有限公司;BT124S 万分之一电子天平 北京赛多利斯天平有限公司;紫外-可见分光光度计UV-2550 岛津企业管理(中国)有限公司;DHG-9140A 型电热恒温鼓风干燥箱 上海益恒实验仪器有限公司;兴易Φ100 mm布氏漏斗,唐山市开平盛兴化学瓷厂;淘福CX-100小型粉碎机,上海缘沃工贸有限公司;洁盟JP-020B,深圳市洁盟清洗设备有限公司。
1.2 实验方法
1.2.1 水芹叶总黄酮类化合物标准曲线的测定 采用芦丁标准品作为水芹叶总黄酮类化合物的对照品,通过硝酸铝络合分光光度法测定水芹叶总黄酮类化合物的含量[11]。称取芦丁标准品28.0 mg,用80%乙醇定容至50.0 mL,作为标准母液备用。取10.0 mL具塞试管,分别加入标准母液0、0.5、1.0、1.5、2.0、2.5 mL,用80%乙醇补足至5.0 mL。在具塞试管加入0.30 mL 5% NaNO2,混匀后静置5 min;在具塞试管加入0.30 mL 10% Al(NO3)3,混匀后静置6 min;在具塞试管加入4.0 mL 1 mol/L NaOH,在具塞试管加入0.40 mL 80%乙醇,混匀后静置10 min;于510 nm处测定其吸光光度值。由测定结果得水芹叶总黄酮类化合物标准曲线方程A510 nm=4.637C+0.007(A:吸光光度值;C:质量浓度,mg/mL;R2=0.998)
1.2.2 水芹叶总黄酮类化合物萃取得率的测定 取水芹叶粉1.000 g,经超声波-微波协同萃取后,萃取液减压抽滤,移置50.0 mL容量瓶中用80%乙醇定容,精确移取1.0 mL定容液,采用硝酸铝络合分光光度法测定水芹叶总黄酮类化合物的含量,根据标准曲线方程计算水芹叶总黄酮类化合物的质量浓度,再由质量浓度计算水芹叶总黄酮类化合物的萃取得率。R=500×C/M×100%。式中:R为水芹叶总黄酮类化合物的萃取得率(mg/g);C为水芹叶总黄酮类化合物的质量浓度(mg/mL);M为水芹叶质量(g)。
1.2.3 单因素实验设计依据前期预实验的结果 取水芹叶粉在不同乙醇体积分数和不同液料比下,设定超声波-微波协同萃取功率和萃取时间,改变其中一个因素,进行单因素实验。各因素梯度设计为:乙醇体积分数20%、40%、60%、80%和100%;液料比10∶1、15∶1、20∶1、25∶1、30∶1 mL/g;萃取功率200、300、400、500、600 W;萃取时间2、4、6、8、10 min。
1.2.4 响应曲面实验设计 依据超声波-微波协同萃取水芹叶总黄酮类化合物的单因素实验结果,采用Box-Behnken设计方案[12]进行超声波-微波协同萃取水芹叶总黄酮类化合物的响应曲面研究。四个自变量乙醇体积分数、液料比、萃取功率和萃取时间分别以A、B、C和D表示,以+1,0,-1分别代表各自的不同水平,编码因素及水平、实验设计方案见表1。
表1 Box-Behnken设计方案的因素及水平
Table 1 Factors and levels of Box-Behnken experiment
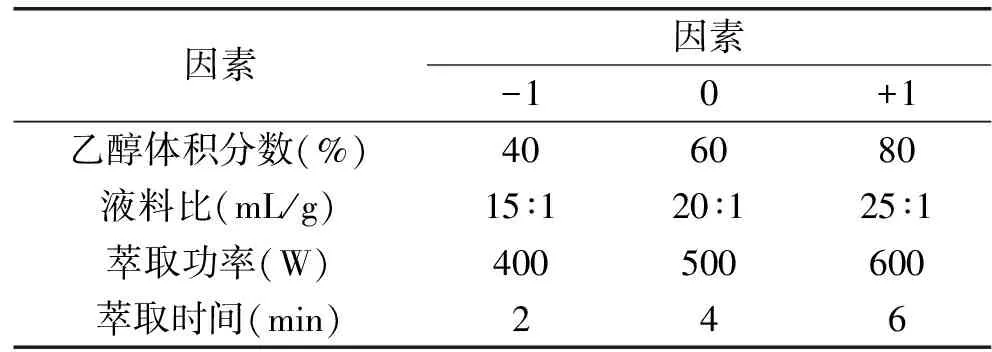
因素因素-10+1乙醇体积分数(%)406080液料比(mL/g)15∶120∶125∶1萃取功率(W)400500600萃取时间(min)246
1.2.5 萃取方法比较 取水芹叶粉1.000 g,加入22 mL 80%乙醇,经563 W超声波萃取30 min后,萃取液减压抽滤,移置50.0 mL容量瓶中用80%乙醇定容,精确移取1.0 mL定容液,测定超声波水芹叶总黄酮类化合物萃取得率;取水芹叶粉1.000 g,加入22 mL 80%乙醇,经563 W微波萃取4.2 min后,萃取液减压抽滤,移置50.0 mL容量瓶中用80%乙醇定容,精确移取1.0 mL定容液,测定微波水芹叶总黄酮类化合物萃取得率;与超声波-微波协同萃取技术进行比较分析。
1.3 数据处理与分析
超声波-微波协同萃取水芹叶总黄酮类化合物的响应曲面实验数据采用Design Expert 8.0软件绘图,并做方差和显著性分析。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 乙醇体积分数对水芹叶总黄酮类化合物萃取得率的影响 由图1可知,超声波-微波协同萃取水芹叶总黄酮类化合物,随着乙醇体积分数从20%提高到80%,水芹叶总黄酮类化合物萃取得率不断提高;当乙醇体积分数达到80%后,水芹叶总黄酮类化合物萃取得率反而降低。可以初步推断,在超声波-微波协同萃取条件下,合适的乙醇体积分数有利于水芹叶总黄酮类化合物从叶粉中溶出。超声波-微波协同萃取时,若乙醇体积分数过高,不仅增大乙醇使用成本,增加其他杂质的溶出。所以,选择40%~80%乙醇体积分数作为响应曲面优化考察范围。
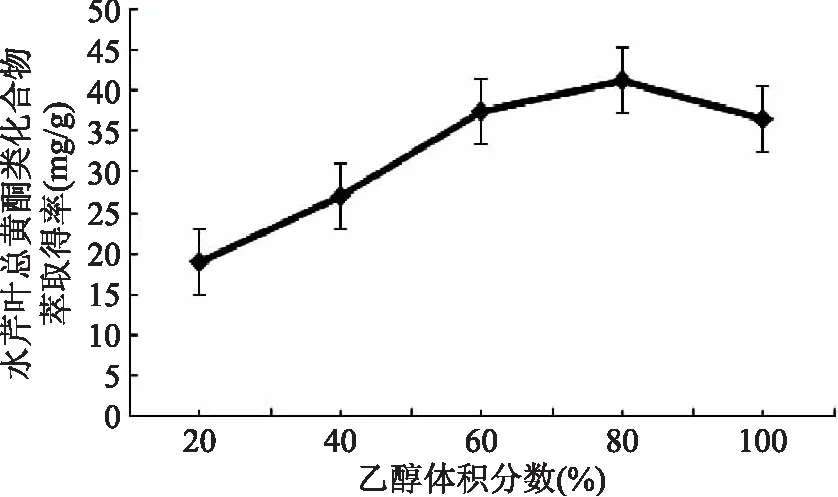
图1 乙醇体积分数对水芹叶总黄酮类化合物萃取得率的影响Fig.1 Effect of ethanol concentration on extraction rate of flavonoids from Oenanthe Javanica leaves
2.1.2 液料比对水芹叶总黄酮类化合物萃取得率的影响 由图2可知,超声波-微波协同萃取水芹叶总黄酮类化合物,随着液料比从10∶1 mL/g提高到20∶1 mL/g,水芹叶总黄酮类化合物萃取得率不断提高;当液料比达到20∶1 mL/g后,水芹叶总黄酮类化合物萃取得率变化趋缓,反而略有降低。可以初步推断,在超声波-微波协同萃取条件下,合适的液料比有利于水芹叶总黄酮类化合物从水芹叶中溶出。超声波-微波协同萃取时,若萃取溶剂使用过多,不仅增大溶剂使用成本,增加其他杂质的溶出,而且还会大大增加下游减压浓缩的能耗。所以,选择15∶1 mL/g至25∶1 mL/g液料比作为响应曲面优化考察范围。

图2 液料比对水芹叶总黄酮类化合物萃取得率的影响Fig.2 Effect of liquid-solid ratio on extraction rate of flavonoids from Oenanthe Javanica leaves
2.1.3 萃取功率对水芹叶总黄酮类化合物萃取得率的影响 由图3可知,超声波-微波协同萃取水芹叶总黄酮类化合物,随着萃取功率从200 W到500 W,水芹叶总黄酮类化合物萃取得率逐渐提高。当萃取功率到500 W后,水芹叶总黄酮类化合物萃取得率变化趋缓,反而略有降低。可以初步推断,在较高的萃取功率下有利于水芹叶总黄酮类化合物的提取。另一方面,当萃取功率过高,可能会造成水芹叶总黄酮类化合物的破坏。所以,选择400 W至600 W萃取功率作为响应曲面优化考察范围。
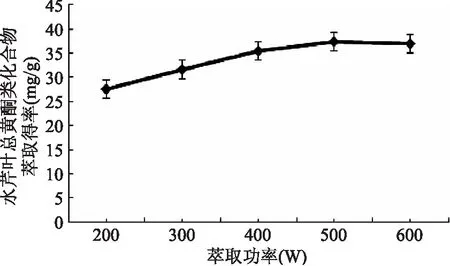
图3 萃取功率对水芹叶总黄酮类化合物萃取得率的影响Fig.3 Effect of treatment power on extraction rate of flavonoids from Oenanthe Javanica leaves
2.1.4 萃取时间对水芹叶总黄酮类化合物萃取得率的影响 由图4可知,超声波-微波协同萃取水芹叶总黄酮类化合物,随着萃取时间从2~4 min,水芹叶总黄酮类化合物萃取得率逐步提高。当萃取时间超过4 min后,水芹叶总黄酮类化合物萃取得率趋于缓慢。可以初步推断,在超声波-微波协同萃取下可以极大地缩短水芹叶总黄酮类化合物的萃取时间,萃取效率相当高。当萃取时间超过4 min后,水芹叶总黄酮类化合物萃取液达到饱和,再延长萃取时间也无明显效果;但是若萃取时间过长,会增加超声波-微波设备的机械损伤,从而提高设备的使用和维护费用。所以,选择2 min至6 min萃取时间作为响应曲面优化考察范围。
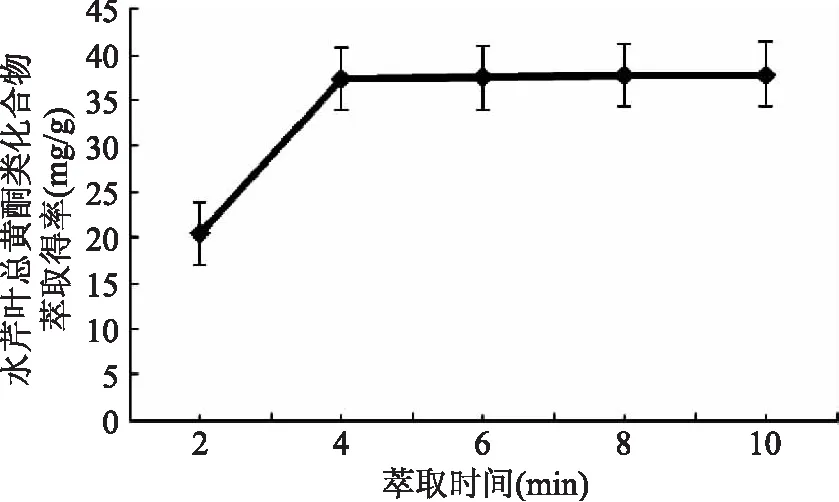
图4 萃取时间对水芹叶总黄酮类化合物萃取得率的影响Fig.4 Effect of extraction time on extraction rate of flavonoids from Oenanthe Javanica leaves
2.2 响应曲面实验结果与分析
以A乙醇体积分数(%)、B液料比(mL/g)、C萃取功率(W)和D萃取时间(min)为自变量,R水芹叶总黄酮类化合物萃取得率(mg/g)为响应值,进行响应曲面优化实验,结果详见表2。
表2 响应曲面优化实验结果
Table 2 Program and results of Response Surface Analysis
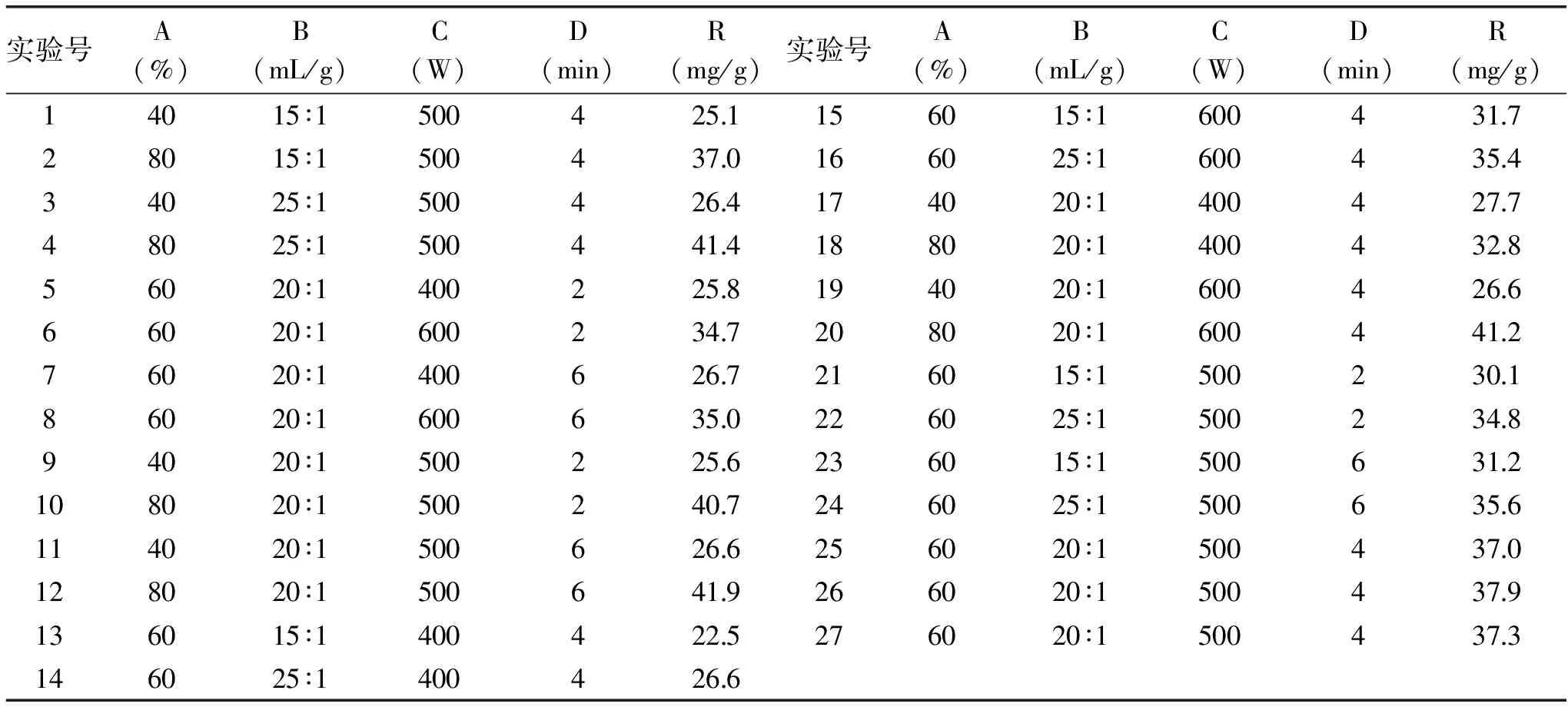
实验号A(%)B(mL/g)C(W)D(min)R(mg/g)实验号A(%)B(mL/g)C(W)D(min)R(mg/g)14015∶15004251156015∶1600431728015∶15004370166025∶1600435434025∶15004264174020∶1400427748025∶15004414188020∶1400432856020∶14002258194020∶1600426666020∶16002347208020∶1600441276020∶14006267216015∶1500230186020∶16006350226025∶1500234894020∶15002256236015∶15006312108020∶15002407246025∶15006356114020∶15006266256020∶15004370128020∶15006419266020∶15004379136015∶14004225276020∶15004373146025∶14004266
表3 响应曲面优化实验结果的方差分析
Table 3 Analysis of variance for response surface regression equation
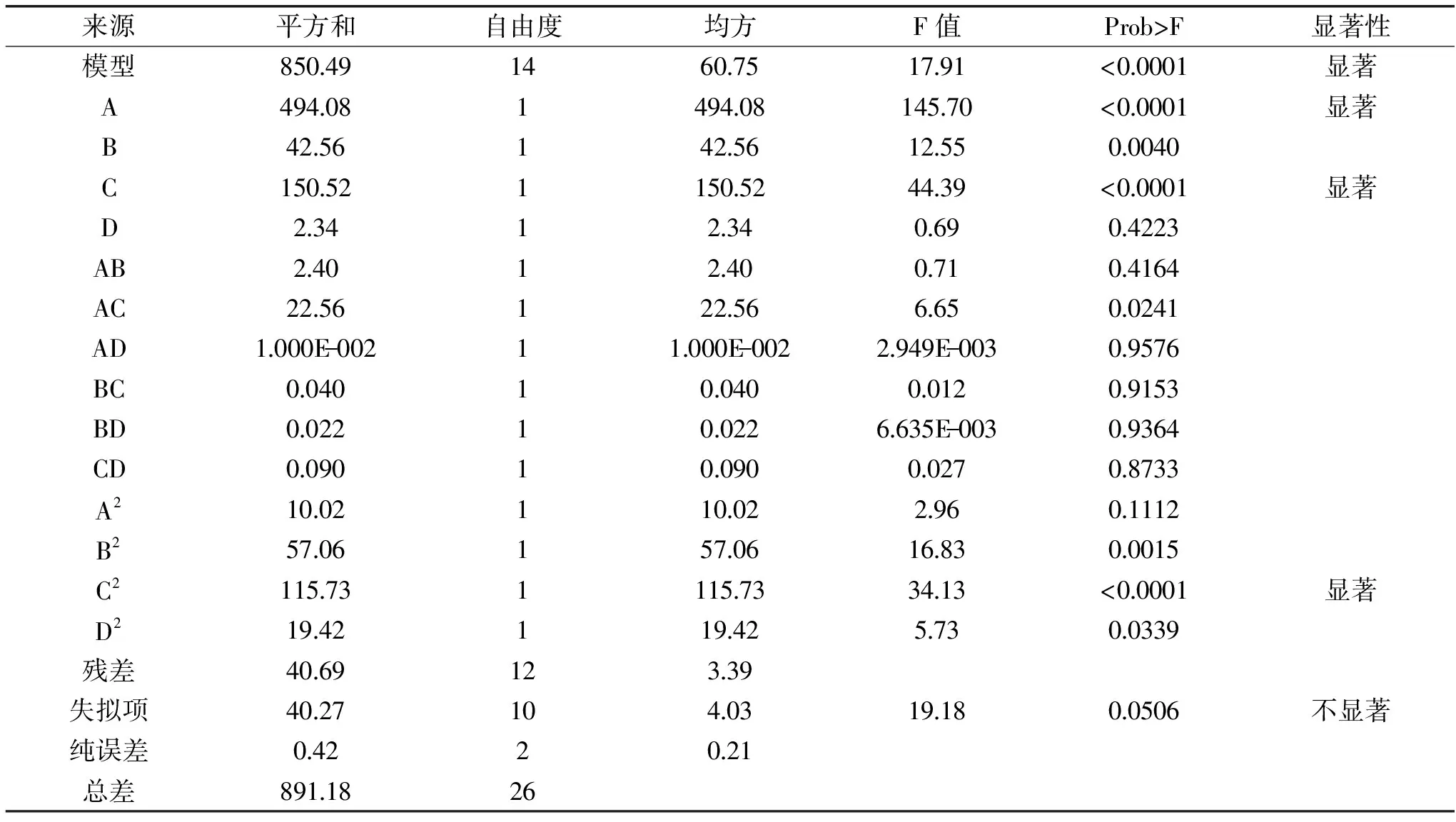
来源平方和自由度均方F值Prob>F显著性模型850491460751791<00001显著A4940814940814570<00001显著B425614256125500040C150521150524439<00001显著D234123406904223AB240124007104164AC22561225666500241AD1000E-00211000E-0022949E-00309576BC004010040001209153BD0022100226635E-00309364CD009010090002708733A210021100229601112B2570615706168300015C2115731115733413<00001显著D219421194257300339残差406912339失拟项402710403191800506不显著纯误差0422021总差8911826
用Design Expert 8.0软件对表2数据进行多元回归拟合,得到水芹叶总黄酮类化合物萃取得率对乙醇体积分数、液料比、萃取功率和萃取时间的二次多项回归方程是:
R=37.40+6.42A+1.88B+3.54C+0.44D+0.78AB+2.38AC+0.050AD-0.10BC-0.075 BD-0.15CD-1.37A2-3.27B2-4.66C2-1.91D2
由表3知,乙醇体积分数和萃取功率的一次项均达到显著水平(p<0.0001),整体模型的Prob>F值<0.0001,表明二次多项回归方程模型达到极显著水平,并且失拟项不显著,说明该回归方程对超声波-微波协同萃取水芹叶总黄酮类化合物实验拟合较好。
图5~图10反映了超声波-微波协同萃取水芹叶总黄酮类化合物,乙醇体积分数、液料比、萃取功率和萃取时间等四因素三水平两两交互的影响。
由图5~图7可知,乙醇体积分数和液料比交互作用中,沿乙醇体积分数A轴的变化较沿液料比B轴的变化密集,所以乙醇体积分数对水芹叶总黄酮类化合物萃取得率R值面积的影响更大;乙醇体积分数和萃取功率交互作用中,沿乙醇体积分数A轴的变化较沿萃取功率C轴的变化密集,所以乙醇体积分数对水芹叶总黄酮类化合物萃取得率R值面积的影响更大;乙醇体积分数和萃取时间交互作用中,沿乙醇体积分数A轴的变化较萃取时间D轴的变化密集,所以乙醇体积分数对水芹叶总黄酮类化合物萃取得率R值面积的影响更大。
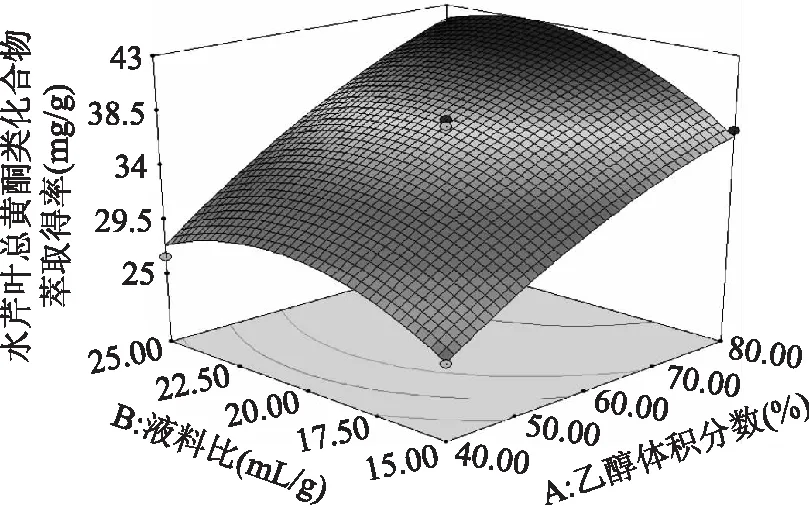
图5 乙醇体积分数和液料比对水芹叶总黄酮类化合物萃取得率影响的响应曲面图Fig.5 Response surface plot showing the interactive effect of ethanol concentration and liquid-solid ratio on flavonoids from Oenanthe Javanica leaves extraction rate

图6 乙醇体积分数和萃取功率对水芹叶总黄酮类化合物萃取得率影响的响应曲面图Fig.6 Response surface plot showing the interactive effect of ethanol concentration and treatment power on flavonoids from Oenanthe Javanica leaves extraction rate
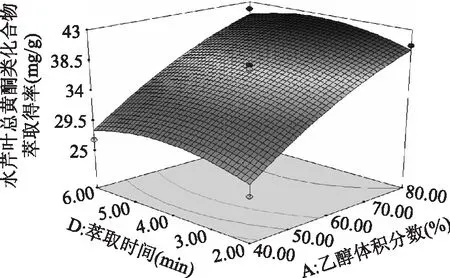
图7 乙醇体积分数和萃取时间对水芹叶总黄酮类化合物萃取得率影响的响应曲面图Fig.7 Response surface plot showing the interactive effect of ethanol concentration and extraction time on flavonoids from Oenanthe Javanica leaves extraction rate
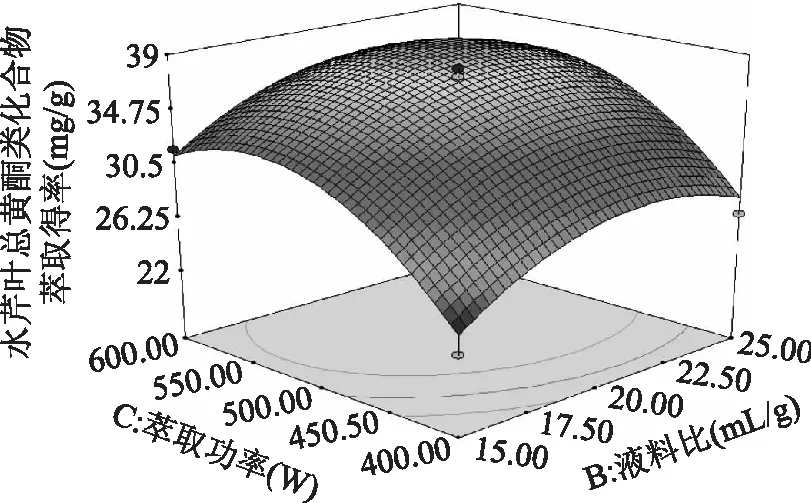
图8 液料比和萃取功率对水芹叶总黄酮类化合物萃取得率影响的响应曲面图Fig.8 Response surface plot showing the interactive effect of liquid-solid ratioand treatment power on flavonoids from Oenanthe Javanica leaves extraction rate

图9 液料比和萃取时间对水芹叶总黄酮类化合物萃取得率影响的响应曲面图Fig.9 Response surface plot showing the interactive effect of liquid-solid ratioand extraction timeon flavonoids from Oenanthe Javanica leaves extraction rate
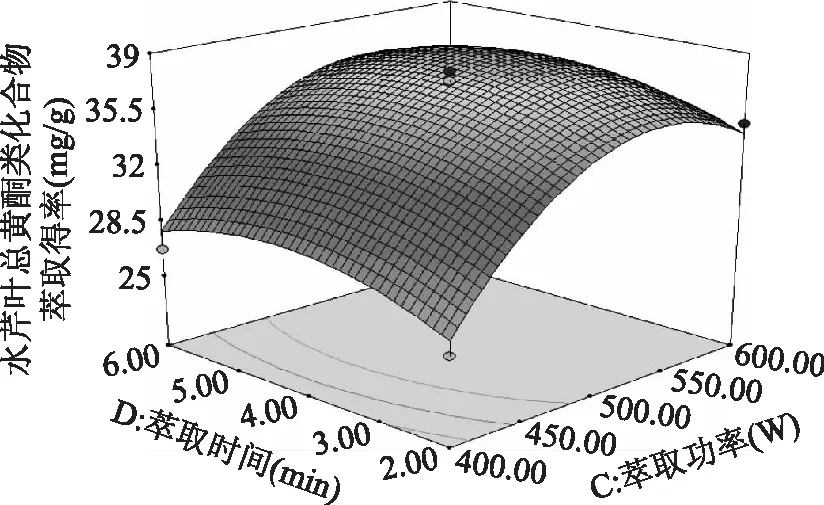
图10 萃取功率和萃取时间对水芹叶总黄酮类化合物萃取得率影响的响应曲面图Fig.10 Response surface plot showing the interactive effect of treatment power and time on flavonoids from Oenanthe Javanica leaves extraction rate
由图8~图10可知,液料比和萃取功率交互作用中,沿液料比B轴的变化较萃取功率C轴的变化稀疏,所以萃取功率对水芹叶总黄酮类化合物萃取得率R值面积的影响更大;液料比和萃取时间交互作用中,沿液料比B轴的变化较沿萃取时间D轴的变化密集,所以液料比对水芹叶总黄酮类化合物萃取得率R值面积的影响更大;萃取功率和萃取时间交互作用中,沿萃取功率C轴的变化较萃取时间D轴的变化密集,所以萃取功率对水芹叶总黄酮类化合物萃取得率R值面积的影响更大。
2.3 工艺优化与验证实验
对超声波-微波协同萃取水芹叶总黄酮类化合物回归方程求导,令水芹叶总黄酮类化合物萃取得率R值等于零,得到响应曲面的最大值,即乙醇体积分数、液料比、萃取功率和萃取时间四因素的最佳水平值,最后获得超声波-微波协同萃取水芹叶总黄酮类化合物的最佳条件是:乙醇体积分数80%、液料比22∶1 mL/g、萃取功率563 W和萃取时间4.2 min,水芹叶总黄酮类化合物萃取得率达44.9 mg/g。实验实际测定此优化工艺条件下,水芹叶总黄酮类化合物萃取得率为44.7 mg/g。表明优化的超声波-微波协同萃取工艺参数科学合理,并且结果可靠。
2.4 萃取方法比较
由图11可知,在相同乙醇体积分数和液料比的条件下,采用超声波法萃取水芹叶总黄酮类化合物,萃取得率仅为27.3 mg/g;采用微波辅助法萃取水芹叶总黄酮类化合物,萃取得率也仅为35.1 mg/g,都显著低于超声波-微波协同萃取法。因此,超声波-微波协同萃取法是一种节能、高效的现代萃取技术。
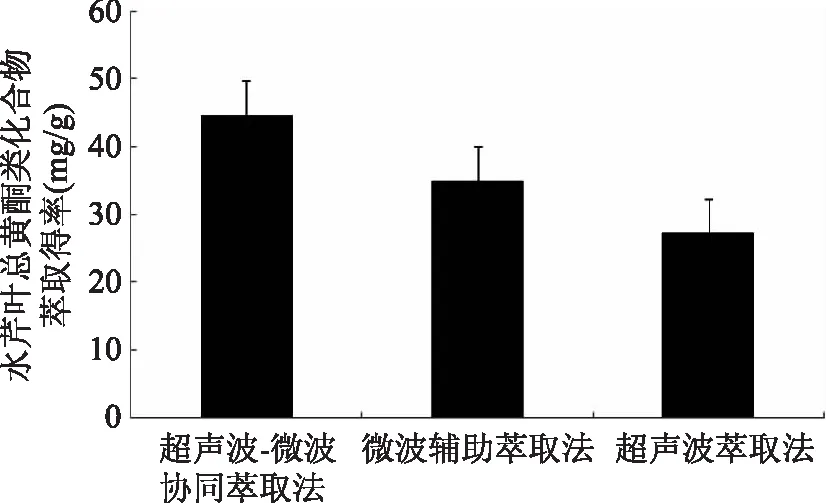
图11 萃取方法比较Fig.11 The comparison of extraction methods
3 结论与讨论
通过超声波-微波协同萃取水芹叶总黄酮类化合物响应曲面寻优实验,结果表明,当乙醇体积分数80%、液料比22∶1 mL/g、萃取功率563 W和萃取时间4.2 min时,水芹叶总黄酮类化合物萃取得率达44.7 mg/g。超声波-微波协同萃取技术在相同乙醇体积分数和液料比的条件下,要优于超声波萃取法和微波辅助萃取法。本研究采用超声波-微波协同萃取工艺技术,本质上是利用超声波-微波协同效应,强化水芹叶总黄酮类化合物的润湿、溶解和扩散等传质过程。利用超声波的机械粉碎作用和空化效应[13],以及微波在水芹叶内部微组织结构热效应[14]的协同下,减少了传质阻力,提高了扩散常数,从而强化了黄酮类化合物从水芹叶粉扩散到乙醇提取液的传质过程。超声波-微波协同萃取水芹叶总黄酮类化合物与传统提取工艺相比,克服了传统工艺提取时间长、液料比较高、萃取得率低等不足,具有萃取得率高、速度快、污染小等优点,符合水芹的深加工和水芹叶总黄酮类化合物工业现代化生产技术的发展方向。
[1]张俭,李胜华,谷荣辉.水芹的化学成分研究[J].中草药,2012(7):1289-1292.
[2]何文兵,夏光辉,刘欢,等.野生水芹总黄酮提取工艺优化及抗氧化活性[J].北方园艺,2015(1):122-127.
[3]Yang XB,Huang ZM,Cao WB,et al.Antidiabetic effect of Oenanthe javanica flavone [J].Acta Pharmacologica Sinica,2000,21(3):239-242.
[4]Chu Chu,Shidi Zhang,Shengqiang Tong,et al.An efficient strategy for the extraction and purification of lignans from Schisandra chinensis by a combination of supercritical fluid extraction and high-speed counter-current chromatography[J]. Journal of Separation Science,2013,36(24):3958-3964.
[5]Min Shi,Yingnan Yang,Xuansheng Hu,et al.Effect of ultrasonic extraction conditions on antioxidative and immunomodulatory activities of a Ganoderma lucidum polysaccharide originated from fermented soybean curd residue[J].Food Chemistry,2014,155:50-56.
[6]Tuyen C,KhaMinh H,NguyenDong T,et al.Stathopoulos.
Optimization of microwave-assisted extraction of Gac oil at different hydraulic pressure,microwave and steaming conditions[J].International Journal of Food Science & Technology,2013,48(7):1436-1444.
[7]俞坚.响应面分析优化加压溶剂法提取甜菊糖苷工艺[J].食品研究与开发,2014 (7):43-47.
[8]Jae-Sung Shin,Soon-Cheol Ahn,Sung-Won Choi,et al.Ultra high pressure extraction (UHPE) of ginsenosides from Korean Panax ginseng powder[J].Food Science and Biotechnology,2010,19(3):743-748.
[9]Qinghong You,Xiulian Yin,Yuping Zhao.Enzyme assisted extraction of polysaccharides from the fruit of Cornus officinalis[J].Carbohydrate Polymers,2013,98(1):607-610.
[10]Xin Liu,Yan Hu,Dongfeng Wei.Optimization of enzyme-based ultrasonic/microwave-assisted extraction and evaluation of antioxidant activity of orcinol glucoside from the rhizomes of Curculigo orchioides Gaertn [J].Medicinal Chemistry Research,2014,23(5):2360-2367.
[11]陈况况,帕塔尔尼牙孜,章宏慧,等. 响应面法优化水芹黄酮提取工艺及其成分研究[J]. 中国食品学报,2014(11):83-89.
[12]Mahmoud Yolmeh,Mohammad B. Habibi Najafi,Reza Farhoosh. Optimization of ultrasound-assisted extraction of natural pigment from annatto seeds by response surface methodology (RSM)[J].Food Chemistry,2014(155):319-324.
[13]Satoshi TAMURA,Yoshiki TSUNEKAWA,Masahiro OKUMIYA.Effect of Ultrasonic Cavitation on Force Acting on Solid Object in Water[J].Japanese Journal of Applied Physics,2006,45(4A):2842-2844.
[14]X. Q. Yang,K. M. Huang,H. C. Zhu,et al.The analysis of “power window” induced by thermal effect during the microwave heating[J].Russian Journal of Physical Chemistry AFocus on Chemistry,2012,86(1):81-84.
Study on ultrasonic and microwave-assisted extraction of flavonoids fromOenantheJavanicaleaves
YU Jian
(Hangzhou Vocational and Technical College,Hangzhou Key Laboratory of Green Fine Chemicals Research and Technological Transformation,Hangzhou 310018,China)
Thetechnologyofultrasonicandmicrowave-assistedextractionofflavonoidsfromOenanthe Javanicaleaveswasstudied.Theexperimentsinvestigatedtheeffectsofextraction,suchasethanolconcentration,liquid-solidratio,treatmentpowerandextractiontime.TheexperimentswereoptimizedusingaBox-Behnkenmethodoftestdesignandresponsesurfacemethodologyonthebasisofthesinglefactorexperiment.Testresultsshowedthatwhentheethanolconcentrationwas80%andliquid-solidratiowas22∶1mL/g,treatmentpower563Wextractionandextractiontimeof4.2min,theextractionyieldofflavonoidsfromOenanthe Javanicaleaveswasupto44.7mg/g.
Ultrasonicandmicrowave-assistedextraction;OenantheJavanicaleaves;flavonoids;ResponseSurfaceAnalysis
2016-03-18
俞坚(1981-),男,硕士研究生,高校讲师,主要研究现代食品加工技术,E-mail:4610483@qq.com。
浙江省教育厅科研资助项目(Y201326615)。
TS201.2
B
1002-0306(2016)19-0206-06
10.13386/j.issn1002-0306.2016.19.032
