熊果苷诱导植物乳杆菌β-D-葡萄糖苷酶对葡萄酒香气的影响
2016-12-19樊明涛张庭静程拯艮刘延琳
彭 帅,樊明涛,*,张庭静,苗 壮,程拯艮,刘延琳
(1.西北农林科技大学食品科学与工程学院,陕西杨凌 712100;2.西北农林科技大学葡萄酒学院,陕西杨凌 712100)
熊果苷诱导植物乳杆菌β-D-葡萄糖苷酶对葡萄酒香气的影响
彭 帅1,樊明涛1,*,张庭静1,苗 壮1,程拯艮1,刘延琳2
(1.西北农林科技大学食品科学与工程学院,陕西杨凌 712100;2.西北农林科技大学葡萄酒学院,陕西杨凌 712100)
熊果苷诱导能够提高β-D-葡萄糖苷酶酶活,增加葡萄酒香气成分,改善葡萄酒品质。本研究在完整细胞、破碎细胞两种细胞形态下,以β-D-葡萄糖苷酶酶活为指标对含有不同浓度熊果苷的MRS培养基进行优化,将在最优培养基和传统MRS培养基中生长的植物乳杆菌分别接种到模拟酒中,通过气相色谱-质谱联用仪分析比较香气的差异。结果表明:乳杆菌完整细胞的酶活高于破碎细胞,含有10 g/L熊果苷的MRS培养基为最适培养基。接种经熊果苷诱导菌株的模拟酒中香气含量明显高于对照组(p<0.05),并且接种XJ-14-X的模拟酒中检测到29种挥发性香气,香气总含量为568.81 μg/L,优于其它处理。结论:熊果苷诱导β-D-葡萄糖苷酶酶活对改善葡萄酒香气品质有积极作用。
植物乳杆菌,熊果苷,β-D-葡萄糖苷酶,气相色谱-质谱
香气是影响葡萄酒品质的重要指标,其种类、含量、阈值及其之间的相互作用决定着葡萄酒的感官质量、风味和典型性[1-2]。葡萄酒香气成分复杂,到目前为止在葡萄酒中已经检测出来的香气种类多达1000多种,包含酸类、酯类、醇类、挥发性酚类、萜烯醇类及硫醇类等[3-4]。
葡萄酒的香气按其来源可以分为3类:品种香、发酵香和陈酿香[5]。发酵香是在发酵过程中产生的香气,也称二级香气,即在发酵过程中由酵母菌、植物乳杆菌等微生物代谢单糖、糖苷等香气前体物质产生香气的过程[6]。β-D-葡萄糖苷酶能够分解葡萄酒中糖苷类香气前体物质,是葡萄酒增香的关键酶。然而目前对糖苷酶的研究主要致力于乳酸菌中的酒酒球菌(Oenococcus oeni)。但是,有人发现植物乳杆菌中同样具有β-D-葡萄糖苷酶活性,甚至其酶活比酒酒球菌的更高。在某些情况下,植物乳杆菌能够触发并完成苹果酸乳酸发酵,降低葡萄酒酸度和粗涩感,进而提高葡萄酒的品质[7]。
β-D-葡萄糖苷酶(β-D-Glucosidase)是催化水解烃基与糖基之间的糖苷键生成芳香物质和葡萄糖的一种水解酶,又称β-D-葡萄糖苷水解酶[8]。葡萄和葡萄酒中的键合态香气物质可以被酸或者酶水解,进而释放出挥发性香气物质,改善葡萄酒的风味。和酸解相比,酶解具有条件温和、高效快速、专一性强、且产物不发生重排等优点,因此目前在实际生产中一般采用酶解来降解键合态香气物质[9]。乳酸菌、酵母菌及丝状真菌是β-D-葡萄糖苷酶的重要来源,且微生物源的糖苷酶具有良好的食品安全性,具有很好的商业应用前景。
熊果苷(Arbutin)化学名称为4-羟苯基-β-D-吡喃葡萄糖苷,是一种白色针状结晶物,易溶于热水、甲醇、乙醇等溶液[10]。最近几年,人们对熊果苷的研究日益增加,这得益于其具有良好的生理生化功能。研究表明熊果苷具有良好的止咳祛痰,消炎抗菌等作用,尤其显著的是在抑制皮肤酪氨酸酶作用方面,因此广泛应用于美白类化妆品中[11-12]。除了在医疗方面的应用外,张哲、李亚辉[13-14]等人报道其对β-D-葡萄糖苷酶具有一定的诱导作用,其诱导原理为微生物生长优先代谢单糖,在没有单糖的环境下会分泌非优先碳源的酶如糖苷酶、转运酶等,分解这些碳源产生单糖[15],但是关于熊果苷诱导对香气影响的报道非常有限。鉴于此,本文拟研究熊果苷对植物乳杆菌β-D-葡萄糖苷酶的诱导作用及其改善葡萄酒香气的可行性,为β-D-葡萄糖苷酶的实际应用和高品质葡萄酒的生产奠定理论基础。
1 材料与方法
1.1 材料与仪器
实验菌种:植物乳杆菌(Lactobacillusplantarum)XJ-14、XJ-25由西北农林科技大学食品学院提供(前期研究该两株菌酶活较高)。
MRS培养基:葡萄糖20 g,酵母浸粉4 g,蛋白胨10 g,牛肉膏5 g,MgSO4·7H2O 0.2 g,MnSO4·4H2O 0.05 g,乙酸钠5 g,磷酸氢二钾2 g,柠檬酸铵2 g,1 mL吐温80,加水至1 L,用1 mol/L的NaOH调pH至6.2~6.4,121 ℃灭菌20 min。
改良MRS1培养基:葡萄糖10 g,熊果苷10 g,其它成分同MRS培养基。
改良MRS2培养基:熊果苷20 g,其它成分同MRS培养基。
实验试剂:对硝基苯基-β-葡萄糖苷 上海宝曼生物科技有限公司;熊果苷 美国Amersc公司;LiChrolut EN柱(1300 mg) 德国默克公司;乙醇、二氯甲烷、戊烷、乙酸乙酯、甲醇,均为国产。
模拟酒配制方法参照李爱霞[16]方法,并添加香气前体糖苷作为酶解的自然底物,其提取方法见1.2.5。
DH-420A电热恒温培养箱、水浴锅 北京科伟永兴仪器有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;HS-840U型水平层流单人净化工作台 苏州净化设备有限公司;pH计 上海雷磁仪器厂;UV-3802H紫外-可见分光光度计 上海尤尼柯仪器有限公司。
1.2 实验方法
1.2.1 菌体生长曲线 将在-40 ℃保存下的菌株在MRS固体培养基上划线培养。2天后取单菌落接种至10 mL MRS液体培养基中培养12 h,重复2次。之后取30支15 mL无菌试管,向每支试管加入10 mL MRS培养基,将活化好的菌株按2%接种量分别接入每支试管,放入37 ℃培养箱培养,每隔1 h取出一支测OD600值。每株菌复测定三次取其OD600平均值。
1.2.2 酶活的测定方法 方法参照Mansfield[17]略有改动。取对数生长末期菌体8 mL离心(5000 r/min 10 min),得菌体并重悬于1 mL无菌生理盐水中。取适量菌体(50~500 μL,确保吸光度值在0.2~0.8之间,并添加无菌水至500 μL),并加入500 μL对硝基苯基-β-葡萄糖苷/柠檬酸磷酸缓冲液(底物浓度5 mmol/L)。在37 ℃水浴1 h,12000 r/min下离心。取上层清液加入2 mL 1 mol/L的Na2CO3溶液中,终止反应,并在400 nm处测吸光度值,对照处理为不添加菌体悬浊液,只添加无菌水。
酶活定义:37 ℃下每分钟每克干菌重生成对硝基苯酚的量(μmol)为一个酶活单位,即μmol/(g·min)。
1.2.3 熊果苷浓度对酶活的影响 两株植物乳杆菌分别接种到MRS培养基、改良MRS1培养基及改良MRS2培养基中,培养到对数生长末期比较其酶活大小。
1.2.4 细胞形态对酶活的影响 将不同培养基中对数生长末期的菌体离心(5000 r/min,10 min)得菌体,用1 mL PBS缓冲液(NaCl 140 mmol/L;KCl 2.7 mmol/L;Na2HPO410 mol/L;KH2PO41.8 mol/L;pH7.4)将菌体重悬并混匀,将菌体置于冰块中,超声破碎,并与相对应培养基中完整菌体进行酶活比较。
1.2.5 香气前体物质的提取 方法参照Wang Kang[18],略有改动。500 g葡萄破碎并悬浮于乙醇含量为13%(v/v)的Na2HPO4/NaH2PO4缓冲液中(0.1 mol/L,pH7.0),在4 ℃下浸渍36 h,使糖苷物质浸渍出来;浸渍液离心(5000 r/min,15 min),过0.45 μm滤膜,得香气糖苷粗提液。
香气前体物质采用聚丙烯-二乙烯苯小柱(Lichrolut EN,Merck,0.5 g填料)萃取分析,方法参照Ma. Jesus Ibarz[19]。先用20 mL二氯甲烷,20 mL甲醇和20 mL超纯水活化,之后取50 mL香气糖苷粗提液上样,分别用40 mL超纯水和40 mL戊烷∶二氯甲烷2∶1洗脱极性小分子杂质和非极性大分子杂质,最后用50 mL乙酸乙酯∶甲醇9∶1洗脱,得香气糖苷物提取液,洗脱流速为 1 mL/min。真空下旋转蒸发,干物质(相当于500 g葡萄中糖苷的量)用20 mL磷酸柠檬酸缓冲液(pH5.0)溶解,并以20 mL/L添加到200 mL模拟酒中。按2%的接种量分别将在MRS 培养基及最优培养基中生长的XJ-14、XJ-25菌株离心后接种到模拟酒中,发酵后进行香气分析。
1.2.6 挥发性香气成分分析 取12 mL 待测模拟酒样,加入到20 mL 顶空瓶中,加入3.0 g NaCl 同时加入40.09 μg/L 的内标3-辛醇,在40 ℃,350 r/min转速下平衡10 min,后进行顶空萃取30 min。
GC条件根据Yuxia Wang[20]略有改变。Agilent HP-5MS(60 m×0.25 mm×0.25 μm);进样口温度250 ℃;程序升温:起始温度50 ℃,保持3 min,程序以6 ℃/min升温至80 ℃,保持2 min;再程序升温5 ℃/min至250 ℃,保持3 min;载气为高纯氦气,流速为1.0 mL/min。
MS条件:电离方式EI;电子电压70 eV;传输线温度250 ℃;离子源温度230 ℃;四极杆温度150 ℃;质量范围35~450;采用wiley7n.l标准谱库检索定性。
1.2.7 数据统计分析 数据的常规分析采用Excel 2010进行,显著性分析采用SPSS 20.0软件进行。
2 结果与分析
2.1 菌体生长曲线
图1显示的是XJ-14和XJ-25在MRS培养基中的生长曲线。如图所示,XJ-14的生长周期比XJ-25的生长周期长。XJ-14的延滞期为0~4 h,对数生长期为4~11 h,11 h以后为稳定期。XJ-25的延滞期为0~2 h,对数生长期为2~8 h,8 h以后为稳定期。
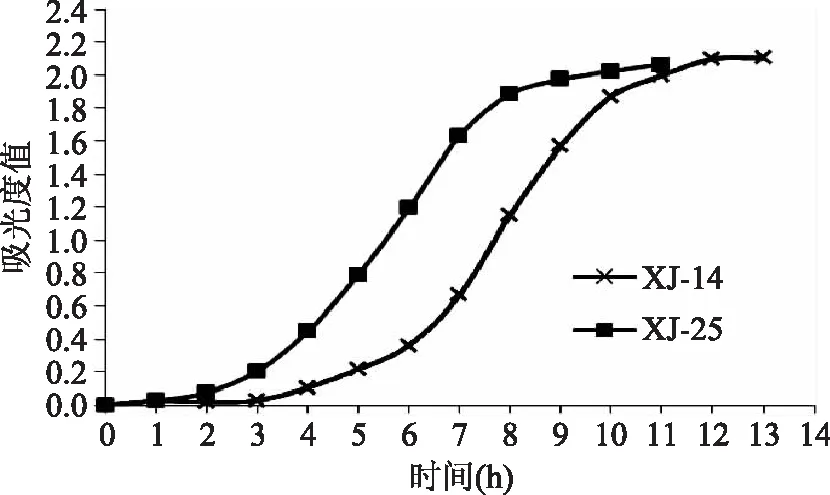
图1 XJ-14和XJ-25在MRS培养基中的生长曲线Fig.1 Growth curve of XJ-14 and XJ-25 in ATB medium
2.2 熊果苷浓度及细胞形态对酶活的影响
细胞形态及不同熊果苷浓度对植物乳杆菌中β-D-葡萄糖苷酶酶活的影响如图2、图3所示。从图中可以看出,在两种细胞形态下,改良MRS1培养基中生长的XJ-14和XJ-25两株菌酶活均高于其在MRS培养基培养下菌株的酶活;改良MRS1与改良MRS2相比较,两株菌糖苷酶酶活没显著变化(p>0.05)。由此表明,10 g/L熊果苷对不同形态下两株菌的β-D-葡萄糖苷酶具有一定诱导作用。但熊果苷浓度由10 g/L变为20 g/L对酶活的影响不显著,可能因为高浓度的熊果苷虽然能够诱导出更高的酶活,但没有足够的葡萄糖作为糖源,导致乳杆菌的生长受到限制。从经济角度考虑,选用熊果苷含量为10 g/L的培养基为最适培养基。
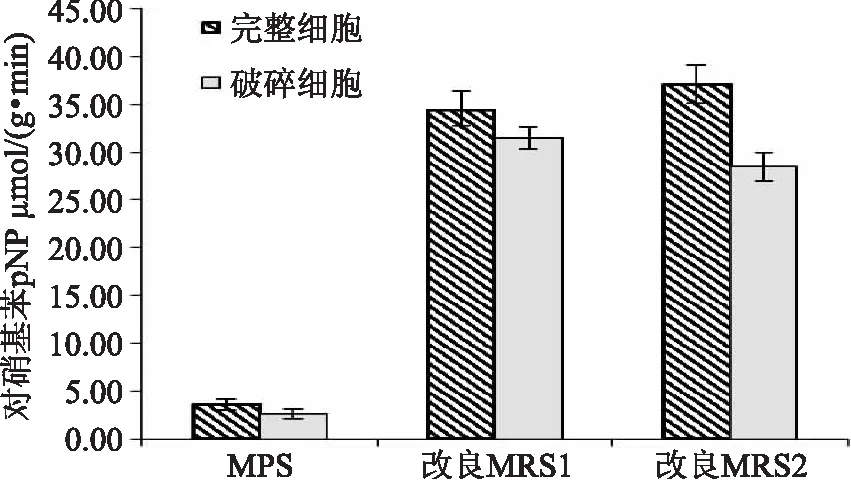
图2 细胞形态及熊果苷浓度对XJ-14中糖苷酶酶活的影响Fig.2 The influence of cell type and concentration of arbutin on enzyme activity注:改良MRS1为含10 g/L熊果苷的MRS培养基,改良MRS2为含20 g/L熊果苷的MRS培养基。

图3 细胞形态及熊果苷浓度对XJ-25中糖苷酶酶活的影响Fig.3 The influence of cell type and concentration of arbutin on enzyme activity注:改良MRS1为含10 g/L熊果苷的MRS培养基,改良MRS2为含20 g/L熊果苷的MRS培养基。
比较完整和破碎两种细胞形态下的酶活可以看出,在不同培养基中均是完整细胞酶活高,这说明细胞破碎过程破坏了部分酶活。因此,完整形态下对酶活更有利,在模拟酒香气分析过程中将接种完整菌体。
2.3 模拟酒香气分析

图4 接种 XJ-14的模拟酒香气成分GC-MS总离子流图Fig.4 GC-MS TIC of volatiles from simulation of wine inoculated XJ-14
2.3.1 模拟酒香气成分GC-MS总离子流图 接种菌株XJ-14及其诱导菌株XJ-14-X模拟酒香气成分GC-MS总离子流图如图4、图5所示。对比两图可知,模拟酒中葡萄糖苷经糖苷酶催化水解后释放出多种挥发性香气成分,具有20~30个良好的色谱峰,且比较同一出峰时间,经诱导菌株XJ-14-X发酵的模拟酒中香气含量较接种非诱导菌株XJ-14的模拟酒有明显变化。

图5 接种XJ-14-X的模拟酒香气成分GC-MS总离子流图Fig.5 GC-MS TIC of volatiles from simulation of wine inoculated XJ-14-X
2.3.2 熊果苷诱导对模拟酒中香气种类数及总含量影响的差异分析 图6、图7表示熊果苷诱导对模拟酒中醇类、酸类、酯类、醛类、酮类及其它类挥发性香气种类数和总含量的影响。菌株XJ-14经熊果苷诱导后,醇类香气种类数无变化,但其香气含量由53.88 μg/L增加到186.44 μg/L,提高了2.4倍;酸类由5种增加到9种,含量也明显提高;酯类挥发性香气的种类数和含量都有所降低,可能酯类香气物质被分解为醇和酸所致。菌株XJ-25经熊果苷诱导后,醇类、酸类挥发性香气含量明显增加(p<0.05),且酸类香气种类数也有所增加;酯类挥发性香气成分含量相对保持不变。酮类挥发性香气物质的种类数在两株菌中都有所下降,但其香气总量没有明显变化。
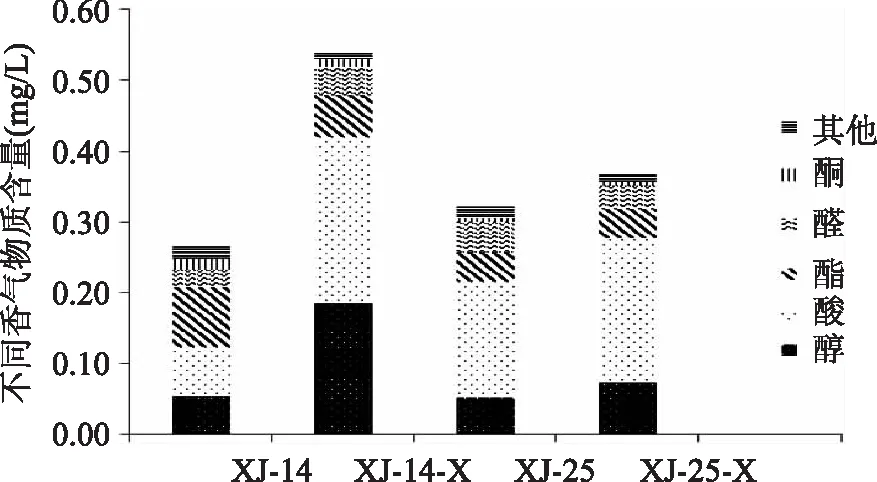
图6 不同处理的菌种对模拟酒香气含量的影响Fig.6 Influence of strains with different processing on simulated wine aroma content
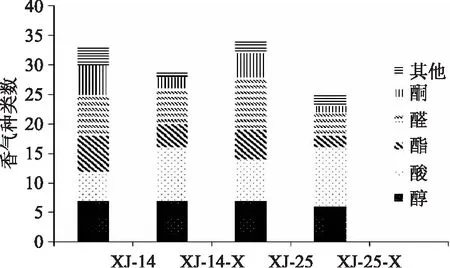
图7 不同处理的菌种对模拟酒香气种类数的影响Fig.7 Influence of strains with different processing on count of simulated wine aroma species注:XJ-14、XJ-25为在MRS培养基中生长的菌株,XJ-14-X、XJ-25-X为在改良MRS1培养基中生长的菌株。
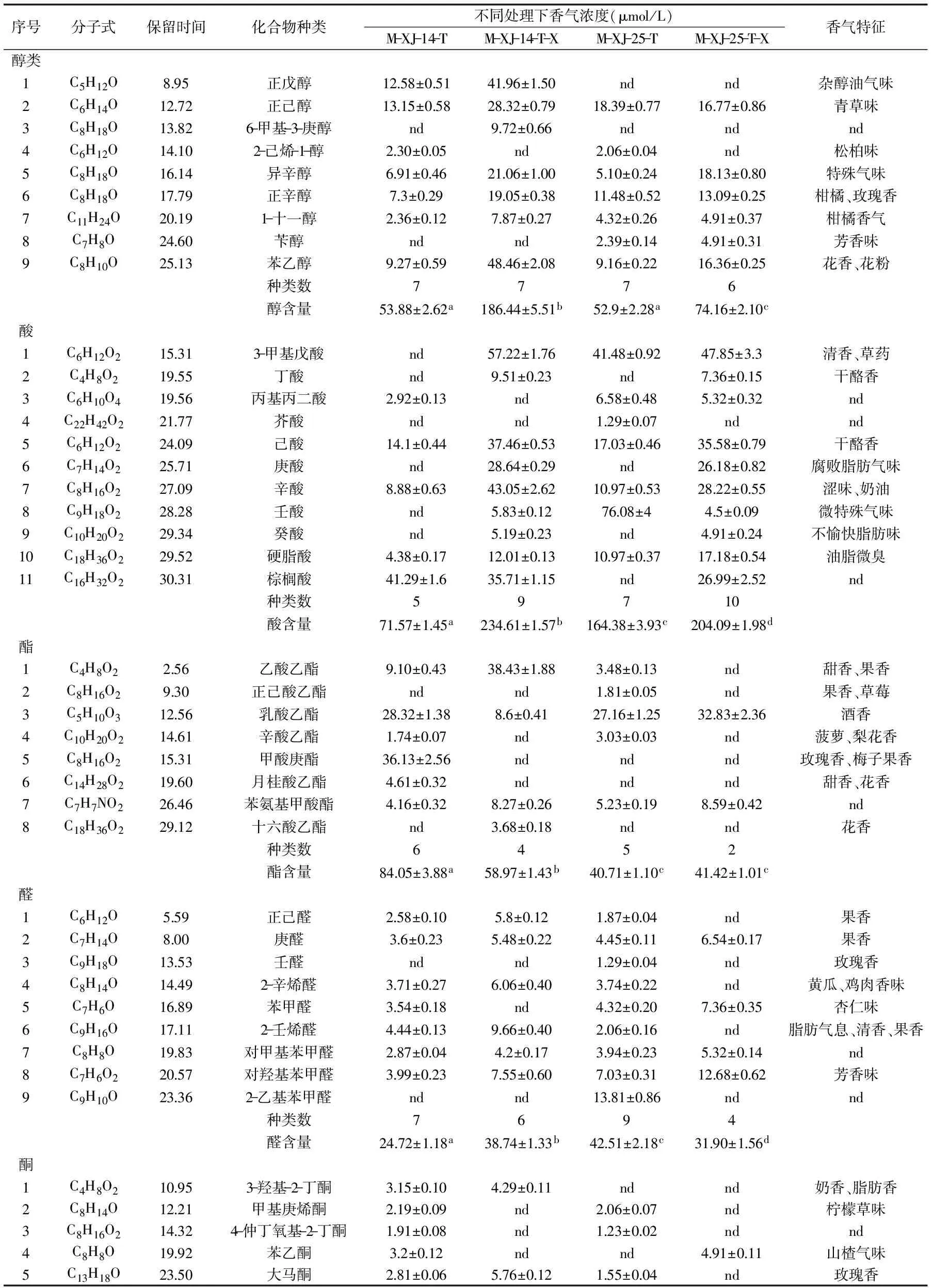
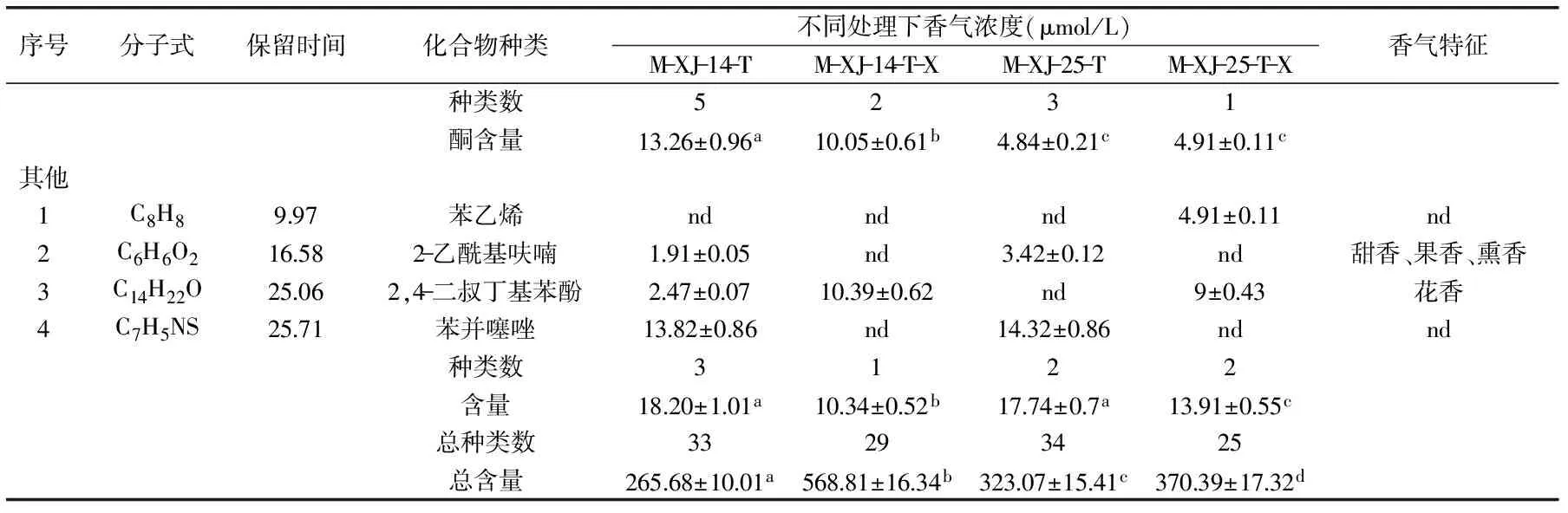
2.3.3 不同处理对模拟酒香气的影响 游离香气成分见表1。酒样中共检测出47种香气物质,主要分为醇类、酸类、酯类、醛类、酮类及其他类,且经熊果苷诱导的酒样中香气含量较对照组有显著差异。在接种XJ-14的模拟酒中,共检测出香气33种,总含量为265.68 μg/L,XJ-14-X接种酒样中共检测出香气29种,总含量为568.81 μg/L;在接种XJ-25的模拟酒中,共检测出香气34种,总含量为323.07 μg/L,XJ-25-X接种酒样中共检测出香气25种,总含量为370.39 μg/L。表明熊果苷诱导后菌体能产生更高含量的香气,浓郁度增加。
醇类化合物是酒中重要的挥发性香气物质,醇类化合物是由酒精发酵、亚麻酸降解物氧化及氨基酸转化的主要产物。在XJ-14、XJ-14-X、XJ-25、XJ-25-X接种酒样中检测到醇含量依次为53.88、186.44、52.90、74.16 μg/L,结果表明,熊果苷能够诱导糖苷酶生成更多的醇类物质。醇类香气物质在酒中主要表现为植物清香,在酒样检测到的挥发性香气中,正己醇呈青草味、正辛醇呈玫瑰香香味、1-十一醇呈柑橘香、苄醇呈芳香味、苯乙醇呈花香味及2-乙烯-1-醇呈松柏香,对改善酒的香气品质起到积极作用。
葡萄酒存在酸味、奶酪味和脂肪味,这是因为葡萄酒中存在有机酸[21]。由表1可知,XJ-14中检测到有机酸5种,含量为71.58 μg/L,XJ-14-X中检测到9种,含量为234.61 μg/L,是XJ-14中有机酸总量的3.28倍。较之XJ-14,在熊果苷诱导下糖苷酶分解香气前体物质,不仅增加了XJ-14中已存在香气的含量,如己酸(干酪味)和辛酸(奶油味),而且新增有益酸类香气成分,如3-甲基戊酸(清香味)和丁酸(干酪香),丰富了挥发性有机酸种类,改善了葡萄酒的香气。这说明熊果苷诱导糖苷酶的种类并不单一[15]。XJ-25-X中有机酸10种,总量为204.09 μg/L,较XJ-25也有明显增加(p<0.05)。
酯类是葡萄酒中重要的香气物质,赋予葡萄酒花香和果香味,酯类物质是由醇与通过酯化反应生成。如表1所示,呈酒香的乳酸乙酯和果香的乙酸乙酯是糖苷酶水解香气前体物质产生的常见挥发性酯类物质,这与Wenhuai Kang[22]的研究结果相似。除这两种酯类物质外,在XJ-14-X中检测到呈花香的十六酸乙酯;在XJ-25-X中检测到的酒香味的乳酸乙酯和果香味的苯氨基甲酸酯较XJ-25有明显增加,这些酯类物质修饰了葡萄酒香气品质。经熊果苷诱导后酯类物质略有减少,这可能是熊果苷在诱导糖苷酶的同时还能够诱导部分酯类水解酶,并将产生的部分酯类物质水解为醇与酸。
表1 不同处理的菌种对模拟酒香气影响
Table 1 Influence of strains with different processing on simulated wine aroma
序号分子式保留时间化合物种类不同处理下香气浓度(μmol/L)M-XJ-14-TM-XJ-14-T-XM-XJ-25-TM-XJ-25-T-X香气特征醇类1C5H12O895正戊醇1258±0514196±150ndnd杂醇油气味2C6H14O1272正己醇1315±0582832±0791839±0771677±086青草味3C8H18O13826-甲基-3-庚醇nd972±066ndndnd4C6H12O14102-己烯-1-醇230±005nd206±004nd松柏味5C8H18O1614异辛醇691±0462106±100510±0241813±080特殊气味6C8H18O1779正辛醇73±0291905±0381148±0521309±025柑橘、玫瑰香7C11H24O20191-十一醇236±012787±027432±026491±037柑橘香气8C7H8O2460苄醇ndnd239±014491±031芳香味9C8H10O2513苯乙醇927±0594846±208916±0221636±025花香、花粉种类数7776醇含量5388±262a18644±551b529±228a7416±210c酸1C6H12O215313-甲基戊酸nd5722±1764148±0924785±33清香、草药2C4H8O21955丁酸nd951±023nd736±015干酪香3C6H10O41956丙基丙二酸292±013nd658±048532±032nd4C22H42O22177芥酸ndnd129±007ndnd5C6H12O22409己酸141±0443746±0531703±0463558±079干酪香6C7H14O22571庚酸nd2864±029nd2618±082腐败脂肪气味7C8H16O22709辛酸888±0634305±2621097±0532822±055涩味、奶油8C9H18O22828壬酸nd583±0127608±445±009微特殊气味9C10H20O22934癸酸nd519±023nd491±024不愉快脂肪味10C18H36O22952硬脂酸438±0171201±0131097±0371718±054油脂微臭11C16H32O23031棕榈酸4129±163571±115nd2699±252nd种类数59710酸含量7157±145a23461±157b16438±393c20409±198d酯1C4H8O2256乙酸乙酯910±0433843±188348±013nd甜香、果香2C8H16O2930正己酸乙酯ndnd181±005nd果香、草莓3C5H10O31256乳酸乙酯2832±13886±0412716±1253283±236酒香4C10H20O21461辛酸乙酯174±007nd303±003nd菠萝、梨花香5C8H16O21531甲酸庚酯3613±256ndndnd玫瑰香、梅子果香6C14H28O21960月桂酸乙酯461±032ndndnd甜香、花香7C7H7NO22646苯氨基甲酸酯416±032827±026523±019859±042nd8C18H36O22912十六酸乙酯nd368±018ndnd花香种类数6452酯含量8405±388a5897±143b4071±110c4142±101c醛1C6H12O559正己醛258±01058±012187±004nd果香2C7H14O800庚醛36±023548±022445±011654±017果香3C9H18O1353壬醛ndnd129±004nd玫瑰香4C8H14O14492-辛烯醛371±027606±040374±022nd黄瓜、鸡肉香味5C7H6O1689苯甲醛354±018nd432±020736±035杏仁味6C9H16O17112-壬烯醛444±013966±040206±016nd脂肪气息、清香、果香7C8H8O1983对甲基苯甲醛287±00442±017394±023532±014nd8C7H6O22057对羟基苯甲醛399±023755±060703±0311268±062芳香味9C9H10O23362-乙基苯甲醛ndnd1381±086ndnd种类数7694醛含量2472±118a3874±133b4251±218c3190±156d酮1C4H8O210953-羟基-2-丁酮315±010429±011ndnd奶香、脂肪香2C8H14O1221甲基庚烯酮219±009nd206±007nd柠檬草味3C8H16O214324-仲丁氧基-2-丁酮191±008nd123±002ndnd4C8H8O1992苯乙酮32±012ndnd491±011山楂气味5C13H18O2350大马酮281±006576±012155±004nd玫瑰香
续表
注:“nd”表示为检测出;同一行中不同小写字母表示差异显著(p<0.05)。
大多数的羰基化合物都有令人愉快的花果香气[23],如表1所示,在四种不同的处理下醛类约占香气总含量的4%~9%之间,酮类约占1.8%~5%,虽然相对含量较低,但对葡萄酒的改善有着不可忽略的作用。酒样中检测到的醛类物质,如庚醛(果香)、苯甲醛(杏仁香)、对羟基苯甲醛(芳香)、2-壬烯醛(脂肪香);酮类物质,如苯乙酮(山楂味)、大马酮(玫瑰香)、3-羟基-2-丁酮(奶香)等对葡萄酒香气改善有着不可替代的作用。此外,在熊果苷诱导下,XJ-14-X中醛类化合物比J-14增加56.7%,表明熊果苷诱导对葡萄酒中醛类香气物质起积极作用。
除了醇类、酸类、脂肪类、醛酮类化合物,在样品中还检测到甜香味的2-乙酰基呋喃、花香味的2.4-二叔丁基苯酚等挥发性香气,这些物质也赋予葡萄酒特殊的香气。
3 结论
研究证实,完整细胞比破碎细胞中糖苷酶活性更高,在10 g/L熊果苷诱导剂的诱导作用下,β-D-葡萄糖苷酶的活性得到明显提高。通过GC-MS从接种诱导菌株XJ-14-X的模拟酒中检测到醇类7种、酸类9种、酯类4种、醛类6种、酮类2种以及其它类挥发性香气物质1种,共计29种香气物质,香气总含量可达568.81 μg/L,明显高于其它处理组。接种诱导菌株XJ-14-X和XJ-25-X的模拟酒中挥发性香气总含量较对照组都有明显增加,香气浓郁度加强,且新增3-甲基戊酸、丁酸、十六酸乙酯等香气物质,香气种类得到丰富。研究证明了熊果苷诱导β-D-葡萄糖苷酶改善葡萄酒香气的可行性,为提高葡萄酒品质提供理论依据。
[1]李记明,贺普超,刘玲. 优良品种葡萄酒的香气成分研究[J]. 西北农业大学学报,1998,26(6):6-9.
[2]李华.葡萄酒品尝学[M].北京:中国青年出版社,1992.
[3]Rapp A,Mandery H. Wine aroma[J]. Experientia,1986,42(8):873-884.
[4]孔程仕,徐兴英. 气质联用技术(GC-MS)在葡萄酒香气成分分析中研究进展[J]. 饮料工业,2012,15(3):43-46.
[5]王家梅,张军翔. 葡萄酒香气来源和形成研究进展[J]. 中国酿造,2014,5:002.
[6]刘峻溪,张将,史涛涛,等. 不同商品酵母对葡萄酒香气成分的影响[J]. 中国酿造,2015,34(4):42-46.
[7]Du Toit M,Engelbrecht L,Lerm E,et al. Lactobacillus:the next generation of malolactic fermentation starter cultures-an overview[J]. Food and Bioprocess Technology,2011,4(6):876-906.
[8]李华,高丽.β-葡萄糖苷酶活性测定方法的研究进展[J]. 食品与生物技术学报,2007,2.
[9]Guo Y,Yan Q,Yang Y,et al. Expression and characterization of a novelβ-glucosidase,with transglycosylation and exo-β-1,3-glucanase activities,from Rhizomucor miehei[J]. Food chemistry,2015,175:431-438.
[10]王慧琛,王丽琴. 熊果苷的应用及检测研究进展[J]. 天津药学,2012,24(4):71-74.
[11]Chakraborty A K,Funasaka Y,Komoto M,et al. Effect of arbutin on melanogenic proteins in human melanocytes[J]. Pigment cell research,1998,11(4):206-212.
[12]丁国斌,陈璧,汤朝武. 熊果苷对体外培养的人黑素细胞的作用[J]. 第四军医大学学报,2001,22(20):1846-1848.
[13]张哲,樊明涛,董梅,等.植物乳杆菌β-D-葡萄糖苷酶的定位及活性研究[J].食品科学,2014,15:035.
[14]李亚辉.酒类酒球菌SD-2a和31MBR的β-D-葡萄糖苷酶研究[D]. 西北农林科技大学,2013.
[15]Deutscher J,Francke C,Postma P W. How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria[J]. Microbiology and Molecular Biology Reviews,2006,70(4):939-1031.
[16]李爱霞. 植物乳杆菌苹果酸-乳酸发酵性能及其苹果酸-乳酸酶的研究[D].杨凌:西北农林科技大学,2014.
[17]Mansfield A K,Zoecklein B W,Whiton R S. Quantification of glycosidase activity in selected strains of Brettanomyces bruxellensis and Oenococcus oeni[J]. American Journal of Enology and Viticulture,2002,53(4):303-307.
[18]Wang Y,Zhang C,Li J,et al. Different influences ofβ-glucosidases on volatile compounds and anthocyanins of Cabernet Gernischt and possible reason[J]. Food chemistry,2013,140(1):245-254.
[19]Ibarz M J,Ferreira V,Hernández-Orte P,et al. Optimization and evaluation of a procedure for the gas chromatographic-mass spectrometric analysis of the aromas generated by fast acid hydrolysis of flavor precursors extracted from grapes[J]. Journal of Chromatography A,2006,1116(1):217-229.
[20]Wang Y,Kang W,Xu Y,et al. Effect of Different Indigenous Yeastβ-Glucosidases on the Liberation of Bound Aroma Compounds[J]. Journal of the Institute of Brewing,2011,117(2):230-237.
[21]Molina A M,Guadalupe V,Varela C,et al. Differential synthesis of fermentative aroma compounds of two related commercial wine yeast strains[J]. Food Chemistry,2009,117(2):189-195.
[22]Kang W,Xu Y,Qin L,et al. Effects of Differentβ-D-Glycosidases on Bound Aroma Compounds in Muscat Grape Determined by HS-SPME and GC-MS[J]. Journal of the Institute of Brewing,2010,116(1):70-77.
[23]赵新节,张家荣,秦绍智,等. 玫瑰香冰葡萄酒香气成分分析[J]. 酿酒科技,2013,9(231):107-119.
Influence ofβ-D-glycosidase enzymes induced by arbutin on aroma of grape wine
PENG Shuai1,FAN Ming-tao1,*,ZHANG Ting-jing1, MIAO Zhuang1,CHENG Zheng-gen1,LIU Yan-lin2
(1.College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China; 2.College of Enology North west A&F University,Yangling 712100,China)
Arbutincaninduceβ-D-glycosidaseenzymeactivity,andthenincreasethewinearomacomponentsandimprovethequalityofwine.Culturemediumaddingdifferentconcentrationsofarbutinwasoptimizedbasedonenzymeactivityunderformofcompleteandbreak.ThedifferenceofaromaofsimulationwineinoculatedLactobacillus plantarumrespectivelyfromMRSandoptimalmediumweredetectedbyGC-MSinthisexperiment.Theresultsshowedthatenzymeactivityofcompletecellwashigherthanbrokencells.whentheconcentrationofarbutinwas10g/L,theenzymesactivityofβ-D-glycosidasewascomparativelyhigh.Thearomacontentofsimulationwinefermentedwithinduciblestrainwassignificantlyhigherthanthecontrolgroup.Inaddition,therewere29speciesofaromaandthecontentwas568.81μg/LinsimulationwinefermentedbyXJ-14-X,whichwassuperiortotheothersamples.Thusitcanbeseenthatarbutincaninduceβ-D-glycosidaseenzymetoimprovearomaofgrapewineintheprocessoffermentation.
Lactobacillus plantarum;arbutin;β-D-glycosidaseenzyme;GC-MS
2016-04-01
彭帅(1989-),男,硕士研究生,研究方向:微生物发酵,E-mail:15502973992@163.com。
*通讯作者:樊明涛(1963-),男,博士,教授,研究方向:食品生物技术与食品安全 ,E-mail:fanmt@nwsuaf.edu.cn。
08现代农业-葡萄酿造(CARS-30-gj-3)。
TS262.1
A
1002-0306(2016)19-0170-07
10.13386/j.issn1002-0306.2016.19.025
