藜麦萌发过程中营养物质变化规律及藜麦芽乳制浆工艺研究
2016-12-19陈树俊庞震鹏刘晓娟徐晓霞
胡 洁,陈树俊,庞震鹏,刘晓娟,徐晓霞,仪 鑫,石 玥,李 乐
(山西大学生命科学学院,山西太原 030006)
藜麦萌发过程中营养物质变化规律及藜麦芽乳制浆工艺研究
胡 洁,陈树俊*,庞震鹏,刘晓娟,徐晓霞,仪 鑫,石 玥,李 乐
(山西大学生命科学学院,山西太原 030006)
为进一步开发利用藜麦芽类产品,以藜麦为原料,经一定条件萌发,分别测定藜麦萌发后蛋白质、粗脂肪、淀粉、还原糖含量、α-淀粉酶、β-淀粉酶活性、维生素B1、B2含量、多酚、黄酮以及γ-氨基丁酸(GABA)含量的变化规律,并确定最佳萌发时间。在单因素的基础上采用正交实验优化,以原料利用率和多酚提取率的综合水平值作为评价指标,探寻藜麦芽乳最佳磨浆工艺。结果表明,最佳萌发时间为第3 d,磨浆温度为60 ℃,磨浆时间为3 min,磨浆液料比为6∶1 mL/g,磨浆pH为6.5时工艺最佳。此条件下原料利用率达到70.91%,多酚提取率为79.79%,综合水平值为77.13%。
藜麦,萌发,营养物质,变化规律,磨浆工艺
藜麦(ChenopodiumquinoaWilld.)是一种原产于印第安地区的植物,藜属藜科,因其性质作用与常见谷物小麦、水稻等相似而被称作“假谷物”[1-2]。藜麦的历史可以追溯到5000年前,印第安人称之为“粮食之母”[3]。我国于上世纪80年代引入藜麦,直到近几年才引起关注[4],虽然藜麦不被人们所熟知,但由于其营养价值极其丰富,受到越来越多人的关注。据报道,藜麦蛋白质含量高达12%~23%,且富含人体生长所需的必需氨基酸[5],特别是赖氨酸,含量达到5.1%~6.4%,高于水稻、小麦和玉米等一般谷物[6]。藜麦还含有丰富的维生素和矿物质(30.0 g/kg),其中钙、铁、钾、锰等远高于传统谷物[7]。另外,藜麦富含多种植物化学物质,如多酚(3.75±0.05 mg/g)、花青素(120.4±7.2 mg/100 g)[8]、黄酮(3.861 mg/g)[9]和皂苷(20%~30%)[10]等,这些物质具有抗氧化、抗衰老的功能,同时能够预防治疗多种疾病。因而藜麦被称为是“超级谷物”、“营养黄金”,联合国粮农组织(FAO)认为,藜麦是唯一一种单体植物即可满足人体基本营养需求的食物,并正式推荐藜麦为最适宜人类的完美的全营养食品[11]。
种子发芽是高等植物生命活动最强烈的一个时期,谷物种子在发芽过程中,会产生一系列生理生化变化,一些营养成分如蛋白质、淀粉会被分解从而减少[12],γ-氨基丁酸、酚类物质的含量将会提高[13],营养物质的变化会使得谷物的原料利用率及消化率得到提高。因此,研究发芽藜麦的一些性质特征将有重大实际意义。目前,国内外对于藜麦的研究仅仅集中在对其种子生物特性及功能特性的研究上,关于藜麦萌发的研究甚少,本实验通过探索藜麦萌发过程中营养物质变化规律,为进一步研究藜麦芽类产品提供理论依据及数据支持。据报道[14],藜麦在食品中的应用相对较少,主要是藜麦研磨成粉做成各种主食及糕点,小吃、饮料如藜麦南瓜八宝粥、藜麦苹果汁等,藜麦芽类产品仍然是一个空缺。因此,通过本实验的初步研究,旨在为研制一种营养丰富、口感俱佳的藜麦芽乳提供前期理论基础,为藜麦芽产品的进一步发展做出贡献。
1 材料与仪器
1.1 材料与试剂
藜麦 山西稼祺农业科技有限公司;维生素B1、维生素B2标准品、GABA标准品 北京索莱宝科技有限公司;Folin-Ciocalteu试剂、没食子酸、乙醇等均为分析纯。
磨粉机 永康市小宝电器有限公司;DHG-9240A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;JA1203N型精密电子天平 上海良平仪器仪表有限公司;UV-2800型紫外分光光度计 美国尤尼柯仪器有限公司;TDL-5型台式离心机 上海安亭科学仪器厂;HRHS24 Haier电热恒温水浴锅 青岛海尔医用低温科技有限公司;JYL-c010料理机 九阳股份有限公司;FA25高剪切分散乳化机 上海弗鲁克流体机械制造有限公司;雷磁PHS25型pH计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 藜麦萌发及芽粉制备 在前期预实验的基础上,确定藜麦萌发条件。将新鲜藜麦挑拣、除杂后,清洗浸泡2 h,用蒸馏水反复冲洗干净后平铺于滤纸上,置于22 ℃培养箱中发芽,发芽过程中每8 h用蒸馏水淋洗一次,每隔24 h取样,连续发芽5 d,所有样品取样后于-20 ℃下冷冻干燥保存直至分析。分析时将藜麦芽置于恒温干燥箱中40~50 ℃下干燥12 h,用粉碎机粉碎得到藜麦芽粉,干燥条件下保存备用。
1.2.2 常规成分测定 蛋白质测定方法:GB/T5009.5-2010《食品中蛋白质的测定-凯氏定氮法》(N系数为6.25,以干基计);粗脂肪测定方法:GB/T5512-2008《粮食中粗脂肪含量测定-索氏抽提法》;淀粉测定方法:GB/T5009.9-2008《食品中淀粉的测定-酸水解法》,还原糖测定方法:GB/T5009.7-2008《食品中还原糖的测定-直接滴定法》。
1.2.3 其他成分测定α-淀粉酶活性、β-淀粉酶活性测定:参见文献[15-16];维生素B1、B2含量测定:参见文献[17];多酚含量测定:参见文献[18];黄酮含量测定:参见文献[19];γ-氨基丁酸(GABA)含量测定:参见文献[20]。
1.2.4 藜麦芽的磨浆工艺 将萌发好的藜麦芽揉搓去皮并用蒸馏水洗净,在一定磨浆温度、磨浆时间、磨浆液料比、磨浆pH下用搅拌机磨碎,过30目筛网后再用纱布过滤去除残渣,得到黎麦芽汁。
1.2.5 单因素实验 选择磨浆初始条件为磨浆温度60 ℃、时间2 min、液料比6∶1 mL/g和pH6,固定其中三个因素条件,考虑剩下因素的变化情况,即分别选取磨浆温度(40、50、60、70、80、90 ℃)、磨浆时间(1、2、3、4、5、6 min)、磨浆液料比(4∶1、6∶1、8∶1、10∶1、12∶1、14∶1 mL/g)、磨浆pH(5、5.5、6、6.5、7、7.5)四个因素进行单因素实验,考察其原料利用率和多酚提取率的影响,其中二者计算公式为:
原料利用率(%)=(原料质量-残渣质量)/原料质量×100
多酚提取率(%)=P1/P2×100
式中:P1为藜麦芽汁中多酚含量(mg/g);P2为藜麦芽原料中多酚含量(mg/g)。
1.2.6 正交实验 在单因素实验的基础上,以磨浆温度、磨浆时间、磨浆液料比、磨浆pH为考察因素,设计四因素三水平正交实验,根据每个因素变化范围及每个因素所取水平设置因素水平表见表1,以原料利用率和多酚提取率的综合水平值作为指标,确定最佳磨浆工艺条件。其中:
综合水平数值=原料利用率值×30%+多酚提取率值×70%
表1 正交实验因素水平表
Table 1 Orthogonal factor level table
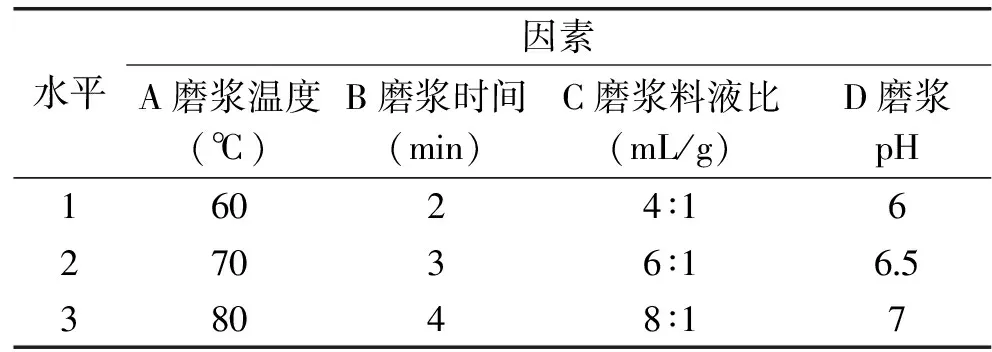
水平因素A磨浆温度(℃)B磨浆时间(min)C磨浆料液比(mL/g)D磨浆pH16024∶1627036∶16538048∶17
1.3 数据分析处理
本实验采用Excel、Origin 6.0与mintab 3软件分析数据作图,每组数据均采用3次重复实验,数据用平均值±SD值来表示。
2 结果与分析
2.1 藜麦种子主要营养物质
由表2可知,藜麦营养物质含量丰富,其中以淀粉为主,含量63.01 g/100 g,蛋白质、多酚等含量也很高,尤其蛋白质,达到17.09 g/100 g,多酚含量达到3.31 mg/g,研究表明,藜麦多酚具有抗氧化、抗衰老、抗癌等多种功效,是一种天然抗氧化物质[21]。所以研究藜麦上述物质在萌发过程中的含量变化,尤其多酚含量,根据其变化规律选择最佳取材时间,为后续实验提供良好数据支持,研制出一款营养丰富的功能饮品。
表2 藜麦种子的主要营养物质
Table 2 Major nutrients of quinoa seed

蛋白质(g/100g)粗脂肪(g/100g)淀粉(g/100g)还原糖(g/100g)水分(g/100g)多酚(mg/g)黄酮(mg/g)1709±005654±0046301±017744±008930±015331±004099±001
2.2 藜麦芽中营养物质变化规律
2.2.1 蛋白质含量变化 由图1可知,藜麦萌发过程中,蛋白质含量呈现先增加后减少的趋势,均比种子中高,在第4 d达到峰值,含量为20.97 g/100 g。在萌发过程中,含氮量相对增加、生长发育需要消耗供能物质导致总干基质量的减少,都会使蛋白质含量增加,另外分解的氨基酸等物质运送到新芽中也会合成新的蛋白质,从而增加蛋白质的含量[22],从未萌发时的17.09 g/100 g增长至第4 d的20.97 g/100 g。第4 d之后开始下降至19.84 g/100 g,可能是由于萌发过程中种子吸水后一些结合的蛋白质从结合体上脱落下来,同时细胞进行分化也需要大量消耗蛋白质,所以导致蛋白质含量下降[23-24]。
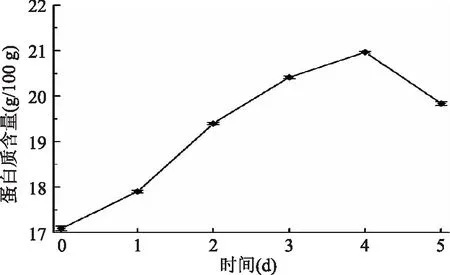
图1 藜麦萌发过程中蛋白质含量Fig.1 Protein contents during germination of quinoa
2.2.2 粗脂肪含量变化 如图2所示,藜麦萌发期间粗脂肪含量总体呈下降的趋势,未萌发的藜麦中粗脂肪含量为6.54 g/100 g,而在萌发5 d后,减少至5.30 g/100 g。原因是藜麦萌发过程中存在于细胞质脂质体中的脂肪被脂肪酶水解、利用,一部分作为能源供给生长需要,一部分参与萌发过程中物质的生成。许多研究也表明,在种子萌发中脂肪逐渐减少,碳水化合物增加,从代谢途径来讲这是由于脂肪首先被脂肪水解酶水解成甘油和脂肪酸,脂肪酸进行β-氧化,再通过糖酵解的逆转转化为蔗糖,输送到生长部位,甘油迅速磷酸化转化成丙酮酸,进入三羧酸循环[25]。
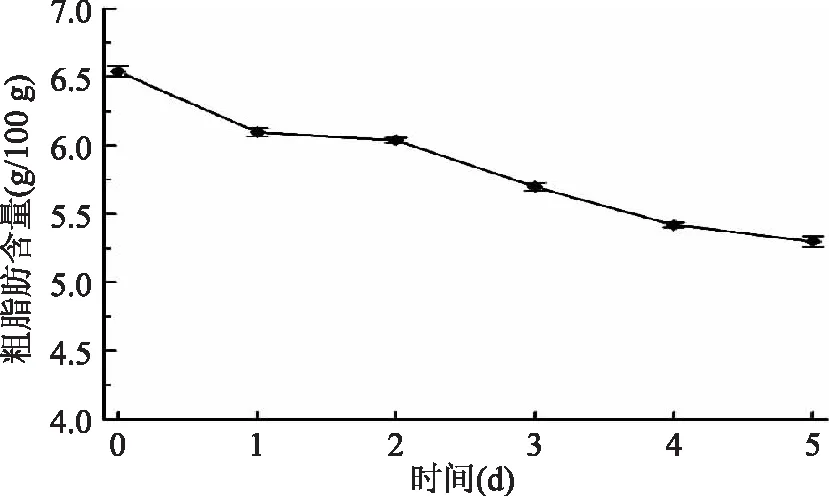
图2 藜麦萌发过程中粗脂肪含量Fig.2 Crude fat contents during germination of quinoa
2.2.3 淀粉和还原糖含量变化 由图3可知,随着萌发时间的延长,淀粉含量呈现逐渐下降的趋势,经 5 d 发芽后其含量从63.01 g/100 g减少至46.78 g/100 g,出现这种变化的原因可解释为:在藜麦发芽过程中藜麦胚乳中贮藏的淀粉从不溶解状态转变为溶解状态,并在各种水解酶的作用下被分解、利用,以及其旺盛的呼吸代谢,消耗了部分糖类从而使淀粉下降。另外由于种子吸水导致干物质减少也是淀粉含量下降的原因之一。
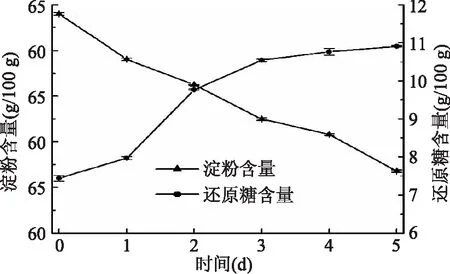
图3 藜麦萌发过程中淀粉和还原糖含量Fig.3 Starch and reducing sugar contents during germination of quinoa
萌发是酶促反应的启动过程,在萌发过程中,藜麦中还原糖含量呈上升趋势,未萌发藜麦中,还原糖含量为7.44 g/100 g,在萌发后,各时期还原糖含量与未萌发时相比均显著增加,最高达10.91 g/100 g。藜麦萌发时淀粉酶被激活,会不同程度地作用于淀粉骨架结构,将淀粉转化成分子量由大到小的各种糊精,最后形成麦芽糖,再由α-葡萄糖苷酶将麦芽糖转化为葡萄糖[26],因此导致还原糖含量增加。
2.2.4α-淀粉酶活性、β-淀粉酶活性变化 藜麦淀粉酶活力主要在发芽阶段形成,主要是α-淀粉酶和β-淀粉酶。α-淀粉酶随机水解淀粉的α-1,4-糖苷键,作为淀粉分解的起始酶而起主要作用,其水解产物为麦芽糖、麦芽三糖、糊精等还原糖,β-淀粉酶水解非还原端的第二个α-1,4-糖苷键,水解产物为麦芽糖,并能使一部分糊精糖化,这也是还原糖增加的原因之一。藜麦发芽过程中α-淀粉酶与β-淀粉酶均发生变化,由图4可以看出藜麦萌发的第0~2 d,β-淀粉酶活力逐渐增加,从2.451 mg/(g·min)增加至5.877 mg/(g·min),而α-淀粉酶活力相对下降,从4.680 mg/(g·min)减少至3.637 mg/(g·min),是由于二者作用点不同,合成速度有明显区别。随着萌发时间的延长,种子内的淀粉消耗,β-淀粉酶活力呈现下降趋势,从第2 d的5.877 mg/(g·min)减少至0.189 mg/(g·min),而α-淀粉酶活力从第3 d到第5 d变化进入一个相对稳定的状态,这说明在这段时间α-淀粉酶起主要作用,并且在第3 d达到最大值为5.240 mg/(g·min)。
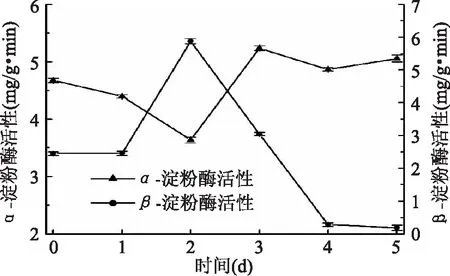
图4 藜麦萌发过程中α-淀粉酶活性和β-淀粉酶活性Fig.4 α-amylase activity and β-amylase activity during germination of quinoa
2.2.5 维生素B1、B2含量变化 由图5可以看出,藜麦萌发过程中维生素B1、B2含量均有所增加,但变化不同,其中维生素B1含量呈现上升的趋势,由0.43 mg/100 g增长至0.95 mg/100 g,而维生素B2含量先稍微减少而后增加,第3 d达到最低值0.61 mg/100 g。由于藜麦在发芽过程中为了维持正常的代谢过程而需要微量的维生素,所以二者作为辅酶均会增加,其中维生素B2稍有下降可能是由于营养需要的消耗而导致。
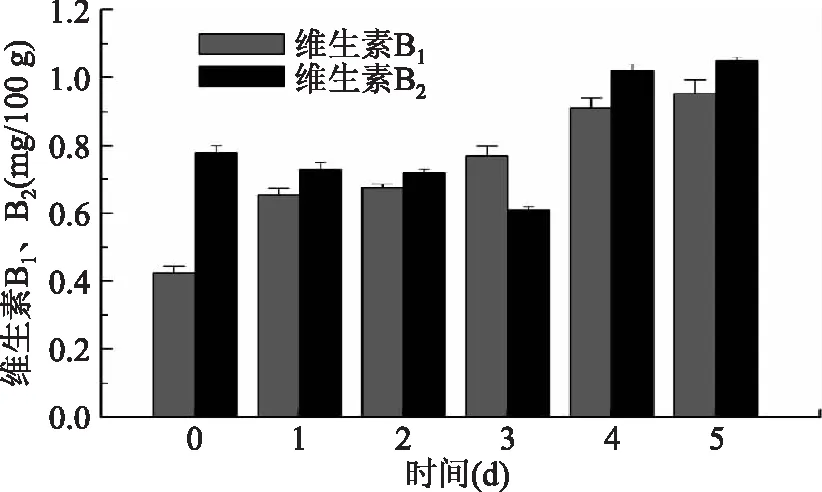
图5 藜麦萌发过程中维生素B1和维生素B2含量Fig.5 Vitamin B1and vitamin B2 contents during germination of quinoa
2.2.6 多酚含量变化 由图6可知,在藜麦萌发过程中,第0~1 d多酚含量稍微增加,第1 d之后呈现先增加后逐渐减少的趋势,第3 d达到峰值4.94 mg/g。这与多酚类物质经过苯丙烷代谢有关,藜麦萌发时,随着种子湿度的增加,种皮受到氧化或微生物的浸入而破坏,诱导糖酶分解淀粉,苯丙烷代谢途径酶被激活,逐步将代谢中间产物(羟基苯乙烯蔗糖酯等)分解转化,进而不断修饰和释放酚类物质,从而提高多酚含量[27]。由于随着发芽的进行,淀粉含量下降,控制酚类代谢途径的酶类活性下降,另外多酚氧化酶活性的增强使多酚氧化分解这些原因均会导致多酚含量的减少。
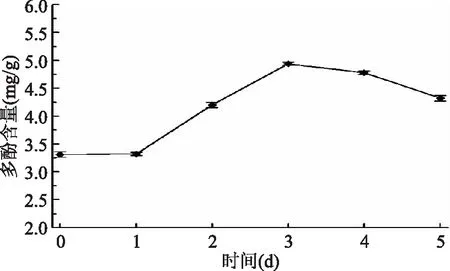
图6 藜麦萌发过程中多酚含量Fig.6 Polyphenol contents during germination of quinoa
2.2.7 黄酮含量变化 由图7可知,藜麦萌发后黄酮的含量逐渐增加而后减少,第4 d达到最高值1.29 mg/g。这是因为黎麦的萌发过程使藜麦呼吸作用增强,同时也激活了不同的酶类,合成异黄酮的重要酶即苯丙氨酸解氨酶也随之激活,从而増加了藜麦黄酮含量,第4 d之后开始减少,是由于萌发时间增长,旺盛的呼吸作用消耗使黄酮含量下降[28]。
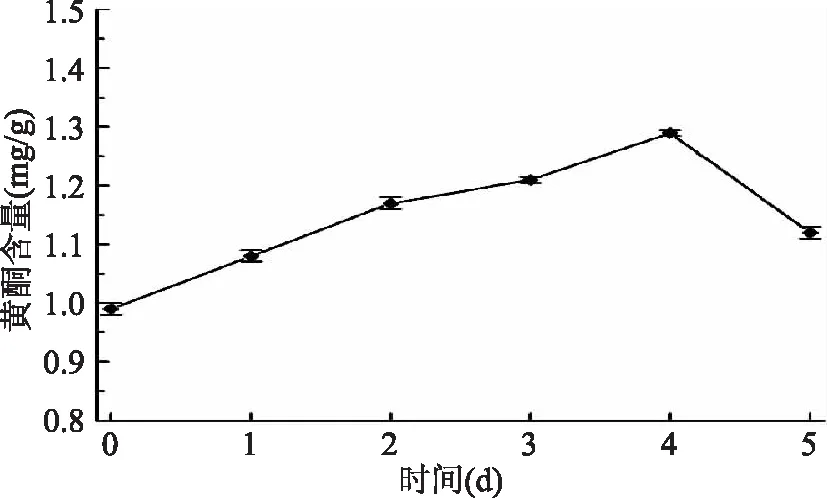
图7 藜麦萌发过程中黄酮含量Fig.7 Flavonoids contents during germination of quinoa
2.2.8 GABA含量变化 由图8可知,藜麦萌发期间GABA含量逐渐增加,从0 μg/g增加至546.53 μg/g,其原因主要有以下,首先由于发芽期间蛋白质在蛋白酶的作用下开始分解,增加了游离谷氨酸的含量,而谷氨酸是合成GABA的底物,谷氨酸在谷氨酸脱羧酶(GAD)的作用下发生脱羧的不可逆反应,使反应平衡向合成GABA的方向移动,从而提高了GABA的含量。另外多胺也是合成GABA的底物,二胺氧化酶(DAO)是GABA合成的一个关键酶,在藜麦种子萌发过程中,二胺氧化酶活性显著增加,在合适的温度、湿度条件下,GABA合成加速,提高了GABA的含量[29-30]。
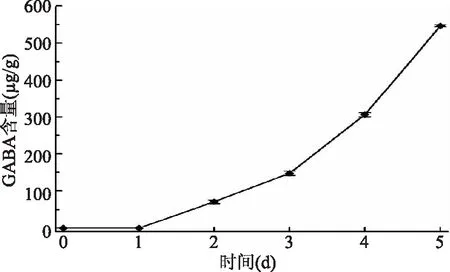
图8 藜麦萌发过程中GABA含量Fig.8 GABA contents during germination of quinoa
2.3 藜麦芽磨浆工艺单因素实验结果分析
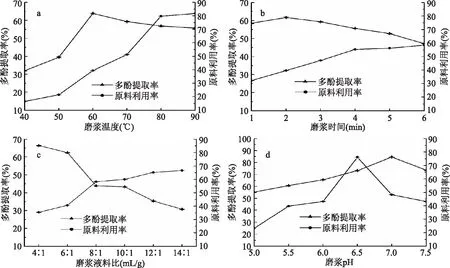
图9 藜麦芽磨浆温度(a)、时间(b)、液料比(c)和pH(d)的影响Fig.9 Effect of temperature(a),time(b),liquid-solid ratio(c)and pH(d)of quinoa malt
通过对藜麦萌发过程中营养物质变化规律分析发现,藜麦中营养物质会呈现不同程度变化,萌发初期还原糖、多酚、黄酮和GABA等生物活性物质均不断增加,随着萌发时间继续增加,部分营养物质出现减少的趋势,而且伴随藜麦芽颜色变深并出现根部,不利于后续实验。所以综合考虑,藜麦在第3 d营养物质含量相对较高,营养价值较为丰富,其中尤其多酚含量达到4.94 mg/g,最终选择发芽第3 d为磨浆实验发芽时间。
经过对磨浆温度、磨浆时间、磨浆液料比和磨浆pH的单因素实验进行探索,最终结果见图9。
表3 正交实验结果
Table 3 Orthogonal experimental results
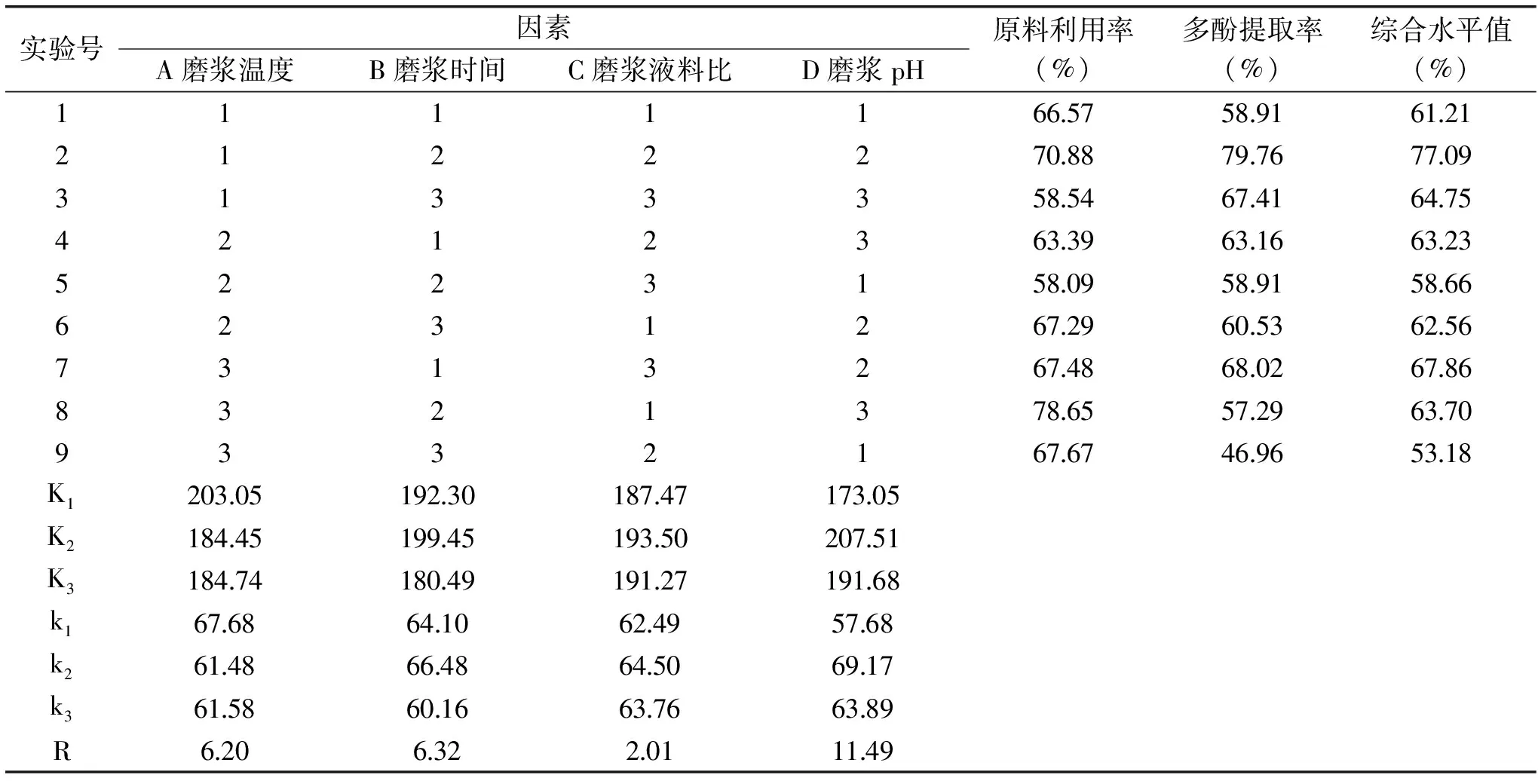
实验号因素A磨浆温度B磨浆时间C磨浆液料比D磨浆pH原料利用率(%)多酚提取率(%)综合水平值(%)111116657589161212122270887976770931333585467416475421236339631663235223158095891586662312672960536256731326748680267868321378655729637093321676746965318K120305192301874717305K218445199451935020751K318474180491912719168k16768641062495768k26148664864506917k36158601663766389R6206322011149
由图可以看出,在其他条件一定的情况下,藜麦芽原料利用率随着磨浆时间、温度、液料比的增加而增加,而磨浆pH呈现先增加后减少的趋势,在pH为6.5时达到最大为76.16%。由此可见,长时间、温度高、液料比大的条件下都有利于原料的溶出从而提高原料利用率。相同情况下,多酚提取率的变化与原料利用率不同,其中磨浆温度、时间和pH均是先增加后减少,分别在60 ℃、2 min、pH7时达到最大,多酚提取率增加是由于该条件下有利于多酚的溶出,提高多酚提取率,相反减小是因为温度增加、时间加长、pH增大会导致多酚内部结构破坏,使多酚含量减少,从而使多酚提取率减小。而磨浆液料比对原料利用率的影响则是使其一直减少,原因是由于水比例增加,使得藜麦芽汁浓度降低,多酚溶出少含量减少。但综合考虑各因素,由于是制作一款口感适中、营养平衡的藜麦芽产品,所以选择以下条件作为正交实验的最佳水平值范围:磨浆温度60~80 ℃;磨浆时间2~4 min;磨浆液料比4∶1~8∶1 mL/g;磨浆pH6~7。
2.4 藜麦芽磨浆工艺正交实验结果分析
在单因素实验的基础上,选取磨浆温度、磨浆时间、磨浆液料比和磨浆pH进行四因素三水平正交实验,根据下一步研制藜麦芽乳的实验要求及实际需要,同时考虑原料利用率和多酚提取率的影响,分析综合水平值。正交设计及实验结果如表3。
根据表3可知,影响藜麦芽磨浆工艺的主要因素顺序为:磨浆pH>磨浆时间>磨浆温度>磨浆液料比,最佳实验条件为A1B2C2D2,即磨浆温度60 ℃,磨浆时间3 min,磨浆液料比6∶1 mL/g,磨浆pH6.5,以优化所得组合进行3次验证实验,取平均值,结果表明在最优条件下,原料利用率为70.91%,多酚提取率为79.79%,综合水平值为77.13%。
3 结论
本实验测定藜麦萌发过程中多种营养物质的变化规律,并分析出这些物质的基本分布趋势,蛋白质、多酚、黄酮含量以及β-淀粉酶活性均呈现先增加后减少的趋势,达到最大值分别为20.97 g/100 g、4.94 mg/g、1.29 mg/g、5.877 mg/(g·min);粗脂肪和淀粉含量逐渐减少,分别由开始的6.54 g/100 g减少至5.30 g/100和63.01 g/100 g减少至46.78 g/100 g;还原糖、维生素B1和GABA含量反而一直增加,分别由7.44 g/100 g增长至10.91 g/100 g、0.43 mg/100 g增长至0.95 mg/100 g和0 μg/g增长至546.53 μg/g,在测定指标中,只有α-淀粉酶活性和维生素B2含量呈现先略微减少后又增加的趋势,但是符合萌发作用趋势的。通过对上述营养物质进行综合分析,最终得出最佳萌发时间为第3 d,适合进行后续磨浆实验。
通过单因素实验,筛选出了藜麦芽磨浆温度、磨浆时间、磨浆液料比和磨浆pH四个因素的最佳水平范围,在此基础上进行正交实验,确定最佳磨浆工艺为磨浆温度60 ℃,磨浆时间3 min,磨浆液料比6∶1 mL/g,磨浆pH6.5,此条件下原料利用率为70.91%,多酚提取率为79.79%,综合水平值为77.13%。得到的藜麦芽汁色泽、细腻度俱佳,为后期藜麦芽乳研制提供很好的理论基础及数据支持。
[1]Bhargava A,Sydhir S,Ohri D.Chenopodiumquinoa:an Indian perspective[J]. Industrial Crops and Products,2006,23(1):73-87.
[2]Nowak V,et al. Assessment of the nutritional composition of quinoa(ChenopodiumquinoaWilld.)[J]. Food Chemistry,2016,193(15):47-54.
[3]肖正春,张广伦. 藜麦及其资源开发利用[J]. 中国野生植物资源,2014,33(2):62-66.
[4]魏爱春,杨修仕,刘浩,等. 藜麦营养功能成分及生物活性研究进展[J]. 食品科学,2015,36(15):272-276.
[5]Abugoch L,Romero N,Tapia C,et al. Study of some physicochemical and functional properties of quinoa(ChenopodiumquinoaWilld.)protein isolates[J]. Journal of Agricultural & Food Chemistry,2008,56(12):4745-4750.
[6]Bhargava A,Shukla S,Ohri D. Genetic variability and interrelationship among various morphological and quality traits in quinoa(ChenopodiumquinoaWilld.)[J]. Field crops research,2007,101(1):104-116.
[7]James A,Lilian E. Quinoa(ChenopodiumquinoaWilld.):composition,chemistry,nutritional,and functional properties[J]. Advances in food and nutrition research,2009,58:1-31.
[9]董施彬,宁亚萍,杨喆,等. 藜麦总黄酮提取及大孔树脂纯化工艺的研究[J]. 食品工业科技,2015,36(16):272-278.
[10]Woldemichael GM,Wink M. Identification and biological activities of triterpenoid saponins from Chenopodium quinoa[J]. Journal of Agricultural & Food Chemistry,2001,49(5):2327-2332.
[11]刘洋,熊国富,闫殿海,等. “粮食之母”、“超级食物”——藜麦“落户”青海[J]. 青海农林科技,2014,04:95-98.
[12]于立梅,钟惠曾,于新,等. 大豆发芽过程中营养成分变化规律的研究[J]. 中国粮油学报,2010(8):19-22.
[13]吕俊丽,王国泽,游新勇. 发芽谷物研究进展[J]. 粮食与油脂,2014,27(2):5-7.
[14]王黎明,马宁,李颂,等. 藜麦的营养价值及其应用前景[J]. 食品工业科技,2014,35(1):381-384,389.
[15]李合生. 植物生理生化实验原理和技术[M]. 北京:北京高等出版社,2000:169-172.
[16]宁正祥. 食品成分分析手册[M]. 北京:中国轻工业出版社,1987:682-685.
[17]宁正祥. 食品成分分析手册[M]. 北京:中国轻工业出版社,1987:263-280.
[18]Hirose Y,Fujita T,Ishii T,et al. Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan[J]. Food Chemistry,2010,119(4):1300-1306.
[19]董晶,张焱,曹赵茹,等. 藜麦总黄酮的超声波法提取及抗氧化活性[J]. 江苏农业科学,2015,43(4):267-269.
[20]陈恩成,张名位,彭超英,等. 比色法快速测定糙米中γ-氨基丁酸含量研究[J]. 中国粮油学报,2006,21(1):125-128.
[21]Yao Tang,Xihong Li,Bing Zhang.Characterisation of phenolics,betanins and antioxidant activities in seeds of three Chenopodium quinoa Willd. Genotypes[J]. Food Chemistry,2015,166(1):380-388.
[22]凌孟硕,唐年初,赵晨伟,等. 苦荞麦萌发过程中营养物质的变化分布及磨浆提取工艺[J]. 食品科学,2013,34(22):92-96.
[23]李淑艳,王建中. 大豆种子萌发过程中蛋白质的变化[J]. 中国种业,2009,04:41-43.
[24]周一鸣,崔琳琳,王宏,等. 苦荞在萌发过程中营养物质的变化及其营养评价[J]. 食品科学,2014,35(13):208-212.
[25]王倩雯. 芸豆萌发过程中营养成分、淀粉理化特性变化及相关性研究[D]. 大庆:黑龙江八一农垦大学,2015:13-14.
[26]高荣岐,张春庆. 作物种子学[M]. 北京:中国农业出版社,2010.
[27]翟玮玮. 萌发谷物中多酚类物质与苯丙氨酸解氨酶的研究进展[J]. 食品工业科技,2010,31(8):370-372,376.
[28]刘金福,李晓雁,孟蕊,等. 苦荞发芽过程中促进黄酮合成的因素初探[J]. 食品工业科技,2006,10:106-108.
[29]陈振,黄维娜,康玉凡,等. 食用豆品种萌发过程中γ-氨基丁酸(GABA)含量变化[J]. 食品工业科技,2014,35(17):115-118,124.
[30]谢海玉. 小杂粮中γ-氨基丁酸形成机理及富集技术的研究[D]. 兰州:兰州理工大学,2013:2-3.
Study on the nutrients change rules during germination of quinoa and quinoa malted milk pulping process
HU Jie,CHEN Shu-jun*,PANG Zhen-peng,LIU Xiao-juan,XU Xiao-xia,YI Xin,SHI Yue,LI Le
(College of Science,Shanxi University,Taiyuan 030006,China)
Forfurtherdevelopmentandutilizationofquinoamaltproducts,quinoawastakenasrawmaterialtogerminateincertainconditions,changerulesofprotein,crudefat,starch,reducingsugarcontent,α-amylaseactivity,β-amylaseactivity,vitaminB1,B2,polyphenol,flavonoidsandγ-aminobutyricacid(GABA)contentweremeasuredafterquinoagermination,respectively.Theoptimalgerminationtimewasdetermined.Usingcomprehensivelevelvalueofrawmaterialsutilizationrateandpolyphenolextractionrateastheevaluationindex,orthogonalexperimentdesignwasadoptedonthebasisofsinglefactortoexplorequinoamaltedmilkoptimumpulpingprocess.Resultsshowedthatthebestgerminationtimewas3d,andtheoptimumpulpingprocesswastemperatureof60 ℃,pulpingtimeof3min,pulpingliquid-solidratioof6∶1mL/gandpH6.5.Undertheseconditions,therawmaterialsutilizationratereached70.91%,polyphenolextractionratewas79.79%,thecomprehensivelevelvaluewas77.13%.
quinoa;germination;nutrients;changerules;pulpingprocess
2016-04-25
胡洁(1991-),女,硕士,研究方向:食品新工艺,E-mail:hujie01010215@163.com。
*通讯作者:陈树俊(1964-),男,大学本科,副教授,研究方向:食品新工艺及功能食品,E-mail:chenshujun515@163.com。
TS210.4
A
1002-0306(2016)19-0136-07
10.13386/j.issn1002-0306.2016.19.018
