荔枝低分子量多糖的分离纯化及抗氧化吸湿保湿性能分析
2016-12-19景永帅张丹参吴兰芳戎欣玉杜红霞许伟涛
景永帅,张丹参,吴兰芳,戎欣玉,杜红霞,许伟涛
(1. 河北科技大学化学与制药工程学院,石家庄 050018;2. 河北中医学院药学院,石家庄 050200)
荔枝低分子量多糖的分离纯化及抗氧化吸湿保湿性能分析
景永帅1,张丹参1,吴兰芳2※,戎欣玉1,杜红霞1,许伟涛1
(1. 河北科技大学化学与制药工程学院,石家庄 050018;2. 河北中医学院药学院,石家庄 050200)
为进一步开发和利用荔枝中的多糖成分,该文对荔枝低分子量多糖组分进行分离纯化,并对其理化性质、抗氧化和吸湿保湿性进行研究。采用超声波辅助提取、分级醇沉、DEAE-cellulose 52和Sephadex G-100柱分离纯化荔枝多糖;紫外-可见光谱扫描法、比旋光度法、渗透凝胶色谱法3种方法验证纯度;高效凝胶渗透色谱法测定相对分子量,高效阴离子交换色谱测定单糖组成;清除DPPH自由基和羟基自由基评价体外抗氧化活性;体外法测定吸湿保湿性。结果表明:荔枝多糖经分离纯化后获得组分荔枝多糖PLC-1,经3种方法验证PLC-1为精多糖,相对分子量为2.35×104Da,是由半乳糖、鼠李糖、葡萄糖组成,摩尔比为:1.00∶3.52∶5.89。抗氧化活性研究结果表明PLC-1对DPPH和羟基自由基呈良好的量效关系,半数清除浓度IC50分别为0.41和0.31 mg/mL。吸湿保湿性的结果表明,PLC-1具有良好的吸湿和保湿性,在32 h时的吸湿率为58.3%,32 h时的失水率为45.3%,荔枝多糖PLC-1为具抗氧化和吸湿保湿活性的多糖,研究结果可为荔枝的深加工和进一步研究开发提供一定的理论基础。
提取;纯化;柱层析;荔枝;多糖;抗氧化活性;吸湿保湿活性
0 引言
荔枝(Litchi chinensis Sonn.)为无患子科荔枝属植物,其果肉富含多糖、多酚、维生素、膳食纤维、矿物质等成分,具有较高的营养价值和生物活性[1]。中国是荔枝的主产国,面积与产量均居世界第一,荔枝种植面积约60万hm2,100多个品种,产量130万t,分别占世界荔枝总种植面积的84.5%和总产量的70.5%[2]。《本草纲目》中记载:“常食荔枝,能补脑健身,治疗瘴疠疗肿,开胃益脾,干制品能补元气,为产妇及老弱补品”[3]。现代研究表明,荔枝多糖具有抗氧化、免疫调节、降血糖,抗疲劳等作用[4-5],并且初步明确活性多糖是荔枝重要的保健物质之一[6]。
近年来,国内外研究者对荔枝果肉多糖已有报道,主要包括提取工艺、分离纯化、抗氧化活性研究。如:周董永[7]、吴雅静[8]和陈卫云[9]分别用微波法、超声波法以及超声微波酶解协同提取荔枝粗多糖,并证实在一定条件下能提高多糖得率,其均侧重于提取工艺研究,未进行多糖的结构和活性研究;Kong Fanli[10]和Hu Xuqiao[4]均分离纯化了 50%乙醇沉淀的荔枝多糖,制备得到了 4个荔枝精多糖;董周永[7]分离纯化80%乙醇沉淀的多糖,采用DEAE-52纤维素柱纯化得到1个荔枝精多糖;李巍巍[2]报道4个荔枝多糖组分均有一定的抗氧化能力,其中LCP-2的清除作用最强,其清除.OH、O2-和DPPH的半数清除率浓度分别为3.8、22.3、14.2 mg/mL;Kong Fanli[10]报道3个荔枝多糖组分均有一定的抗氧化能力,其中LFP-3的清除作用最强,其清除O2-和.OH的半数清除率浓度分别为0.11和0.44 mg/mL,但均不如对照品维生素C抗氧化效果好。本课题组前期研究发现蛹虫草多糖的70%~90%乙醇沉淀多糖部分具有较好的抗氧化效果[11],因此本试验主要研究荔枝的70%~90%乙醇沉淀的部分,其属于相对较低分子量的多糖[11],且至今未见关于荔枝低分子量多糖的文献报道。
目前抗氧化性多糖作为当今热点,为自由基氧化损伤相关疾病的治疗带来了新的希望。多糖由于分子结构中存在大量羟基或羧基等极性基团,能与水分子形成氢键且相互交联呈网状结构,表现出良好的吸湿和保湿性能[12]。抗氧化和吸湿保湿是延缓衰老、保证皮肤健康的重要条件。本课题组前期研究发现荔枝低分子量粗多糖组分具有较强的抗氧化和吸湿保湿性,但关于荔枝多糖的吸湿和保湿性未见相关报道。因此,本文重点研究70%~90%乙醇沉淀荔枝多糖,对荔枝中较低分子量的多糖组分进行提取、分离和纯化,并对其理化性质及其抗氧化和吸湿保湿性进行系统研究,可进一步对荔枝中含有的多糖组分全面考察,旨在为更好地开发荔枝的保健产品或化妆品提供理论依据,同时为荔枝多糖作为功能材料在食品或精细化工行业的应用打下良好的前期研究基础。
1 材料与方法
1.1 材料与试剂
荔枝干购自河北安国药材市场,经河北中医学院严玉平教授鉴定为无患子科植物荔枝(妃子笑)的干燥果肉;DEAE-cellulose 52柱,英国Whatman公司分装;Sephadex G-100、Sephacryl S-300 HR柱,美国GE Healthcare公司;标准品葡聚糖Dextran系列T4、T7、T10、T70、T200和蓝葡聚糖、各标准单糖、1,1-二苯基-2-苦肼基(2,2-diphenyl-1-picrylhydrazyl,DPPH)、维生素C (Vitamin C),美国Sigma公司;其他化学试剂为进口或国产分析纯。
1.2 试验仪器
DBS-100自动部分收集器、恒流泵(上海沪西分析仪器厂有限公司)、EYELA N-1000旋转蒸发仪(日本东京理化器械公司)、TU- 2450紫外-可见分光光度计(日本岛津公司);傅里叶变换红外吸收光谱仪(德国Bruker公司);WZZ-2B自动旋光仪(上海精密科学仪器厂);Dionex ICS-2500高效离子色谱(美国戴安公司);3110型酶标仪(美国Thermo公司)。
1.3 试验方法
1.3.1 荔枝多糖的提取
依据本课题组前期优化的提取纯化工艺制备荔枝低分子量精多糖,具体操作如下:取荔枝果实,去壳去核,充分干燥(至含水率为5%),粉碎,过60目筛,称量(1 000 g),使用10倍体积的体积分数为95%食用乙醇浸提12 h,醇提后进行抽滤,提取液使用旋转蒸发仪减压浓缩回收乙醇,荔枝残渣晾干至无醇味。称量醇提后的荔枝果肉(880 g),加入10倍体积的蒸馏水提取,在超声波辅助(功率为280 W)的条件下,80℃恒温提取3次,每次1 h,合并水提液,用旋转蒸发仪减压浓缩至一定体积,乙醇沉淀(乙醇最终体积分数为70%),4℃下静置24 h,离心(25℃,5 000×g),沉淀为粗多糖PLC70(另作他用),剩余的上清液减压浓缩至一定体积,乙醇沉淀(乙醇最终体积分数为90%),4℃下静置24 h,离心(25℃,5 000×g),沉淀为荔枝粗多糖(PLC90)。PLC90使用木瓜蛋白酶结合Sevag法脱蛋白,用AB-8型大孔树脂进行静置脱色处理[13],分别用自来水、蒸馏水各透析48 h(500 Da透析袋),减压浓缩,真空冷冻干燥(温度为−50℃,真空度为10 Pa)后得到荔枝粗多糖PLC。
1.3.2 荔枝多糖的分离纯化
将粗多糖溶于少量蒸馏水中,配制成50 mg/mL多糖溶液,在多糖分离纯化系统上,采用DEAE-cellulose 52柱(4.0 cm×80.0 cm)以0~1.0 mol/L的NaCl线性洗脱,根据线性洗脱结果确定梯度洗脱的条件为0~0.8 mol/L 的NaCl,流速为0.5 mL/min,自动部分收集(每管收集5.0 mL),以苯酚-硫酸法检测各梯度中多糖组分的位置,分别收集相应梯度的多糖组分,透析脱盐后浓缩冻干(温度为−50℃,真空度为10 Pa)得纯化后多糖样品。随后采用Sephadex G-100柱(2.6 cm×100.0 cm)以双蒸水为洗脱液,自动部分收集(每管收集3.0 mL),以苯酚-硫酸法检测多糖洗脱情况,分别收集相应的多糖组分,透析后浓缩冻干(温度为−50℃,真空度为10 Pa)得纯化后多糖样品。具体提取纯化过程见图1。

图1 荔枝多糖PLC-1提取纯化工艺流程图Fig.1 Process flow chart of extraction and purification of PLC-1
1.3.3 荔枝多糖的纯度验证
1)紫外光谱分析
将纯化后的多糖样品制成1 mg/mL的溶液,在200~700 nm波长范围内进行扫描,观察其在260、280、620 nm处有无吸收[11]。
2)比旋光度法验证荔枝多糖的纯度
在20℃钠光下测定30%、60%、80%体积分数的乙醇沉淀物的旋光度值[14]。
3)凝胶渗透色谱法验证荔枝多糖的纯度
纯化后的多糖样品配成5.0 mg/mL溶液,上样于Sephacryl S-300 HR凝胶柱,以水为洗脱液,流速为0.2 mL/min,每管2 mL,苯酚-硫酸法检测多糖洗脱情况,以流出液的管数为横坐标,吸光度值为纵坐标,绘制洗脱曲线[5]。
1.3.4 多糖样品分子量测定
采用凝胶渗透色谱法(GPC法)测定荔枝多糖的相对分子量(M)[15]。以标准品葡聚糖Dextran系列(T4、T7、T10、T70、T200)制作标准曲线,用相对分子量为200万的蓝葡聚糖确定凝胶柱的空体积V0,以葡萄糖确定凝胶柱的总柱体积Vt,以有效分配系数Kav为纵坐标,lgM为横坐标作标准曲线,分配系数Kav由以下公式求得

式中Ve为待测样品的洗脱体积,V0为色谱柱空体积,Vt为色谱柱总体积,Ve,V0,Vt单位均为mL。
取适量荔枝多糖样品配制成质量浓度为2.0 mg/mL的溶液,0.22 μm微孔滤膜滤过,上Sephacyl S-300 HR凝胶柱,根据出峰洗脱体积,计算Kav,代入上述标准曲线中,计算得到多糖PLC-1的相对分子量。
1.3.5 荔枝多糖的理化性质研究
以葡萄糖为标准品,采用硫酸-苯酚法测定总糖含量[16]。以牛血清蛋白为标准品,采用Folin-酚法测定蛋白含量[17]。以葡萄糖醛酸作为标准品,采用咔唑-硫酸法测定糖醛酸含量[18]。以硫酸钾为标准品,采用氯化钡-明胶比浊法测定硫酸根含量[19]。将荔枝多糖配制成10 mg/mL溶液,在20℃下用1 dm的旋光管测定其旋光度[5]。
1.3.6 红外光谱分析
取1.0 mg荔枝多糖PLC-1,以100 mg的KBr混合研磨成粉,压片,在4 000~500 cm-1范围内扫描红外光谱扫描[5]。
1.3.7 荔枝多糖的单糖组成分析
精密称量各标准单糖(L-阿拉伯糖、L-鼠李糖、D-果糖、D-甘露糖、D-葡萄糖和D-半乳糖)1.0 mg,加蒸馏水配成1.0 mg/mL的标准品溶液,取20.0 μL进行高效阴离子交换色谱(HPAEC-PAD)测定。取荔枝多糖样品5.0 mg,加入5.0 mL的2.0 mol/L的三氟乙酸(TFA),封管后于110℃条件下水解6 h,冷却后减压浓缩蒸干。反复加甲醇蒸干,除去剩余的TFA。取水解后的样品,蒸馏水溶解,取20.0 μL进行HPAEC-PAD测定,并根据各峰的保留时间和峰面积比计算出各单糖的组成和摩尔比[11]。高效离子色谱分析条件为:带在线自动脱气的四元梯度泵;脉冲安培检测器(PAD);Carbo PAC TMPA10分析色谱柱(2.0 mm×250 mm);进样量为20.0 μL;流速为0.2 mL/min;柱温为25℃;流动相为A[H2O(92%)]+B[200 mmol/L NaOH(8%)]。
1.3.8 荔枝多糖的扫描电子显微镜(SEM)分析
取适量的干燥荔枝多糖样品,黏着于电镜专用的铜台上,置于离子溅射仪中镀一层导电金膜后,在Philips XL-30扫描电镜下观察。工作条件:加速电压5.0 kV,放大倍数(1 000和20 000倍),选择相应的视野照相记录[20]。
1.3.9 荔枝多糖的抗氧化活性测试
荔枝多糖清除DPPH、OH自由基的测定参照文献方法进行测定[21-22]。
1.3.10 吸湿保湿活性测定
吸湿性能评价选用饱和硫酸铵溶液置于干燥器中,环境温度为20℃。选用甘油为阳性对照品,测定荔枝多糖PLC-1的吸湿率。将样品干燥至恒质量后称其质量,置于相对湿度为80%的干燥器中,放置2、4、8、16 h,称其质量变化,试验设3次重复。

式中M0为样品起始质量g;Mt为放置一定时间后样品质量g。
采用体外法对荔枝多糖PLC-1的保湿性能与甘油进行比较。将荔枝多糖、甘油分别配成5%水溶液,选用7.5 cm×7.5 cm的玻璃板,贴一层医用透气胶带,吸取200 μL样品,均匀涂敷在透气胶带上,放进干燥器中一定时间(2、4、8、16 h)后分别称量,计算失水率。一定时间内,失水率越小,保湿效果越好,试验设3次重复[23]。
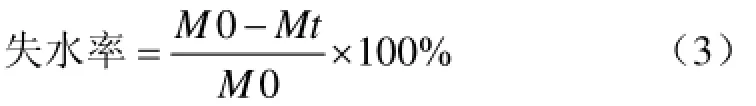
1.3.11 数据处理
试验数据的统计使用Oringe8.5软件,试验数据的差异性分析使用SPSS 18.0软件,其结果表示为平均值±标准差(x±s,n=3)。
2 结果与分析
2.1 荔枝多糖的提取、分离和纯化
1 000 g的荔枝果肉经乙醇除脂、超声波提取、分级醇沉、除蛋白、除色素、透析冻干后,得到荔枝粗多糖PLC样品25.5 g,得率为2.55%。多糖PLC经DEAE-cellulose 52离子交换柱分离,分别在水洗脱与梯度盐洗脱部分得到2个主峰(如图2所示),收集第2个主峰样品进行下一步纯化,经Sephadex G-100凝胶柱纯化,得到对称的单峰组分,命名为PLC-1。

图2 PLC经DEAE-cellulose 52 柱层析的洗脱曲线Fig.2 Curve of PLC in DEAE-cellulose 52 column chromatography
2.2 荔枝多糖PLC-1的纯度验证
紫外-可见分光光度计检测结果显示,PLC-1在260 和280 nm处均无明显特征吸收,提示多糖中不含有蛋白质和核酸,在620 nm处无吸收峰则表明不含色素类物质,纯度较高。采用比旋光度法对荔枝多糖PLC-1进行纯度鉴定,在乙醇体积分数分别为30%,60%,80%条件下,测定PLC-1的比旋光度值基本相同,分别为:+52°,+52°, +53°,表明其为相对均一多糖。由图3洗脱曲线可知,分离纯化后的PLC-1在Sephacryl S-300 HR凝胶柱层析中获得单一、对称的洗脱峰。
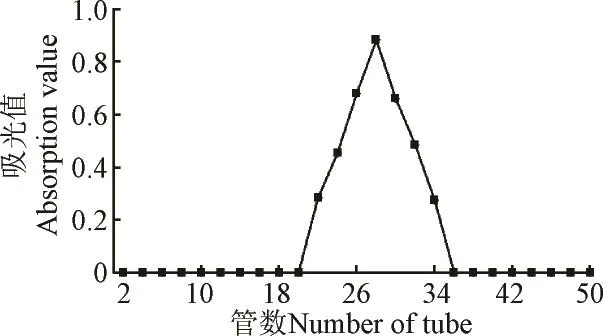
图3 PLC-1的Sephacryl S-300 HR凝胶柱层析洗脱曲线Fig.3 Curve of PLC-1 in Sephacryl S-300 HR column chromatography
经过紫外-可见光谱扫描法、旋光度法、凝胶渗透色谱法(GPC)验证多糖PLC-1的纯度,结果表明多糖PLC-1为均一性良好的精多糖。
2.3 荔枝多糖的理化性质
多糖的理化性质为其进一步的结构鉴定和活性筛选提供重要的参考价值。通过高效凝胶渗透色谱法测定荔枝精多糖PLC-1相对分子量为2.35×104Da。荔枝多糖PLC-1的总糖质量分数为94.7%,比旋光度平均值为+52.33°,且不含有蛋白、糖醛酸和硫酸根的中性多糖。
2.4 荔枝多糖红外光谱分析
荔枝多糖PLC-1的红外光谱如图4所示,3 335 cm-1附近处强吸收峰为-OH的伸缩振动峰;在2 950、1 640、1 420、1 095 cm-1波长处的吸收均为多糖的特征吸收,824 和894 cm-1处的吸收显示在结构中同时含有α和β 2种糖苷键构型存在,在1 740 cm-1波长处无吸收显示在多糖样品中没有糖醛酸的结构存在[24]。

图4 荔枝多糖PLC-1的红外光谱图Fig.4 FT-IR spectrum of PLC-1
2.5 荔枝多糖的单糖组成分析
经与标准单糖的高效离子色谱保留时间和峰面积对照分析,结果表明PLC-1由半乳糖、鼠李糖、葡萄糖组成,其摩尔比为:1.00∶3.52∶5.89。
2.6 荔枝多糖的扫描电镜分析
荔枝多糖PLC-1的扫描电镜图像如图5所示,从外观形态和超微结构上看,荔枝多糖主要由自由分布的不规则球形体和片状体组成,比较粗糙,有凹陷和空隙,有随机分布的不规则粒子存在,直径约为1.8~3.0 μm,这些可能是由于多糖的性质、结构和分支结构等原因形成的,也和多糖在提取、分离和纯化的过程中,使用的方法不同引起不一样的超微结构。

图5 荔枝多糖PLC-1的扫描电镜图Fig.5 SEM images of PLC-1
2.7 荔枝多糖PLC-1的抗氧化测定结果
由图6a可知,荔枝多糖PLC-1对DPPH自由基有一定的清除作用,且清除率随多糖的剂量增加而升高,具有浓度依赖性。其中,在质量浓度为0.8 mg/mL时,荔枝多糖的清除率为62.8%。荔枝多糖PLC-1和维生素C对DPPH自由基清除率的IC50值分别为0.41和0.12 mg/mL。李巍巍等[2]报道4个荔枝多糖组分均有一定的清除DPPH自由基能力,其半数清除率的IC50值分别为20.0、14.2、18.5和18.1 mg/mL;孔凡利[25]报道在质量浓度为0.85 mg/mL时,荔枝多糖LFP1、LFP2、LFP3和LFP4对DPPH自由基的清除率分别为23.4%、32.5%、22.5%和29.2%。本试验纯化得到的荔枝多糖PLC-1的清除DPPH自由基能力明显优于前人报道的荔枝多糖组分的能力。
如图6b所示,荔枝多糖PLC-1对羟基自由基有一定的清除作用,且清除率随多糖的剂量增加而升高,呈现一定的量效关系。其中,在质量浓度为0.8 mg/mL时,荔枝多糖的清除率为65.3%。荔枝多糖PLC-1和维生素C对羟基自由基清除率的IC50值分别为0.38和0.15 mg/mL。李巍巍等[2]报道4个荔枝多糖组分均有一定的清除羟基自由基能力,其半数清除率的IC50值分别为6.0、3.8、5.8 和5.9 mg/mL;孔凡利[25]报道在质量浓度为0.8 mg/mL时,荔枝多糖LFP1、LFP2、LFP3和LFP4对羟基自由基的清除率分别为15.3%、49.5%、12.5%和42.3%。本试验纯化得到的荔枝多糖PLC-1的清除羟基自由基能力均优于前人报道的荔枝多糖组分的抗氧化能力。

图6 荔枝多糖PLC-1和维生素C抗氧化活性结果Fig.6 Antioxidant activity of PLC-1 and Vitamin C
2.8 荔枝多糖PLC-1的吸湿保湿性测定结果
吸湿性试验结果如图7a所示,样品的吸湿率均随时间逐渐增加而增加,具有较强的吸湿能力,32 h时的吸湿率,荔枝多糖PLC-1和甘油分别为58.3%和70.2%,荔枝多糖PLC-1吸湿性能低于甘油,经SPSS 18.0软件分析,二者存在显著性差异(P<0.05)。
保湿性试验结果如图7b所示,样品的失水率均随时间增加而有所下降,多糖样品具有良好的保湿性能,32 h时的失水率,荔枝多糖PLC-1和甘油分别为45.3%和53.7%,荔枝多糖PLC-1的保湿性能优于甘油,经SPSS 18.0软件分析,二者存在显著性差异(P<0.05)。荔枝多糖PLC-1以其来源天然、优良的抗氧化能力以及吸湿保湿性将会在医药、保健品及化妆品工业中拥有广泛的应用。

图7 荔枝多糖PLC-1和甘油的吸湿保湿活性Fig.7 Hygroscopicity and moisture retention activity of PLC-1 and Glycerol
3 结论
1)采用超声波辅助提取法、经过分级醇沉、除蛋白、除色素、透析、冷冻干燥后得到荔枝粗多糖。荔枝粗多糖经DEAE-cellulose 52和Sephadex G-100柱依次分离纯化获得多糖组分荔枝多糖PLC-1,采用3种方法验证了其纯度,表明PLC-1为均一精多糖。
2)通过高效凝胶渗透色谱法测定其相对分子量为2.35×104Da,单糖组成分析表明PLC-1由半乳糖、鼠李糖、葡萄糖组成,其摩尔比为:1.00∶3.52∶5.89。
3)抗氧化活性研究结果表明,荔枝多糖PLC-1在一定的浓度范围内对1,1-二苯基-2-苦肼基和羟基自由基均具有明显的剂量效应,半数清除浓度分别为0.41和0.31 mg/mL。吸湿保湿性的研究表明,荔枝多糖PLC-1具有良好的吸湿和保湿性,在32 h时的吸湿率为58.3%,32 h时的失水率为45.3%,荔枝多糖PLC-1的保湿性能优于甘油,吸湿性能低于甘油。
[1] 黄菲,张瑞芬,刘慧娟,等. 荔枝多糖级分的溶液性质研究[J]. 食品安全质量检测学报,2015,6(5):1770-1775. Huang Fei, Zhang Ruifen, Liu Huijuan, et al. Study on the solution properties of polysaccharide fractions from litchi pulp[J]. Journal of Food Safety and Quality, 2015, 6(5): 1770-1775. (in Chinese with English abstract)
[2] 李巍巍. 荔枝多糖的提取分离纯化及其免疫调节作用研究[D]. 武汉:华中农业大学,2009. Li Weiwei. Studies on extraction, separation, purification and immunomodulating activities of Litchi polysaccharide[D]. Wuhan: Huazhong Agricultural University, 2009. (in Chinese with English abstract)
[3] 周浓. 荔枝粗多糖提取工艺的研究[J]. 现代食品科技,2009,22(3):121-123. Zhou Nong. The extracting techniques of crude Litchi polysaccharide[J]. Modern Food Science and Technology, 2009, 22(3): 121-123. (in Chinese with English abstract)
[4] Hu Xuqiao, Huang Yuanyuan, Dong Quanfeng, et al. Structure characterization and antioxidant activity of a novel polysaccharide isolated from pulp tissues of Litchi chinensis[J]. Journal of Agricultural and Food Chemistry, 2011, 59(21): 11548-11552.
[5] Jing Yongshuai, Huang Lijiao, Lü Wenjie, et al. Structure characterization of a novel polysaccharide from pulp tissues of Litchi chinensis and its immnunomodulatory activity[J]. Journal of Agricultural and Food Chemistry, 2014, 62(4): 902 -911.
[6] Chen Weiyun, Zhang Mingwei, Liao Sentai. et al. Optimization of ultrasonic-microwave-enzyme synergistic extraction technology of polysaccharides from Litchi pulp[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(5): 77-84.
[7] 周董永. 荔枝多糖的提取、分离纯化及抗氧化活性研究[D].杨凌:西北农林科技大学,2006. Zhou Dongyong. Study on extraction, purification and antioxidant activity of polysaccharide isolated from Litchi flesh[D]. Yangling: Northwest A&F University, 2006. (in Chinese with English abstract)
[8] 吴雅静,张名位,孙明远,等. 荔枝多糖的超声波辅助提取工艺优化研究[J]. 华南师范大学学报,2007(2):120-124. Wu Yajing, Zhang Mingwei, Sun Yuanming, et al. Investigation on the ultrasonic wave-assisted extraction technology for Litchi polysaccharides[J]. Journal of South China Normal University, 2007(2): 120-124. (in Chinese with English abstract)
[9] 陈卫云,张名位,廖森泰,等. 荔枝多糖超声微波酶解协同提取工艺优化[J]. 中国食品学报,2013,13(5):77-84. Chen Weiyun, Zhang Mingwei, Liao Sentai, et al. Optimization of ultrasonic-microwave-enzyme synergistic extraction technology of polysaccharides from Litchi pulp[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(5): 77-84. (in Chinese with English abstract)
[10] Kong Fanli, Zhang Mngwei, Kuang Ruibin, et al. Antioxidant activities of different fractions of polysaccharides purified from pulp tissue of litchi Lichi chinensis Sonn[J]. Carbohydrate Polymers, 2010, 81(3): 612-616.
[11] Jing Yongshuai, Cui Xinlu, Chen Zhiyan, et al. Elucidation and biological activities of a new polysaccharide from cultured Cordyceps militaris[J]. Carbohydrate Polymers, 2014, 102(1): 288-296.
[12] 李万芬,汪超,李红斌,等. 魔芋葡甘聚糖-丙烯酸接枝共聚物的吸湿特性研究[J]. 农业工程学报,2006,22(11):228-231. Li Wanfen, Wang Chao, Li Hongbin, et al. Moisture absorption characteristics of konjac glucomannan grafted acrylic acid[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2006, 22(11): 228-231. (in Chinese with English abstract)
[13] 黎英,陈雪梅,严月萍,等. 超声波辅助酶法提取红腰豆多糖工艺优化[J]. 农业工程学报,2015,31(15):293-301. Li Ying, Chen Xuemei, Yan Yueping, et al. Optimal extraction technology of polysaccharides from red kindey bean using ultrasonic assistant with enzyme[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(15): 293-301. (in Chinese with English abstract)
[14] 刘金花,李富奎,贾得儒,等. 中国被毛孢发酵虫草菌丝体多糖的提取、纯化及其理化性质[J]. 食品与发酵工业,2014,40(3):222-226. Liu Jinhua, Li Fukui, Jia Deru, et al. Research on extraction,purification and physicochemical properties of mycelia polysaccharides of Hirsutella sinensis[J]. Food and Fermentation Industries, 2014, 40(3): 222-226. (in Chinese with English abstract)
[15] Yuan Fei, Yu Rongmin, Yin Yin, et al. Structure characterization and antioxidant activity of a novel polysaccharide isolated from Ginkgo biloba[J]. International Journal of Biological Macromolecules, 2010, 46(4): 436-439.
[16] 朱振元,连红玉,陈 婧,等. 雪莲果水溶性粗多糖提取分离工艺优化[J]. 农业工程学报,2011,27(增刊1):397-401. Zhu Zhenyuan, Lian Hongyu, Chen Jing, et al. Process optimization of extraction and separation of water-soluble crude polysaccharide in yacon[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2011, 27(Supp.1): 397-401. (in Chinese with English abstract)
[17] 曲文娟,马海乐,王婷,等. 交替双频逆流超声辅助提取条斑紫菜蛋白和多糖[J]. 农业工程学报,2013,29(1):285-292. Qu Wenjuan, Ma Haile, Wang Ting, et al. Alternating two-frequency countercurrent ultrasonic-assisted extraction of protein and polysaccharide from Porphyra yezoensis[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2013, 29(1): 285-292. (in Chinese with English abstract)
[18] Wang Lishan, Hu Xianjing, Bi Sixue, et al. A novel polysaccharide isolated from Litchi chinensis by using a simulated gastric medium and its immunomodulatory activity[J]. Drug Discoveries & Therapeutics, 2015, 9(2): 107-115.
[19] Jin Mingliang, Lu Zeqing, Huang, Ming, et al. Sulfated modification and antioxidant activity of exopolysaccahrides produce by Enterobacter cloacae Z0206[J]. International Journal of Biological Macromolecules, 2011, 48(4): 607-612.
[20] Chen Shuhai, Chen Haixia, Tian Jingge, et al. Chemical modification, antioxidant and α-amylase inhibitory activities of corn silk polysaccharides[J]. Carbohydrate Polymers, 2013, 98(1): 428-437.
[21] Jing Yongshuai, Zhu Jianhua, Liu Ting, et al. Structural characterization and biological activities of a novel polysaccharide from cultured Cordyceps militaris and its sulfated derivative[J]. Journal of Agricultural and Food Chemistry. 2015, 63(13): 3464-3471.
[22] 王振斌,刘加友,马海乐,等. 无花果多糖提取工艺优化及其超声波改性[J]. 农业工程学报,2014,30(10):262-269. Wang Zhenbin, Liu Jiayou, Ma Haile, et al. Extraction process optimization and ultrasonic modification of polysaccharide from Ficus carica L.[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2014, 30(10): 262-269. (in Chinese with English abstract)
[23] 刘新,王令充,吴皓,等. 四角蛤蜊多糖的吸湿保湿性及体外抗氧化性研究[J]. 食品工业科技,2012,33(24):85-88. Liu Xin, Wang Lingchong, Wu Hao, et al. Study on moisture absorption, moisture retention and antioxidant activity in vitro of Mactra veneriformis polysaccharide[J]. Science and Technology of Food Industry, 2012, 33(24): 85-88. (in Chinese with English abstract)
[24] Hu Xuqiao, Wang Jinlin, Jing Yongshuai, et al. Structural elucidation and in vitro antioxidant activities of a new heteropolysaccharide from Litchi chinensis[J]. Drug Discoveries & Therapeutics, 2015, 9(2): 116-122.
[25] 孔凡利. 荔枝果肉多糖的分离纯化与结构表征及抗氧化活性研究[D]. 广州:华南理工大学,2010. Kong Fanli. Studies on isolation, purification, structure and antioxidant activity of polysaccharides from pulp tissue of Litchi[D]. Guangzhou: South China University of Technology, 2010. (in Chinese with English abstract)
Purification, antioxidant, hygroscopicity and moisture retention activity of low molecular weight polysaccharide from Litchi chinensis
Jing Yongshuai1, Zhang Danshen1, Wu Lanfang2※, Rong Xinyu1, Du Hongxia1, Xu Weitao1
(1. College of Chemistry and Pharmaceutical Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China; 2. College of Pharmacology, Hebei University of Chinese Medicine, Shijiazhuang 050200, China)
Litchi (Litchi chinensis Sonn.), a tropical/subtropical fruit originally from China, is cultivated all over the world with warm climates. It has become one of the most popular fruits in the world due to its delicious flavor and abundant nutrition. As a good source of minerals, dietary fiber, and phytochemicals, litchi has been employed in traditional Chinese medicine. In addition, litchi has also been used to produce various types of health products and foods, such as medicinal beverages, drinks, or soups. Litchi fruit’s pericarp tissues contain a lot of flavonoids, polysaccharides, and various proteins. Polysaccharides are a kind of biomacromolecules composed of more than 10 monosaccharide units, which generally exist in plants, animals, algae and microorganisms such as fungi and bacteria. Some investigations have indicated that Litchi chinensis polysaccharides have strong antioxidative activity and can be explored as novel potential antioxidants. Plant polysaccharides are excellent candidates for health and therapeutics, and searching for polysaccharides with antioxidant activity from plant resources has become a hot research topic. Furthermore, the polysaccharides exhibit good hygroscopicity and moisture retention activity due to the presence of a large number of hydroxyl or carboxyl polar groups, which can form hydrogen bonds with water molecules and cross-linked reticular structure. Antioxidant activity and hygroscopicity and moisture retention activity are important for healthcare to protect mankind from the attack of free radicals and retard the initiation of many chronic diseases. Therefore, it is necessary to more effectively purify and determine the physicochemical properties of polysaccharides from Litchi chinensis. In the current research, crude polysaccharides were extracted from Litchi chinensis to obtain the polysaccharide fraction (PLC). PLC was further purified and a kind of homogenous hetero polysaccharide (PLC-1) was isolated. The physicochemical properties, antioxidant activity, hygroscopicity and moisture retention activity of PLC-1 were analyzed. The polysaccharides of Litchi chinensis were extracted and purified by ultrasonic-assisted extraction, alcohol precipitation, deprotein, decolouring, dialysis, DEAE-cellulose 52 and Sephadex G-100 gel column chromatography. Purity was determined by ultraviolet-visible spectral scanning, spin spectrophotometry and gel filtration chromatography (GPC). The relative molecular mass was determined by high-performance gel permeation chromatography. The monosaccharide composition was analyzed by HPAEC-PAD. The antioxidant activity was evaluated on the basis of DPPH, OH free radical scavenging activity. The hygroscopicity and moisture retention activity was evaluated by adopting the in vitro method. PLC-1 was isolated and purified from Litchi chinensis, which was a kind of homogeneous polysaccharide. The relative molecular mass of PLC-1 was 2.35 × 104Da. The monosaccharide of PLC-1 included galactose, rhamnose and glucose with a molar ratio of 1.00:3.52:5.89. The antioxidant activity showed PLC-1 had a good dose-effect relationship on DPPH radical and hydroxyl radical in a certain concentration range, and the 50% inhibiting concentration (IC50) of DPPH and hydroxyl radical scavenging activity was 0.41 and 0.31 mg/mL, respectively. The hygroscopicity and moisture retention activity indicated PLC-1 had good effect. Due to the physicochemical properties, antioxidant activity, hygroscopicity and moisture retention activity, PLC-1 has a good prospect in the preparation of functional food and cosmetics.
extraction; purification; column chromatography; Litchi chinensis; physicochemical property; antioxidant activity; hygroscopicity and moisture retention activity
10.11975/j.issn.1002-6819.2016.09.039
TS218
A
1002-6819(2016)-09-0277-07
景永帅,张丹参,吴兰芳,戎欣玉,杜红霞,许伟涛. 荔枝低分子量多糖的分离纯化及抗氧化吸湿保湿性能分析[J]. 农业工程学报,2016,32(9):277-283.
10.11975/j.issn.1002-6819.2016.09.039 http://www.tcsae.org
Jing Yongshuai, Zhang Danshen, Wu Lanfang, Rong Xinyu, Du Hongxia, Xu Weitao. Purification, antioxidant, hygroscopicity and moisture retention activity of low molecular weight polysaccharide from Litchi chinensis[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(9): 277-283. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2016.09.039 http://www.tcsae.org
2016-01-08
2016-03-22
国家级大学生创新创业训练计划项目(201510082002);河北省食药监局食品药品安全科技项目(QN2015016);河北科技大学五大平台开放基金项目(2014PT96);河北科技大学博士启动项目(1181184)
景永帅,男,河北石家庄人,河北科技大学讲师,博士,主要从事药食资源开发与利用研究。石家庄 河北科技大学化学与制药工程学院,050018。Email:cjys1985@126.com
※通信作者:吴兰芳,女,福建寿宁人,河北中医学院讲师,博士,主要从事农副产品加工与利用研究。石家庄 河北中医学院药学院,050200。Email:wulanfang757@163.com
