涂膜和热处理对葡萄能量和贮藏生理及品质的影响
2016-12-19周文化杨明之刘细霞
张 群,周文化,谭 欢,杨明之,刘细霞
(1. 中南林业科技大学食品学院,长沙 410004; 2. 湖南省农业科学院农产品加工研究所,长沙 410125;3. 湖南省长沙县第一中学,长沙 410125; 4. 湖北省野生植物资源重点实验室,黄石 435002)
涂膜和热处理对葡萄能量和贮藏生理及品质的影响
张 群1,2,周文化1※,谭 欢2,杨明之3,刘细霞4
(1. 中南林业科技大学食品学院,长沙 410004; 2. 湖南省农业科学院农产品加工研究所,长沙 410125;3. 湖南省长沙县第一中学,长沙 410125; 4. 湖北省野生植物资源重点实验室,黄石 435002)
研究不同处理对欧亚种“维多利亚”葡萄组织能量水平和生理品质的影响。采后葡萄经钙联合涂膜和热处理,即在质量分数为0.2%CaCl2和1%壳聚糖中浸泡20 min,45℃的0.2%CaCl2溶液中浸泡20 min,晾干后(4±0.5)℃贮藏,每10 d测定果实的呼吸强度、褐变指数(browning index,BI)、腐烂率、硬度、丙二醛(malondialdehyde,MDA)含量、三磷酸腺苷(adenosine triphosphate,ATP)、二磷酸腺苷(adenosine diphosphate,ADP)、单磷酸腺苷(adenosine monophosphate,AMP)的含量,多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase,POD)、脂氧合酶(lipoxygenase,LOX)和超氧化物歧化酶(soperoxide dismutase,SOD)活性变化,以未处理为对照。结果显示对照组葡萄组织中能量物质处于亏损状态,呼吸强度减弱,细胞膜氧化增加,膜透性、BI、腐烂率增加,PPO、POD和LOX活性增加,SOD降低,果实软化。钙联合热和涂膜处理较好维持了果实的能量水平和生理品质,且涂膜优于热处理。ATP与硬度、SOD显著正相关(r=0.938,0.930,P<0.01),与MDA、膜透性、LOX显著负相关(r=−0.896,−0.932,−0.940,P<0.01);能荷(energy charge,EC)值与膜透性、LOX负相关(P<0.05),与呼吸强度和SOD活性正相关(P<0.05)。随贮藏时间的延长,葡萄组织的能量水平处于亏损状态,能量水平显著影响生理品质。经适当的采后处理可延缓能量亏损,涂膜优于热处理。
贮藏;酶;品质控制;葡萄;能量水平;涂膜处理;热处理;生理指标
0 引言
葡萄(Vitis vinifera L.)属浆果类,落叶藤本植物,营养丰富,具有很高的食用价值及医疗保健价值。葡萄采后在贮藏中极易发生生理品质劣变,如质地软化、褐变、腐烂及霉变等[1]。大量研究表明,园艺作物的衰老褐变和细胞膜透性的增加可能与能量合成下降而造成的细胞能量亏缺有关[2-8]。果实组织细胞的能量状态对保持细胞膜的完整性发挥了重要作用。三磷酸腺苷(adenosine triphosphate,ATP)是生物体机体的能量来源,在细胞代谢中占有重要地位。其中ATP、二磷酸腺苷(adenosine diphosphate,ADP)和一磷酸腺苷(adenosine monophosphate,AMP)3种能量物质所占比例可以反映细胞的能荷变化,调节组织的代谢活动,细胞组织中许多呼吸代谢关键性酶的活性都依赖于能荷变化的调节[3-4]。果实采后的衰老程度与ATP含量和能荷值呈负相关性[3,7-8],如Saquet等研究发现,梨果实组织能量状态在维持细胞膜的完整性中起重要作用,低ATP含量和低比例的ATP:ADP导致褐变发生[3-4]。荔枝纯氧处理后减少褐变和膜透性,与高含量的ATP和ADP有关,与AMP含量无关[7]。采用外源ATP处理可提高荔枝果皮组织的能量水平,从而减轻褐变[5]。通过适当的处理可减缓果蔬新陈代谢,减少能量亏损,延缓果蔬衰老和品质劣变[6-8]。对葡萄采后处理方法有较多的研究[9-10],但葡萄贮藏过程中其组织细胞的能量水平变化及果实组织的能量水平对生理品质劣变的影响还未见报道。湖南葡萄产业飞速发展,但葡萄成熟和采收出现在多雨季节,不耐贮藏,这可能与葡萄质地和品质有关。作者根据前期的试验基础对葡萄采后采用加钙结合其他处理进行采后处理,可以较好延长贮藏期。本文研究采用欧亚种“维多利亚”葡萄(Victoria)为研究对象,对其进行钙联合涂膜和热处理,以未处理为对照,探析贮藏期葡萄组织细胞能量水平和生理品质的变化规律及相关性,以期通过调控能量状态来控制采后葡萄果实的生理品质、延长果实保鲜期。
1 材料与方法
1.1 材料与试剂
葡萄(品种为欧亚种“维多利亚”Victoria葡萄),八至九成熟,可溶性固形物质量分数10%~12%,2013 年8月13日采自湖南省澧县张公庙镇葡萄园,采前10 d停止施水,采收时间为7:00—9:00,采收无病害、无霉变、无机械损伤的果实,采收后装入透气的塑料筐内,并于采收当日运回中南林业科技大学食品学院进行风冷12 h,去除田间热,于次日进行不同处理。
5′-磷酸腺苷钠盐(adenosine 5′-triphosphate disodium salt hydrate):纯度大于98.5%;5′-二磷酸腺苷钠盐(adenosine 5′-diphosphate sodium salt):纯度大于95%;5′-单磷酸腺苷钠盐(adenosine 5′-monophosphate disodium salt):纯度大于99.0%,美国Sigma-Aldrich公司;乙腈:色谱纯,美国天地公司;三羟甲基氨基甲烷、考马斯亮蓝G250和牛血清蛋白:生化试剂,美国Sigma公司;亚油酸钠、核黄素、氮蓝四唑、愈创木酚和邻苯二酚:生化试剂,上海阿拉丁生化科技股份有限公司;其他化学试剂均为分析纯,购自国药集团化学试剂有限公司;氯化钙(食品级);壳聚糖(食品级);实验室用水(18 MΩ)由Millipore Milli QRG超纯水系统制备。
1.2 主要仪器与设备
高效液相色谱仪:日本Shimadzu公司,型号为PDA 2010AT;TPA质构仪(textural profile analysis):美国Brookfield公司,型号为CT3;高效冷冻离心机:美国贝克曼库尔特有限公司,型号为Avanti J-26XP;紫外分光光度计:日本Shimadzu公司,型号为UV7100;电子天平:梅特勒-托利多仪器上海有限公司,型号为Mettler Toledo AL204;电导率仪:上海雷磁仪器有限公司,型号为DDS-11A;pH计:梅特勒-托利多仪器上海有限公司,型号为Mettler Toledo Delta 320。
1.3 方 法
1.3.1 果实采后处理方法
根据前期的试验结果(表1),仅采用涂膜和热水处理,葡萄的腐烂率高于钙联合涂膜和热水复合处理。
对照组(CK):对果实不做处理。
涂膜处理(coating treatment):在质量分数1%壳聚糖和0.2% CaCl2溶液中浸泡20 min,果实全部浸没,晾干备用。
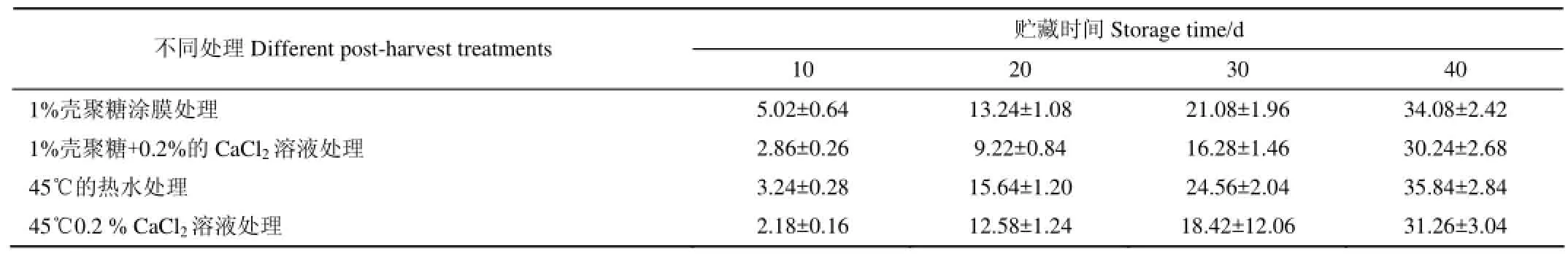
表1 前期贮藏试验腐烂率的结果Table 1 Results of preliminary storage test on decay rate %
热处理(heat treatment):于45℃的质量分数0.2% CaCl2溶液中浸泡20 min,果实全部浸没,晾干备用。
每个处理组3个重复,每个重复3个托盘,每个托盘装果2.5 kg,表面覆上保鲜膜,入(4±0.5)℃冷库冷藏。
每隔10 d测定葡萄的感官指标、生理指标以及衰老指标,测定周期为40 d。测定呼吸强度时从每个重复中取1个托盘,即每个处理组合计3个托盘取果进行测定。能量物质、丙二醛和相关酶活测定从每个重复中取1个托盘,即每个处理组合计3个托盘葡萄果粒全部液氮粉碎后放于−70℃冰箱内保存,取样进行测定。硬度、褐变指数、腐烂率、细胞膜透性测定是从每个重复中取一个托盘,合计3个托盘的果进行测定。
1.3.2 测定指标与方法
呼吸强度:采用静置法。从每个重复中取1个托盘,即每个处理组合计3个托盘,在葡萄果穗的不同部位剪取小串葡萄,质量约1 kg葡萄置于6 L密闭的干燥器中,干燥器底部放入0.2 mol/L NaOH作为CO2的吸收剂,贮藏温度下放置5 h,用0.2 mol/L的草酸滴定。结果以mg/(kg·h)表示。
腐烂率的测定:从每个重复中取1个托盘,每个处理3个托盘中葡萄作为样品,每10 d对贮藏葡萄进行质量测定,分别测定腐烂果的质量,并按下式进行计算:
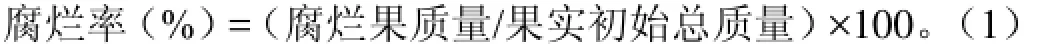
褐变指数(browning index,BI):参照赵颖颖等的方法[11],稍有修改。随机取40粒葡萄果粒,按褐变面积占果皮总面积的比例将果皮褐变程度分为4级,分级标准为:0级,无褐变;1级,褐变面积≤25%(轻微褐变);2级,25%<褐变面积≤50%;3级,50%<褐变面积≤75%;4级,褐变面积>75%。计算公式为

硬度测定:将保留果梗的葡萄试样横放于质构仪夹具正下方进行硬度测试,选用的夹具直径为50.8 mm,长20 mm的圆柱形探头TA25/1 000。经预试验选取合适的测试参数:目标类型为TPA试验,距离4 mm,触发点负载50N,测试速度0.5 mm/s,循环2次。由质地特征曲线得到表征果实质地状况的力学参数,其中硬度以双峰曲线中第1个峰的最大值表示,单位为N。每次取20粒果实,分别在果实的对角线取2个点,进行测定,取平均值。测试温度:室温(18~20)℃。
细胞膜透性的测定:参照Liu等的方法[12],稍有修改。随机取30粒葡萄,用打孔器取30片葡萄果肉圆片(直径10 mm)。用去离子水洗3次,每次1 min,放入50 mL容量瓶中,且加水到刻度,静置20min,用电导仪测定初始电导值。煮沸20 min后,补齐蒸发掉的蒸馏水,冷却至室温后再测总电导值,以前后2次电导值之比所得的相对电导率(%)来表示细胞膜透性的大小。
能量物质:参照Liu等[13]方法,略做调整。取葡萄果肉组织(2 g)(−70℃冰箱内液氮粉碎的样品)用液氮研磨后加入10 mL 0.6 mol/L高氯酸冰浴研磨后,提取1 min,16 000×g冷冻(4℃)离心15 min,取5 mL上清液迅速用1.0 mol/L KOH 中和至pH6.5~6.8,冰浴中稳定30 min使高氯酸沉淀,之后经8 000×g冷冻(4℃)离心5 min,取上清液定容至5 mL,并过0.45 μm微孔滤膜过滤。按Liu等[13]的HPLC法测定ATP、ADP和AMP的含量,色谱条件为 Shimadzu C18反相柱(柱长250 mm,色谱柱内径为4.6 mm,填充物颗粒直径为5.0 μm)(250 mm×4.6 mm,5.0 μm),检测波长254 nm,流动相pH值为7.0的20 mmol/L磷酸氢二钾缓冲溶液(A),60%乙腈(B)相,A与B体积比为4∶6,柱温30℃,流速0.8 mL/min;进样体积20 μL。定量方法采用外标法,根据标准品保留时间和峰面积进行定性定量[13],

式中[ATP],[ADP],[AMP] 表示果肉组织中的三种能量物质的质量分数,μg/g。样品测定结果表示为平均值±标准差。
丙二醛(malondialdehyde,MDA)的测定:参照Duan等方法[14]稍有修改。5 g(−70℃冰箱内液氮粉碎的样品)葡萄果肉组织加25 mL质量分数为 10%的三氯乙酸(TCA),冰浴研磨,27 000×g冷冻(4℃)离心10 min,上清液用10%的TCA定容到10 mL。取1 mL上清液加2 mL质量分数为0.6%硫代巴比妥酸(TBA)(TBA配制时用10%三氯乙酸定容),混合,沸水浴中煮沸20 min,冷却至室温后再次离心,分别测定上清液在450,532和600 nm波长处的吸光度。
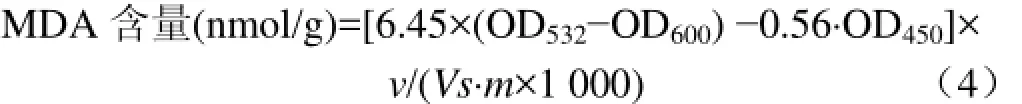
式中v为提取液的总体积,mL;Vs为测定所用提取液体积,mL;m为样品质量,g;OD值分别为不同波长下的吸光度。
脂氧合酶(lipoxygenase,LOX)的测定:参照Liu等的方法[12]稍有修改。取果肉组织5 g(−70℃冰箱内液氮粉碎的的样品),加25 mL 100 mmol/L,pH值8.0 Tris-HCl 磷酸缓冲液,冰浴研磨,27 000×g冷冻(4℃)离心10 min,取上清液用于LOX酶活的测定。反应液包括2.85 mL pH值6.0 100 mmol/L磷酸钠缓冲液,50μL 10 mmol/L亚油酸钠和0.1 mL酶液,空白为2.95 mL pH 值6.0,100 mmol/L磷酸钠缓冲液和50 μL 10 mmol/L亚油酸钠,30℃反应,在234 nm下测定吸光度。酶活以U/mg表示,其中以每分钟234 nm下吸光度增加0.001为一个单位。
超氧化物歧化酶(superoxide dismutase,SOD))活性的测定:参照Duan等[14]的方法略做修改。果肉组织5 g(−70℃冰箱内液氮粉碎的的样品),加入20 mL 50 mmol/L(pH值7.0)的磷酸钠缓冲液(内含质量分数0.1%聚乙烯聚吡咯烷酮(polyvingypyrrolidone,PVPP)和适量石英砂,冰浴研磨,15 000×g冷冻(4℃)离心20 min,取上清液用于SOD活性氧清除酶活性测定。2.5 mL反应液中包含1.5 mL 50 mmol/L磷酸钠缓冲液,0.3 mL 10 μmol/L乙二胺四乙酸(EDTA),0.3 mL 13 mmol/L 核黄素,0.3 mL75 μmol/L氮蓝四唑(nitro-blue tetrazolium, NBT),0.1 mL酶液,空白则以缓冲液代替酶液。反应液在光照4 000 lx下进行10 min的光照反应,然后用黑暗终止反应,立即在560 nm波长下测定吸光度。一个酶活单位为相当于引起2.5 mL反应液达到抑制50%所需的酶量。酶活以U/mg表示。
过氧化物酶(peroxidase,POD)活性的测定:酶液提取方法参考李桂峰等[15]。称取2 g葡萄果肉组织(−70℃冰箱内液氮粉碎的的样品),加入10 mL 50 mmol/L pH 值5.5的磷酸钠缓冲液中,冰浴研磨,15 000×g 冷冻(4℃)离心20 min,取上清液用于过氧化物酶(POD)活性测定。酶活性测定采用愈创木酚法:取一支试管,加入3.0 mL 25 mmol/L的愈创木酚溶液和0.5 mL酶提取液,再加入0.5 mL质量分数1%的H2O2溶液迅速混合启动反应,同时开始计时。将反应混合液倒入比色杯中,以蒸馏水为参比,在反应30 s 时测其在波长460 nm处的吸光值,并每间隔1 min记录1次,连续测定,至少获得6个点的数据,重复3次。酶活以U/mg表示,其中以每毫克蛋白质在460 nm下每分钟吸光度增加0.01为一个单位。
多酚氧化酶(polyphenol oxidase,PPO)活性的测定:取−70℃冰箱内液氮粉碎的的样品,酶液提取方法同POD提取法。酶活测定采用邻苯二酚法[15]:取1支试管,加入1.5 mL 50 mmol/L、pH值5.5的乙酸-乙酸钠缓冲液和1.0 mL 50 mmol/L邻苯二酚溶液,最后加入1 mL酶提取液,以缓冲液为参比,同时开始计时。在反应30 s 时测其在波长398 nm处的吸光值,并每间隔30 s记录1次,连续测定,至少获得5个点的数据,重复3次,酶活以U/mg表示,其中以每分钟每毫克蛋白质在398 nm下吸光度增加0.001为一个单位。
蛋白质含量测定:参照考马斯亮蓝G250染色法测定,以牛血清蛋白作标准曲线。
以上各指标测定均重复3次,结果以平均值±标准差表示。
1.3.3 数据处理
所有图表绘制采用Sigmaplot 12.5 和 Excel 2003软件进行处理;利用SPSS 16.0软件进行相关性和ANOVA分析,置信概率为0.95,P<0.05为显著差异。
2 结果与分析
2.1 涂膜和热处理对葡萄果实贮藏期间能量指标的影响
采收时葡萄果肉组织有高水平的ATP、ADP含量和能荷(EC)值(图1a、b、d),相对低水平的AMP含量(图1c),这与Duan等对荔枝能量物质的研究结果一致[7]。随贮藏期的延长,葡萄果肉组织中的ATP、ADP含量和EC值总体下降,在梨和荔枝贮藏过程中也有同样的结果[7,12]。
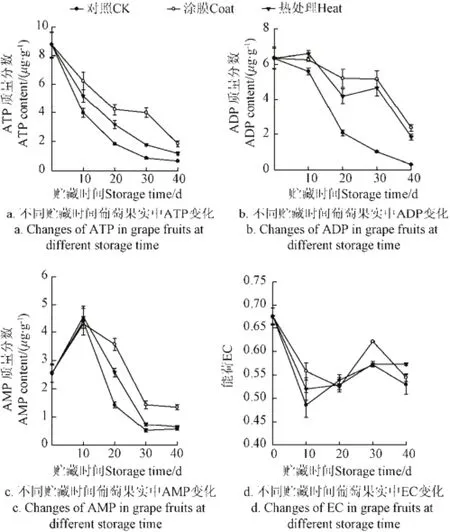
图1 不同贮藏时间葡萄果实中ATP、ADP、AMP和EC的变化Fig.1 Changes of ATP, ADP, AMP contents and EC of grape fruits at different storage time
在贮藏初期(0~10 d),ATP、ADP含量和EC值下降(图1a、b、d),AMP含量上升(图1c)。贮至20 d,各组ATP、ADP和AMP含量快速下降。贮藏20~30 d时,涂膜和热处理组ATP含量缓慢下降。在整个贮藏期间,对照组与涂膜和热处理间葡萄组织中ATP含量呈显著性差异(P<0.05),涂膜与热处理组ATP含量缓慢下降,但涂膜组ATP含量高于热处理组。涂膜和热处理中ADP含量的变化与ATP含量变化类似。贮藏40 d后,涂膜组的葡萄组织ATP为1.84 μg/g,热处理组1.17 μg/g,对照组为0.65 μg/g(图1a)。涂膜组中ADP 为2.37 μg/g,热处理组为1.85 μg/g,对照组为0.30 μg/g(图1b),涂膜比热处理能更好的延缓ATP和ADP含量的下降。
葡萄果肉组织中AMP含量在10 d内增加,然后呈现下降趋势。贮至20 d时,葡萄组织呈高水平AMP含量,不同组间呈现出显著性差异(P<0.05),随后出现下降。贮至30 d时,AMP含量快速下降,并呈现出显著差异(P<0.05)。在贮藏中后期(10 d后),涂膜和热处理的葡萄组织中AMP含量要高于对照组,尤其是涂膜组AMP含量最高,最低为对照组。贮藏末期,涂膜组AMP质量分数为1.35 μg/g,热处理组为0.64 μg/g,对照组为0.56 μg/g(图1c),在涂膜和热处理间AMP含量有显著性差异(P<0.05),但空白与热处理组间无显著性差异(P>0.05)。涂膜比热处理可以更好延缓AMP含量的下降。
采收时葡萄的EC值为0.68。在贮藏期间,不同组葡萄组织中EC值总体呈下降趋势,贮藏末期EC值低于贮藏初始值。贮藏从10~30 d,能荷EC值有小幅的上升。在整个贮藏期间,能荷EC值的变化为0.49~0.68。在贮藏末期,EC缓慢下降,能荷水平为热处理组(0.57)>涂膜组(0.54)>对照组(0.53)(图1d)。对照组EC值最低,但涂膜与对照间无显著性差异(P>0.05)。
2.2 涂膜和热处理对葡萄果实贮藏期间硬度的影响
葡萄果肉质地随贮期延长逐渐出现软化,严重影响食用品质。由图2可知,在贮藏期间葡萄果实硬度随贮藏时间的延长呈显著性下降(P<0.05),与张昆明等[16]对不同保鲜膜包装的葡萄进行TPA测试结果一致。

图2 不同贮藏时间葡萄果实硬度的变化Fig.2 Changes of hardness of grape fruits at different storage time
图2显示葡萄果实经不同处理后硬度有所改变,对照组的初始硬度值为(10.63±1.06)N,经涂膜和热处理后,硬度值变为(11.72±1.17)N,(9.18 ±0.91)N,其中涂膜后硬度值最大,热处理比对照低,热处理组的初始硬度最低,这与Wu等[10]的研究结果相同,热处理降低了葡萄的初始硬度。在贮藏初期(贮至10 d),对照、涂膜处理和热处理硬度显著下降(P<0.05),下降幅度分别为30%、23%和10%,对照下降最明显,其次为涂膜和热处理。在贮藏后期,下降幅度有所减缓。贮至40 d,对照组大多数葡萄已经腐烂不能进行下一步试验。在整个贮藏期间,涂膜处理的葡萄果实硬度高于热处理和对照组,这说明涂膜能够延缓葡萄果实的软化。葡萄采后果肉软化一般认为是果胶物质和细胞壁降解所致,与能量物质的关系鲜见报道。涂膜处理可减缓能量水平ATP、ADP和AMP的下降。相关分析结果表明,葡萄硬度(y)与能量ATP水平(x)呈极显著正相关(y=72.420x+434.033,R=0.938,P<0.01)。不同处理如何维持高水平的能量及保持葡萄硬度的机理,尤其是降解变化规律待进一步研究。
2.3 涂膜和热处理对葡萄果实贮藏期间膜渗透性和丙二醛(MDA)含量的影响
随贮藏时间的延长,葡萄果实膜渗透性逐渐增加(图3a),与荔枝贮藏结果一致[12]。对照组的膜渗透性在贮藏10,20,30 d后分别为37.93%, 46.20%和56.25%,涂膜和热处理显著(P<0.05)抑制了膜渗透性的上升[9-10],保持了细胞膜良好的完整性。
从图3b可以看出,葡萄果实组织过氧化物MDA含量随贮藏时间的延长而增加,这与荔枝组织MDA含量随着贮藏时间的延长而显著增大结果一致[14]。在整个贮藏期间,对照组和处理组葡萄组织中MDA含量均快速增加。在贮藏末期,涂膜组MDA含量要显著低于热处理组和对照组(P<0.05),对照和热处理间葡萄组织的MDA含量没有显著性差异(P>0.05)。涂膜抑制了果实中MDA含量的上升,抑制膜脂过氧化作用,维持细胞结构的完整性。在贮藏中后期,对照组能量物质低于涂膜和热处理组(图1a、b、c)。ATP参与了脂质的合成和脂肪链的去饱和影响膜的理化性质,有利于保持果实细胞膜的完整性,延缓衰老。高能量水平可减缓膜透性和过氧化物MDA含量的升高,抑制膜水解酶的活性,减缓膜脂质的过氧化,维持膜的完整性[5,14]。这些效应的发挥可能是涂膜和热处理有利于维持果实组织较高的能量水平。相关分析结果表明,葡萄膜透性(y)与能量水平ATP(x)呈极显著负相关(y=−3.837x+54.048,R=0.932,P<0.01);葡萄MDA含量(y)与能量水平ATP(x)呈负相关(y=−6.542x+ 61.441,R=0.896,P<0.01)。
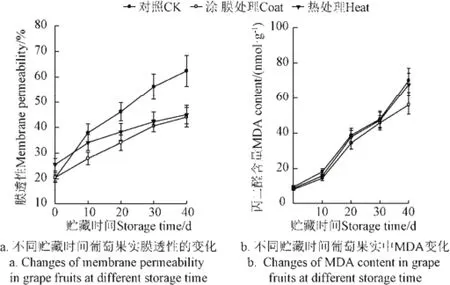
图3 不同贮藏时间葡萄果实膜透性和MDA的变化Fig.3 Changes of membrane permeability and MDA content in grape fruits at different storage time
2.4 涂膜和热处理对葡萄果实呼吸强度的影响
葡萄果实的呼吸强度随贮藏时间的延长而下降(图4),没有出现呼吸高峰,与梁丽雅的研究结果一致[18]。在整个贮藏期间,涂膜和热处理的呼吸强度均低于对照组,大小依次为对照组>热处理组>涂膜组。涂膜组呼吸强度显著低于对照组和热处理组(P<0.05),对照组和热处理组则差异不显著(P>0.05)。呼吸强度越大,果实的营养物质消耗越快,果实衰老加速,贮藏寿命缩短。呼吸作用增加不利于较低温度下长时间贮藏果蔬,涂膜和热处理通过抑制呼吸强度而实现延长贮藏期的目的。涂膜后在果实表面形成一层膜,内部自成一个微小的气调环境,减缓呼吸损耗,维持优良品质[9];热水处理可减缓呼吸代谢和乙烯的生成,减缓果胶降解,增加抗氧化能力[10]。能量由呼吸作用产生,能量的生成速率和效率决定于呼吸强度和各种呼吸途径的实际运行量[2]。能量水平与呼吸活性密切相关,参与采后衰老和品质变化[2]。常温下呼吸作用加强有利于物质的转化,Duan等[7]认为荔枝纯氧处理后呼吸作用加强,ATP含量和能荷水平较高,有利于保持膜的完整性,延缓了荔枝果皮的褐变。在本研究中发现呼吸强度下降(图4),ATP、ADP含量也下降(图1a、b),显示出一定的正相关性。相关分析结果表明,葡萄呼吸强度(y)与能量水平ATP(x)正相关(y=0.680x+1.364,R=0.881,P<0.01)。
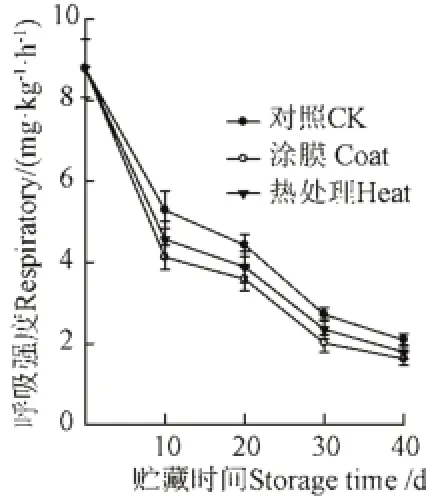
图4 不同贮藏时间葡萄果实呼吸强度的变化Fig.4 Changes of respiratory of grape fruits at different storage time
2.5 涂膜和热处理对葡萄果实贮藏期间褐变指数(BI)和腐烂率的影响
随贮藏时间的延长,葡萄果皮BI快速增加,与荔枝贮藏结果一致[7]。在整个贮藏期间,对照组的BI高于涂膜和热处理组,涂膜和热处理缓解葡萄果皮褐变的发生,且三组间葡萄果皮的BI呈显著性差异(P<0.05)。贮至10 d时,涂膜和热处理组葡萄未出现果皮褐变,但对照组葡萄果皮的BI为1.27%;贮至20 d时,对照组BI达一个高水平(13.2%),涂膜和热处理组的BI分别为4.98% 和10.86%,涂膜可明显抑制褐变;贮至30 d时,对照组的BI为29.97%,但涂膜和热处理组分别为16.68%和24.83%。结果显示涂膜和热处理可抑制褐变的发生,且涂膜效果优于热处理。Qu等[8]在对荔枝研究中发现ATP含量与BI负相关,苹果和梨发生褐变是由于ATP供应不足,低比例的ATP:ADP,低EC[3],高能荷可减少梨的生理失控和褐变[4]。对照组能量物质下降趋势比涂膜和热处理组明显(P<0.05),且含量处于低水平,褐变严重,与Saquet对梨的研究结果相同[4]。涂膜和热处理的能量物质ATP含量高于对照组(P<0.05),涂膜组高于热处理组(P<0.05),BI与ATP含量显示出负相关。ATP含量高,维持细胞的区室化结构,降低酶与底物接触氧化的几率。
随贮藏时间的延长,葡萄腐烂率呈上升趋势。涂膜和热处理组葡萄贮至20 d前未发现腐烂,但对照组则出现了12.3%的腐烂率,这可能是涂膜和热处理增加了果皮和果肉中抗真菌基因的表达诱导和激活耐腐机制,抑制葡萄果实表面微生物的生长繁殖[9-10]。但贮至30 d时,涂膜和热处理组腐烂率分别达10.8%和16.9%,对照组达34.6%,是处理组的2倍多。贮至40 d时,各组的腐烂率均快速上升,对照组达71.5%,且大多葡萄已不能食用;涂膜组达39.23%,热处理组达49.24%,热处理组比涂膜组高约10%。贮藏至30d时,不同组间腐烂率差异显著性(P<0.05)。贮藏末期,对照组与处理组间差异显著(P<0.05),但涂膜和热处理间差异不显著(P>0.05)。涂膜组的延迟效果要高于热处理组,可能热处理后葡萄果实的起始硬度下降,加速果实的软化和腐烂。在能量物质方面,涂膜组的ATP、ADP含量比热处理组要高,能量物质水平高,腐烂率低,部分原因可能是由于经过处理后葡萄果实中碳水化合物代谢的酶活增加,加强了能量物质的供应[10]。
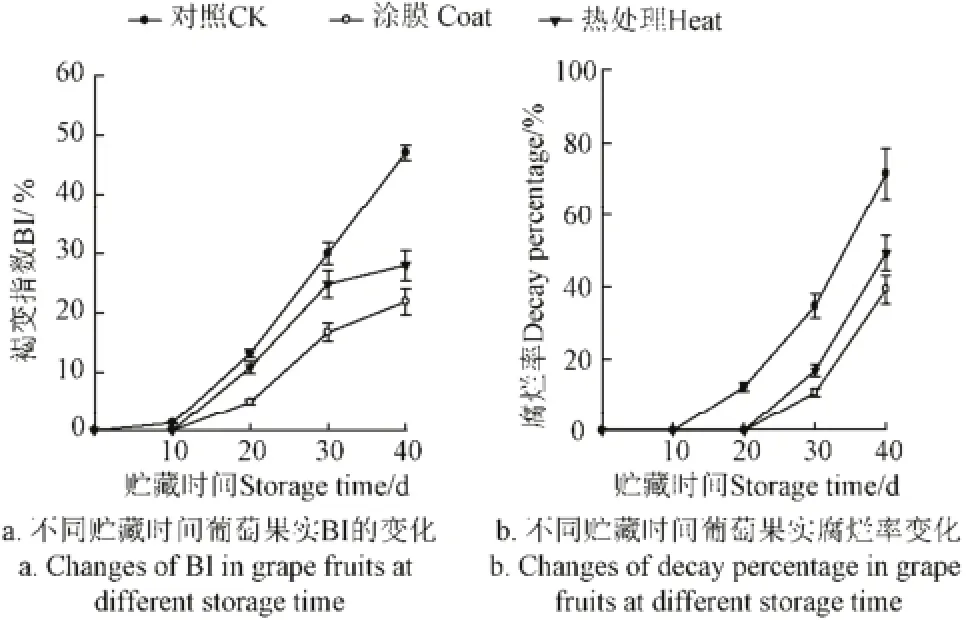
图5 不同贮藏时间葡萄果实的BI和腐烂率的变化Fig.5 Changes of BI and decay percentage of grape fruits at different storage time
2.6 涂膜和热处理对葡萄果实贮藏期间酶活性的影响
图6a中显示,各组葡萄果肉组织的LOX活性均呈上升趋势,番茄、猕猴桃、草莓和辣椒等在后熟衰老中LOX活性也逐渐上升[19]。本研究中LOX活性的大小依次为对照>热处理>涂膜。在贮藏期间LOX活性上升,对照组的LOX活性高于涂膜和热处理组。贮藏初期和末期,对照组与处理组间LOX活性有显著性差异(P<0.05),但涂膜和热处理间差异不显著(P>0.05)。在贮藏中期(20-~30 d),三组LOX活性差异不显著(P>0.05)。涂膜和热处理可保持果实较高的能量水平,延缓膜脂过氧化进程,缓解LOX活性的增加,减缓衰老。葡萄能量短缺,LOX活性增加,引发膜完整性破坏,细胞间隔消失,加速褐变和品质劣变[14]。
图6b表明,在整个贮藏期间,葡萄果肉组织活性氧清除酶SOD活性均呈现下降,与Meng等[9]的研究结果一致。贮至10 d时,处理组的SOD活性比对照组要高,贮至30 d时处理组仍维持相对高的SOD活性,贮藏10~30 d期间,三组间SOD活性差异显著(P<0.05)。在贮藏末期,涂膜组SOD活性显著高于热处理和对照组(P<0.05),但对照和热处理组间差异不显著(P>0.05)。涂膜和热处理组能保持较高的SOD活性,减缓SOD活性降低[9-10],保持细胞内有较高的活性氧清除能力,减少活性氧积累,减轻膜脂过氧化作用,保持细胞膜结构完整性,涂膜组的SOD活性高于热处理组(P<0.05)。
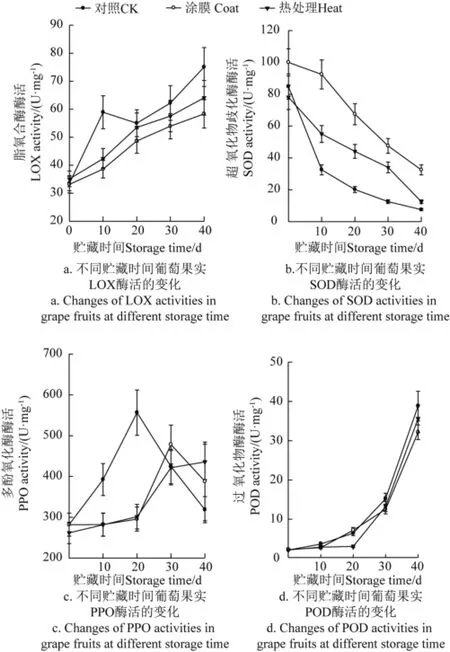
图6 不同贮藏时间下葡萄组织的LOX、SOD、PPO和POD酶活的变化Fig.6 Changes of activities of LOX, SOD, PPO, POD in grape fruits at different storage time
图6c表明,对照组葡萄PPO活性在贮藏0~20 d内显著升高(P<0.05),贮藏20 d时PPO酶活性达到高峰;贮藏中后期呈下降趋势,贮至40 d时PPO活性仍比贮藏初始高,但比涂膜和热处理组贮藏40 d时低。涂膜和热处理组葡萄PPO活性在贮藏20 d内无明显变化,在贮至30 d时涂膜组PPO活性达高峰,然后下降,但热处理组PPO活性在贮藏期内一直呈上升趋势。贮藏初期(10~20 d),对照组PPO活性显著高于处理组(P<0.05),但涂膜和热处理间差异不显著(P>0.05)。贮藏后期,三者PPO活性差异不显著(P>0.05)。涂膜和热处理可推迟高峰的出现,且峰值比对照组低,对照组PPO活性出现高峰后急剧下降。在贮藏末期,PPO活性大小依次为热处理组>涂膜组>对照组,且各组PPO活性均高于初始值。正常细胞中PPO酶与酚类底物区室化分布,但当果实衰老,膜透性增加,区室化分布破坏,PPO酶游离出来,易与酚类物质接触发生氧化,导致褐变的发生[12]。涂膜和热处理延缓膜氧化,延缓区室分布的破坏,延缓PPO活性峰值的出现。随贮藏期延长,衰老不可避免,PPO活性高于初始值。
POD活性变化与PPO不同。图6d表明,各组葡萄POD活性随着贮藏时间的延长而持续上升。京亚葡萄常温贮藏过程中,POD活性不断升高[20]。可能是POD在衰老过程中一方面起清除H2O2的作用,另一方面参与活性氧的生成和膜脂过氧化作用。本研究中葡萄果实中的POD活性不断上升,果实衰老加重,膜透性增加。涂膜和热处理的葡萄组织中POD活性与对照组无显著差异(P>0.05)。贮藏末期,POD活性大小依次为对照组>热处理组>涂膜组。涂膜可抑制荔枝褐变,减少腐败,延缓PPO和POD活性的增加,涂膜可抑制葡萄PPO、POD活性的增加[9,15]。
2.7 能量水平与主要生理品质劣变指标及酶活性之间的相关性分析
从表2看出,能量物质ATP与硬度极显著正相关(R=0.938,P<0.01)。能量水平高,有利于保持细胞壁和细胞膜的完整性,延缓果实的软化。

表2 能量水平与主要生理品质劣变指标间的皮尔逊相关性分析(n=14)Table 2 Pearson correlation analysis among energy levels and main physiological indicators of quality deterioration (n=14)
ATP含量与膜透性、MDA含量和LOX活性极显著负相关(R=−0.932,−0.896,−0.940,P<0.01),ATP含量下降破坏了细胞膜的完整性,膜脂氧化加剧,细胞膜透性增加,细胞间区室化破坏,亚细胞结构降解,PPO、POD游离出来,底物与酶接触氧化产生褐变[3-4],BI升高,与采后梨、龙眼和荔枝等果实ATP含量影响褐变和膜透性结果一致[2,5-6]。能量物质下降,LOX酶活增加,膜脂过氧化物(ROOH)、H2O2和自由基的积累增多,脂质过氧化物MDA增加,细胞膜透性增大,膜的完整性显著下降。细胞膜透性增加和膜脂过氧化作用损害线粒体的结构和功能,破坏线粒体膜的完整性,膜的破坏使酶无法存在,功能随之丧失,细胞合成ATP能力受损,ATP酶活性降低[21]。高水平的ATP含量可延缓梨褐变,保持低渗透性,维持膜的完整性[3-5,14],与本文结果一致。
ATP含量与呼吸强度正相关(R=0.881,P<0.01),这与刘亭等对荔枝呼吸活性和能量代谢的研究报道一致[2]。Saquet等也发现梨呼吸活性高,能量水平高[4]。园艺作物采后气调和低温贮藏保鲜很大程度上是通过抑制呼吸强度而发挥作用的。本研究中涂膜和热处理通过抑制呼吸作用延长贮藏期,且涂膜组的呼吸强度最低,其次是热处理组,对照组呼吸强度最高。但在同一贮藏时间上,涂膜组的能量水平最高,可能是涂膜组不仅抑制了呼吸强度,而且更大程度延缓了能量物质的下降,维持采后的高能量水平。
ATP的生产与活性氧清除酶的诱导有关[14],ATP含量与SOD极显著正相关(R=0.930,P<0.01),SOD酶是自由基去除酶,需要消耗能量,可提供的能量物质高,去氧能力强。
3 结论
1)采后葡萄果实随贮藏时间的延长,组织细胞的三磷酸腺苷、二磷酸腺苷、单磷酸腺苷、能荷值总体下降,能量水平出现亏损,呼吸强度减弱,脂氧合酶活性增加、超氧化物歧化酶活性下降,抗氧化能力下降,细胞膜脂过氧化作用加强;细胞膜透性增大,丙二醛含量上升、细胞膜结构的完整性破坏,多酚氧化酶、过氧化物酶在细胞中的区室化分布结构被破坏,褐变指数增加,腐烂率升高,硬度下降。
2)钙联合涂膜和热处理维持了较高的三磷酸腺苷、二磷酸腺苷含量及能荷水平,延缓多酚氧化酶活性峰值的出现,抑制丙二醛的积累和细胞膜透性的增加,延缓超氧化物歧化酶活性降低,保持细胞内较高的活性氧清除能力,减少活性氧积累,减轻膜脂过氧化作用,保持细胞膜结构的完整性,抑制葡萄果皮褐变,减轻腐败。
3)在贮藏中后期,涂膜组的三磷酸腺苷、二磷酸腺苷、单磷酸腺苷含量比热处理高(P<0.05),涂膜组的超氧化物歧化酶显著高于热处理组(P<0.05),褐变指数显著低于热处理组(P<0.05)。呼吸强度、腐烂率、脂氧合酶、膜透性、丙二醛含量和过氧化物酶酶活比热处理低,但差异不显著(P>0.05)。涂膜处理组葡萄品质优于热处理组。涂膜处理减缓了呼吸损耗,维持较高的能量水平,抑制脂氧合酶的活性,减缓膜透性和过氧化物丙二醛含量的升高,维持膜的完整性,减缓褐变。
4)能量物质三磷酸腺苷与硬度、超氧化物歧化酶活性极显著正相关(R=0.938,0.930,P<0.01)。能量水平高,有利于保持细胞壁和细胞膜的完整性,延缓果实的软化;保持细胞内较高的活性氧清除能力,减少活性氧积累,减轻膜脂过氧化作用。三磷酸腺苷与丙二醛,膜透性,脂氧合酶活性极显著负相关(R=−0.896,-0.932,-0.940,P<0.01)。在葡萄贮藏中,维持高水平的三磷酸腺苷可维持细胞膜的完整性,减缓膜脂过氧化,减缓膜透性增加,减缓因细胞膜破坏引起的系列生理品质劣变。
[1] 李志文,张平,刘翔,等. 1-MCP 结合冰温贮藏对葡萄采后品质及相关生理代谢的调控[J]. 食品科学,2011,32(20):300-306. Li Zhiwen, Zhang Ping, Liu Xiang, et al. Effects of 1-MCP treatment in combination with controlled freezing-point storage on post-harvest qualities and physiological metabolism of grape (Vitis vinifera L.)[J]. Journal of Fruit Science, 2011, 32(20): 300-306. (in Chinese with English abstract)
[2] 刘亭,钱政江,杨恩,等. 呼吸活性和能量代谢与荔枝果实品质裂变的关系[J]. 果树学报,2010,27(6):946-951. Liu Ting, Qian Zhengjiang, Yang En, et al. Respiratory activity and energy metabolism of harvested litchi fruit and their relationship to quality deterioration[J]. Journal of Fruit Science, 2010, 27(6): 946-951. (in Chinese with English abstract)
[3] Saquet A A, Streif J, Bangerth F. Changes in ATP, ADP and pyridine nucleotide levels related to the incidence of physiological disorders in ‘Conference’ pears and ‘Jonagold’apples during controlled atmosphere storage[J]. Hortic. Sci. Biotechnol, 2000, 75(2): 243-249.
[4] Saquet A A, Streif J, Bangerth F. Energy metabolism and membrane lipid alterations in relation to brown heart development in ‘Conference’ pears during delayed controlled atmosphere storage[J]. Postharvest Biology and Technology, 2003, 30(2): 123-132.
[5] Song L L, Jiang Y M, Gao H Y, et al. Effects of adenosine triphosphate on browning and quality of harvested litchi fruit[J]. American Journal of Food Technology, 2006, 1(2): 173-178.
[6] Su X G, Jiang Y M, Duan X W, et al. Effects of pure oxygen on the rate of skin browning and energy status in longan fruit[J]. Food Technology and Biotechnology, 2005, 43(4): 359-365.
[7] Duan X W, Jiang Y M, Su X G, et al. Role of pure oxygen treatment in browning of litchi fruit after harvest[J]. Plant Science, 2004, 167(3): 665-668.
[8] Qu H, Duan X, Su X, et al. Effects of anti-ethylene treatments on browning and energy metabolism of harvested litchi fruit[J]. Australian Journal of Experimental Agriculture, 2006, 46(8): 1085-1090.
[9] Meng X, Li B, Liu J, et al. Physiological responses and quality attributes of table grape fruit to chitosan preharvest spray and postharvest coating during storage[J]. Food Chemistry, 2008, 106(2): 501-508.
[10] Wu Z M, Yuan X Z, Li H, et al. Heat acclimation reduces postharvest loss of table grapes during cold storage-analysis of possible mechanisms involved through a proteomic approach[J]. Postharvest Biology and Technology, 2015, 105(7): 26-33.
[11] 赵颖颖,陈京京,金鹏,等. 低温预贮对冷藏桃果实冷害及能量水平的影响[J]. 食品科学,2012,33(4):276-281. Zhao Yingying, Chen Jingjing, Jin Peng, et al. Effect of low temperature conditioning on chilling injury and energy status in cold-stored peach fruit[J]. Food Science, 2012, 33(4): 276-281. (in Chinese with English abstract)
[12] Liu H, Song L L, You Y L, et al. Cold storage duration affects litchi fruit quality, membrane permeability, enzyme activities and energy charge during shelf time at ambient temperature [J]. Postharvest Biology and Technology, 2011, 60(1): 24-30.
[13] Liu H, Jiang Y M, Luo Y B, et al. A simple and rapid determination of ATP, ADP and AMP concentrations in pericarp tissue of litchi fruit by high performance liquid chromatography[J]. Food Technol Biotechnol, 2006, 44(4): 531-534.
[14] Duan X W, Liu T, Zhang D D,et al. Effect of pure oxygen atmosphere on antioxidant enzyme and antioxidant activity of harvested litchi fruit during storage[J]. Food Research International, 2011, 44(7): 1905-1911.
[15] 李桂峰,刘兴华. 可食涂膜处理对红地球葡萄成熟衰老和果肉褐变的影响[J]. 河北农业大学学报,2006,29(2):34-37. Li Guifeng, Liu Xinghua. Effects of edible coating on browning and senescence of Red-globe grape[J]. Journal of Agricultural University of HeBei, 2006, 29(2): 34-37. (in Chinese with English abstract)
[16] 张昆明,张平,李志文,等. 葡萄贮藏期间果肉质地参数变化规律的TPA表征[J]. 食品与生物技术学报,2011,30(3):353-358. Zhang Kunming, Zhang Ping, Li Zhiwen, et al. Study on the variation of grape berry texture properties during storage by texture profile analysis[J]. Journal of Food Science and Biotechnology, 2011, 30(3): 353-358. (in Chinese with English abstract)
[17] Wakabayashi K. Changes in cell wall polysaccharides during fruit ripening[J]. Journal of Plant Research, 2000, 113(3): 231-237.
[18] 梁丽雅,郝利平,闫师杰. 保鲜剂对红地球和巨峰葡萄呼吸强度和贮藏品质的影响[J]. 农业工程学报,2003,19(4):205-208. Liang Liya, Hao Liping, Yan Shijie. Effects of freshness keeping agent on respiratory intensity and storage quality of Red Globe, Kyoho grape[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2003, 19(4): 205-208. (in Chinese with English abstract)
[19] 李志强,刘春泉,李大婧,等. 脂氧合酶在果实后熟衰老中的功能进展[J]. 江西农业学报,2009,21(7):123-126. Li Zhiqiang, Liu Chunquan, Li Dajin, et al. Research on function of lipoxygenase in fruit ripening[J]. Acta Agriculturae Jiangxi, 2009, 21(7): 123-126. (in Chinese with English abstract)
[20] 李方远. 葡萄贮藏过程中几个生理参数动态变化研究[J].商丘师范学院学报,2001,17(4):97-99. Li Fangyuan. Study on the dynamic changes of a few physiological parameter during the preservation of grapes[J]. Journal of Shangqiu Teachers College, 2001, 17(4): 97-99. (in Chinese with English abstract)
[21] 祝美云,白欢,梁丽松,等. 冷锻炼处理减轻低温贮藏桃果实冷害的能量代谢机理[J]. 农业工程学报,2012,28(23):257-264. Zhu Meiyun, Bai Huan, Liang Lisong,et al. Mechanism of energy metabolism on cold acclimation treatment for alleviating chilling injury of peach fruit during low temperature storage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(23): 257-264. (in Chinese with English abstract)
Effects of coating and heat treatments on energy levels and physiological indexes and qualities of grape fruits during storage
Zhang Qun1,2, Zhou Wenhua1※, Tan Huan2, Yang Mingzhi3, Liu Xixia4
(1. Food Science and Engineering, Central South University of Forestry Science and Technology, Changsha, 410004, China; 2. Hunan Agricultural Sciences Academy of Agricultural Products Processing Institute, Changsha, 410125, China; 3. Changsha County First Senior High School in Hunan Province, Changsha, 410125, China; 4. Key Laboratory of Wild Plant Resources in Hubei Province, Huangshi, 435002, China)
Harvested grape fruit tissues are still alive. Grape fruit tissues still have metabolism including physiological and biochemical reactions. They are prone to physiological deterioration, such as texture softening, browning, decay and mildew. More and more studies have indicated that senescence and cell membrane permeability of horticultural crops may be related to energy deficit caused by the decline of energy synthesis. Changes of energy levels in grape fruit tissues during storage have not been reported. Effects of energy level on physiological quality of grape fruit tissues after coating and heat treatment with Ca2+are not clear. In this paper, the effects of coating and heat treatments with Ca2+on post-harvest energy levels and physiological deterioration of “Victoria” grape fruit during cold storage were explored through determining energy levels and physiological indices. Coating and heat treatments with Ca2+were applied to post-harvest grape fruits (compared with untreated grape fruits, i.e. the CK treatment). Grape fruits after coating and heat treatments with Ca2+were stored at (4±0.5) ℃. Respiratory rate, browning index, decay rate, hardness, contents of malondialdehyde (MDA), adenosine triphosphate (ATP), adenosine diphosphate (ADP) and adenosine monophosphate (AMP), energy charge (EC), and enzyme activities of polyphenol oxidase (PPO), peroxidase (POD), lipoxygenase (LOX) and soperoxide dismutase (SOD) of grape fruits were tested every 10 days. Results showed that with the extension of storage time, energy levels were in a loss state for grape fruit tissue under the CK. Respiratory rate decreased, but cell membrane oxidation and permeability increased. Browning index and decay rate increased, and enzyme activities of POD, PPO and LOX increased too, but enzyme activities of SOD were decreased. Physiological qualities of grape fruits decreased, and fruits were softened. Calcium combined with heat and coating treatment reduced the loss of grape fruits by rotting during storage. In addition, treatment of heat and coating with Ca2+could maintain higher energy status, energy charge, hardness and enzyme activities of SOD to keep qualities of grape fruit, delay grape fruit softening, inhibit respiratory intensity and accumulation of membrane lipid peroxidation, slow down growth of cell membrane permeability, decrease MDA content, inhibit enzyme activities of POD, PPO and LOX, and delay browning and rotting, aging process and physiological quality deterioration of grape fruits. But coating treatment was better than heat treatment. ATP was significantly positive correlation with hardness and SOD enzyme activity (r=0.938,0.930, P<0.01), but negative correlation with MDA membrane permeability and LOX enzyme activity (r=-0.896,-0.932,-0.940, P<0.01). EC was negative correlation with membrane permeability and LOX enzyme activity (P<0.05), but positive correlation with respiration intensity and SOD enzyme activity (P<0.05). Browning of grape fruits was closely related to membrane lipid peroxidation and membrane structure (the integrity of membrane structure was destroyed). PPO and POD were reacted with phenolic substrates to form brown pigment. Results showed that with the extension of storage time, energy levels of grape fruits were in a loss state. Fall of energy level significantly affected oxidation and integrity of cell membrane. Coating and heat treatments with Ca2+could maintain higher energy levels of ATP and ADP, and EC, which could slow down aging and physiological quality deterioration of grape fruit tissues. Coating and heat treatments with Ca2+may maintain high energy status and physiological qualities, and slow down aging and physiological quality deterioration of grape fruits tissues. Effects of coating treatment with Ca2+were better than heat treatment with Ca2+. Slowing down physiological deterioration of grape fruits can be realized by maintaining high energy status and preventing development of physiological deterioration.
storage; enzymes; quality control; grape fruit; energy levels; coating treatment; heat treatment; physiological index
10.11975/j.issn.1002-6819.2016.09.036
S662.1
A
1002-6819(2016)-09-0255-09
张 群,周文化,谭 欢,杨明之,刘细霞. 涂膜和热处理对葡萄能量和贮藏生理及品质的影响[J]. 农业工程学报,2016,32(9):255-263.
10.11975/j.issn.1002-6819.2016.09.036 http://www.tcsae.org
Zhang Qun, Zhou Wenhua, Tan Huan, Yang Mingzhi, Liu Xixia. Effects of coating and heat treatments on energy levels and physiological indexes and qualities of grape fruits during storage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2016, 32(9): 255-263. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2016.09.036 http://www.tcsae.org
2015-12-29
2016-03-24
湖南省重点科技专项(No.2015NK3027),名称为《鲜食型提子葡萄品质劣变机理及其调控的研究》。
张 群,女,湖南常德人,博士生,湖南省农业科学院农产品加工研究所研究员,主要从事果蔬贮藏与加工的科研工作。长沙 中南林业科技大学食品学院,410004。Email:zqun208@163.com.
※通信作者:周文化,男,湖南常德人,中南林业科技大学食品学院教授,博士,博士生导师,主要从事农产品加工与贮藏的科研和教学工作。长沙 中南林业科技大学食品学院,410004。Email:13786129879@126.com.
