基于CYB5A基因的广东小耳花猪群体遗传背景检测
2016-12-19曾检华何祖勇陈瑶生刘小红
王 晨,曾检华,秦 珂,何祖勇,陈瑶生,刘小红
(1.中山大学生命科学学院/有害生物控制与资源利用国家重点实验室,广东 广州 510006;2.广东壹号食品股份有限公司,广东 广州 510620)
基于CYB5A基因的广东小耳花猪群体遗传背景检测
王 晨1,曾检华2,秦 珂1,何祖勇1,陈瑶生1,刘小红1
(1.中山大学生命科学学院/有害生物控制与资源利用国家重点实验室,广东 广州 510006;2.广东壹号食品股份有限公司,广东 广州 510620)
广东小耳花猪是广东省饲养量最大的地方猪品种,农户自繁自养过程中可能混入外来猪种血缘,实际生产中主要通过表型进行评估和选育。CYB5A基因启动子中的突变位点可以鉴定中外猪种遗传背景,因此可通过分子方法检测广东小耳花猪群体中是否混有外来猪种血缘。采用PCR扩增CYB5A基因启动子并进行单向直接测序,将得到的基因序列进行对比以鉴定变异位点。结果显示,32头种猪和36头后备母猪中均有1头为杂合子AB型,A等位基因频率分别为0.0152和0.0139,其余种猪和后备母猪均为中国猪种纯合子BB型。经卡方检验,种猪和后备母猪群体在检测位点上处于Hardy-Weinberg平衡状态(P>0.05),表明外来猪种该位点在广东小耳花猪群体内没有受到人工选择。该AB型种母猪毛色表型正常,与纯种广东小耳花猪BB型公猪配种生出6头毛色异常仔猪,其中2头为杂合子AB型。该种母猪与杜洛克公猪配种后生出红毛仔猪,该杂交后代的表型也验证其混有外来猪血缘,表明分子鉴定的准确性。研究结果表明,广东小耳花猪群体的血统基本纯正,只有极少数个体混有外来猪种血缘,通过表型选择与分子辅助育种相结合的方法可以准确、快速地提纯该地方品种。
广东小耳花猪;CYB5A基因;外来猪种;检测
我国是世界猪肉生产与消费大国,拥有丰富的猪品种资源(共125个),约占世界猪品种总数的1/3,其中地方品种88个[1]。广东小耳花猪是广东省饲养量最大的地方猪种之一,主产于广东西江以南及粤西一带。该猪品种的头型和体型均较小,具有头短、耳短、颈短、身短、脚短和尾短的“六短”特征,被毛表现为黑白花,除了头、耳、背、腰、臀部为黑色外,其余均为白色。广东小耳花猪能适应高温多湿的环境、耐粗饲、早熟易肥、皮薄肉嫩、肉味鲜美、母性温顺、繁殖力强,属于典型的华南型猪种。近年来,随着生活水平的提高,人们对猪肉品质的要求越来越高,使得地方优质种质资源得到越来越多的重视和开发利用。
微粒体细胞色素b5A(Cytochrome b5A,CYB5A)是微粒体细胞色素b5(Cytochrome b5,CYB5)的组成成员。CYB5在动植物中普遍存在,是一种重要的电子转移血红素蛋白。在猪上,CYB5A基因在雄烯酮合成上起着重要作用[2],公猪的膻味主要是由于粪臭素和雄甾烯酮引起的,因此CYB5A基因的高表达量可能与公猪肉质的膻味有关[3]。研究表明,由于中国地方猪易早熟的特性,使得猪体内的膻味积累水平比欧洲猪种高[4]。众多研究发现,CYB5A基因的编码区不存在遗传变异,而在ATG起始密码子上游8 bp处存在一个G>T的SNP,并表明该SNP与脂肪雄甾烯酮水平相关[5],造成雄甾烯酮积累[6]。Bai等[7]发现在CYB5A基因起始密码子的上游共有3个SNP 位点(-660 bp、-380 bp 和-69 bp),改变了转录因子与其结合的能力。同时,研究还发现欧洲猪种主要是单倍型A,在-660 bp、-380 bp、-69 bp 处碱基分别为G、T、C,而中国猪种主要是单倍型B,各变异位点分别为单碱基缺失、C、T。因此,该3个位点可以用来鉴定中国猪种和外来猪种不同的遗传背景[8]。
地方猪遗传资源是培育新品种、新品系以及保护生物多样性的重要基础,是养猪业今后可持续发展的重要保障。近30年来,由于大量引进外来猪种,几乎导致了每个地方猪品种的数量急剧减少甚至消失,外来猪种与地方品种杂交乱配,造成一些品种的部分群体遗传资源混杂。地方猪保种场内的种猪均来自于农户的自繁自养,毛色表型是评估广东小耳花猪血统是否纯正的重要指标之一。在实际生产中,广东小耳花猪群体中偶尔会出现毛色异常个体,通常采取表型剔除方式进行品种提纯和保护。本试验对广东小耳花猪种猪CYB5A基因启动子的突变位点进行检测,在分子水平鉴定该品种的遗传背景中是否混有外来猪种血缘,从而了解其群体资源的保护现状,为今后该品种的保护与利用提供理论参考。
1 材料与方法
1.1 试验材料
广东小耳花猪耳组织样品采自广东壹号食品股份有限公司湛江猪场,其中采集了成年种猪32头、后备母猪36头、同一窝全同胞仔猪6头,74份耳组织样品用剪耳钳采集后,用PBS溶液清洗干净,保存在75%乙醇中,放置于-80℃冰箱中备用。
试验主要试剂:2×Taq PCR StarMix(包含Taq DNA 聚合酶、dNTP、PCR buffer)购自GenStar公司,DNA Marker DS 2000购自广州东盛生物科技有限公司,Gelview型核酸染料购自北京百泰克生物技术有限公司。
1.2 试验方法
1.2.1 基因组DNA的提取及检测 采用SDS法提取基因组DNA,提取的DNA用1%琼脂糖凝胶电泳和紫外分光光度计检测DNA的浓度和纯度,最终稀释成100 ng/μL,放置于-20℃下保存备用。
1.2.2 引物设计与PCR扩增 参照Bai等[7]设计的引物(CYB5-F:5'AAGGAG GAGGTAAGCAATG3',CYB5-R:5'GAGATG AGCGGAACAGAGT3')对CYB5A基因的启动子区域进行PCR扩增(预期产物长度为917 bp),引物由生工生物工程(广州)股份有限公司合成。PCR扩增采用2×Taq PCR StarMix,反应体系总体积为50 μL。反应程序为94℃ 3 min;94℃ 30 s、65℃ 30 s、72℃ 2 min,33个循环;72℃ 5 min。PCR产物用1.7%的琼脂糖凝胶进行电泳检测,在凝胶成像系统下观察并拍照。
1.2.3 序列分析 PCR产物经检测后送到广州艾基生物技术有限公司进行纯化和测序。使用Chromas 2.22软件对测序结果进行校正,再使用MAGE 5.05软件进行序列比对,检测遗传变异位点。
1.2.4 数据分析 统计广东小耳花猪群体的基因型分布和等位基因频率,采用卡方检验进行各群体内Hardy-Weinberg平衡适合性检验。
2 结果与分析
2.1 PCR扩增产物检测
对74份广东小耳花猪DNA样品进行PCR扩增CYB5A基因的启动子序列,PCR产物用1.7%琼脂糖凝胶进行电泳检测,结果(图1)显示,PCR产物为特异性单一条带,片段大小为917 bp,符合预期大小。
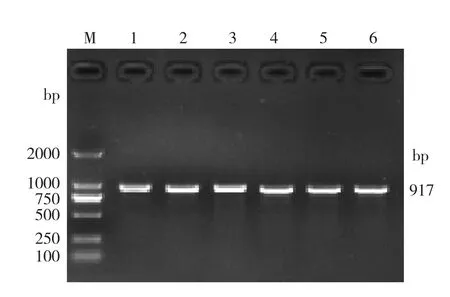
图1 CYB5A基因启动子PCR产物琼脂糖凝胶电泳结果
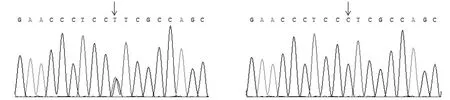
图2 -380 bp处C>T突变
2.2 测序结果分析
由于CYB5A启动子区域中的3个SNP 位点(-660 bp、-380 bp 和-69 bp)在同一个个体中均相同,存在明显的连锁情况[8],因此本试验仅使用反向引物CYB5-R进行单向测序。但-69 bp处T>C靠近反向引物而无法检测,测序结果可以鉴定-380 bp处C>T突变和-660 bp处单碱基缺失>G突变。运用软件Chromas 2.22分析测序结果,发现有1头种母猪、1头后备母猪以及2头仔猪在380 bp(图2)和-660 bp(图3)处分别出现一个双峰和连续双峰,表明在380 bp处存在单碱基突变,而在-660 bp处存在插入/缺失。采用外来猪种约克夏猪的序列(GenBank登录号:KM067157.1)作为参考序列,利用序列比对软件Mega 5.05将参考序列与74个个体测得的序列进行比对。结果显示,在32头成年猪和36头后备母猪中各有1头母猪为杂合子AB型,A等位基因频率分别为0.0152和0.0139,其余均为中国猪种纯合子BB类型。6头仔猪为杂合子AB型种母猪的全同胞后代,其中有2头为杂合子AB型,其余均为中国猪种纯合子BB类型(表1)。经卡方检验,种猪、后备母猪以及仔猪在这两个位点上处于Hardy-Weinberg平衡状态(P>0.05)。
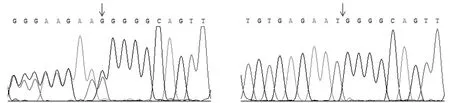
图3 -660 bp处单碱基缺失>G突变

表1 广东小耳花猪CYB5A基因型检测结果
2.3 杂交结果分析
杂合子AB型的种母猪表型为正常广东小耳花猪毛色(图4A,封三),与BB型的广东小耳花猪种公猪交配后,生出20头仔猪,其中6头仔猪毛色异常,呈现无规律的大小不一的黑色斑点(图4B,封三),而非一整块黑色,即非典型广东小耳花猪毛色表型。对6头毛色异常仔猪检测,结果发现AB型有2头,其余均为BB型。正常情况下,纯种广东小耳花猪母猪与杜洛克公猪杂交,后代均为全黑色个体或者部分白脚的毛色表型(图4D,封三)。然而,该杂合子AB型种母猪与杜洛克公猪进行杂交后,后代中出现了类似杜洛克的红色毛发个体(图4C,封三),两个组合后代表型均表明该种母猪确实混有外来猪的血缘。
3 讨论
广东小耳花猪是优良的地方猪种,肉质鲜美,但生长速度缓慢,日增重仅为260 g,瘦肉率为30.97%。实际生产中,通常将广东小耳花猪作为母本,与杜洛克、长白猪进行经济杂交生产杜×长×小耳花猪,商品猪既保留了母本皮薄肉嫩的特点,而且提高了日增重和瘦肉率[9]。因此,在利用广东小耳花猪作为母本进行开发利用时,部分个体可能会导入外来猪种血缘,使得其品种资源混杂。Bai等[7]检测了11种国内地方猪的CYB5A基因的启动子,其中属于华南型的蓝塘猪和五指山猪、属于华中型的上高猪、属于江海型的嘉兴黑猪以及浙江和江西地区的野猪全部均为BB型。然而,属于华北型的民猪、汉江猪、里岔黑猪,属于江海型的金华猪,属于高原型的藏猪,属于西南型的黔北黑猪和内江猪以及东北野猪均检测出一定基因频率的A单倍型,其中里岔黑猪A单倍型频率最高,这与其品种形成过程中掺入外来猪种有关。外来猪种主要是欧洲猪种,其驯化与中国地方猪种是相互独立的过程[10]。Ai等[11]通过全基因组重测序发现中国地方猪为适应南北方温度,导致北方猪种基因组中很多位点与欧洲猪种相同,而与南方猪种之间存在差异。因此,广东小耳花猪作为华南型猪种,其CYB5A基因的启动子基因型应该为BB型。本试验利用CYB5A基因进行检测广东小耳花猪种猪群体及其部分后代,仅发现2头母猪为杂合子AB型以及2头仔猪是杂合子AB型。经卡方检验,这两个位点在种猪和后备母猪群体中处于Hardy-Weinberg平衡状态(P>0.05),表明外来猪种血缘没有受到人工选择。通过分子检测,可以直接剔除该杂合个体进行品种提纯。
猪的毛色有多种类型,包括野猪色、全黑色、全白色、全红色、两头乌、乌云盖雪、六白和黑白花猪等。研究表明,影响猪毛色的基因主要有黑素皮质素受体1(melanocortin receptor 1 gene,MC1R)[12]、酪氨酸酶相关蛋白1(Tyrosinase-related protein 1,TYRP1)[13]、v-kit猫科肉瘤病毒转化基因(v-kit Hardy-Zuckerman 4 feline sarcoma viral oncogene homolog,KIT)[14]、刺鼠信号蛋白(agouti signaling protein,ASIP)[15]和内皮素受体B基因(endothelin receptor B gene,DNRB)[16]等。本次检测的杂合子AB型广东小耳花猪母猪毛色表型正常,分别与广东小耳花猪公猪和杜洛克公猪交配后,两次生产的仔猪均出现毛色异常的个体,同窝内出现毛色分离现象,验证该母猪的血统不纯。CYB5A基因位于1号染色体上,而很多毛色相关基因位于其他染色体上,渗入的外来猪基因在广东小耳花猪群体中会发生染色体自由重组与分离。因此,单一对CYB5A基因启动子中的突变位点进行检测,仅能鉴定出中外猪品种的遗传背景,而无法判断杂合AB型个体中混有外来猪种的毛色基因。探究本试验中仔猪出现了毛色分离现象,还需要进一步对多个毛色基因位点分析,才能判断杂种母猪中混有的外来猪种毛色基因。
本研究结果表明广东小耳花猪群体的血统基本纯正,只有极少数个体混有外来猪种血缘,通过表型选择与分子辅助育种相结合的方法可以准确、快速地进行品种提纯,为广东小耳花猪群体以及其他地方猪种保护提供科学的理论依据,防止地方品种中潜在优良基因资源的流失。
[1]国家畜禽遗传资源委员会. 中国畜禽遗传资源志·猪志[M]. 北京:中国农业出版社,2011.
[2]Davis S M,Squires E J. Association of cytochrome b5 with 16-androstene steroid synthesis in the testis and accumulation in the fat of male pigs[J]. Journal of Animal Science,1999,77(5):1230-1235.
[3]Leung M C,Bowley K L,Squires E J. Examination of testicular gene expression patterns in Yorkshire pigs with high and low levels of boar taint[J]. Animal Biotechnology,2010,21(2):77-87.
[4]Xue J. Highly prolific swine breeds of China[J]. World Review Animal Production,1991,26(3):53-56.
[5]Lin Z,Lou Y,Peacock J,et al. A novel polymorphism in the 5′ untranslated region of the porcine cytochrome b5(CYB5) gene is associated with decreased fat androstenone level[J]. Mammalian Genome Official Journal of the International Mammalian Genome Society,2005,16(5):367-373.
[6]Peacock J,Lou Y,Lundström K,et al. The effect of a c.-8G>T polymorphism on the expression of cytochrome b5A,and boar taint in pigs[J]. Animal Genetics,2008,39(1):15-21.
[7]Bai Y,Zhang J B,Xue Y,et al. Differential expression of CYB5A,in Chinese and European pig breeds due to genetic variations in the promoter region[J]. Animal Genetics,2015,46(1):16–22.
[8]方美英,白莹,陈刚,等. 一种鉴定中外猪种的方法[P]. 北京:CN102816837A,2012-12-12.
[9]谢水华,曾铨品. 广东小耳花猪生产性能与杂交效果的研究[J]. 养猪,2015(6):63-64.
[10]Larson G,Dobney K,Albarella U,et al. Worldwide phylogeography of wild boar reveals multiple centers of pig domestication[J]. Science,2005,307(5715):1618-1621.
[11]Ai H,Fang X,Yang B,et al. Adaptation and possible ancient interspecies introgression in pigs identified by whole-genome sequencing.[J]. Nature Genetics,2015,47(3):217-225.
[12]Liu R,Jin L,Long K,et al. Detection of genetic diversity and selection at the coding region of the melanocortin receptor 1 gene(MC1R)in Tibetan pigs and landrace pigs[J]. Gene,2016,575(2 Pt 2):537-542.
[13]Wu X,Yi Z,Shen L,et al. A 6-bp deletion in exon 8 and two mutations in introns of TYRP1,are associated with blond coat color in Liangshan pigs[J]. Gene,2015,578(1):132–136.
[14]Fontanesi L,D'Alessandro E,Scotti E,et al. Genetic heterogeneity and selection signature at the KIT gene in pigs showing different coat colours and patterns[J]. Animal Genetics,2010,41(5):478-492.
[15]Mao H R,Ren J,Ding N S,et al. Genetic variation within coat color genes of MC1R,and ASIP,in Chinese brownish red Tibetan pigs[J]. Animal Science Journal,2010,81(6):630–634.
[16]Lü M D,Han X M,Ma Y F,et al. Genetic variations associated with six-white-point coat pigmentation in Diannan small-ear pigs[J]. Scientific Reports,2016,6:27534.
(责任编辑 崔建勋)
Detection of genetic background of Guangdong Small-ear Spotted pig population by CYB5A gene
WANG Chen1,ZENG Jian-hua2,QIN-Ke1,HE Zu-yong1,CHEN Yao-sheng1,LIU Xiao-hong1
(1. School of Life Sciences,Sun Yat-sen University/State Key Laboratory of Biocontrol and Resources Utlization,Guangzhou 510006,China;2. Guangdong YIHAO Food Co.,Ltd.,Guangzhou 510620,China)
Guangdong Small-ear Spotted pig is the largest local pig breed raised in Guangdong province. This pig breed can be mixed with genes from exotic pigs during the rearing process by famers,and it is usually evaluated and bred through phenotype in actual production. Mutations in CYB5A gene promoter region could be applied in identifing different genetic backgrounds of Chinese and exotic pig breeds,so we detected Guangdong Small-ear Spotted pig population by molecular method to identify whether this breed was mixed with exotic pig breeds. CYB5A gene was amplified by PCR method and sequenced only by one direction,then the DNA sequences were analyzed to identify the mutations. The results showed that both 32 breeding pigs and 36 gilts had one heterozygotes of ABgenotype respectively and A allele frequency was 0.0152 and 0.0139,the remaining pigs were Chinese pig breed type of BB genotype. The 32 breeding pigs and 36 gilts were under Hardy-Weinberg equilibrium(P>0.05) by Chi-Square tests,it indicated that the mutations from exotic pig breeds were not under human selection in Guangdong Small-ear Spotted pig population. The heterozygous sow had normal phenotype,it was mated with a pure Guangdong Small-ear Spotted boar and produced six abnormal colour pattern piglets,and two of them were heterozygotes of AB genotype by the detection. The heterozygous sows were also mated with a pure duroc boar and produced red coat piglets,which also validated that the sow was heterozygous and the molecular method was accurate. The results demonstrated that most of the Guangdong Small-ear Spotted pigs were purebreed,only a few individuals had been introgressed from exotic pig breeds. Combined phenotype selection with molecular-assisted selection methods,the local pig breed could be purified quickly and accurately.
Guangdong Small-ear Spotted pig;CYB5A gene;exotic pig breed;detection
S813;Q346+.5
A
1004-874X(2016)11-0122-05
2016-08-17
国家科技基础性工作专项(2014FY120800);广东省科技计划项目(2014B020202001);广东省扬帆计划(2014YT02H042)
王晨(1988-),男,在读博士生,E-mail: chenwangias@gmail.com
刘小红(1970-),男,博士,研究员,E-mail:liuxh8@mail.sysu.edu.cn
王晨,曾检华,秦珂,等. 基于CYB5A基因的广东小耳花猪群体遗传背景检测[J].广东农业科学,2016,43(11):122-126.
