苜蓿高频再生组织培养体系的优化
2016-12-19张喜斌麻冬梅
秦 楚,李 昱,张喜斌,麻冬梅,许 兴
(1.宁夏大学生命科学学院,宁夏 银川 750021;2.宁夏农业综合开发办公室,宁夏 银川 750021;3.宁夏大学农学院,宁夏 银川 750021)
苜蓿高频再生组织培养体系的优化
秦 楚1,李 昱2,张喜斌1,麻冬梅3,许 兴3
(1.宁夏大学生命科学学院,宁夏 银川 750021;2.宁夏农业综合开发办公室,宁夏 银川 750021;3.宁夏大学农学院,宁夏 银川 750021)
以3个品种紫花苜蓿7日龄无菌苗的下胚轴为外植体,以MS培养基为基础培养基,研究不同浓度激素配比对紫花苜蓿离体再生体系中愈伤组织的形成、不定芽诱导以及生根的影响。结果表明:金皇后、甘农1号、阿尔冈金愈伤组织诱导的最佳培养基分别为MS+2,4-D 2.5 mg/L+6-BA 0.5 mg/L、MS+2,4-D 2.0 mg/L+NAA 1.0 mg/L、MS+2,4-D 3.0 mg/L+KT 1.0 mg/L;不定芽诱导的最佳培养基分别为MS+6-BA 2.0 mg/L+CH 0.5 g/L、MS+NAA 0.3 mg/L+KT 0.5 mg/L、MS+KT 1.2 mg/L;最佳生根培养基为1/2MS+IBA 1.0 mg/L。
苜蓿;激素;愈伤组织;再生体系
苜蓿(Medicaho sativa L.)是世界上分布最广的一种豆科牧草[1],享有“牧草之王”的美誉[2],其本身具有一定的耐盐能力,可在低浓度的盐碱地中良好生长[3]。苜蓿不仅抗逆性强、适应范围广,还能为土壤提供大量有机质,改良土壤酸碱度。近年来,随着我国土壤盐碱化程度的加剧,迫切需要培育出抗逆性苜蓿品种[4]。由于传统育种手段见效缓慢,而通过转基因技术可更加快速有效地获得目标品种。为了提高转基因效率,建立最佳的植物再生体系尤为重要,早在1972年,Saunder等就从未成熟的苜蓿花药、子房、子叶愈伤组织分化再生苜蓿植株获得成功,标志着苜蓿组织培养研究的开始,自此大量苜蓿组织培养方面的研究得以开展[5-9]。然而,紫花苜蓿作为遗传转化的受体,存在转化效率低、分化率低、生根困难和再生周期长等缺点,因此,本试验通过研究不同激素的配比继而有效提高苜蓿的再生组织培养体系,以期为苜蓿的遗传转化研究工作奠定基础。
1 材料与方法
1.1 试验材料
试验于2015年在宁夏大学科技楼实验室进行,供试苜蓿品种为中国草业公司提供的金皇后、甘农1号、阿尔冈金。
1.2 试验方法
1.2.1 种子消毒 挑选健康饱满的苜蓿种子,置于100 mL锥形瓶中,用流水冲洗4~5次,去除漂浮于水面上的种子和杂质,移至超净工作台中。
1.2.2 无菌苗培养 先用75%酒精振荡灭菌30 s,用灭菌的蒸馏水冲洗3次;再用0.1%HgCl2振荡灭菌8 min后,蒸馏水冲洗4~5次;最后将处理后的苜蓿种子接种于MS培养基(附加琼脂8 g/L、蔗糖20 g/L,121℃下高压灭菌20 min,下同)上。培养条件为:温度25℃,光照强度3 000~4 000 lx,光照12 h/d,连续光照7 d。
1.2.3 愈伤组织诱导 切取种子萌发培养基上生长7 d的无菌苗下胚轴(3~5 mm)为外植体,接种至分别添加不同浓度激素配比2,4-D、6-BA、NAA的MS培养基中(表1~表2),每个处理3次重复,每个重复接种25个外植体,置于25℃黑暗培养。形成愈伤组织后20 d统计愈伤组织诱导率,诱导率(%)=诱导出愈伤组织的外植体数/接种外植体总数×100。
1.2.4 愈伤组织分化 愈伤组织形成后,每隔15 d继代培养1次,愈伤组织继代3次后,挑选组织结构致密的淡黄色愈伤组织,接种至添加不同浓度激素配比的MS培养基(表3~表5)中,每个处理3次重复,每个重复接种20个愈伤组织,每隔15 d继代培养1次。培养条件为:温度25℃,光照强度3 000~4 000 lx,光照12 h/d。形成分化的小苗,60 d后统计分化率,分化率(%)=分化出芽的愈伤组织个数/接种愈伤组织总数×100。
1.2.5 生根培养 将出现1 cm左右不定芽的愈伤组织接种至添加不同浓度IBA(0、0.25、0.5、0.75、1.0 mg/L)的1/2MS培养基(大量元素是MS培养基的50%,微量、维生素、铁盐含量保持不变,pH为5.8~6.2)中。培养条件为25℃、光照强度3 000~4 000 lx、光照12 h/d。培养约4周,发育成正常的植株。
1.2.6 炼苗移栽 去掉培养瓶的盖子,向培养瓶中加入少量蒸馏水,在室内炼苗72 h,取出培养基中的幼苗,用蒸馏水洗净根部培养基,移栽于混有灭菌的营养土∶蛭石(1∶1)的小花盆中,最初1周盖上保鲜膜,每天通风3~5次,当幼苗长出茎叶时移入大棚。
2 结果与分析
2.1 不同激素配比对苜蓿愈伤组织诱导的影响
在诱导苜蓿愈伤组织过程中,培养基中加入不同浓度激素时,愈伤组织诱导率不同(表1~表2)。当2,4-D浓度逐渐升高时,金皇后和阿尔冈金愈伤组织诱导率呈上升趋势,2,4-D浓度为2.5 mg/L时诱导率最高,说明此浓度是诱导金皇后和阿尔冈金愈伤组织的最适浓度。甘农1号在2,4-D浓度从2.0 mg/L提高至2.5 mg/L时,愈伤组织诱导率降低,说明高浓度抑制了甘农1号愈伤的形成,2.0 mg/L 2,4-D是其最佳的愈伤形成浓度。在相同2,4-D浓度下,随着6-BA浓度的提高,金皇后愈伤组织诱导率大致呈现出先增加后降低的趋势,说明过高浓度的6-BA会对金皇后愈伤的形成起到抑制作用。由表1可知,金皇后愈伤组织最佳诱导培养基为MS+2,4-D2.5 mg/L+6-BA 0.5 mg/L。随着NAA和KT浓度的提高,甘农1号和阿尔冈金愈伤形成率大致呈上升趋势,表2显示,当NAA浓度为1.0 mg/L时,甘农1号愈伤诱导率达最大值,其最佳培养基为MS+2,4-D 2.0 mg/L+NAA 1.0 mg/L;当2,4-D浓度为2.5 mg/L时愈伤形成率均达90%以上,说明低浓度2,4-D不利于阿尔冈金愈伤的形成,其最佳愈伤形成的培养基为MS+2,4-D 2.5 mg/L+KT 1.0 mg/L。三者比较可知,甘农1号在2,4-D与NAA诱导下愈伤形成率较高,均达到80%以上。

表1 不同激素配比对金皇后苜蓿愈伤组织诱导的影响
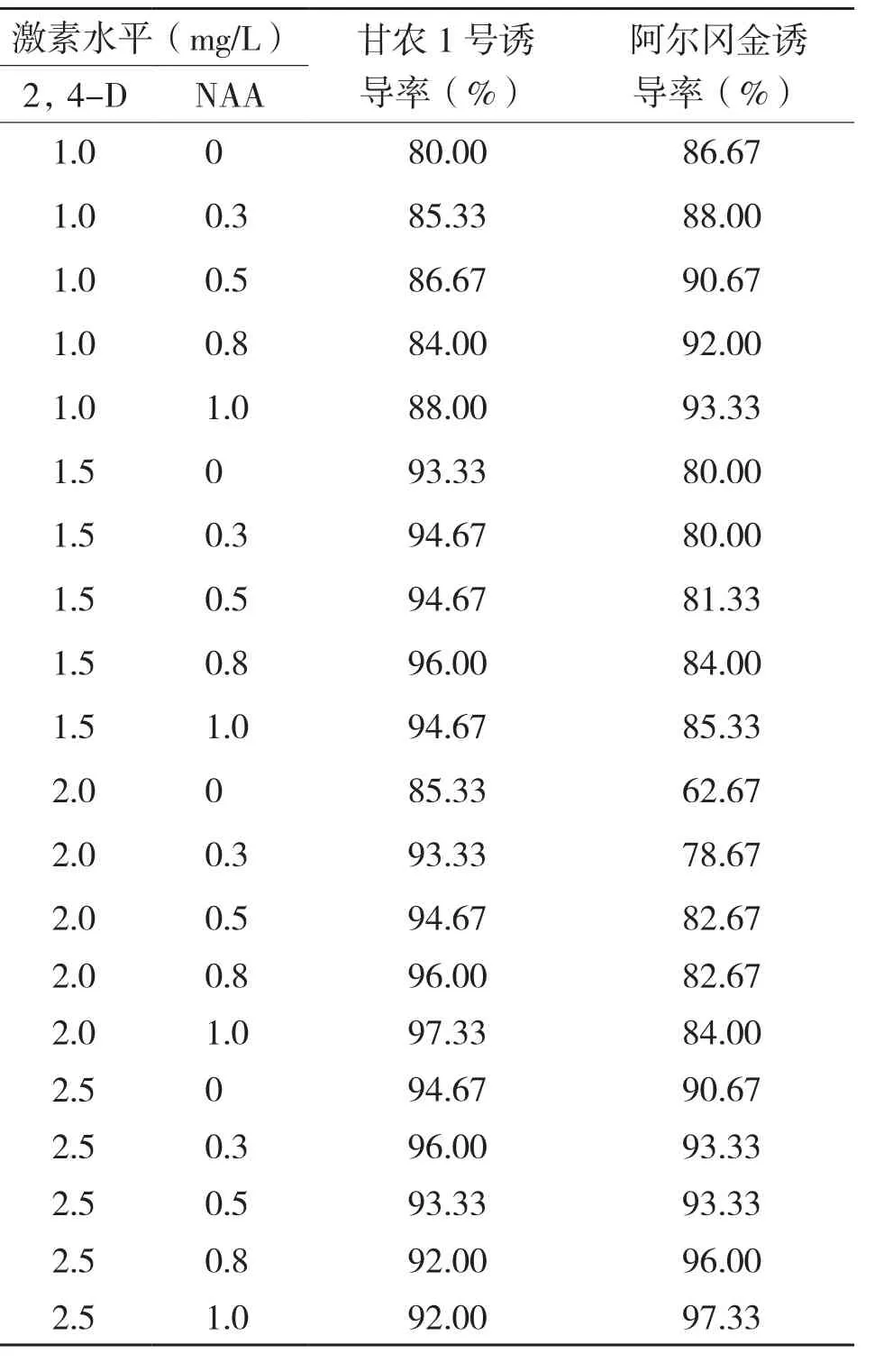
表2 不同激素配比对甘农1号、阿尔冈金苜蓿愈伤组织诱导的影响
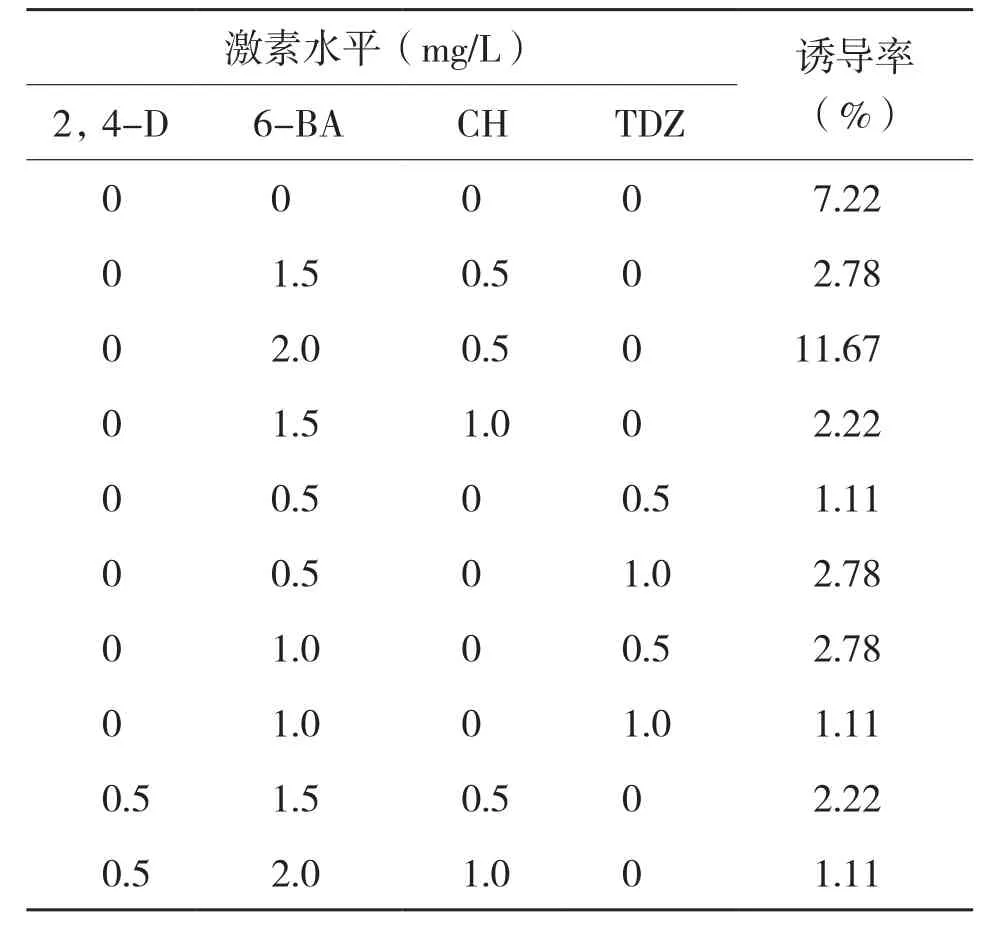
表3 不同激素配比对金皇后苜蓿愈伤组织分化的影响
2.2 不同激素配比对苜蓿愈伤组织分化的影响
分化过程中,愈伤组织会膨大、变绿、出现绿点和长芽,MS培养基中添加不同浓度激素时,愈伤分化率差别较大,通常情况下,愈伤分化率都较低,当用同种激素来筛选时,不同浓度对愈伤组织分化诱导效果的差别也很大。表3显示,当培养基中加入6-BA 2.0 mg/L+CH 0.5 mg/L时,金皇后的诱导率最大达11.67%,而在培养基中不加入任何激素诱导率也较高。由表4可知,甘农1号愈伤分化的诱导率相对高于金皇后,培养基中加入2.0 mg/L 6-BA时诱导率也较高,当培养基中加入NAA 0.3 mg/L+KT 0.5 mg/L时诱导率最高可达13.33%,说明适量配比的生长素和细胞分裂素有助于甘农1号的分化。从表5可以看出,3种苜蓿相比,阿尔冈金愈伤分化诱导率最高、达20%以上,当培养基中加入2.0 mg/L 6-BA或NAA 0.3 mg/L+KT 0.5 mg/L时,阿尔冈金分化率均达10%以上,当加入相同浓度的激素时,若加入0.5 mg/L CH均可提高诱导率。说明适量CH有助于愈伤组织的分化,阿尔冈金的最佳分化诱导培养基为MS+KT 1.2 mg/L+CH 0.5 mg/L。
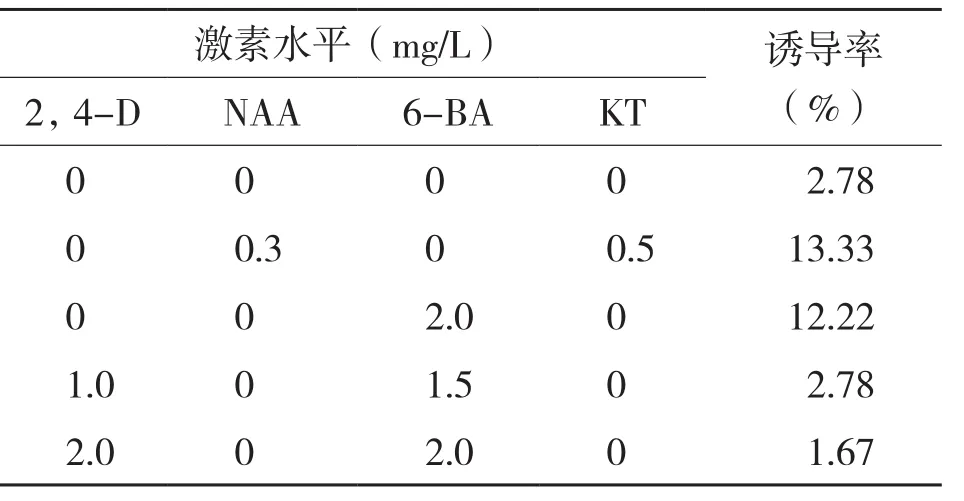
表4 不同激素配比对甘农1号苜蓿愈伤组织分化的影响
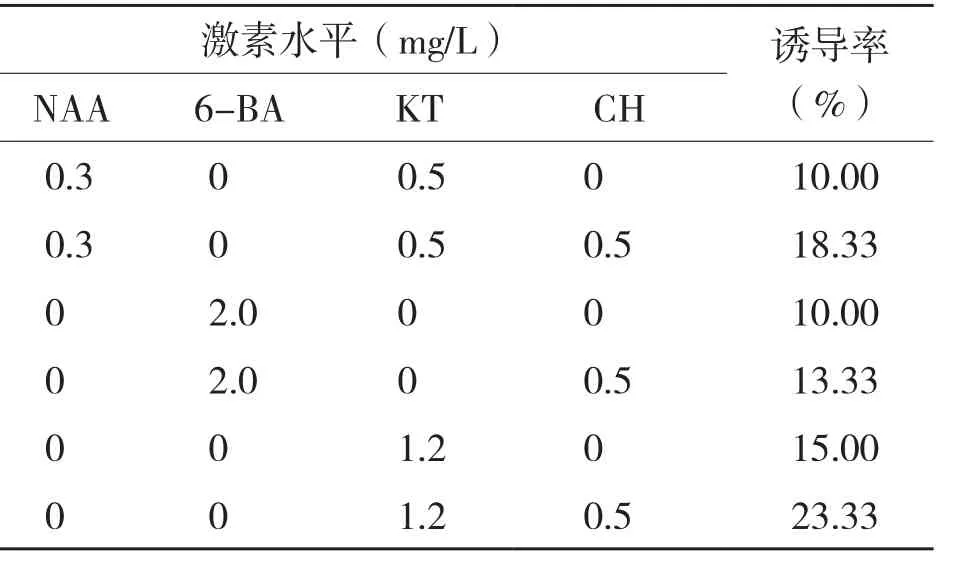
表5 不同激素配比对阿尔冈金苜蓿愈伤组织分化的影响
2.3 不同浓度IBA对苜蓿生根移栽的影响
IBA对不定芽生根有一定的促进作用,在培养基中加入适量IBA有助于苜蓿的生根。由表6可知,在未添加IBA的培养基中,3个品种苜蓿的生根率均较低,随着IBA浓度的增加,3个品种苜蓿的生根率均呈现上升趋势,当IBA浓度为1.0 mg/L时生根率均达到最大。苜蓿的再生体系见图1(封三)。
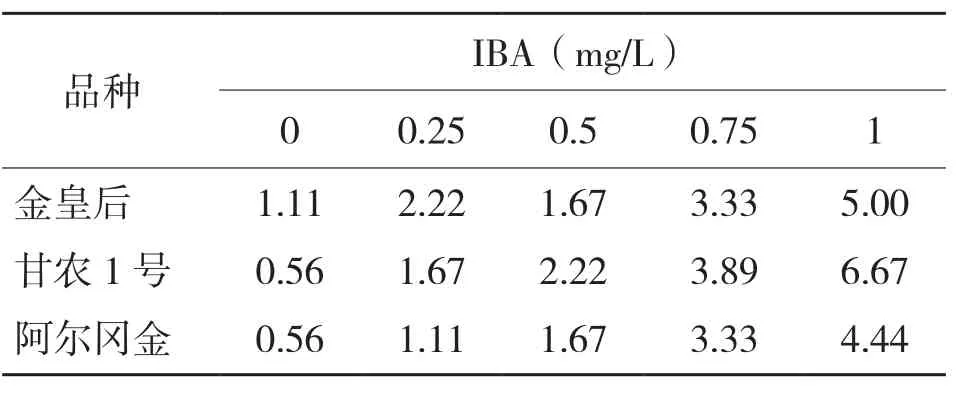
表6 不同浓度IBA对苜蓿生根率(%)的影响
3 结论与讨论
植物的不同基因型和不同外植体均会对愈伤组织的形成产生一定影响[10]。David等[11]、杨广东等[12]研究认为,下胚轴是诱导苜蓿愈伤组织的最佳外植体,因此,本试验采用2,4-D与6-BA、NAA、KT配比对外植体进行愈伤组织的诱导,2,4-D在单独使用或与其他激素配合使用时均能诱导出愈伤组织,李聪等[13]认为诱导苜蓿愈伤组织时,2,4-D是不可缺少的且最适浓度为2 mg/L。本试验也证实当2,4-D浓度达到2 mg/L时,甘农1号的愈伤形成效果较好且比较致密,但在此浓度下金皇后和阿尔冈金的水浸化较严重,不便于下一步进行基因转化试验,适当提高2,4-D浓度可以使愈伤变得更致密,更有利于下一步试验。另外,舒文华等[14]认为高浓度的2,4-D容易使愈伤组织褐化,本试验也表明当2,4-D浓度超过甘农1号愈伤生长的最适浓度达到2.5 mg/L时,甘农1号的愈伤组织诱导率降低且易发生褐化现象。苜蓿再生体系的建立过程中,提高愈伤组织的分化效率是最主要问题。植物的外源激素对愈伤组织不定芽的分化起着重要作用[15-16],不同激素对不同基因型苜蓿产生的影响也略有不同,3个品种苜蓿相比,当培养基中添加2.0 mg/L 6-BA时,阿尔冈金的分化率最高。多数植物组织培养过程中,2,4-D阻碍愈伤组织的分化[17],本试验也显示,当培养基中加入2,4-D后,金皇后的分化诱导率降低;聂王星等[18]研究在培养基中添加适量的6-BA和TDZ对大豆的子叶节丛生芽的诱导有一定促进作用,而在本次试验中,二者的配比并不能提高苜蓿愈伤的分化能力,可能是不同品种植物对激素的响应不同。吕东霞等[19]指出生长素和细胞分裂素结合使用比单一使用更有利于植物愈伤组织的分化,本试验中,当培养基中添加NAA和KT时,甘农1号的分化率最高。李忠光等[20]报道了水解酪蛋白对烟草愈伤组织有促进作用,本试验培养基中添加同种激素,当加入0.5 mg/L的水解酪蛋白时,阿尔冈金的分化率均提高。本研究结果表明,当1/2MS培养基中加入1.0 mg/LIBA时,3个品种苜蓿的生根率均最高,这与葛军[21]的研究结果一致。
苜蓿再生体系存在再生周期长、植株再生率低等问题。一般从外植体诱导愈伤到得到再生植株需要3~5个月,在此过程中,愈伤分化出的绿苗数量较少,还会有出现白化苗现象,虽然本研究通过筛选激素浓度缩短了再生体系建立的时间,但仍存在重复性差、分化率低等问题,希望能够进一步改良再生体系,建立更加高效的遗传转化体系,为转基因工作奠定基础。
[1]从学滋,秦孟根,王书安. 苜蓿总皂甙的提取与分析[J]. 中药通报,1998,13(9):19-20.
[2]黄文惠,刘自学. 概论苜蓿的分布和发展[A].耿华珠. 中国苜蓿[M]. 北京:中国农业出版社,1995.
[3]阎旭东,朱志明,李桂荣,等. 六个苜蓿品种特性分析[J]. 草地学报,2011,9(4):302-306.
[4]黄远新. 南方紫花苜蓿不同外植体离体培养的研究[J]. 中国草地,2003,25(3):42-47.
[5]Saunder J M,Bingham B T. Production of alfalfa plants :from callus tissue [J]. Crop Sci,1972(12):804-808.
[6]王家传,张利莉. GsPPCK1和GsPPCK3基因转化苜蓿及其耐碱性分析[J]. 塔里木大学学报,2014,26(2):20-31
[7]徐博,任伟. 农杆菌介导的朝鲜碱茅PuP5CS基因转化紫花苜蓿的研究[J]. 草业科学,2015,32(6):895-901.
[8]薛晓锋,周岩,陈亚东,等. 超声波辅助农杆菌介导SeNHX1基因转化紫花苜蓿的研究[J]. 中国农学通报,2014(18):264-270.
[9]杨权,王月月,刘炎光,等. 豆子叶节遗传转化体系优化及抗逆基因AtNHX5的转化研究[J].大豆科学,2015(2):205-211.
[10]杨青川. 苜蓿生产与管理指南[M]. 北京:中国林业出版社,2003.
[11]David A,Stuart,Carol M. McCall Induction of somatic embryogenesis using side chain and ring modified forms of phenoxy acid growth regulators[J]. Plant Physiol,1992,99:111-118.
[12]杨广东,朱祯,李燕娥,等. 大白菜高效遗传转化体系的建立[J]. 农业生物技术学报,2002,10(2):127-132.
[13]李聪,熊德邵,耿华珠. 苜蓿愈伤组织再生植株研究[J]. 中国草地,1989(3):51-55.
[14]舒文华,耿华珠,阎伦兴,等. 紫花苜蓿胚轴愈伤组织培养与植株再生[J]. 草业科学,1993,10(3):65-67.
[15]王晓春,师尚礼,梁慧敏,等. 2,4-D和6-BA组合配比对金达苜蓿愈伤组织诱导与分化的影响[J]. 草业学报,2010,18(2):119-222.
[16]张元新. 2,4-D浓度对苜蓿愈伤组织分化和再生的研究[J]. 吉林化工学院学报,2007,24(4):14-16.
[17]崔凯荣,戴若兰. 植物体细胞胚发生的分子生物学[M]. 北京:科学出版社,2000.
[18]聂王星,於丙军. TDZ和6-BA对大豆子叶节再生体系中丛生芽诱导的效应[J]. 南京农业大学学报,2012,35(4):130-134.
[19]吕冬霞,曲长福. 植物生长调节剂对愈伤组织培养的影响[J]. 北方园艺,2004(5):68-72.
[20]李忠光,龚明. 水解酪蛋白对烟草愈伤组织和悬浮培养细胞生长的促进作用[J]. 云南师范大学学报,2006(4):60-61.
[21]葛军. 紫花苜蓿组织培养再生体系的研究[D].北京:北京林业大学,2004.
(责任编辑 张辉玲)
Optimization of high-frequncy regeneration system of Alfalfa
QIN Chu1,LI Yu2,ZHANG Xi-bin1,MA Dong-mei3,XU Xing3
(1.School of Life Science,Ningxia University,Yinchuan 750021,China;2. Agricultural Comprehensive Development Office of Ningxia,Yinchuan 750021,China;3. School of Agriculture,Ningxia University,Yinchuan 750021,China)
Hypocotyls of 3 varieties of Alfalfa in 7 days old seedlings were used as explants,Ms medium was used as basic medium,the effects of different concentrations of auxins on Alfalfa callus regeneration system,adventitious bud induction and rooting were studied. The results indicated that, for Golden Empress,Gan-nong No.3 and Algonquin,the best mediums for callus induction were MS+2,4-D 2.5 mg/L+6-BA 0.5 mg/L,MS+2,4-D 2.0 mg/L+NAA 1.0 mg/L,MS+2,4-D 3.0 mg/L+KT 1.0 mg/L;the best differentiation mediums were MS+6-BA 2.0 mg/L+CH 0.5 g/L,MS+NAA 0.3 mg/L+KT 0.5 mg/L,MS+KT 1.2 mg/L;the best rooting medium for plant development were 1/2MS+IBA 1.0 mg/L.
Medicaho sativa L.;hormones;callus;regeneration system
S541+.1
A
1004-874X(2016)11-0022-05
2016-07-17
项目来源:宁夏自然科学基金(NZ15002)
秦楚(1992-),女,在读硕士生,E-mail:932505357@qq.com
许兴(1959-),男,博士,教授,E-mail:495323582@qq.com
秦楚,李昱 ,张喜斌,等. 苜蓿高频再生组织培养体系的优化[J].广东农业科学,2016,43(11):22-26.
