应用16S rDNA克隆文库解析苏铁珊瑚状根内生放线菌种群多样性
2016-12-19王国娟马焕成郑艳玲伍建榕
王国娟 ,曹 妍,王 芳 ,马焕成 ,郑艳玲 ,伍建榕
(1. 国家林业局 西南地区生物多样性保育重点实验室,云南 昆明 650224;2.西南林业大学 林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224 )
应用16S rDNA克隆文库解析苏铁珊瑚状根内生放线菌种群多样性
王国娟1,曹 妍1,王 芳2,马焕成2,郑艳玲2,伍建榕1
(1. 国家林业局 西南地区生物多样性保育重点实验室,云南 昆明 650224;2.西南林业大学 林学院 云南省高校森林灾害预警控制重点实验室,云南 昆明 650224 )
苏铁为古老孑遗植物,被誉为“植物界的大熊猫”和“活化石”。为了研究苏铁珊瑚状根内生放线菌的多样性,通过16S rDNA克隆文库开展了珊瑚状根内生放线菌种群多样性研究,从16S rDNA克隆文库中随机挑选了164个克隆子进行序列测定,对测序结果进行了Blast对比,结果表明,苏铁珊瑚状根中放线菌多样性十分丰富,存在5个目7个科10个属,主要类群为短小杆菌属Curtobacterium、利夫森氏菌属Leifsonia、考克氏菌Kocuria、鸟氨酸微菌属 Ornithinimicrobium、微球菌属 Micrococcus、丙酸杆菌属Propionibacterium、链霉菌属 Streptomyces、拟诺卡氏菌属 Nocardiopsis、芽球菌属Blastococcus;克隆得到的内生放线菌优势菌为短小杆菌属Curtobacterium,其次为拟诺卡氏菌属 Nocardiopsis和链霉菌属Streptomyces。其中68株内生放线菌是能分离培养的,经16S rDNA片段测序分析,结果表明这些内生放线菌分别与GenBank中已知属相似性达97%~100%;其余的序列相似性低于97%,表明苏铁珊瑚状根中可能存在着放线菌新种。
苏铁;珊瑚状根;16S rDNA克隆文库;内生放线菌;种群多样性
苏铁Cycas spp.是一类古老的孑遗植物,是我国的一级保护植物[1-2]。近年来苏铁的研究热点及重点一直是其系统的进化,而其内生菌的多样性却未见报道。苏铁的根共具3种不同类型:正常根、肉质根和珊瑚状根。其中珊瑚根是可暴露在土壤表层的苏铁类植物的重复二叉分枝的、一类背地性生长的根丛,因其形状似珊瑚状从而得名[3]。苏铁珊瑚根的结构与形成一直存在很大的争议。目前,人们已在苏铁的育种、栽培技术等方面开展了研究,而涉及到放线菌与苏铁珊瑚根之间的研究尚未见报道。本研究的目的是从苏铁珊瑚状根结构中分离内生放线菌,探究宿主内生放线菌的多样性,为苏铁快速繁育生长提供基础研究。即便纯培养的方法对植物根内可培养微生物的研究取得了一些成果[4],大量的实验数据表明纯培养的方法已经不能很好的反映微生物种群存在的原始状态。在自然环境样品中可分离出的微生物种类仅占总微生物种类总数的0.1%~1%,得到的结论很难全面地、客观地反映植物根内菌群的种群变化和结构[5];本研究所采用克隆文库的构建是微生物分子生态学中用来研究微生物组成的常用方法之一[6],本研究运用构建16S rDNA克隆文库的方法,运用测序的手段和与GenBank已知序列进行Blast比对法,确定苏铁珊瑚状根内生放线菌的种类,以揭示苏铁珊瑚状根内生放线菌的多样性。同时亦可以根据克隆文库中克隆子出现的频率得知苏铁珊瑚状根系统中菌群的构成比例。
1 材料与方法
1.1 样品采集
2014年10月,在云南昆明金殿森林保护区附近采集苏铁珊瑚状根,冲洗干净表面泥土后放于-20 ℃冰箱中备用。
1.2 实验方法
1.2.1 珊瑚状根表面的消毒灭菌
珊瑚状根先用蒸馏水清洗表面,依次用75%乙醇消毒60 s,无菌水清洗3~4遍,0.1%的升汞浸泡5 min,无菌水清洗3遍,最后用无菌滤纸吸去多余水分。取0.2 mL最后一道清洗的无菌水涂布在ISP 2的平板上,在28 ℃下培养2~3周,用以检测其表面灭菌的效果。
1.2.2 珊瑚状根原生质体的制备与内生微生物的富集
根据秦盛对滇南美登木的酶解-差速离心法略有改动。取经表面消毒后干燥的植物样品1~2 g,剪成小段(无菌条件下),用液氮研磨成颗粒状,将研磨好的材料悬浮于100 mL经过滤灭菌的酶反应液中(1 320 mg/L CaCl2·2H2O,88.3 mg/L KH2PO4,0.7 mol/L 甘露醇,1 g/L 2-N-吗啉乙烷磺酸,10 g/L 纤维素酶,1 g/L 果胶酶),黑暗避光条件下于170 r/min,28 ℃条件下与摇床中反应7 h,然后将反应液分装到灭菌的2 mL离心管中低温条件下差速离心,先用500 g的离心力 (具体转速根据所用离心机进行计算) 离心25 min,吸取上清部分再用3 500 g的离心力离心20 min,收集沉淀用于总DNA的提取。
1.2.3 样品总DNA提取及纯化
收集3 500 g的离心沉淀用CTAB小量法提取[7-8]:
(1)将沉淀分装在7个2 mL 的离心管中,每管分别加入1.6 mL EB(0.1 M Tris-HCl pH 8.0,5 mmol EDTA pH 8.0, 0.35 mol 三梨醇,0.004 g/mL三梨醇糖) 和20 μL 2-Mercaptoethanol,漩涡振荡,室温下10 000 r/min 离心10 min。
(2)弃上清,然后加入 100 μL TE,100 μL L-Lysine(400 mmol),100 μL EGTA(60 mmol pH 8.0),7 μL 2-Mercaptoethanol 和 11 μL 溶菌酶(100 mg/mL),混匀,于37 ℃水浴0.5 h,中间多次摇动。
(3)再加入 100 μL EB,5μL 2-Mercaptoethanol,漩涡振荡,加入960 μL LB(0.2 mol Tris-HCl pH 8.0,0.05 mmol EDTA pH 8.0,2 mol NaCl,2% CTAB,96 μL 5% N-Lauroyl,NaCl和5μL RNase A(10 mg/mL),颠倒混匀,65 ℃水浴15 min,间隔5 min摇匀一次。
(4)室温静置10 min。
(5)加入500 μL 氯仿:异戊醇(v/v=24/1),漩涡振荡,12 000 r/min 离心10 min,取上清。
(6)重复上一步操作。
(7)加入2/3体积异丙醇,轻轻混匀,-20 ℃静置30 min,4 ℃, 12 000 r/min离心10 min。
(8)用-20 ℃预冷的70%乙醇洗涤沉淀3次,室温倒置在干净的滤纸上晾干,再加入50 μL TE溶液溶解沉淀,DNA粗体液采用PCR.clean.up kit试剂盒纯化。-20 ℃保存备用。
1.2.4 PCR扩增
样品放线菌16S rDNA全长PCR扩增见参考文献 [9]。PCR 扩增总体系为 50 μm:S-20(10 μmol)1 μL,A-19(10 μmol) 1 μL,DNA 模 板 5 μL,Mix25 μL,ddH2O18 μL;采用放线菌门特异性引物对 (Stach et al., 2003):S-C-Act-0235-a-S-20(5’CGCGGCCTATCAGCTTGTTG3’),S-C-Act-0878-a-A-19(5’-CCGTACTCCCCAGGCGGGG-3’),目的扩增片段大小为650 bp左右,即为扩增放线菌16S rDNA基因V3~V5区域。
1.2.5 克隆文库的构建
割胶纯化PCR产物,先使其与pMDl9-T载体连接,然后转化大肠杆菌DH5a,涂布,最后在37 ℃下培养12 h后,用无菌牙签挑取阳性克隆子,用限制性内切酶Csp6与HinfI分型,每个酶切类型挑取1个代表菌株进行测序(克隆试剂盒选用百泰克生物技术有限公司提供的通用型Ultra Power PUM-T快速克隆试剂盒,感受态细胞由博迈德公司提供。上海生工生物工程技术服务有限公司),运用DNAMAN和Gene Tool等软件对测序结果进行编辑、分析,并把编辑好的序列在GenBank数据库中进行Blast同源性检索后下载同源性序列,绘制系统发育树用MEGA5软件完成,算法为邻(neighbour-joining-analysis)。
2 结果与分析
2.1 植物表面灭菌处理
最后一遍清洗的水0.2 mL涂布至ISP 2平板上,28 ℃培养3周未见有菌落生长,表明植物表面灭菌消毒效果理想,提取的总DNA为植物基因组与内生微生物的基因组,从而排除掉植物表面微生物的干扰。
2.2 苏铁珊瑚状根总DNA提取
经0.8%的琼脂糖凝胶电泳检测,通过酶解-差速离心方法提取的总DNA质量较好,大小在19 Kb以上,而且条带亮度较高、完整性好 。图1为苏铁珊瑚状根总DNA提取电泳图。由图1可知,试验提取的DNA片段较完整,表明提取的DNA适合进行下一步的PCR扩增。

图1 苏铁珊瑚状根基因组总DNA提取电泳图Fig. 1 Electrophoresis of the extracted DNA of Cycas coralloid root
利用S-20和A-19引物对上述提取的总DNA进行16S rDNA基因的V3~V5区进行扩增,经1%的琼脂糖凝胶检测扩增结果。结果表明,利用上述PCR反应条件能够成功扩增出目的片段,符合预期要求,为该植物内生放线菌总的16S rDNA基因的V3~V5区片段。而以最后一次清洗植物表面的水为模板未扩增出目的片段,说明上述珊瑚状根表面灭菌的方法完全排除了外面微生物DNA的干扰,后续扩增出的DNA是珊瑚状根内生放线菌的16S rDNA基因。图2为PCR扩增产物的电泳图,图中泳道1、2为电泳试验平行样。电泳结果表明,PCR扩增所产生的DNA片段大小约为640 bp,说明得到的PCR扩增产物适合下一步的16S rDNA克隆文库的构建。图1、图2中电泳所用标记物(Marker)为Progema公司生产的LambdaDNA/HindⅢMakers。
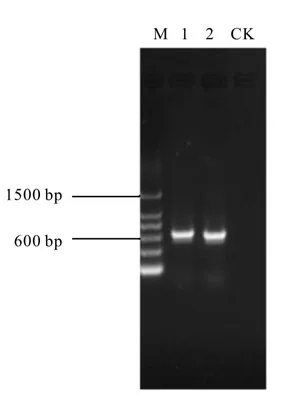
图2 苏铁珊瑚状根内生放线菌16S rDNA PCR扩增产物电泳图Fig. 2 Electrophoresis of the PCR products of endophytic actinobacterial of Cycas coralloid root
2.4 阳性克隆的检测
继续用引物S-20和A-19扩增挑选的白色菌落,然后取5 μL PCR产物用1%的琼脂糖凝胶电泳检测假阳性。经检测发现,经过蓝白斑筛选后仍有部分白色菌落没有扩增成功,呈假阳性。部分菌落PCR电泳检测结果见图3。
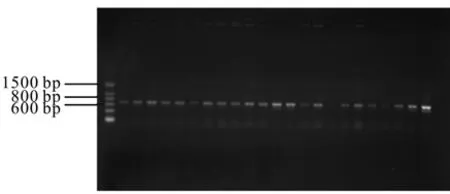
图3 16S rDNA基因克隆文库阳性克隆的鉴定Fig. 3 Identification of positive clones of 16S rDNA gene libraries
2.5 珊瑚状根中16S rDNA克隆文库构建
在构建苏铁珊瑚状根16S rDNA克隆文库时,从众多转化子中随机挑选200个克隆子进行测序,剔除20个测序失败的克隆子,去除测序有问题的,测序成功的有164个为有效克隆子(PCR产物送上海生工测序)测得有效克隆子16S rDNA序列在GenBank数据库中进行Blast比对,将序列比对结果相同的克隆子定义为一个操作单元(OTU),经在EzTaxon-e Database检索发现,这164个克隆子可以分为16个单元 (见表1)。从表1表明,164个克隆子分布于细菌域、放线菌纲的短小杆菌属Curtobacterium、利夫森氏菌属 Leifsonia、考克氏菌 Kocuria、鸟氨酸微菌属 Ornithinimicrobium、微球菌属 Micrococcus、丙酸杆菌 属Propionibacterium、链霉菌属 Streptomyces、拟诺卡氏菌属 Nocardiopsis、芽球菌属 Blastococcus共10个属。其中,短小杆菌属 Curtobacterium出现频率最高,为34.8% (57个克隆);其次为拟诺卡氏菌属 Nocardiopsis和链霉菌属 Streptomyces,分别为31.7% (52个克隆)、29.3% (48个克隆)。珊瑚状根中的克隆序列相似性大多在97%以上,如克隆R66 与Curtobacterium albidum的相似性达到100%,R4与Streptomyces badius的相似性达到99.67%。但也有些序列的相似性较低,如克隆R3与Nocardiopsis ganjiahuensis的相似性只有89.48%,R13与Nocardiopsis alkaliphila的相似性只有92.42%,预示着该植物的珊瑚状根中可能存在着放线菌新物种。
2.6 苏铁珊瑚状根内生放线菌系统发育分析
使用MEGA 5软件,按照最大同源性原则将代表不同OUT放线菌的17个序列进行排序,构建克隆文库放线菌的系统发育树,从系统发育树 (见图4)可以看出,164个克隆分布于5个目、7个科、10个属。这5个目分别为微球菌目 Micrococcales、丙酸杆菌目Propionibacteriales、链霉菌目Streptomycetales、链孢囊菌目 Streptosporangiales 、弗兰克氏菌目 Frankiales,科属分布如表1。从图5可以看出该克隆文库中的克隆子在各目中所占比例,优势菌为微球菌目 Micrococcales,占37%;其次为链霉菌目 Streptomycetales和链孢囊菌目Streptosporangiales,分别为32%、29%。另外,还发现有弗兰克氏菌目 Frankiales的芽球菌属,在植物内生环境中的具体作用还没有报道。

表1 苏铁珊瑚状根内生放线菌基因克隆子16S rDNA测序结果Table 1 16S rDNA sequence analysis results of clone endophytes actinomycetes in Cycas coralloid root

图4 苏铁珊瑚状根内生放线菌系统发育树Fig. 4 The phylogenetie tree of endophytes actinomycetes in Cycas coralloid root
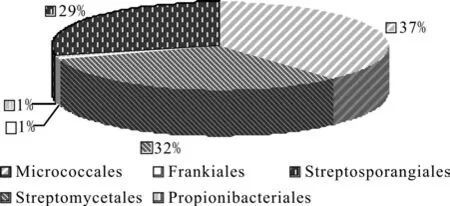
图5 苏铁珊瑚状根内生放线菌16S rDNA基因克隆在不同目中的分布Fig. 5 Distribution of 16S rDNA clones of endophytic actinobacteria in different orders from stems of Cycas
3 讨论与结论
3.1 免培养内生放线菌多样性
本研究利用酶解—差速离心方法成功提取到苏铁珊瑚状根总DNA,并且成功构建了苏铁珊瑚状根内生放线菌16S rDNA克隆文库。经过研究发现,苏铁珊瑚状根中存在着丰富的放线菌资源,分布于放线菌纲的5个目7个科10个属。这10个属分别为短小杆菌属 Curtobacterium、利夫森氏菌属 Leifsonia、考克氏菌 Kocuria、鸟氨酸微菌属Ornithinimicrobium、微球菌属 Micrococcus、丙酸杆菌属 Propionibacterium、链霉菌属Streptomyces、拟诺卡氏菌属 Nocardiopsis、芽球菌属 Blastococcus。克隆得到的内生放线菌其优势菌为短小杆菌属Curtobacterium,其次为拟诺卡氏菌属 Nocardiopsis 和链霉菌属 Streptomyces。克隆文库中部分序列相似性低于97%,表明苏铁珊瑚状根中可能存在着放线菌新种。
链霉菌属 Streptomyces为大多数植物中内生放线菌的优势菌[10-11],获得纯培养已比较容易。短小杆菌属 Curtobacterium和微球菌属 Micrococcus菌已有学者从植物的内生环境中获得纯培养菌株[12-13]。秦盛等从药用植物中分离到少数拟诺卡氏菌属Nocardiopsis菌考克氏菌属 Kocuria 也从灯台树中分离到[14-15]。弗兰克氏菌目Frankiales的芽球菌属Blastococcus菌在喜树中已获得纯培养[16-17],但该菌在植物中的作用目前还未见报道。鸟氨酸微菌属 Ornithinimicrobium在滇南美登木的16S rDNA克隆文库中检测到。利夫森氏菌属 Leifsonia、Chryseoglobus、丙酸杆菌属 Propionibacterium三属在其他植物中是否存在,还未见报道。
3.2 免培养方法的应用
免培养法应用于土壤中微生物的多样性检测已经有很多,但用免培养方法对植物内生放线菌的研究报道较少,仅在小麦、水稻、马铃薯等少数经济植物中有些研究。免培养应用于植物内生菌的研究刚刚开始,这是由于植物组织中的叶绿体DNA与线粒体DNA会干扰总DNA的提取,而其中最大的困难是:用免培养方法研究植物内生细菌时,总是缺乏适合的引物。2008年,刘玮琦教授带领团队用16S rDNA基因文库技术分析土壤细菌群落的多样性[18],取得了突破性进展。秦盛分别构建了滇南美登木根、茎、叶中内生放线菌的16S rDNA克隆文库,检测到的放线菌种类远远比纯培养获得的多。由于免培养法不能给出群落中菌株的具体功能信息,只能对微生物群落多样性有一个较为全面的了解[19]。因此,要找到可利用的有价值的菌株必须通过纯培养分离来得到。要对植物内生环境中的微生物进行较客观地认识与评价,就必须将免培养法与纯培养法相互结合。
致谢:特别感谢攀枝花苏铁国家级自然保护区余志祥高级工程师、中国科学院昆明植物研究所龚洵研究员赠送的部分苏铁研究材料。
[1] 国家林业局、农业部令(1999)第4号,《国家重点保护野生植物名录(第一批)》[R]. 1999.
[2] 韩宁林.银杏育种策略的探讨[J]. 经济林研究, 1993, 1l(S1):136-141.
[3] 苏建英, 李 楠, 廖 芬.苏铁类珊瑚根内藻胞层的解剖观察[J].阴三学刊, 2007, 2l(1): 54-57.
[4] Amann R I, Ludwig W j, Schleifer K H, et a1.Phylogenetic identification and insitu detection of individual microbial cells without cultivation[J].Microbiol. Rev., 1995,59(1):143-169.
[5] Brock T D. The study of microorganisms in situ:progress and problems[J]. Syrup. Soc. Gene. Microbiol., 1987(41):1-17.
[6] Amann R I, Ludwig W j, Schleifer K H, et a1.Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiol. Rev., 1995, 59(1): 143-169.
[7] 文才艺, 吴元华, 田秀玲. 植物内生菌研究进展及其存在的问题[J]. 生态学杂志, 2004, 23(2): 86-91.
[8] 张 宇, 黄国弟, 唐志鹏,等.芒果总DNA提取方法比较分析[J]. 经济林研究, 2014, 32(2): 62-65.
[9] Tian X L, Cao L X, Tan H M, et a1. Diversity of Cultivated and Uncultivated Actinobacterial Endophytes in the Stems and Roots of Rice[J]. Microb. Ecol., 2007, 53(4): 700-707.
[10] 马 勇, 李 楠. 中国苏铁属植物的分类学研究现状与展望[J].山西师范大学学报:自然科学版 , 2005, 19(2): 73-77.
[11] Conn V M, Franca C M. Analysis of the endophytec actinobacterial population in the roots of wheat (Triticum aestivum L.) by terminal restriction fragment length polymorphism and sequencing of 16S rDNA clones[J]. Appl.Environ. Microbiol., 2004(70):1787-1794.
[12] Cao L, Qiu Z, You J, et a1. Isolation and characterization of endophytic streptomycete antagonists of fusarium wilt pathogen from surface-sterilized banana roots[J]. FEMS Microbiology Letters, 2005, 247(2):147-152.
[13] 展丽然, 张克诚, 冉隆贤,等. 烟草赤星病菌拮抗放线菌的筛选与鉴定[J]. 华北农学报, 2008, 23(增刊): 230-223.
[14] 张秀敏, 马友楠, 王 顺,等. 麦冬和菊三七药用植物内生放线菌的多样性及产酶特性的研究[J]. 河北农业大学学报,2011, 34(3): 50-55.
[15] 黄海玉, 李 洁, 赵国振,等. 灯台树内生放线菌多样性及抗菌活性评价[J].生物学通报, 2011, 38(5):780-785.
[16] 朱文勇,李 洁,赵国振,等.喜树内生放线菌多样性及抗菌活性评价[J].微生物学通报, 2010, 37(2): 211-216.
[17] 秦 盛. 滇南美登木内生放线菌多样性及生物活性初步研究[D].云南大学博士论文, 2009.
[18] 刘玮琦, 茆振川, 杨宇红,等. 应用16S rDNA基因文库技术分析土壤细菌群落的多样性[J]. 微生物学报, 2008, 48(10):1344-1350.
[19] 曹 妍, 伍建榕. 苏铁珊瑚根结构观察及其内生放线菌分离[J]. 中南林业科技大学学报, 2012, 32(11):47-50.
Application of 16S rDNA clone library analysis for Cycas spp. coralloid roots endophytic actinomycetes population diversity
WANG Guo-juan1, CAO Yan1, WANG Fang2, MA Huan-cheng2, ZHENG Yan-ling2, WU Jian-rong1*
(1.Key Laboratory of Biodiversity Conservation in Southwest China, State Forestry Administration, Kunming 650224, Yunnan,China; 2. College of Forestry, Southwest Forestry University, The Forest Disaster Warning Control Key Laboratory in University in Yunnan Province, Kunming 650224, Yunnan, China)
Cycas ancient relict plant, known as the “plant Panda” and “living fossil”. In order to have diversity of actinomycetes of Cycas coral root, the actinomycetes diversity in Cycas coral root of was studied by 16S rDNA cloning and sequencing method.164 clones were randomly selected, and their 16S rDNA genes were sequenced and blasted. The results showed that the Cycas coral mycorrhiza exist actinomycete resource rich. Distributed in 5 orders and 7 families, 10 genera. These 10 genera were Curtobacterium,Leifsonia, Chryseoglobus, Kocuria, Ornithinimicrobium, Micrococcus, Propionibacterium, Streptomyces, Nocardiopsis, Blastococcus.The advantage of actinomycetes actinomycetes as Curtobacterium students within the cloned (Curtobacterium), followed by quasi Nocardia and Streptomyces (Nocardiopsis) (Streptomyces). Similarity is less than 97%, the partial sequence in clone libraries showed that, there may be Actinomyces species in the coralloid root.
Cycas spp.; coralloid root; 16S rDNA clone library; endophytic actinomycetes diversity
S718.46
A
1673-923X(2016)08-0115-06
10.14067/j.cnki.1673-923x.2016.08.020
2015-09-17
国家自然科学基金项目(31360198、31260175);云南省高校干热河谷植被恢复创新团队项目; 云南省重点学科森林保护学项目(XKZ200905);云南省高等学校森林病虫害综合治理教学团队项目
王国娟,硕士研究生
伍建榕,教授;E-mail:wujianrong63@aliyun.com
王国娟,曹 妍,王 芳,等. 应用16S rDNA克隆文库解析苏铁珊瑚状根内生放线菌种群多样性 [J].中南林业科技大学学报,2016, 36(8): 115-120.
[本文编校:文凤鸣]
