胡杨大片段转化拟南芥植株表型分析
2016-12-19谭诗梦敖小平符泽华覃建庸徐刚标卢孟柱
谭诗梦,敖小平,符泽华,覃建庸,徐刚标,卢孟柱
(1.中南林业科技大学,湖南 长沙 410004;2. 中国林业科学研究院林研所,北京 100091)
胡杨大片段转化拟南芥植株表型分析
谭诗梦1,敖小平1,符泽华1,覃建庸1,徐刚标1,卢孟柱2
(1.中南林业科技大学,湖南 长沙 410004;2. 中国林业科学研究院林研所,北京 100091)
胡杨是研究林木对极端逆境响应的首选材料。开展胡杨随机插入大片段遗传转化,克服了单基因对植物表型的微效应而不易检测的难题,是植物基因功能研究思路的新尝试。用花序浸染法将胡杨基因大片段转化到拟南芥中,筛选出有特异性状并稳定表达的转化型植株。表型分析结果表明,转化型拟南芥植株与野生型的生长性状存在明显差异,与野生型相比,转化型种子粒径增长达14%、千粒重增加达27%,这为进一步开展该基因大片段功能研究,奠定了前期实验基础。
胡杨大片段;BIBAC;花序浸染法;遗传转化
胡杨Populus euphratica为耐盐碱而非盐生植物,是我国西北戈壁沙漠荒原上特有的高大乔木,已成为研究木本植物耐盐碱、干旱、高温等极端逆境的首选材料[1]。近年来,植物逆境应答基因的功能及其表达调控受到广泛重视[2-3],但大多数研究仍处于单基因克隆探索的阶段,鲜有大片段基因的系统整合及对基因簇整体功能的报道[4]。植物抗逆性状通常是由多基因及基因簇协同作用的结果,单基因研究已不能很好地阐明植物抗逆的分子机理,因此,开展多基因大片段的功能研究是植物分子遗传研究的需求,具有广阔的发展空间[5]。
文库构建、芯片杂交和测序技术的快速发展为植物全基因组中特异性关键基因的挖掘、分离和功能鉴定提供了多种手段[6]。Miranda等[7]和Hamilton等[8]基于细菌人工染色体(bacterial arti ficial chromosome,BAC)构建了在大肠杆菌和根癌农杆菌中穿梭复制的双元载体双元细菌人工染色体(binary BAC,BIBAC),通过农杆菌真空侵染植株直接将外源基因整合到拟南芥基因组中[9],在此基础上,Clough & Bent探索出花序浸染法[10]。本研究以胡杨基因组大片段随机插入pCLD04541质粒(见图1)构建的BIBAC文库,采用花序浸染法转化野生型拟南芥,筛选生长特异型转化型植株,旨在为进一步探索胡杨基因组大片段序列的功能奠定前期研究基础。
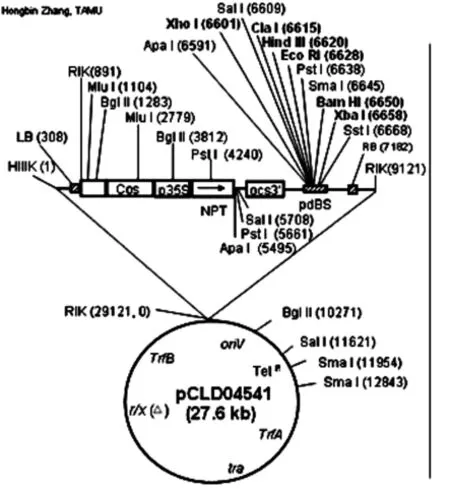
图1 pCLD04541质粒图谱Fig. 1 The plasmid pro file of pCLD04541
1 材料与方法
1.1 培养基
农杆菌培养采用LB培养基,植物组织培养采用MS培养基。
1.2 供试文库、农杆菌及拟南芥
选用双元载体pCLD04541构建胡杨全基因组BIBAC文库[9],载体文库由美国德克萨斯农工大学张洪斌实验室构建。依据384孔板上的位置,确定农杆菌菌株编号。
pCLD04541质粒全长约27.3 kb,携带四环素(Tet)抗性基因及新霉素磷酸转移酶(NPT II)基因。检测引物序列为[11]:
Tet R3:5′-TCAACGTTCCTGACAACGAG-3′;
Tet F3:5′-GTCTGACGACACGCAAACTG -3′;
NPT-R:5′-TCAGAAGAACTCGTCAAGAAG- 3′;
NPT-F:5′-ATCTCCTgTCATCTCACCTTgCTC CT-3′。
引物由华大基因公司合成。Tet扩增片段大小约为540 bp,NPT II扩增片段大小约为490 bp。
拟南芥室内培养条件为:温度22 ℃,16 h光照,8 h黑暗。
1.3 拟南芥转化
农杆菌解冻后,依次进行摇菌培养、划平板培养、挑单菌落扩大培养。培养温度为28 ℃。质粒小提试剂盒提取质粒DNA后,进行PCR检测。
菌液经离心机浓缩,弃上清液,用质量体积比为50%的蔗糖溶液重悬,按0.5%体积加入silwet-77配制转化液。选择主茎长5~10 cm的拟南芥倒置,使主茎全部浸没在转化液中,轻轻转动60 s,确保转化液均匀包裹花穗[12]。浸花后,覆盖保鲜膜,黑暗中放置12~16 h后,光照培养。5~7 d转化1次,直到盛花期结束。
1.4 转基因植株筛选、移栽
收获的种子灭菌后,用0.1%无菌琼脂溶液重悬,均匀铺板,晾干,在抗性板和无抗生素平板上铺野生型种子作为对照。4 ℃春化2~3 d后,于温度20~23 ℃、湿度60%~70%、16 h光照8 h黑暗的条件下培养[12]。
挑取叶片颜色正常的植株移植于土壤中,定期观察、记录生长情况。
1.5 转基因植株分子检测
拟南芥叶片总DNA提取,采用CTAB法[13]。CTAB浓度为3.0%,巯基乙醇浓度为0.4%。
PCR扩增反应体系与程序参考文献[11]。PCR扩增产物,采用琼脂糖凝胶电泳检测并拍照。
1.6 数据分析
随机抽取转化型T1代和野生型拟南芥种子各5 000粒,游标卡尺测量粒径,电子分析天平称量千粒重,重复3次。采用SPSS statistics 19软件进行数据统计分析。
2 结果与分析
2.1 转基因植株筛选、检测
68A1B2号农杆菌质粒的分子检测结果见图2。由图2可知,扩增片段大小约为540 bp,表明所用的68A1B2号农杆菌质粒保留外源片段,可用于侵染。
68A1B2转化型T1代拟南芥的分子检测结果见图3,扩增片段大小约为490 bp,表明拟南芥转化型携带有NPT II片段。
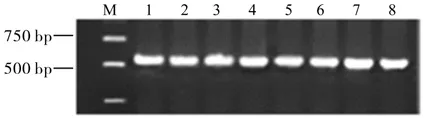
图2 68A1B2号农杆菌PCR检测琼脂糖凝胶电泳图像Fig. 2 Gel electrophoresis image of 68A1B2 Agrobacterium
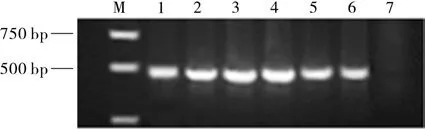
图3 68A1B2转化型拟南芥PCR检测琼脂糖凝胶电泳图像Fig. 3 Gel electrophoresis image of transformed Arabidopsis
2.2 转基因植株生长表现
68A1B2转化型与野生型拟南芥植株在不同生长期的表型差异见图4。由图4可知,播种5周后,相对于野生型,68A1B2转化型开花提早,生长快(图4A)。播种8周后,68A1B2转化型植株较野生型更高,主茎增多(图4B)。68A1B2转化型植株主茎顶端可见多果荚轮生,但野生型植株顶端停止发育(图4C)。与野生型植株相比,68A1B2转化型的主茎相对位置上着生的果荚长度差异不明显,但果荚数增多,节间长度明显不均匀(图4D)。
2.3 转基因植株种子特征
68A1B2转化型和野生型拟南芥的种子粒径及千粒重数据统计分析结果见图5。由图5可知,68A1B2转化型拟南芥T1代种子比野生型拟南芥种子粒径增大14%、千粒重增加近27%,在统计学上有显著意义(P<0.05)。
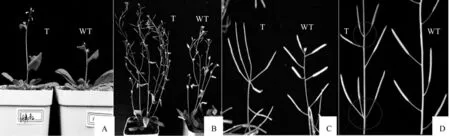
图4 拟南芥转基因植株的生长特征Fig. 4 Growth characteristics of transgenic Arabidopsis

图5 2种拟南芥植株种子性状统计Fig. 5 Seed characteristics statistical figure of two types of Arabidopsis
3 结论与讨论
2013年公布的胡杨全基因组序列,为进一步探索有价值的性状和功能提供了蓝本[14]。同年,中国林业科学研究院构建了胡杨转化基因组学的BIBAC文库,用于分析胡杨的耐盐基因簇及其它潜在的有益片段[11]。在此基础上,通过胡杨基因组大片段转化拟南芥的研究,发现和验证胡杨基因簇功能的报道日益增多[15]。如,朱晓静获得了全黄化拟南芥植株,并探知该插入片段位于拟南芥第5条染色体,推测插入片段与叶绿体发育有关[16]。王智获得了赤霉素高合成拟南芥转化植株,并检测到植株内赤霉素水平明显高于野生型拟南芥,但没有提供性状与外源片段表达直接相关的证据[17]。
本研究表明,携带胡杨大片段基因的拟南芥转化型植株在侧枝发育、种子表型等方面与野生型存在明显差异。种子生长与植物激素分泌[18]、泛素途径[19]或相关调控[20-21]有关,调控花发育[22]、侧枝发育[23]等相关基因也可能参与植物生长过程。胡杨大片段基因长度远超过单个基因序列的长度,其功能是否与上述分子机理有关,目前还不清楚。为了进一步探讨68A1B2大片段基因的功能,下一步计划针对68A1B2片段及其插入位点进行测序,分析胡杨68A1B2大片段在转化型植株性状表达中起到的作用,为胡杨转化基因组学研究提供有益的补充。
本研究发现,大片段基因在农杆菌GV3101内能稳定遗传。但是,转化型拟南芥表型随着世代数增加而减弱甚至消失。这说明胡杨大片段基因作为外源物质,农杆菌介导转入拟南芥后,存在遗传不稳定现象。有研究报道,随着插入片段长度增加,发生插入、缺失、倒位等结构变异的可能性也增加[24];也有研究认为,外源片段成功整合到植物基因组后,可能发生高效表达、破坏正常阅读框或打断调控3种情况[25]。Zhang等[26]认为大片段基因的BIBAC克隆在转基因植物中,尤其在远源物种中的稳定性还需要深入探索。本研究中转化型植株表型随着世代的增加,表型减弱或消失的原因,还有待进一步研究。
[1] 韩 路,王家强,王海珍,等. 塔里木河上游胡杨种群结构与动态[J].生态学报, 2014(16): 4640 - 4651.
[2] 贾 琪,吴名耀,梁康迳,等.基因组学在作物抗逆性研究中的新进展[J].中国生态农业学报, 2014, 1(4): 375 – 385.
[3] 雷 志,周美亮,吴燕民.非生物逆境相关基因在棉花抗逆研究中的进展[J].中国农业科技导报, 2014, 16(2): 35-43.
[4] 刘 春,曹丽敏,李玉中,等. 利用转基因途径提高植物非生物胁迫耐受性的研究进展[J]. 生物技术通报,2013(1):16-24.
[5] 毕毓芳,诸葛强.林木非生物胁迫抗性基因工程研究进展[J].世界林业研究, 2008, 21(5): 30-36.
[6] 骆 翔,刘志颐,章树民,等.植物转基因技术研究进展[J].中国农学通报, 2014, 30(15): 234-240.
[7] Miranda A, Janssen G, Hodges L, et al. Agrobacterium tumefaciens transfers extremely long T-DNAs by a unidirectional mechanism.[J]. Journal of Bacteriology, 1992, 174(7): 97-2288.
[8] Hamilton CM, Frary A, Lewis C, et al. Stable transfer of intact high molecular weight DNA into plant chromosomes [J].Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(18): 9975-9979.
[9] Tao Q, Wang A, Zhang H. One large-insert plant-transformation competent BIBAC library and three BAC libraries of Japonica rice for genome research in rice and other grasses [J]. Theoretical and Applied Genetics, 2002, 105(6): 1058-1066.
[10] Steven J. Clough, Andrew F. Bent. Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana [J]. The Plant Journal, 1998, 16(6): 735-743.
[11] 周 婧. 利用BIBAC文库建立胡杨转化基因组学平台及鉴定胡杨耐盐基因(簇)的研究[D].北京:中国林业科学研究院, 2013.
[12] 曲冠证,郑唐春. 拟南芥实验技术[M]. 北京:中国林业出版社,2012.
[13] 田晔林,张党权,宋志丹,等. 苔藓标本基因组DNA的提取方法研究[J]. 中南林业科技大学学报,2012,32(10):125-129.
[14] 冉 洪,张 莹,胡 陶,等.经济树种全基因组测序成果要报[J].经济林研究,2015,33(2): 149-157.
[15] 种 康,王 台,钱 前,等. 2014年中国植物科学若干领域重要研究进展[J]. 植物学报, 2015, 50(4): 412 - 459.
[16] 朱晓静.胡杨基因组DNA大片段的拟南芥转化及突变体初步鉴定[D].保定:河北农业大学, 2013.
[17] 王 智.胡杨基因组大片段转化拟南芥及突变体生物性状分析[D].保定:河北农业大学, 2014.
[18] 董庆坤,刘慧丽,陶利珍. 植物激素调控籽粒大小的研究进展[J]. 华南师范大学学报:自然科学版, 2015, 47(5): 1-7.
[19] 陈 默,于丽杰,金晓霞,等. 植物泛素/26S蛋白酶体途径的研究进展[J]. 中国生物工程杂志, 2014, 34(4): 118-126.
[20] 何 访,梅文莉,郭 冬,等. 植物激素应答元件研究进展[J].热带作物学报, 2015, 36(1): 211 - 218.
[21] 覃 碧. 泛素蛋白酶体途径及其对植物激素信号转导的调控[J]. 热带农业科学, 2013(4): 39-45.
[22] 孙 颖,刘 儒,罗 敏,等. 油桐Tunglfy基因在花芽分化期对不同外源激素的分子响应[J]. 中南林业科技大学学报,2014, 34(4): 25-29.
[23] 邢朝斌,刘 岩,修乐山,等. 刺五加过氧化氢酶基因的克隆与表达分析[J]. 经济林研究,2014,32(2): 24-27.
[24] 杨海娇 张德强. 植物基因组拷贝数变异研究现状[J]. 分子植物育种, 2015, 13(8): 1895-1910.
[25] Cellini F, Chesson A, Colquhoun I, et al. Unintended effects and their detection in genetically modified crops [J]. Food and Chemical Toxicology, 2004, 42: 1089-1125.
[26] Zhang HB, Zhang MP, Chang YL. Characterization of a planttransformation-ready large-insert BIBAC library into tobacco[J]. Genome, 2011(54): 437-447.
The phenotypic analysis of Arabidopsis thaliana transformed by Populus euphratica genome fragment
TAN Shi-meng1, AO Xiao-ping1, FU Ze-hua1, QIN Jian-yong1, XU Gang-biao1, LU Meng-zhu2
(1. Central South University of Forestry and Technology, Changsha 410004, Hunan, China; 2. Research Institute of Forestry, Chinese Academy of Forestry, Beijing 100091, China)
Populus euphratica is one of valuable material on abiotic stress research of trees. It is a new attempt to research plant gene function that using random genome fragments but not a single gene of P. euphratica to transform Arabidopsis. The study transform wildtype Arabidopsis (columbia) by the floral dip method, then specific traits of transformed plants were screened, recording the new phenotype and analyzing the new function, to explore the specific function of the Populus genome sequence. The experiments showed that the growth traits of transformed type Arabidopsis were significantly different from the wild-type. The grain size of the transformed seed increased nearly 14%, and the weight increased by nearly 27%, which laid a foundation for further study on the function of the inserted fragment.
Populus euphratica genome fragment; BIBAC; floral dip; transformation
S718.46;S792.119
A
1673-923X(2016)08-0053-04
10.14067/j.cnki.1673-923x.2016.08.011
2015-09-30
中央级公益性科研院所基本科研业务费专项资金“胡杨功能基因组研究平台构建和功能基因发掘”(CAFYBB2011001)
谭诗梦,硕士研究生
卢孟柱,教授;E-mail: lumz@caf.ac.cn;徐刚标,教授;E-mail:gangbiaoxu@163.com
谭诗梦,敖小平,符泽华,等. 胡杨大片段转化拟南芥植株表型分析 [J].中南林业科技大学学报,2016, 36(8): 53-56.
[本文编校:文凤鸣]
