水分胁迫对刨花润楠幼苗生长及光合特性的影响
2016-12-19刘全勇吕佳斌谭晓风
刘全勇 ,卢 锟 ,李 泽 ,吕佳斌 ,谭晓风
(1.中南林业科技大学 a.经济林培育与保护省部共建教育部重点实验室;b.经济林培育与利用湖南省协同创新中心,湖南 长沙 410004;2.茶陵县林业局,湖南 茶陵 412400)
水分胁迫对刨花润楠幼苗生长及光合特性的影响
刘全勇1a,1b,2,卢 锟1a,1b,李 泽1a,1b,吕佳斌1a,1b,谭晓风1a,1b
(1.中南林业科技大学 a.经济林培育与保护省部共建教育部重点实验室;b.经济林培育与利用湖南省协同创新中心,湖南 长沙 410004;2.茶陵县林业局,湖南 茶陵 412400)
采用盆栽试验, 研究水分胁迫对刨花润楠幼苗光合生理指标及叶绿素荧光参数的影响, 揭示水分胁迫对刨花润楠光合作用及生理指标之间的关系,为刨花润楠苗期水肥管理及栽培提供参考依据。结果表明:在4种水分胁迫下,刨花润楠幼苗的净光合速率、蒸腾速率及气孔导度的日变化均呈双峰曲线,有明显的光合午休现象,轻度干旱(LS)对刨花润楠幼苗的净光合速率(Pn)、初始荧光(Fo)、非光化学猝灭系数(NPQ)无明显影响(P>0.05);中度干旱(MS)及重度干旱(SS)均使刨花润楠幼苗叶片叶绿素含量、净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)、电子传递速率(ETR)、最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPSII)、PSII的潜在活性(Fv/Fo)、光化学猝灭系数(qP)及生长显著下降(P<0.05);初始荧光(Fo)、非光化学猝灭系数(NPQ)显著升高(P<0.05);在轻度干旱和中度干旱胁迫下刨花润楠幼苗光合作用的降低主要是由气孔关闭引起的,而重度干旱胁迫下光合作用的下降主要是由光合机构活性降低的非气孔因素引起的。
刨花润楠;水分胁迫;光合特性;叶绿素荧光
刨花润楠Machilus pauhoi为樟科Lauraceae润楠属Machilus常绿乔木,别名香粉树、楠木、刨花树,是我国中亚热带和南亚热带地区优良的乡土树种,干形通直,萌芽力强,新叶粉红色,是优良的庭院绿化树种[1]。其木材纹理通直,结构细密,材质较轻,干燥后易加工,不变形,刨面光滑,是制造家具及细木工具的优良材料[2]。近年来, 随着气候的改变, 南方大部分地区在盛夏会出现高温干旱天气, 加之刨花润楠幼苗耐阴喜湿,长期以来,夏季高温干旱影响了刨花润楠幼苗的正常生长。
光合作用是影响植物生长和生物量积累的重要指标, 也是品种选育与评价的重要指标之一[3-4],它的高低反映了植物的遗传特性和对环境中水肥气热的适应能力, 是对水分胁迫最敏感的生理过程之一, 可以作为判断植物生长和抗逆性的重要指标[5]。叶绿素荧光动力学检测技术是研究植物光合功能的快速无损伤探针, 已被广泛应用于各种胁迫对植物生理生态影响的研究中[6-7]。目前,关于刨花润楠的研究还处于初始研究阶段, 主要介绍了刨花润楠生物生态学特性、育苗栽培、种植密度及施肥对生长的影响[8-11]。关于水分胁迫对刨花润楠光合生理方面的研究还未见报道, 本研究通过盆栽试验研究了水分胁迫对刨花润楠幼苗生长及光合特性的影响, 以期了解刨花润楠对水分胁迫的适应性及其抗旱机理,为刨花润楠的育苗及栽培过程中水分科学管理提供理论依据。
1 材料与方法
1.1 供试材料
试验材料刨花润楠Machilus pauhoi由茶陵县虎踞镇虎踞林场提供,为1年生的盆栽苗。试验于2014年5月~9月在长沙中南林业科技大学校内进行。
1.2 试验设计
本研究采用盆栽试验, 选取长势一致的实生苗,移栽到18 cm×18 cm×15 cm装有基质的塑料盆中,田间持水量为25.8%,有机质含量为11.3 g·kg-1,全氮为 0.5 g·kg-1,全磷为 3.7 mg·kg-1,速效钾为100.3 mg·kg-1。干旱胁迫设4个水分处理,正常供水(CK)、轻度干旱(LS)、中度干旱(MS)、重度干旱(SS), 其土壤含水量分别为土壤田间最大持水量的85%~90%、75%~70%、55%~50%、35%~30%,称重法控制不同处理土壤水分条件恒定。播种后每天于18:00称质量,补充失去的水分,使各处理保持设定的土壤含水量[12]。公式:FMC=(Dp-Sd)/(Ip-Sd)。其中:FMC为土壤田间最大持水量;Dp为当天盆子和土壤的质量;Sd为盆子和土壤干质量;Ip为浇透水盆子和土壤质量。装盆后在85℃下烘干土壤后装盆称质量,为盆子和土壤干质量,然后在下午浇透水过夜使多余的水流干,第2天早上称质量为浇透水盆子和土壤质量,根据设定的田间最大持水量可以推算出当天盆子和土壤的质量,为了减少蒸发,在盆口套塑料袋防止水分蒸发[13]。每个处理18盆,总共72盆,水分胁迫一个月后测定刨花润楠幼苗的光合作用日变化、生理指标及叶绿素荧光参数等各项指标。
1.3 生长指标及生理指标的测定
苗高和地径分别用卷尺和游标卡尺测量, 每个处理测定9株,3次重复。叶片叶绿素含量参照张宪政丙酮乙醇混合液法提取[14], 用打孔器切取0.1 dm2鲜叶剪成细丝, 浸泡在10 mL丙酮乙醇 (V∶V=1∶1) 溶液中遮光处理24 h, 按照Arnon的方法用分辨率较高的分光光度计测定663 nm和645 nm处读光密度(OD值)[15], 计算叶绿素a、叶绿素b及叶绿素总量, 每个处理重复3次。
1.4 光合作用的测定
用LI-6400xt便携式光合仪( LI-COR, USA)对刨花润楠光合作用日变化进行测定。测定时选取叶位及长势基本一致且无病虫害的叶片, 保持叶片自然生长角度, 为了保证测定时间的一致性,每个处理测定6株,每株测定1枚叶片, 重复3次(连续测定3 d)。从早上7:00到晚上19:00, 每隔2 h测定1次。测定的光合指标包括净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)等参数。水分利用效率(WUE,R)为R=Pn/Tr[16]。
1.5 叶绿素荧光的测定
叶绿素荧光参数的采用LI-6400xt光合仪测定,参考LI-6400xt操作手册,经过充分暗适应的叶片在凌晨破晓前照射检测光测定Fo,然后施加饱和脉冲为 7 200 μmol·m-2s-1的光强下 0.8 s,测得暗适应下最大荧光Fm,荧光参数的计算参照Rohácˇek[17]的方法。天亮后用叶室内活化光活化30 min以上,直接测定PSII有效光化学量子产量Fv′/Fm′、实际光化学量子效率 ΦPSII、光化学猝灭系数qP及非光化学猝灭系数NPQ等参数。
1.6 数据统计与分析
用Excel 2007对数据进行处理作图, 用SPSS 17.0软件进行相关性分析及其差异显著性。
2 结果与分析
2.1 环境因子的日变化
植物光合作用的高低受内部生理因素及外部环境(光照、温度、CO2浓度、大气相对湿度等)因子共同影响,环境因子的日变化直接影响植物光合作用的日变化。由图1可知, 光合有效辐射(PAR)及气温从7:00到19:00呈单峰曲线, 在7:00左右的光合有效辐射及气温分别为 86 μmol·m-2s-1、29.0℃,在13:00时PAR及气温达到最高,分别为1 321 μmol·m-2s-1、39.0℃,之后又逐渐降低。大气相对湿度的日变化呈不规则的“V”型,7:00左右最高为63%,随着气温的升高,大气相对湿度逐渐降低,到15:00时最低为39%,下午随着PAR的降低而逐渐升高,到19:00大气相对湿度达57%以上。大气CO2浓度在7:00最高, 随着植物光合作用的进行,CO2浓度逐渐降低,到15:00左右CO2浓度达到最低,之后又逐渐升高。
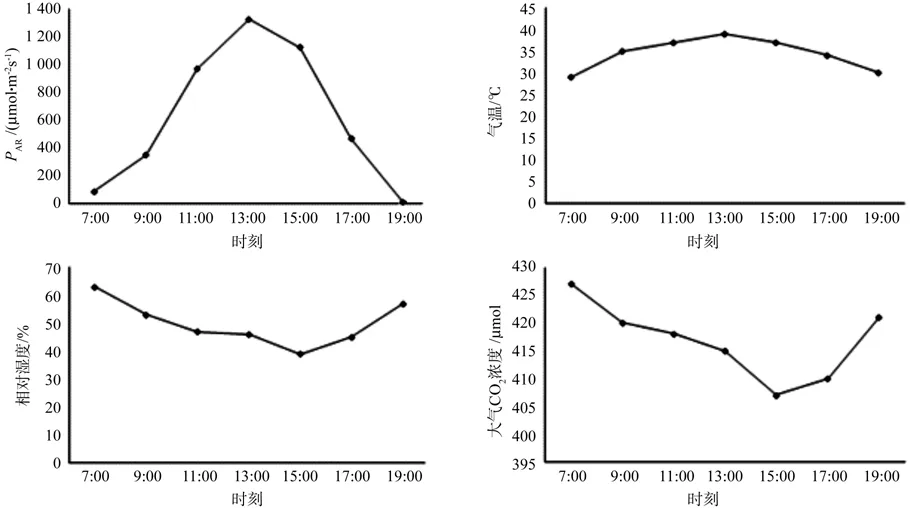
图1 环境因子日变化Fig.1 Diurnal variation of environmental factors
2.2 水分胁迫对刨花润楠生长的影响
由表1可知, 随着水分胁迫的加重, 刨花润楠幼苗的生长均受到不同的影响,轻度水分胁迫对刨花润楠幼苗的苗高、地径、叶片总数、地上鲜质量、根系鲜质量等影响不明显(P>0.05);中度水分胁迫使刨花润楠的地径、株高、叶片总数、地上鲜质量和地上干质量分别降低了29.88%、6.61% 、32.39%、36.11%,差异显著(P<0.05);重度干旱使刨花润楠幼苗的地径、株高、叶片总数、地上鲜质量和地上干质量分别降低了50.56%、34.60%、41.31%、58.33%, 差异显著(P<0.05)。轻度干旱(LS)、中度干旱(MS)、重度干旱(SS)分别使刨花润楠幼苗叶片总数从38.3降低到34.2、16.3、12.5。分枝数是植物生长的指标之一,由表2可知,在正常供水下,刨花润楠幼苗的分枝数为2.6,在轻度干旱下的分枝数为1.5,而在中度干旱和重度干旱胁迫下刨花润楠幼苗的分枝数均为0,说明水分胁迫对刨花润楠幼苗的生长产生严重影响。

表1 水分胁迫对刨花润楠幼苗生长的影响†Table 1 Effects of water stress on the growth of seedlings Machilus pauhoi
2.3 水分胁迫对刨花润楠叶绿素含量的影响
叶绿素是植物光能吸收、传递和转换的物质基础,其质量分数的高低是反映植物光合强度的重要生理指标之一[18]。如表2所示, 随着水分胁迫的加重, 刨花润楠幼苗叶片的叶绿素a、叶绿素b及总叶绿素含量均呈降低趋势。与正常供水(CK)相比, 轻度干旱(LS)对刨花润楠幼苗的叶绿素a、叶绿素b及总叶绿素含量的影响不显著(P>0.05);中度干旱使刨花润楠幼苗的叶绿素a、叶绿素b及总叶绿素含量分别降低了37.26%、28.94%、35.07%, 差异显著(P<0.05);重度干旱使刨花润楠幼苗叶片的叶绿素a、叶绿素b及总叶绿素含量分别降低了51.89%、47.37%、50.69%, 差异极显著(P<0.05)。

表2 水分胁迫对刨花润楠叶绿素含量的影响Table 2 Effects of water stress on chlorophyll content of seedlings Machilus pauhoi
2.4 水分胁迫对刨花润楠光合日变化的影响
净光合速率(Pn)的高低直接体现了植物同化CO2的能力,也是植物高光效品种选育的重要指标,一般与气孔导度(Gs)呈正相关关系[19]。由图2可知,在不同水分含量的处理下,刨花润楠幼苗的Pn、Tr及Gs均呈双峰曲线,有明显的光合午休现象,Pn、Tr及Gs的第一个峰值分别出现在11:00、13:00、9:00,第二个峰值均出现在17:00。在轻度水分胁迫下,刨花润楠幼苗的Pn、Tr、Gs日变化的平均值分别比对照降低了14.58%、30.88%、32.99%,差异显著(P<0.05);在中度水分胁迫下,刨花润楠幼苗的Pn、Tr、Gs日变化的平均值分别比对照降低了30.80%、57.35%、67.01%%,差异显著(P<0.05);在重度水分胁迫下,刨花润楠幼苗的Pn、Tr、Gs日变化的平均值分别比对照降低了55.24%、80.15%、83.51%%,差异显著(P<0.05)。由以上分析可以看出,水分胁迫对刨花润楠幼苗Tr的影响最大,对Pn的影响较小。4种水分处理下Ci的日变化曲线呈不规则的“V”型,最低值出现的时间段不一致。在正常供水条件的CK下,胞间CO2浓度较高,重度干旱胁迫下在9:00出现了低谷,主要原因是重度干旱下,刨花润楠幼苗的气孔关闭,光合作用消耗了叶片内部的CO2,而大气中的CO2不能顺利地通过气孔进入植物叶片内部;在下午之后刨花润楠幼苗的胞间CO2浓度整体呈上升趋势, 主要原因是下午随着光照强度的减弱,光合作用关键酶的活性受到抑制,无需消耗再多的CO2,从而使胞间CO2浓度升高。在4中水分胁迫处理下,刨花润楠幼苗的胞间CO2浓度日变化的平均值分别为:308(CK)、275(LS)、231(MS)、241(SS) mmol·m-2s-1。

图2 水分胁迫对刨花润楠光合日变化的影响Fig.2 Effects of water stress ondiurnal change of photosynthetic of seedlings Machilus pauhoi
2.5 水分胁迫对刨花润楠叶绿素荧光参数的影响
2.5.1 水分胁迫对刨花润楠叶片Fo、Fm、Fv/Fm和Fv/Fo的影响
Fo为初始荧光,表示植物叶片对外界光的全开放状态,它的大小与叶绿素浓度有关[20]。由图3可知,水分胁迫增加了刨花润楠幼苗的初始荧光Fo,轻度水分胁迫对刨花润楠幼苗的Fo影响不明显,中度干旱和重度干旱分别使刨花润楠幼苗的Fo增加了7.14%、13.33%,差异显著(P<0.05);Fm为暗适应下最大荧光,反映了植物在自然状态下体内光合机构的开放程度[21-22]。水分胁迫降低了刨花润楠幼苗的最大荧光Fm,轻度干旱(LS)、中度干旱(MS)、重度干旱(SS)下刨花润楠幼苗的最大荧光Fm分别比对照(CK)降低了7.92%、8.16%、13.81%,差异显著(P<0.05)。Fv/Fm反映了PSII最大光化学效率,Fv/Fm的高低变化常被用来判断植物是否受到了胁迫,随着干旱胁迫的加重,刨花润楠幼苗的Fv/Fm降低。在轻度干旱胁迫下,刨花润楠幼苗的Fv/Fm为0.76,说明轻度干旱胁迫并未对刨花润楠幼苗的生长产生胁迫;在中度干旱和重度干旱胁迫下,刨花润楠幼苗的Fv/Fm分别为0.74和0.71,说明在中度干旱胁迫下刨花润楠已经受到水分引起的胁迫。Fv/Fo值表示PSII潜在光化学活性,它是反映植物光能吸收转化机构的完整性。随着水分胁迫的加重,刨花润楠幼苗的Fv/Fo逐渐降低,说明水分胁迫影响了刨花润楠幼苗的潜在活性,与对照(CK)相比,轻度干旱(LS)、中度干旱(MS)、重度干旱(SS)使刨花润楠幼苗的潜在光化学活性分别降低了11.11%,19.44%、33.32%,差异显著(P<0.03)。
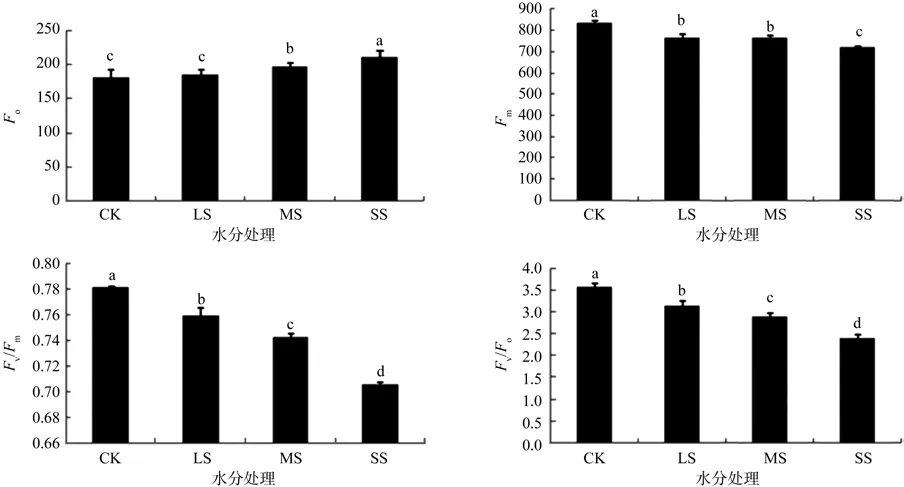
图3 水分胁迫对刨花润楠叶片Fo、Fm、Fv/Fm和Fv/Fo的影响Fig.3 Effects of water stress on the Fo, Fm, Fv/Fm and Fv/Fo of seedlings Machilus pauhoi
2.5.2 水分胁迫对刨花润楠ETR、ΦPSII、qP和NPQ的影响
光合电子传递速率(ETR)是植物光合代谢机构吸收的光能发生电荷分离产生电子沿光合电子传递链顺梯度传递的速率[23]。与对照(CK)相比,轻度干旱(LS)、中度干旱(MS)、重度干旱(SS)分别使刨花润楠幼苗的电子传递速率降低了33.78%、39.19%、68.91%,差异显著(P<0.05)。ΦPSII反映了植物在光合作用下PSII反应中心在环境胁迫下,部分关闭情况下的实际原初光能捕获效率,植物叶片的ΦPSII值越高,越有利于提高植物的光能转化效率[24-25]。水分胁迫显著降低了刨花润楠幼苗的实际光化学效率ΦPSII,且随着水分胁迫的加重,实际光化学效率ΦPSII降低程度越大。与正常供水(CK)相比,轻度干旱(LS)、中度干旱(MS)、重度干旱(SS)分别使刨花润楠幼苗的实际光化学效率ΦPSII降低了35.29%、41.17%、70.59%,差异显著(P<0.05)。
qP为光化学猝灭系数,它反映的是植物叶片PSII天线色素吸收的光能用于电子传递的份额,在一定程度上反映了PSII反应中心的开放程度,其值越大,说明PSII的光合机构活性越高[26]。由图4可知,水分胁迫使刨花润楠幼苗的影响与电子传递相似,轻度干旱(LS)、中度干旱(MS)、重度干旱(SS)分别比对照降低了12.50%、20.83%、52.08%,差异显著(P<0.05)。非光化学猝灭系数(NPQ)反映的是PSII天线色素吸收的光能不能用于光合电子传递而以热的形式耗散掉的部分[27]。随着水分胁迫的加重,刨花润楠幼苗的非光化学淬灭系数NPQ逐渐升高,与对照相比,轻度胁迫(LS)使刨花润楠幼苗的NPQ升高了2.52%,差异不显著(P>0.05);中度干旱(MS)及重度干旱(SS)分别使刨花润楠幼苗的NPQ分别升高了8.36%、16.36%,差异显著(P<0.05)。说明在干旱胁迫下,刨花润楠幼苗吸收的光能主要以热能的形式散发掉了,从而使光合速率下降,使刨花润楠幼苗的有机物积累减少。
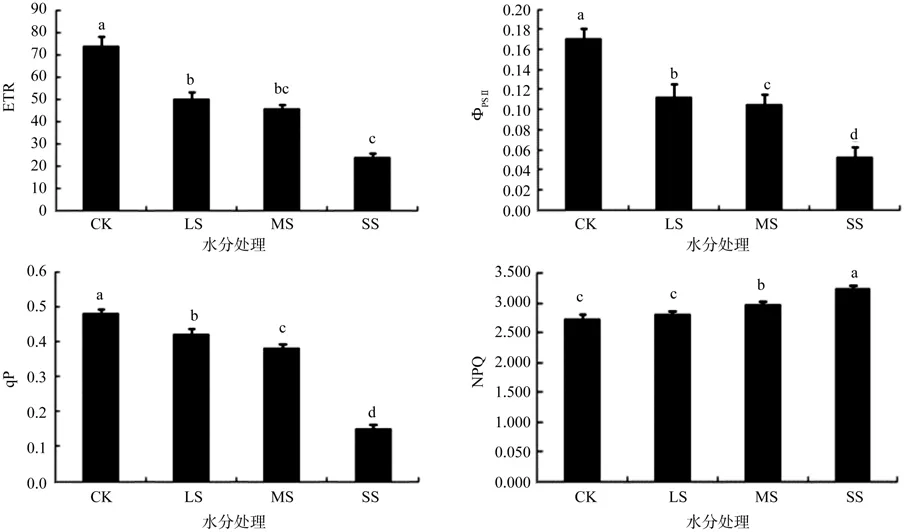
图4 水分胁迫对刨花润楠幼苗叶片ETR、ΦPSII、qP和NPQ的影响Fig.4 Effects of water stress on the ETR, ΦPSII, qP and NPQ of seedlings Machilus pauhoi
3 结论与讨论
水分胁迫是影响植物光合作用的最主要环境因子之一,它能够导致光合器官的损伤,从而抑制光合作用[28-29]。叶片净光合速率、气孔导度、蒸腾速率等光合参数通常是植物受外部环境因子(比如光照强度、CO2浓度、水分、气温和养分供应等)和内部生理反应(如光合酶活性、电子传递速率等)综合作用的结果。水分胁迫对刨花润楠幼苗的光合日变化及生长均有影响,但不同处理差异显著,通过研究发现,轻度干旱(LS)对刨花润楠幼苗的净光合速率及生长无明显影响,中度干旱(MS)及重度干旱(SS)均显著降低了刨花润楠幼苗的净光合速率、蒸腾速率、气孔导度及生长指标,且重度干旱(SS)要比中度干旱(MS)影响大。前人研究表明,在外界环境胁迫下,光合作用的限制因子可分为气孔因素和非气孔因素,如果气孔导度与胞间CO2浓度同时下降时,净光合速率下降主要是由气孔限制引起的,如果净光合速率的降低伴随着胞间CO2浓度的升高,光合作用的主要限制因素则是由植物叶片光合机构活性降低的非气孔因素引起的[30]。本研究发现,在轻度干旱(LS)及中度干旱(MS)胁迫下,净光合速率降低的同时,气孔导度及胞间CO2浓度均降低,说明在轻度干旱(LS)及中度干旱(MS)胁迫下,刨花润楠幼苗净光合速率的降低是由于气孔关闭引起的,减少水分蒸发,从而提高水分利用效率,这也是植物在长期进化过程中形成的一种自我保护机制。在重度干旱(SS)胁迫下发现,净光合速率降低,气孔导度也伴随降低,但是胞间CO2浓度有所升高,说明在重度干旱(SS)胁迫下已经破坏了刨花润楠幼苗叶片的光合机构功能及活性,进入叶肉细胞的CO2浓度不能及时同化,是由非气孔因素引起的。
戚冰洁等[31]认为,叶绿素含量的高低是影响植物光合效率的因素之一,不能单一的以叶绿素含量多少来推断植物光合作用的高低。许大全等[32]研究表明,仅仅在弱光下,光合速率会随叶绿素含量的增加而增高,存在良好的线性关系,而在饱和光下光合速率往往与叶绿素含量的多少无关。叶绿素是植物光合作用的主要色素。通过本研究发现,轻度干旱对刨花润楠幼苗的叶绿素含量无明显影响,而净光合速率等光合参数有所降低,说明轻度干旱使刨花润楠幼苗光合作用降低是通过气孔关闭引起的,主要是气孔因素影响了刨花润楠幼苗的光合效率,这与前人的研究结果相一致。
在正常情况下,植物体叶绿素吸收的光能主要通过光合电子传递、叶绿素荧光发射和热耗散三种途径来消耗,这三种途径之间存在着此消彼长的关系,光合作用和热耗散的变化会引起荧光发射的相应变化,因此,可以通过对荧光的观测来探究光合作用和热耗散的情况[33]。在干旱胁迫下最大光化学效率(Fv/Fm)的降低主要是用来反映PSII复合物的光抑制伤害,初始荧光值的升高主要是PSII部分反应中心失活而引起的[34]。通过研究发现,水分胁迫降低了刨花润楠幼苗的最大光化学效率(Fv/Fm)、实际光化学量子效率(ΦPSII)、PSII的潜在活性(Fv/Fo)、电子传递速率(ETR)及光化学猝灭系数(qP),且随着水分胁迫的加重均表现出逐渐降低的趋势,在重度干旱下影响最明显。由此可知,刨花润楠幼苗天线色素捕获的光能向PSII反应中心传递效率下降,同时热耗散能力增加,减少反应中心过剩光能的大量积累,从而降低了光合机构活性免受破坏。在重度水分胁迫下,初始荧光及非光化学猝灭系数显著升高,最大光化学效率及实际光化学效率都降低,表明此时刨花润楠幼苗PSII已经受到了损伤,由此可知,PSII光系统的损伤是非气孔因素降低刨花润楠幼苗净光合速率的主要原因。蒲光兰等[35]研究干旱胁迫对2年生金太阳杳的影响表明,干旱胁迫降低了金太阳杳最大光化学效率(Fv/Fm)、PSII的潜在活性(Fv/Fo)等参数,且各参数之间相关性随土壤相对含水量的下降而逐渐减弱。尹赜鹏等[36]研究表明,干旱胁迫对欧李荧光参数的日变化发现,适当的干旱胁迫对欧李的日变化没有明显影响,说明持续干旱胁迫并没有破坏欧李的光系统活性,恢复正常供水情况下,欧李能够恢复正常的生长,由此可知,欧李具有一定的抗旱性。由以上分析可知,刨花润楠幼苗的抗旱性较差,与对照相比,在轻度水分胁迫下各叶绿素荧光参数受到不同程度的抑制,因此,刨花润楠苗期适当的浇水及遮光有利于刨花润楠幼苗的正常生长。
[1]陈存及, 陈伙法.阔叶树种栽培[M]. 北京: 中国林业出版社,2000: 162-164.
[2]成俊卿.中国热带及亚热带木材识别、材性和利用[M]. 北京: 科学出版社, 1980: 194-195.
[3]李 泽, 谭晓风, 袁 军,等.4个油桐品种光合特性的日变化研究[J].中国农学通报,2013,29(25):12-15.
[4]何 凤, 王 森, 张 龙,等.两个金银花品种光合作用日变化的比较[J]. 经济林研究, 2015, 33(2): 40-44.
[5]魏爱丽, 王志敏, 翟志席,等. 土壤干旱对小麦旗叶和穗器官C4光合酶活性的影响[J].中国农业科学, 2003,36(5):508-512.
[6]吴玲利,雷小林,龚 春,等. 干旱胁迫对白木通光合生理特性的影响[J]. 中南林业科技大学学报, 2015, 35(11): 68-73.
[7]Kocurek V, Smutny V, Filova J. Chlorophyll fl uorescence as an instrument for the assessment of herbicide efficacy[J]. Cereal Res. Commun., 2009, 37(1):289-292.
[8]温胜房,李祥云.刨花润楠育苗与造林技术[J].广西林业科技,2008,24(2):115-116.
[9]童国华.坡向与造林密度对刨花润楠幼林生长的影响[J].福建林业科技,2010,37(4):70-72.
[10]胡希华.刨花润楠的优良特性及育苗栽培技术[J].湖南林业科技,2006,33(1):65-66.
[11]陈国彪.刨花楠的利用与培育技术[J].广西林业科学,2004,33(4): 212-213.
[12]王智威, 牟思维, 闫丽丽, 等. 水分胁迫对春播玉米苗期生长及其生理生化特性的影响[J].西北植物学报, 2013, 33(2):0343-0352.
[13]Mauro Centritto1, Federico Brilli, Roberta Fodale,et al. Different sensitivity of isoprene emission, respiration and photosynthesis to high growth temperature coupled with drought stress in black poplar(Populus nigra) saplings [J]. Tree Physiology, 2011,31, 275-286.
[14]张宪政.植物叶绿素含量测定-丙酮乙醇混合液法[J].辽宁农业科学,1986(3):26-28.
[15]Arnon D I. Copper enzymes in isolated chloroplasts.Polyphenoloxidase in Beta vulgaris[J]. Plant Physiol., 1949, 24: 1-15.
[16]李 泽, 谭晓风, 卢 锟,等.供镁水平对油桐幼苗生长及光合特性的影响[J].生态学杂志,2015,34(9):2440-2447.
[17]Roháček K. Chlorophyll fl uorescenceparameters: thede fi nitions photosynthetic meaning and mutual relationships[J].Photosynthetica, 2002, 40(1): 13-29.
[18]郑顺林, 杨世民, 李世林,等. 氮肥水平对马铃薯光合及叶绿素荧光特性的影响[J]. 西南大学学报:自然科学版, 2013,35(1): 1-9.
[19]吴玲利,熊 利,柯镔峰,等.3个木通品种光合特性比较研究[J]. 经济林研究, 2015, 33(2), 46-48.
[20]尤 鑫,龚吉蕊. 叶绿素荧光动力学参数的意义及实例辨析[J].西部林业科学, 2012,41(5):90-94.
[21]宗 梅, 谈 凯, 吴甘霖. 两种石楠叶绿素荧光参数日变化的比较研究[J].生物学杂志, 2010,27(1): 27 -30.
[22]李 泽, 谭晓风, 卢 锟,等.根外追肥对油桐幼苗生长、光合作用及叶绿素荧光参数的影响[J]. 中南林业科技大学学报,2016, 36(2): 40-44.
[23]孙景宽,张文辉,陆兆华,等.干旱胁迫下沙枣和孩儿拳头叶绿素荧光特性研究[J]. 植物研究, 2009,259(2): 216-223.
[24]Martinez-Carrasco R, Sanchez-Rodriguez J, Perez P. Changesin chlorophyll fl uorescence during the course of photoperiodand in response to drought inCasuarina equisetifolia[J].Forst and Forst.Photosynthetica, 2002,40 (3): 363-368
[25]吕芳德, 徐德聪, 侯红波. 5 种红山茶叶绿素荧光特性的比较研究[J].经济林研究, 2003, 21 (4) : 4-7.
[26]Guo C F, Sun Y, Tang Y H,et al. Effect of water stress on chlorophyll fl uorescence in leaves of tea plant (Camellia sinensis)[J]. Chinese Journal of Eco-Agriculture, 2009, 17(3): 560-564.
[27]Bader M R, von Caemmerer S, Ruuska S,et al. Electron fl ow to oxygen in higher plants and algae: rates and control ofdirect phot oreducti on (Mehler reaction) and rubiscooxygenase[J].Biol. Sci.,2000, 355: 1433-1446
[28]Guo W H, Li B, Huang Y M,et al.Effectsof different water stresses on ecophysiological characteristicsofHippophaerhamnoidesseedlings[J].Acta. Bot. Sin., 2003.45 (10): 1238-244
[29]李庆华. 稀土元素镧对刺槐幼苗抗旱性的影响 [J].中南林业科技大学学报, 2014, 34(12) : 62-65.
[30]Farquhar G D. Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Physiology, 1982,33:317-345.
[31]戚冰洁, 汪吉东, 马洪波, 等.盐胁迫对不同基因型(品系)甘薯苗期光合特性的影响[J]. 生态学杂志, 2012, 31(12):3102-3108.
[32]许大全.叶绿素含量的测定及其应用中的几个问题[J]. 植物生理学通讯,2009,45 (9): 896-898.
[33]Pererson R B, Sivak M N, Waiker D A. Relationship betweensteady-state fluorescence yield and photosynthetic ef fi ciency inspinach leaf tissue [J]. Plant Physiol., 1998, 88(1):158-163.
[34]Maxwell K, Johnson G N.Chlorophyll fluorescence-a practicalguide [J]. J. Exp. Bot., 2000, 51: 659-668.
[35]蒲光兰, 周兰英, 胡学华, 等.干旱胁迫对金太阳杏叶绿素荧光动力学参数的影响[J].干旱地区农业研究,2005,23(3):44-48.
[36]尹赜鹏, 刘雪梅, 商志伟,等.不同干旱胁迫下欧李光合及叶绿素荧光参数的响应[J]. 植物生理学报, 2011,47(5):452-458.
Effects of water stress on photosynthetic physiological characteristics ofMachilus pauhoiseedlings
LIU Quan-yong1a,1b,2, LU Kun1a,1b, LI Ze1a,1b, LV Jia-bin1a,1b, TAN Xiao-feng1a,1b
(1a. Key Laboratory ofCultivation and Protection for Non-Wood Forest Trees, Ministry of Education; 1b. Cooperative Innovation Center of Cultivation and Utilization for Non-Wood Forest Trees ofHunan Province,Central South University of Forestry and Technology,Changsha 410004, Hunan, China; 2.Forestry bureau of Chaling county Chaling 410004, Hunan, China)
In order to provide theoretical basis for different water and fertilizer managements and water resistance cultivation, a pot experiment was conducted to study the physiological and biochemical responses and chlorophyll fl uorescence parameters to reveal the effect of drought stress on photosynthesis and associated physiological characters ofMachilus pauhoiseedlings. The results showed that there was an apparent photosynthetic lunch break phenomenon and the net photosynthetic rate(Pn), transpiration rate(Tr), stomatal conductance(Gs) in the diurnal variation of seedingsMachilus pauhoiwere double-peak curve at four levels of water stress.there is no significant effect on net photosynthetic rate(Pn)、Foand NPQ of Machiluspauhoi seedlings under light drought stress; When under modest andsevere drought stress, the chlorophyll content, net photosynthetic rate(Pn), transpiration rate(Tr), stomatal conductance(Gs),intercellular CO2concentration(Ci), electron transfer rate(ETR), the maximum photochemical ef fi ciency(Fv/Fm), ΦPSII,Fv/Foand qP ofMachilus pauhoiseedling sdecreased signi fi cantly(P<0.05),whileFoand NPQ increased signi fi cantly (P<0.05). Under light and modest drought stress, the photosynthesis reduce ofMachilus pauhoiseedlings was primarily caused by stomatal closure while the decrease of net photosynthetic rate was considered as a result of non-stomatal factors under severe drought stress condition.
Machilus pauhoi; water stress; photosynthetic characteristics; chlorophyll fl uorescence
S718.43
A
1673-923X(2016)09-0029-07
10.14067/j.cnki.1673-923x.2016.09.006
2015-04-19
国家林业公益性行业科研专项“红壤丘陵区经济林生态经营关键技术研究”(201104052);优良乡土树种刨花楠丰产栽培技术推广项目([2012]XT07)
刘全勇,硕士研究生
谭晓风,教授,博士,博士生导师;E-mail:tanxiaofengcn@126.com
刘全勇,卢 锟,李 泽,等.水分胁迫对刨花润楠幼苗生长及光合特性的影响[J].中南林业科技大学学报,2016, 36(9):29-35, 43.
[本文编校:谢荣秀]
