小麦条锈病菌夏孢子在水稻叶片上的侵染动态
2016-12-17张重梅章振羽姬红丽胡培松彭云良
张重梅,章振羽,姬红丽,胡培松,彭云良, *
(1.四川省农业科学院植物保护研究所/农业部西南作物有害生物综合治理重点实验室,四川 成都 610066;2.华中农业大学植物科学技术学院,湖北 武汉 430070;3.中国水稻研究所,浙江 杭州 311404)
小麦条锈病菌夏孢子在水稻叶片上的侵染动态
张重梅1, 2,章振羽1,姬红丽1,胡培松3,彭云良1, 3*
(1.四川省农业科学院植物保护研究所/农业部西南作物有害生物综合治理重点实验室,四川 成都 610066;2.华中农业大学植物科学技术学院,湖北 武汉 430070;3.中国水稻研究所,浙江 杭州 311404)
水稻是一种对已知所有锈菌免疫的重要粮食作物,从组织和细胞水平研究锈菌与水稻之间的互作关系对于利用水稻抗锈性机制具有重要意义。通过系统观察小麦条锈病菌夏孢子在水稻品种丽江新团黑谷叶片上的侵染过程,发现小麦条锈菌混合菌株的夏孢子在水稻叶片上附着不稳定。在静置叶片上病菌夏孢子能够萌发、侵入,并形成气孔下囊、侵染菌丝、吸器母细胞、吸器、次生菌丝等结构,但是自侵入起便受到丽江新团黑谷对其侵染和扩展的抵抗,表现在侵染各个环节成功率均显著低于在小麦感病品种铭贤169叶片上的成功率。接种后5 d内夏孢子芽管侵入气孔并形成气孔下囊、气孔下囊产生初级侵染菌丝、初生侵染菌丝产生吸器母细胞和/或吸器的比率分别比在铭贤169叶片上低51.01 %、53.99 %和43.05 %;自接种后3 d开始,侵染点便开始逐渐出现越来越强烈的水稻气孔细胞和/或叶肉细胞的坏死反应;最终孢子床和孢子堆发育则完全未发生。研究结果表明,水稻对小麦条锈病菌的非寄主抗性涉及预成型抗性和诱导抗性等多种抗性机制。
水稻;小麦条锈病菌;夏孢子; 侵染结构;非寄主抗性
由禾柄锈菌(Pucciniastriiformisf. sp.tritici)引起的小麦条锈病是我国乃至全世界小麦生产中危害最严重的病害之一[1-2]。国内外生产实践表明,选育和种植抗病品种是防治小麦条锈病最经济、有效并对环境安全的措施。但是由于小麦条锈菌毒性生理小种和毒性类型组成复杂,变异较快,抗性品种在大面积推广3-5年后即丧失抗性,造成病害反复暴发流行,已成为抗病品种选育和利用中的瓶颈问题[3-8]。选育具有持久抗性的品种,是小麦抗条锈病育种的主要努力方向[9-19]。目前所发现的小麦持久抗病品种均为在特定地区种植而长期表现的抗病品种,未经过真正长期大面积的考验,国内大面积生产品种中持久抗病品种尚未见报道[20]。非寄主抗性是植物对绝大多数潜在病原菌所表现出的最基本的抗病形式,能够对病原菌种类中所有个体表现出高抗至免疫程度抗性,因而利用非寄主抗性控制基因,被认为是选育持久抗性品种的有效途径[21-22]。水稻对已知的所有锈菌免疫,作为禾本科作物中的一个特例已引起广泛注意,其对不同锈菌的非寄主抗性的研究近几年来也取得了多方面进展[21-26]。本研究系统观察了小麦条锈病菌在水稻对稻瘟病等多种病害感病的品种丽江新团黑谷以及小麦普感条锈品种铭贤169离体叶片上的侵染动态,以期了解水稻对条锈病菌非寄主抗性的复杂程度并为分阶段研究其非寄主抗性机制奠定基础。
1 材料与方法
1.1 供试品种与菌株
水稻品种为丽江新团黑谷(LTH),对稻瘟病所有测试菌株、纹枯病、白叶枯病和水稻黑条矮缩病等病毒病均表现感病[27-29],由四川省农业科学院植物保护研究所保存和繁殖。小麦品种铭贤169感染小麦条锈病菌所有菌株,由中国农业科学院植物保护研究所繁殖和提供。小麦条锈菌菌株CM42-12,分离自四川郫县,属贵农22致病类型[30]。混合菌株为2012年分离自四川各地的小麦条锈病菌混合夏孢子。
1.2 菌株繁殖
条锈菌株在低温室内于感病品种铭贤169 上隔离繁殖,混合菌株在网室水泥池里种植的铭贤169上繁殖,分别收集其新鲜夏孢子进行接种实验。
1.3 接种方法
当LTH长至3叶1心、铭贤169第1叶完全展开时进行接种。离体叶片接种时,先剪取健康且长势一致的LTH心叶、铭贤169第1叶,正面向上贴于铺有湿润滤纸的培养皿中,以0.02 %吐温20配制2 mg/mL夏孢子悬浮液,采用喷雾法接种[31]。活体接种时,则用毛笔蘸取新鲜夏孢子粉并均匀的轻涂于LTH心叶和(或)铭贤169第1叶叶片正表面,用含0.02 %吐温20溶液喷雾,黑暗保湿24 h后将接种幼苗转移到低温光照培养室继续培养。
1.4 条锈夏孢子附着动态的观察
铭贤169离体叶片接种条锈菌混合菌株后,于8~12 ℃黑暗保湿条件下静置15 min、30 min、1 h、3 h和6 h,然后在含300 mL蒸馏水的500 mL试剂瓶中17 ℃、170 r/min振荡10 min,经蒸馏水中漂洗2次,每次5 s,最后在LEICA体视显微镜10倍目镜下计数叶片中部3.5 cm叶段的夏孢子数目,每处理6个重复。根据铭贤169上条锈菌夏孢子附着动态,在接种、静置6 h后观察病菌在LTH、铭贤169上附着差异:离体叶片于含300 mL蒸馏水的500 mL试剂瓶中17 ℃、160 r/min振荡10 min,再于蒸馏水中漂洗2次,每次5 s,最后于在LEICA体视显微镜10倍目镜下计数叶片中部喷雾接种区域2.5 cm叶段的夏孢子数目,对照组的LTH和铭贤169叶片不振荡洗涤,静置6 h后直接观察,每处理9个重复。
1.5 夏孢子萌发、侵染和扩展观察
LTH和铭贤169叶片喷雾接种CM42-12新鲜夏孢子悬浮液后,于8~12 ℃黑暗保湿条件下静置24 h后,立即镜检叶片中部4cm叶段表面的孢子数目和芽管数目,每处理3个重复。于接种后12 h, 1 d, 2 d, 3 d, 5 d, 7 d, 14 d, 22 d取样,将接种的铭贤169、LTH叶片剪成 2 cm 的叶段,按康振生[32]等方法进行整叶透明处理和荧光染色处理,每处理6个重复。夏孢子在叶片上的侵染动态观测在Nikon eclipse 80i荧光显微镜及Nikon DS-Ril 生物显微镜上进行,观测时调查并记载不同时间每叶段上夏孢子芽管抵达和侵入气孔、产生气孔下囊、形成初级侵染菌丝、吸器母细胞和吸器等结构的比率,以及侵染点中发生可见坏死反应的比率,
1.6 数据处理
用数据统计分析软件DPS v7.05对数据进行统计分析。
2 结果与分析
2.1 小麦条锈病菌夏孢子在LTH叶片上的附着
接种的铭贤169叶片静置不同时间并经振荡漂洗处理后,镜检叶片上粘附的夏孢子数目,发现从15 min到6 h,附着孢子数随着静置时间的增长而增多(图1),静置15 min、30 min和1 h后,3.5 cm铭贤169叶段上经震荡漂洗后后平均残留孢子数分别为 0.50、1.17、和 9.33,附着率分别为0.10 %、0.23 %、1.83 %。当静置3和6 h后,经震荡漂洗后叶段上平均残留夏孢子数分别为 38.33和 61.67,显著高于静置时间1 h以下的附着夏孢子数,附着率分别为7.53 %和12.11 %。

图1 小麦条锈病菌夏孢子接种铭贤169叶片上不同时间后稳定附着的夏孢子数目Fig.1 Number of adhered urediniospores of Pucccinia striiformis f. sp. tritici on Mingxian 169 at different times after inoculation
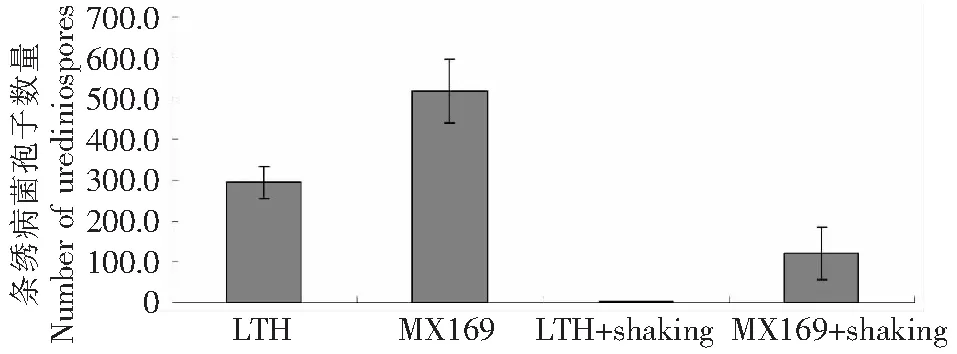
图2 小麦条锈病菌夏孢子在LTH叶片和铭贤169叶片上的附着Fig.2 Number of adhered urediniospores of Pucccinia striiformis f. sp. tritici 6h post inoculation of leaves of LTH and Mingxian 169
观察条锈夏孢子分别在LTH和铭贤169叶片上接种后静置6 h后,2.5 cm 长LTH叶段上平均有295个夏孢子,铭贤169相同长度的叶片上平均有518个孢子,经过振荡处理的LTH叶段上约有3个孢子,而铭贤169叶段上有121个孢子,差异均极为显著(P<0.01)。静置6 h后经振荡漂洗处理,小麦条锈夏孢子在LTH上的附着率仅有1.06 %,而在条锈病菌寄主铭贤169上的附着率则达23.26 %。
2.2 小麦条锈病菌夏孢子在LTH叶片上的萌发
直接在体视显微镜下观察LTH和铭贤169叶片上夏孢子的萌发,发现接种后1 d,条锈病菌菌株CM42-12的夏孢子在LTH叶片上萌发率平均为5.07 %,而在铭贤169上的萌发率为6.88 %,两者间差异不显著(P>0.05)。
2.3 小麦条锈病菌夏孢子在LTH叶片上侵染结构的形成
分别于接种后 12 h、1 d、2 d、3 d、5 d、7 d、14 d和22 d 取样进行组织学观察来了解Pst夏孢子在水稻LTH叶片上的生命发展过程(图4),在接种后12 h小麦条锈菌夏孢子即在LTH叶片上萌发产生芽管;在接种后1 d 芽管进一步伸长扩展,仅有少数芽管侵入气孔并形成气孔下囊;在接种后2 d,有的侵染点的气孔下囊已有初生侵染菌丝产生;在接种后3 d多数侵染点仍停留在气孔下囊或气孔下囊加初生侵染菌丝阶段,并在侵染点开始出现细胞坏死,极少数侵染点有少量次生侵染菌丝和吸器母细胞形成;在接种后5 d多数侵染点仍停留在气孔下囊或气孔下囊加初生侵染菌丝阶段,这些发育停滞的侵染点都发生了明显的细胞坏死,极少数侵染点形成更多的次生侵染菌丝和次生吸器母细胞;在接种后7 d,除了多数发育停滞、细胞明显坏死的侵染点外,少数侵染点形成较多次生侵染菌丝、次生吸器母细胞和少量吸器,并在LTH叶片上形成了小菌落;在接种后14 d,在LTH叶片上可以见到不同大小的侵染点,有的仅限制在气孔区域(图5,h-i),有的则侵染气孔周围数十个叶肉细胞(图5,b, d),有的则形成较大的菌落侵染数百个叶肉细胞(图5,k-l),叶片上未有孢子床或夏孢子堆的形成;接种后22 d,在LTH叶片上,所有的侵染点都可见强烈的细胞坏死反应,仍无孢子床或夏孢子堆的产生(图6)。

图3 小麦条锈病菌接种后1 d夏孢子分别在LTH叶片和铭贤169上的萌发率Fig.3 Percentage of germinated urediniospores of Pucccinia striiformis f. sp. tritici 1 dpi on leaves of LTH and Mingxian 169 1 day post inoculation
在观察中还发现,有大量夏孢子在LTH叶片上萌发产生芽管后,经过2个以上气孔却仅在气孔上略微膨大而未能侵入气孔(图7,a-b),有少量的夏孢子在LTH叶片上萌发后未侵入气孔,而是直接在叶片表面形成类似于附着胞、气孔下囊、初级侵染菌丝甚至是吸器母细胞等侵染结构(图7,c-h)。
对小麦条锈菌在水稻品种LTH和小麦品种铭贤169上的侵染过程进行比较,发现小麦条锈菌夏孢子在LTH叶片上和在铭贤169叶片上侵染发育过程的关键环节存在差异。
如果将夏孢子芽管从气孔上经过或是芽管顶端抵达气孔的状态视为Pst定位了气孔,则如表1所示,条锈菌夏孢子芽管在LTH和铭贤169叶片上定位气孔的比率之间无显著差异。
在接种后12 h,小麦条锈病菌夏孢子在LTH和铭贤169叶片上萌发产生芽管,未观察到芽管已侵入LTH叶片气孔,在铭贤169叶片上有部分芽管已侵入气孔产生气孔下囊(图4,a-b)。

a和b为样品经苯胺蓝染色在光学显微镜下观察所得,c~p均为经荧光增白剂染色在荧光显微镜下观察所得图4 小麦条锈菌分别在LTH和铭贤169上的侵染过程Fig.4 The infection process of urediniospores of Pucccinia striiformis f. sp. tritici on rice (LTH) and wheat (Mingxian 169, MX169) leaves
在接种后1 d,仅有约7.54 %定位了气孔的夏孢子的芽管侵入LTH叶片气孔并形成气孔下囊,而有约59.53 %定位了气孔的夏孢子的芽管侵入铭贤169叶片气孔形成气孔下囊,即此时Pst夏孢子萌发后侵入LTH和铭贤169气孔的比率分别为3.75 %和30.36 %,夏孢子成功侵入LTH气孔的比率极显著低于侵入铭贤169气孔的比率(P<0.01),并且此时在LTH叶片上几乎没有初生侵染菌丝生成,在铭贤169叶片上已有少量的初生侵染菌丝甚至是初生吸器母细胞形成(图4,c-d)。
在接种后2 d,在LTH和铭贤169上成功定位气孔的夏孢子中,分别有23.17 %和55.19 %的夏孢子形成了气孔下囊,差异极显著(P<0.01),而气孔下囊下产生初生侵染菌丝的比率分别为55.28 %和88.27 %,两者间无显著差异。此时在LTH叶片上未观察到侵染点有生成明显的吸器母细胞,而在铭贤169叶片上已有较多侵染点有初生吸器母细胞形成(图4,e-f)。
在接种后5 d,在LTH叶片上,少数侵染点开始形成少量次生侵染菌丝及吸器母细胞,初生侵染菌丝形成了初生吸器母细胞的侵染点的比率约为28.33 %,约55.35 %的侵染点则停滞在形成气孔下囊或初级侵染菌丝阶段,这些发育停滞的侵染点都发生了明显的细胞坏死,在铭贤169上,初生侵染菌丝形成了初生母细胞的侵染点的比率约为71.38 %,观察到侵染点有更多的次生菌丝及吸器母细胞形成,未观察到铭贤169组织有明显的坏死反应(图4,i-j)。
在接种后7 d,Pst夏孢子萌发后侵入LTH和铭贤169的比率分别为18.14 %和56.96 %,产生初生侵染菌丝的比率分别约为9.00 %和47.15 %,产生吸器母细胞及吸器的比率分别为5.01 %和41.35 %,差异均极显著(P<0.01),此外在LTH叶片上约73.17 %的侵染点发生了细胞坏死,未观察到铭贤169组织有明显的坏死反应(图4,k-l)。
表1 小麦条锈病菌夏孢子萌发后在LTH和铭贤169离体叶片上芽管抵达气孔、抵达气孔后形成气孔下囊、气孔下囊产生初级侵染菌丝、侵染菌丝形成吸器母细胞/吸器的比例
Table 1 Accomplishment ratio of different infection stages ofPucciniastriiformisf. sp.triticion theinvitroleaves of rice (LTH) and wheat (Mingxian 169)

接种后时间Times(dpi)Timespostinoculation芽管抵达气孔比例(%)Arrivalatstomata抵达后气孔形成气孔下囊(%)Penetrationandformingsub-stomatalvesicle气孔下囊产生初级侵染菌丝(%)Primaryinfectinghyphaefromappresorium侵染菌丝形成吸器母细胞/吸器(%)HMC/HfrominfectinghyphaeLTH铭贤169LTH铭贤169LTH铭贤169LTH铭贤169159.78±8.1352.30±10.93ns1)7.54±10.7259.53±27.42**0±0.0036.51±33.25*--272.57±13.8861.26±10.10ns23.17±13.5055.19±16.70**55.28±34.1688.17±20.21ns--368.46±6.8969.07±6.86ns51.53±35.5379.34±22.44ns54.63±37.5385.82±17.46ns--571.06±12.5059.28±29.04ns29.61±12.1180.62±13.68**33.42±39.1587.41±19.52*28.33±40.2171.38±18.22*773.42±5.1466.43±17.48ns24.69±4.5685.90±9.81**50.22±24.1681.19±18.89*49.17±40.7983.13±23.02ns
注:1)利用t-检测比较了小麦条锈菌分别在水稻LTH叶片和小麦铭贤169叶片上侵染的4个环节的完成率差异,其中*表示在P=0.05的水平上存在显著差异,**表示在P=0.01的水平上存在极显著差异,ns表示没有显著差异。 Note:1)t-tests were used to compare the accomplishment ratio of the infection stages on LTH and Mignxian169 leaves. *and **:respectively indicating the significant difference atP<0.05 andP≤ 0.01 level and ns indicate no significant difference.
表2 小麦条锈菌侵入LTH和铭贤169叶片后侵染点坏死比率
Table 2 The ratio of the infection sites with necrosis at different times after the inoculation ofPucciniastriiformisf. sp.triticion the laves of rice (LTH) and wheat (Mingxian 168)

接种后时间Times(dpi)侵染点坏死率(%)TheratioofinfectionsiteswithnecrosisLTH铭贤169555.35±36.690.00±0.00*1)773.17±29.480.00±0.00**1474.18±10.20-22100.00±0-
注:1)t-检测用于比较水稻LTH叶片和小麦铭贤169叶片上侵染位点发生坏死的比率差异,其中*表示在P=0.05的水平上存在显著差异,**表示在P=0.01的水平上存在极显著差异。 Note:1)T-tests were used to compare the accomplishment ratio of rust infection stages at infection sites on rice and wheat leaves. *,**:Indicate the values of differ significantly atP<0.05 andP≤ 0.01 according tot-test, respectively. ns indicate no significant difference.

a~d 显示LTH上的侵染位点伴随较少/轻微的细胞坏死。e~i显示LTH上的侵染位点伴随相对较强的细胞坏死。j显示在铭贤169上,条锈菌菌丝的扩展不受维管束限制。k~l显示在LTH上,条锈菌菌丝的扩展受到维管束限制。a和g为LTH叶片接种后7d经荧光增白剂染色后在荧光显微镜下观察所得,b~f、h~i及k~l为LTH叶片接种后14d经荧光增白剂染色后观察所得,g为铭贤169叶片接种后14d经荧光增白剂染色后观察所得。GT :芽管, SSV:气孔下囊, PH:初生侵染菌丝, HMC:吸器母细胞, H:吸器. 标尺:25 μm图5 小麦条锈菌在LTH和铭贤169离体叶片上的侵染位点及侵染结构Fig.5 Infection structures and infection sites of Puccinia striiformis f. sp. tritici on/in in vitro leaves of rice (LTH) and wheat (Mingxian 169, Mx169) leaves
在接种后14 d,在LTH叶片上可以见到不同大小的侵染点(图5,b,d, h, i, k, l),约74.18 %的侵染点发生了细胞坏死,不同的侵染点受到的LTH对其的抵抗程度也存在较大变化,表现不同的侵染点发生的细胞坏死程度不一(图5,b-f, h-i, k-l),此外还可以发现在各侵染点条锈菌菌丝的扩展受到叶脉的限制(图5,b, h, i),在铭贤169叶片上,条锈菌菌丝大片纠结,并已形成大量的夏孢子堆或孢子床(图4,m-n)。
在接种后22 d,在LTH叶片上,所有的侵染点都已发生较为强烈的细胞坏死反应,各个侵染点的锈菌的进一步扩展和发育受阻,仍无夏孢子堆的产生(图6)。在铭贤169叶片上则布满夏孢子堆或孢子床,并且夏孢子堆中部分夏孢子已经萌发并有较长芽管生成(图4,o-p)。
2.4 LTH叶片接种条锈菌夏孢子后的表观特征
在LTH和铭贤169离体叶片上喷接新鲜夏孢子悬液,在接种后14d, 在LTH叶片上仅形成少量淡褐色微小坏死斑,此时在铭贤169叶片上已形成大量黄色夏孢子堆,在接种后22 d, LTH叶片上形成的少量比较明显的坏死斑,呈深褐色细短条状,但此时仍无夏孢子堆产生。

a和b显示芽管从LTH叶片气孔上经过而不侵入(白色箭头所示)。c~f显示夏孢子在LTH叶表分化形成类似气孔下囊及初生侵染菌丝的结构。g显示夏孢子在LTH叶片气孔上形成附着胞类似结构。h显示夏孢子在LTH叶表形成类似气孔下囊、初生侵染菌丝以及初生吸器母细胞的结构。S:夏孢子,GT:芽管,SL气孔下囊类似结构,PL初生侵染菌丝类似结构,AL附着胞类似结构, HL吸器母细胞类似结构。标尺:25 μm图7 小麦条锈菌夏孢子在LTH叶片表面的发育分化现象Fig.7 The differentiation of Pst on the surface of in vitro leaves of rice (LTH)

a接种后14 d在LTH叶片上仅形成微小的浅褐色病斑而在铭贤169叶片上已形成了大量夏孢子堆。b接种后22 d仅在LTH叶片上形成一些深褐色病斑,而在铭贤169叶片上夏孢子堆几乎占据了整个叶片图8 LTH和铭贤169叶片接种小麦条锈菌后的宏观特征Fig.8 The external symptoms on the in vitro leaves of rice (LTH) and wheat (Mingxian 169) infected by Pst
3 讨 论
锈菌目真菌寄主广泛,包括了裸子植物、被子植物中单子叶植物和双子叶植物的众多种类,在长期历史进化过程中,仅对水稻、烟草等少数植物未进化出致病类型。非寄主抗性具有广谱高效、稳定持久的特点,而转基因技术的发展,使非寄主抗性传递给病原菌寄主成为可能,因此人们对非寄主抗性分子机理研究的兴趣日益增加。一般认为植物对于真菌、细菌以及卵菌的非寄主抗病性可分为Type I型和Type II型两种。Type I型即无明显症状型非寄主抗性,是指当某种植物的病菌接种到另外一种植物时,表现出没有明显肉眼可见的症状(HR)的现象。此类非寄主抗性主要是依靠植物细胞壁的物理强度、细胞骨架、产生和积累胼胝质、酚类、抗毒素、PR蛋白等抗菌物质来抑制病原微生物的侵入与定殖,从而与植物预成型抗性关系密切。而Type II型则为过敏反应型,其主要机理为植物识别了病原微生物的无毒蛋白、胞外蛋白、吸器等激发子,从而诱导植物产生相应的防御反应,制止病原微生物的扩展[33-37]。从组织细胞水平对小麦锈菌与其非寄主水稻互作关系的研究是水稻抗锈性机制研究的一个重要组成部分[21-22,26]。Ayliffe等报道[21-22]Pucciniagraminisf.sptritici,P.triticina,P.striiformis和P.hordei均能侵染水稻并形成包括吸器在内的所有侵染必须结构,而水稻则回应以胼胝质沉积、活性氧产生以及偶尔的细胞死亡等非寄主抗性反应。李红兵[24]发现接种1 d后,只有大约10 %的小麦叶锈病菌的芽管能够抵达气孔并在产生附着胞,接种3天后,水稻靠近附着胞的细胞积累过氧化氢,接种7 d,后大约3 %的附着胞在叶片内产生短的菌丝,仅约0.2 %的穿透菌丝继续在叶肉细胞间扩展,在接种后22 d,极少量的侵染菌丝生长横跨几个叶肉细胞形成侵染菌丝,然而,没有观察到吸器母细胞和吸器,接种后45 d,在侵染点周围观察到片段化的菌丝并伴随侵染点周围的胼胝质和酚类物质的沉积,然而,自始至终没有观察到坏死斑和孢子堆。邢慧君[25]发现小麦条锈菌可以在水稻品种日本晴叶片上正常萌发并长出芽管,但是仅少量芽管可以识别并侵入水稻气孔,形成气孔下囊,多数夏孢子萌发产生的芽管无法形成气孔下囊,且部分芽管出现形态异常现象;而小麦条锈菌侵入水稻品种9311叶片未见明显抑制,但侵入后扩展缓慢,且吸器形成极少,并引起细胞过敏性坏死反应;Yang等人[26]而发现不同品种对条锈病菌非寄主抗性存在差异,小麦条锈病菌在籼稻型水稻品种上更易形成侵染结构,H2O2积累仅在粳稻型水稻品种-小麦条锈病菌互作的早期发生。对于不同锈菌种类,水稻所表现出的非寄主抗性也有差异。Ayliffe等[21,22]观察到水稻对杆锈和叶锈的非寄主抗性效率存在遗传差异,而亚麻的锈菌Melampsoralini因为明显不能识别水稻产生的信号而很少能成功侵染单子叶的水稻,并且在水稻上产生一些异常的侵染结构和与气孔不匹配的附着胞。越来越多的研究表明,非寄主抗性是一种多基因控制的数量性状,机理非常复杂,预成型抗性(胼胝质、酚类等)和诱导抗性在非寄主抗性中都发挥了重要作用[38-41]。而对于不同种类的锈菌,水稻可能对应以不同类型非寄主抗性(Type I型或Type II型),甚至同一片水稻叶片上的不同侵染点,对应于同一种锈菌也表现不同程度或层面的非寄主抗性[21-26]。
在本研究中,丽江新团黑谷在病菌侵入前就表现出稳定的抗性。其一,夏孢子在丽江新团黑谷叶片上不能稳定地附着,其二在静置丽江新团黑谷叶片上条锈病菌夏孢子侵入气孔的成功率也显著低于铭贤169,许多芽管即便经过2个以上的气孔也不侵入气孔,而只是在气孔上略微膨大。前者可能是因为非寄主水稻叶片表面的物理结构(乳突、表皮毛、蜡质等)与寄主小麦叶片间的差异造成的,后者的原因尚不清楚。值得注意的是,条锈病菌夏孢子在丽江新团黑谷和铭贤169上抵达气孔的比例没有显著差异。与其他研究者所获结果相一致,小麦条锈病菌在丽江新团黑谷叶片上即使成功侵染气孔,其后的进一步的侵染和扩展也受到明显抑制,接种后3 d部分侵染点即开始出现细胞坏死,但不同的侵染点发生的细胞坏死的时间和程度不一。研究中还发现,离体丽江新团黑谷心叶接种Pst菌株在接种14 d后在叶片上形成少量小坏死斑,但接种活体丽江新团黑谷心叶时却没有观察到明显的坏死斑,表明该活体丽江新团黑谷存在比离体丽江新团黑谷更为复杂的非寄主抗性。这与Yang等人[26]的研究结果相一致,他们发现丽江新团黑谷叶片活体接种CR32孢子悬液10 d后未观察到有气孔下囊/侵染菌丝的形成。可见,丽江新团黑谷对小麦条锈病菌的非寄主抗性贯穿了自夏孢子附着叶片到次生菌丝形成、扩展的全过程,预成型抗性和诱导抗性均起重要作用。多种抗性机制的交互作用,可能是水稻能够在进化过程中长期保持对条锈病菌抗性的重要原因,值得进一步研究。
[1]李振岐, 曾士迈.中国小麦锈病[M].北京:中国农业出版社, 2002.
[2]Bushnell W R, Roelfs A P. Race specificity and methods of study[A]. The Cereal Rusts. v. 1[M]. Orlando:Academic Press, 1985. 131-164.
[3]万安民, 吴立人, 金社林.1997-2001年我国小麦条锈菌生理小种变化动态[J].植物病理学报, 2003, 33(3):261-266.
[4]Wan A M, Zhao Z H, Chen X M. Wheat stripe rust epidemic and virulence ofPucciniastriifrmisf.sp.triticiin China in 2002[J]. Plant Disease, 2004, 88(8):896-904.
[5]Chen W Q, Wu L R, Liu T G. Race dynamics, diversity and virulence evolution inPucciniastriifomisf.sp.tritici,the causal agent of wheat stripe rust in China from 2003 to 2007[J]. Plant Disease, 2009, 93(11):1093-1101.
[6]章振羽, 沈 丽, 刘太国.不同小麦抗条锈基因及小麦品种在四川的有效性[J].西南农业学报, 2010, 23(1):16-21.
[7]向运佳, 章振羽, 沈 丽, 等. 2005-2010年四川省小麦条锈病菌毒性变化动态[J]. 西南农业学报, 2013(5):1858-1863.
[8]康振生, 王晓杰, 赵 杰, 等. 小麦条锈菌致病性及其变异研究进展[J]. 中国农业科学, 2015, 17:3439-3453.
[9]全国小麦条锈病水平抗性联合鉴定协作组. 小麦条锈病水平抗性多点联合鉴定方法的研究初报[J]. 中国农业科学,1983(4):58-67.
[10]宋位中, 王沛有, 刘守俭, 等. 建立小麦条锈病周年病圃监测品种抗性持久性的研究初报[J]. 植物病理学报,1988(2):57-61.
[11]曾士迈, 王沛有. 小麦条锈病水平抗病性育种方法研究之一随机多交的试用[J]. 北京农业大学学报, 1990, S1:149-150.
[12]王凤乐, 吴立人, 徐世昌, 等. 持久抗条锈小麦品种抗病性特点分析[J]. 植物保护, 1997(3):3-6.
[13]胡小平, 杨之为, 梁承华, 等. 小麦种质资源抗条锈病性数据库系统的建立[J]. 西北农林科技大学学报(自然科学版),2001(3):95-97.
[14]殷学贵, 尚勋武, 宋建荣, 等. 小麦品种里勃留拉的持久抗条锈性遗传机制[J]. 麦类作物学报, 2006(2):147-150.
[15]阎秋洁. 小麦持久抗条锈品种的抗病特点及抗性品种斯汤佩利抗病基因的SSR标记初探[D].甘肃农业大学,2006.
[16]李 强,胡茂林,井金学,等. 小麦持久抗条锈性品种N.strampelli苗期抗性遗传分析[J]. 植物病理学报, 2008(5):521-525.
[17]刘 娟. 小麦持久抗条锈品种里勃留拉抗条锈基因的分子标记[D].甘肃农业大学, 2008.
[18]冯 晶, 章振羽, 蔺瑞明, 等. 小麦持久抗条锈病品种Champlein的抗性遗传分析[J]. 植物保护, 2010(6):31-35.
[19]周新力, 詹刚明, 黄丽丽, 等. 80份国外春小麦种质资源抗条锈性评价[J]. 中国农业科学, 2015(8):1518-1526.
[20]万安民, 牛永春, 徐世昌, 等. 持久抗条锈病小麦品种抗性特点及其在我国的利用价值[J]. 作物学报, 2004, 26(6):751-755.
[21]Ayliffe M, Jin Y, Kang Z, et al. Determining the basis of nonhost resistance in rice to cereal rusts[J]. Euphytica, 2011, 179(1):33-40.
[22]Ayliffe M, Devilla R, Mago R, et al. Nonhost Resistance of Rice to Rust Pathogens[J]. MPMI. 2011, 1143-1155.
[23]Huang X, Wang J, Du Z, Zhang C, et al. Enhanced resistance to stripe rust disease in transgenic wheat expressing the rice chitinase gene RC24[J]. Transgenic Res., 2013, 22(5):939-47.
[24]李红兵.水稻对小麦叶锈菌的非寄主抗性研究及条锈菌侵染的小麦叶片蛋白质组学分析[D].杨凌:西北农林科技大学, 2011.
[25]邢慧君. 水稻对小麦条锈菌非寄主抗性的遗传分析及小麦TaMPK6基因的克隆和功能分析[D].杨凌:西北农林科技大学, 2013.
[26]Yang Y, Zhao J, Xing H, et al. Different non-host resistance responses of two rice subspecies,japonicaandindica, toPucciniastriiformisf. sp.tritici[J]. Plant Cell Rep. ,2014, 33(3):423-33.
[27]Ling Z Z, Mew T W, Wang J L, et al. N1 Development of new isogenic lines as international differential of blast pathogen[J]. Int Res Rice Inst Notes, 1995, 20:13-14.
[28]Tsunematsu H, Yanoria M J T, Ebron L A, et al. Development of monogenic lines of rice for blast resistance[J]. Breeding Science, 2000, 50 (3):229-234.
[29]凌忠专, 蒋琬如, 王久林, 等. 水稻品种丽江新团黑谷普感特性的研究和利用[J].中国农业科学, 2001, 34(1):116.
[30]邝文静, 张贵胜, 章振羽, 等. 小麦条锈病菌avrYr10/24/26/ch42突变体的毒性研究[J]. 西南农业学报, 2013(6):2323-2331.
[31]王英杰. 小麦条锈孢子悬浮液保存时间与接种效果[J]. 植物保护, 1989(4):45.
[32]康振生, 王 瑶, 黄丽丽, 等.小麦品种对条锈病低反应型抗性的组织学和超微结构研究[J].中国农业科学, 2003, 36(9):1026-1031.
[33]Mysore K S, Ryu C M. Nonhost resistance:how much do we know? [J].Trends Plant Sci, 2004, 9(2):97-104.
[34]Ingle R A, Carstens M, Denby K J. PAMP recognition and the plant-pathogen arms race[J]. Bioessays, 2006, 28(9):880-889.
[35]陈红霖, 王义琴, 储成才, 等. 植物非寄主抗性研究进展[J]. 遗传, 2008(8):977-982.
[36]Lu M, Tang X, Zhou J. Arabidopsis NHO1 is required for general resistance against Pseudomonas bacteria[J]. Plant Cell, 2001, 13(2):437-447.
[37]Jones J D G, Dangl J L. The plant immune system[J]. Nature, 2006, 444:323-329.
[38]Jafary H, Szabo L J, Niks R E. Innate nonhost immunity in barley to different heterologous rust fungi is controlled by sets of resistance genes with different and overlapping specificities[J]. Mol Plant Microbe Interact, 2006, 19(11):1270-1279.
[39]Zhang N, Lindhout P, Niks R, et al. Genetic dissection of Lactuca saligna nonhost resistance to downy mildew at various lettuce developmental stages[J]. Plant Pathol, 2009, 58(5):923-932.
[40]Zhang N W, Pelgrom K, Niks R E, et al. Three combined quantitative trait loci from nonhost Lactuca saligna are sufficient to provide complete resistance of lettuce against Bremia lactucae[J]. Mol Plant Microbe Interact, 2009, 22(9):1160-1168.
[41]Jeuken M, Pelgrom K, Stam P, et al. Efficient QTL detection for nonhost resistance in wild lettuce:backcross inbred lines versus F2 population[J]. Theor Appl Genet, 2008, 116(6):845-857.
(责任编辑 李 洁)
Infection Process ofPucciniastriformisf. sp.triticiUrediniospores on Rice Leaves
ZHANG Zhong-mei1, 2, ZHANG Zhen-yu1, JI Hong-li1, HU Pei-song3, PENG Yun-liang1, 3*
(1. Institute of Plant Protection, Sichuan Academy of Agricultural Sciences/Key Laboratory of Integrated Pest Management on Crops in Southwest China, Ministery of Agriculture, Sichuan Chengdu 610066, China; 2. College of Plant Sciences & Technology of Huazhong Agricultural University, Hubei Wuhan 430070, China; 3. China National Rice Research Institute, Zhejiang Hangzhou 311404, China)
Rice is one of the most intensively cultivated cereal crops and feeds over 1/3 of the world population. It is also mysterious that rice is immune to all cereal and other plant rust pathogens. Researches on the interaction between rust and rice on the tissue and cellular level is an important part to elucidate and deploy the immune mechanisms of rice. The infection process of the urediniospores ofPucciniastriformisf.sp.tritici(Pst) was systematically observed on the Japonica rice variety Lijiangxintuanheigu (LTH) and susceptible wheat control variety Mingxian 169. The results had indicated that multiple mechanisms had been involved in the non-host resistance of LTH.Psturediniospores failed to adhere the rice leaves stably. On the stable, levelinvitroleaves of LTH, however,Pstcould germinate, penetrate the stomata and produce all the infection structures including sub-stomatal vesicle (SSV), primary infection hyphae (PIH), haustorium mother cell (HMC), haustorium (H) and secondary infection hyphae (SIH). But the complishment ratios ofPstto form SSV、PIH and HMC/H on in the leaves of LTH were respectively 51.01 %, 53.99 % and 43.05 % lower than that on Mingxian 169 at 5dpi. Necrosis around infection sites with stomata and different number of surrounding mesophyl cells were observed since 3dpi but the formation of uredium-bed and uredium were not observed in LTH.
Rice;Pucciniastriformisf.sp.tritici; Urediniospores; Infection structure;Non-host resistance
1001-4829(2016)11-2520-09
10.16213/j.cnki.scjas.2016.11.003
2015-12-23
国家科技支撑计划(2012BAD19B04);四川省财政专项(2011JYGC06-021)
张重梅(1983-),女,土家族,湖北恩施人,在读博士,从事植物病理学研究,E-mail:zhongmeizhang12@163.com,*为通讯作者:彭云良,E-mail: pengyunliang@aliyun.com。
S511
A
