Ca2+信号在植物与环境微生物互相作用中的分子调控机制
2016-12-17巩雪峰宋占锋苗明军李跃建
巩雪峰,宋占锋*,苗明军,李跃建
(1 四川省农业科学院园艺研究所,成都 610066;2四川省农业科学院,成都 610066)
Ca2+信号在植物与环境微生物互相作用中的分子调控机制
巩雪峰1,宋占锋1*,苗明军1,李跃建2
(1 四川省农业科学院园艺研究所,成都 610066;2四川省农业科学院,成都 610066)
自然界植物与环境微生物之间的相互关系除了胁迫以外,同时也有互利互惠的共生互作关系。无论是能对植物造成胁迫伤害的植物-病原菌互作体系,还是能够为植物提供营养的植物-微生物共生互作体系,其细胞信号转导通路中Ca2+信号的分子调控对两种互作体系都有着非常重要的作用。该文对近年来国内外有关植物-病原菌和植物-微生物互作体系在细胞信号转导过程中Ca2+信号上游的分子调控机制分别进行了综述。
Ca2+信号;内共生;病原菌;细胞信号转导
自然界中,植物与动物的本质区别之一是没有自然行走的能力,它们一旦固定了生长环境,一生都不可更换。那么,当植物在遭受环境带来的不适时,它们就不能用移动或者迁移的方式躲避伤害。通常植物既要面对由环境气候改变而带来的各种逆境刺激,如干旱、寒冷、高温、高湿等非生物胁迫;也要面对其所在自然生物群落中各种外源微生物的侵染,如由病原菌导致的生物胁迫。植物为了生存,只能通过将外界胁迫信息整合到内在细胞中,再通过完整、精确的细胞信号转导体系实现对自身机制的调节。在这个过程中,外源胁迫刺激被细胞膜识别进入细胞质,并以特异的信号形式传递给细胞核,随后转化成能适应这个刺激的特异基因表达,产生相应的应答反应,最终调控植物生理和生长[1]。
在一个自然生物群落中,植物受到环境微生物的入侵后,彼此随即建立相互作用的关系。这种关系除了胁迫以外,同时也存在互利互惠的共生关系。植物与微生物的互作关系就微妙得犹如硬币的正反面,虽然一面有害,但是另一面又有利。其正反双方内在细胞信号转导体系信号调控分子具有相似性,该相似性反应为Ca2+对胞内信号通路所具有的调控作用。研究表明,微生物如根瘤菌或者丛枝菌根菌等是通过互惠的内共生信号系统入侵到植物的根系细胞,形成根瘤或根系生节的过程。在该信号通路中,植物与微生物双方成功发生互作的标志即是钙离子振荡(Ca2+oscillation)的形成[2-4]。与此同时,病原菌微生物与植物的互作是植物通过先天免疫系统抵御外源刺激的过程。在该信号通路中,细胞质第二信使Ca2+通过参与瞬间改变细胞质钙离子浓度([Ca2+]cyt)的形式将刺激信号传递至下游[5-10]。
在上述两个植物细胞信号通路系统中,Ca2+将细胞外的刺激以信号的形式整合到细胞内,同时将刺激信号特异地放大并传递到下游,细胞核内转录因子对信号进行转录,诱导相应基因表达和细胞应答。只有Ca2+信号上游的细胞膜受体对外界刺激实现跨膜转换,激活细胞膜系统上钙离子通道的开放,引起细胞内Ca2+浓度在时间、空间、频率、幅度等不同形式的特异性变化后,才能导致下游特异的基因表达及生理应答。因此,在环境微生物与植物互作的分子机制中,Ca2+信号的调控是植物感受外界刺激后引起细胞信号应答及生理反应的主要调控因子之一,对整个信号转导体系发挥着非常重要的作用。
近年来,科学家在植物基因组学领域对植物基因功能的探索已经取得了大量的研究成果。从而使得我们对植物共生互作和生物胁迫互作体系有了更深层次的了解。本文就植物细胞Ca2+上游信号分子在微生物与植物的共生互作和胁迫互作中的调控进行概述。
1 植物与微生物互作的正面关系——植物内共生体系
自然界多数植物能够与微生物建立互利互惠的共生关系,形成植物根系内共生体系(symbiosis pathway)。在内共生体系中,目前研究最广泛的两个类型分别是真菌类的丛枝菌根菌(arbuscular mycorrhizal fungi)-植物互作[11],以及细菌类固氮根瘤菌(rhizobial bacteria)-豆科植物的互作[12]。通常在根瘤菌(rhizobium)-豆科植物互作的根细胞内共生体系中,根瘤菌将环境中的氮气还原为植物可利用的含氮化合物,同时根瘤菌则从植物根系获得其生长繁殖所需的能量和营养物质,最终促成植物根系结瘤[13-14]。在丛枝菌根菌-植物互作的根细胞内共生体系中,菌根菌所形成丛枝菌丝(arbuscule)能够扩大根系与土壤的接触面积,增加根系对土壤中水分和矿质营养元素(尤其是P)的吸收。丛枝菌根再通过植物根系获得生长和生节所需的碳水化合物以及其他营养物质[15]。
在共生互作体系中,细菌和真菌分别对宿主植物进行侵染,宿主植物的根细胞固定根瘤菌或丛枝菌根菌后并分别释放化学信号类黄酮(flavonoids)或独脚金内酯(strigolactones),诱导宿主根细胞自身产生信号分子结瘤因子(nod factors)或菌根因子[Myc(orrhizal) factors],并进入宿主植物细胞,开启共生信号通路(symbiotic signalling),激活细胞共生信号应答反应体系(图1,A)[16]。信号分子结瘤因子和菌根因子在结构上都属于脂质几丁寡糖类物质(lipochitooligosaccharides,即LCOs)[16-17]。
在根瘤菌-豆科植物互作体系中,结瘤因子通过识别细胞膜上含有LysM受体激酶结构域(lysine motif)的受体蛋白进入细胞质,目前,已被定义的受体蛋白如百脉根(Lotusjaponicus)细胞膜上的受体蛋白NFR1 (nod-factor receptor 1) 和NFR5 (nod-factor receptor 5);豆类植物细胞膜上的受体蛋白 SYM2(symbiosis receptor 2)[18-20]。共生信号通路中同时也有另一类受体如百脉根细胞膜上SYMRK蛋白(symbiosis receptor-like kinase)和蒺藜苜蓿(Medicagotruncatula)的DMI2受体蛋白,也称NORK(does not make infection 2/nordulation receptor kinase)。这两个受体都含亮氨酸重复序列LRR(leucine-rich-repeat),但目前该类受体的功能尚未得到完整定义,研究报道指出在共生信号体系中SYMRK或DMI2是作为受体复合体转导结瘤信号[19-20]。丛枝菌根菌-植物互作体系与根瘤菌-豆科植物互作基本相似,菌根菌与蒺藜苜蓿根细胞共生体系信号的应答反应,菌根菌同样依赖所产生的菌根因子LCOs类物质来启动与宿主植物根系的生节生长反应,通过识别根细胞膜上LysM受体蛋白激酶(lysine-like kinase)类物质[17]。
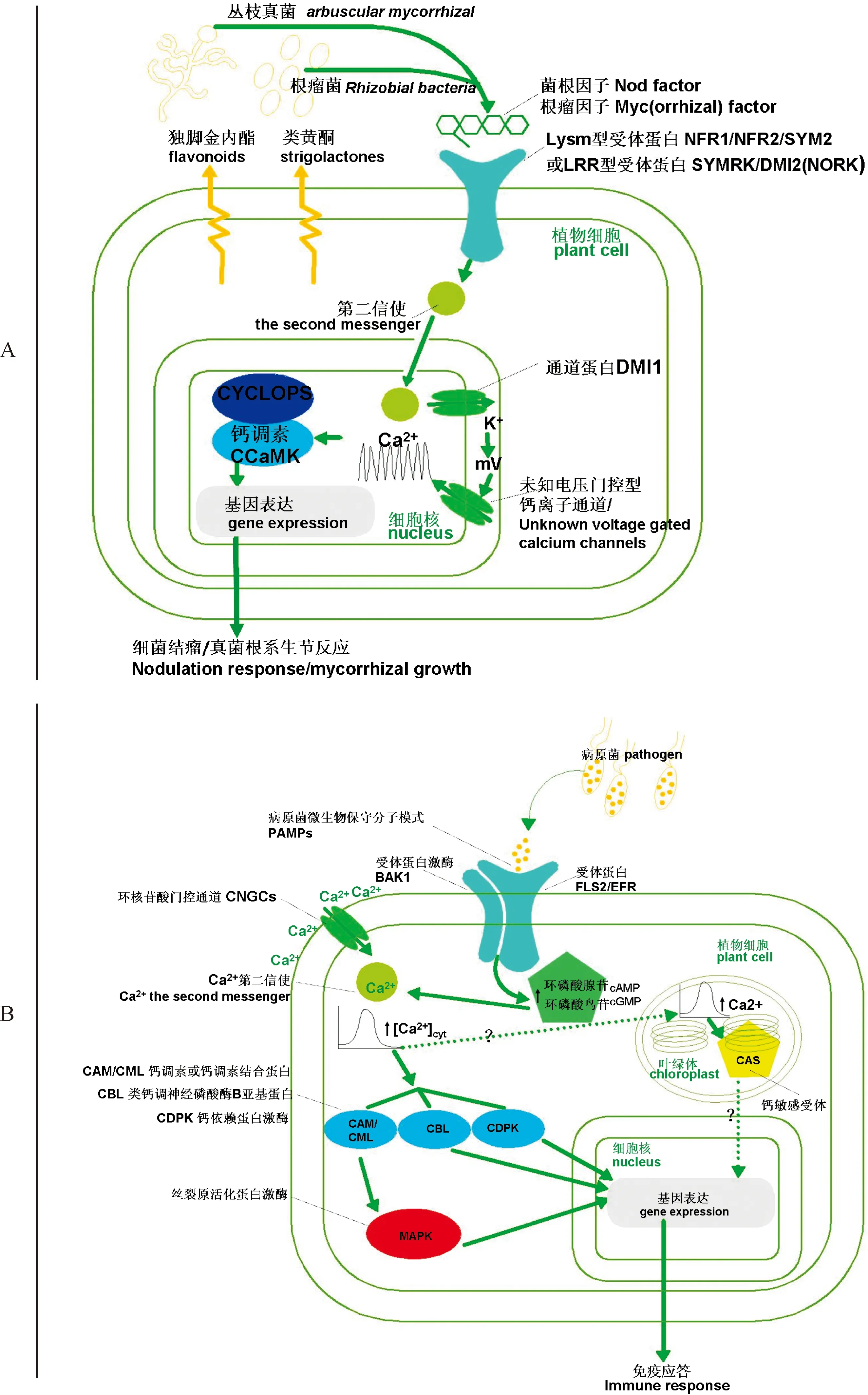
A. 植物—根瘤菌/丛枝菌根互作信号通路;B. 植物—病原菌互作信号通路图1 植物与环境微生物互作信号通路A. The signaling pathway on plant-Rhizobium / Arbuscule interaction; B. The signaling pathway on plant-pathogen interactionsFig.1 The signaling pathway on plant and environmental microorganism interactions
根瘤因子和菌根因子通过细胞膜受体蛋白进入细胞的内共生信号级联通路,随后信号分子钙在细胞核和核膜区域发生钙离子振荡[12,16]。研究指出,蒺藜苜蓿DMI1(doesn’t make infections 1)在根瘤菌结瘤的过程中与产生钙信号有关。DMI1就是产生钙离子振荡的通道蛋白[21]。该蛋白由于其基因缺陷突变体苗不能结瘤而得名[22]。通过荧光GFP融合蛋白和免疫金标记技术表明,DMI1被定义在表皮细胞核膜的内核上[23-24]。目前DMI1对钙离子信号如何进行调控还没有完全被揭示,Capoen、Charpentier等认为DMI1蛋白自身并不是钙离子通道,在信号级联中是一个能够通过第二信使活化的钾离子通道。通过改变细胞核膜上的膜电位,进而激活核膜上的未知电压门控型钙离子通道[21,24]。也有另一种认为,DMI1可能扮演由反离子到钙离子通道的作用[25]。
DMI1同源蛋白质家族都共同拥有RCK功能结构域。RCK是电导调节钾离子(regulate the conductance of K+)结构域。晶体结构研究揭示,在细菌MthK钙离子激活钾离子通道(M.thermautotrophicumK+channel)中,C端的RCK结构域对通道的打开起主要作用。MthK复合体一共有8个RCK结构域,在细胞内膜表面形成一个门控环。4个RCK结构域属于MthK全长的亚基,另外4个是可溶性结构域。当钙离子结合到该结构域,则会导致通道离子门控打开[26-28]。在dmi1突变体和DMI1酵母表达的试验中,DMI1的功能会随 RCK结构域的改变而改变[21]。
无论是单子叶植物还是双子叶植物都存在DMI1同源蛋白质,而目前在同源蛋白中仅有一小部分得到研究。在豆科模式植物百脉根的研究报道中,同源蛋白CASTOR和POLLUX的功能在丛枝菌根和根瘤菌共生体系中和DMI1类似,对细胞核钙离子振荡发挥着重要作用。电生理学和酵母互补分析研究表明CASTOR和POLLUX是钾离子渗透型通道。GFP融合蛋白的实验表明它们位于细胞核区域的核膜上[29]。POLLUX是更接近DMI1的基因,但是POLLUX在苜蓿中不能单独完成和DMI1同样功能。目前认为菌根因子和结瘤因子信号转导是由CASTOR和POLLUX共同激活第二信使,使细胞核周区域钾离子流入,最终导致超极化并激活未知门控电压钙离子通道[30]。豌豆(Pisumsativum)作物中同源蛋白SYM8在蒺藜苜蓿突变体中能够互补DMI1的功能[31]。在非结瘤植物中也有DMI1的同源蛋白。研究发现水稻OsCASTOR和OsPOLLUX缺陷型突变体不能建立丛枝菌根共生体系。说明这两个基因是丛枝菌根共生体系信号转导中的重要原件。另外, OsPOLLUX能够修复蒺藜苜蓿dmi1-1突变体的结瘤,但不能感染丛枝菌根[32]。
在内共生信号级联通路Ca2+信号的下游,钙调素CCaMK(也称DMI3)(calcium-and-calmudulin-dependent protein kinase/ dose not make infection 3)位于细胞核,结合CYCLOPS互作,感知并解码钙振荡信号[4,33],对共生信号进行转录。转录因子NSP1(nodulation signalling pathway 1)和NSP2等诱导基因表达[34-36],最终产生根瘤菌在植物根细胞的结瘤以及丛枝菌根在植物根细胞的生节反应,完成整个共生互作通路[37]。
2 植物与微生物胁迫互作的反面关系——植物防御体系
病原微生物(也就是病原菌)能够与植物产生互作作用,对植物产生致病物质,造成各种感染性病害。例如,炭疽菌属真菌(Colletotrichum),能够侵染大多数粮食作物和果蔬植物,致使其茎叶及果实等出现褐色病斑与褐色凹陷,最终导致死亡。不仅影响粮食、果蔬的品质和产量,而且给植物生长和繁殖造成毁灭性灾害。
当植物遭受病原微生物胁迫入侵时,为保护自身不受病原菌的侵害,先天免疫系统(innate immunity)被激活,该系统是植物细胞内在复杂的防御反应网络体系。植物先天免疫体系分为两个部分[38]:Ⅰ.病原物激发植物细胞相关分子模式的免疫(PAMPs-triggered immunity,PTI),即PAMP诱导免疫系统;Ⅱ.效应因子触发的相关分子模式的免疫(effector-triggered immunity,ETI),即效应诱导免疫系统。PTI是由基础防御(basal defence responses)构成,能够帮助植物抵御大部分病原微生物侵染。而ETI是依赖效应蛋白(effect protein)和防御蛋白(resistance protein, R-Protein)识别病原微生物分泌的效应子引发特异反应,例如过敏反应HR (hypersensitive response),能使细胞程序性死亡[38-40]。
先天免疫系统信号通路是从植物细胞膜上的受体PRR (pattern-recognition receptor)识别病原菌微生物保守的分子模式PAMPs(pathogen-associated molecular patterns)开始的[39]。PAMPs分子不是病原微生物所特有的,而是广泛存在于微生物中,例如,典型的PAMPs分子模式flg22和elf18,flg22是细菌鞭毛蛋白(flagellin)N端的22个氨基酸保守区域,该段氨基酸序列可以取代鞭毛蛋白的完整序列对植物引起刺激反应[41-43]。细菌延伸因子(EF-TU)与鞭毛蛋白类似,是一种非常保守的蛋白,elf18是乙酰化N端具有18个氨基酸的保守序列,可发挥EF-TU的全功能[44]。
在对受体PRRs研究中,已有被完整定义的受体蛋白。如,识别细菌鞭毛蛋白flg22的FLS2受体(flagellin sensing 2)和识别细菌延伸因子elg18的EFR受体(elongation factor tu receptor),这2个PRR受体蛋白都富含亮氨酸的重复序列LRR(leucine-rich-repeat)受体蛋白激酶结构域,为LRR-type受体激酶[43,45-46]。同时,拟南芥BAK1受体(BRI1-associated receptor kinase 1)富含亮氨酸的重复序列LRR,能够迅速与FLS2或者EFR形成共受体复合物结构,识别PAMPs进入细胞[47-50]。受体蛋白激酶BAK1(又称SERK3)是双元受体,既作为激素信号构成组件参与调控植物油菜素内脂BR的信号转导,也是病原菌PRRs受体成员,参与病原菌信号转导[51]。
在免疫系统信号级联通路的分子机制早期,PAMPs诱导受体信号识别开启信号级联通路(如图1,B 所示)。细胞膜上的离子通道对病原菌感知,钙离子作为细胞质第二信使并瞬间向细胞质内流[8],引起胞质钙离子[Ca2+]cyt浓度瞬间提高,钙离子浓度急剧增加甚至能持续增加几分钟[7,52]。目前在植物基因组中有57个编码的离子通道[53],大约有40个是属于2组蛋白质家族的。他们分别是谷氨酸受体通道GLR(glutamate receptor)和环核苷酸门控通道CNGC(cyclic nucleotide gated channel)。GLRs的同源蛋白家族是发现于哺乳动物神经中枢系统的无选择性配体门控离子通道(包括钙离子),植物GLRs已证实能够转导植物细胞的钙离子[54],但目前缺乏直接的证据来证明病原菌防御信号中胞质钙离子信号产生是由GLRs引起的[55]。另一类植物离子通道CNGCs家族蛋白通道(即CNGC1-20)能结合被激活的环磷酸腺苷cAMP或者环磷酸鸟苷cGMP的通道蛋白。目前已经有大量证据证明植物免疫反应中,钙离子信号与CNGCs调控有关,位于细胞膜上的环核苷酸离子通道家族CNGCs则负责病原菌信号通路释放钙离子到细胞质的作用[40]。
CNGC是非选择性配体阳离子门控通道,其结构包括6个跨膜区和位于细胞质内多肽链C端的钙调素结合区域(cyclic nucleotide binding domain,CNBD)[56]。CNBD是一个重叠结构域,参与环核苷酸的结合,又参与钙调素蛋白的结合。受体PRRs激活分布在质膜或者胞质的核苷酸环化酶,环核苷酸的浓度得到上升后,激活了CNGC离子通道,使细胞质钙离子浓度上升。研究发现,CNGC2和CNGC4的拟南芥功能缺失突变体苗dnd1(defence-no-death 1 mutant)和hlm1 (the HR-like lesion mimic 也称作dnd2)能够改变无毒性病原菌(Pseudomonassyringae)的侵染,突变体苗能够修复过敏反应HR[57-60]。CNGC2和CNGC4已被证实能够调控植物免疫系统级联通路中细胞质钙离子跃迁[5,56]。通过删除了3 kb CNGC基因片段的突变体苗cpr22(constitutive expresser of pathogen related genes 22)的表现型能够反映CNGC11/12 的基因型。cpr22突变体的研究结果表明,CNGC11/12能引起过敏反应(HR-like)导致细胞死亡,并发现该过程依赖钙离子的细胞跨膜内流[61-63]。
科学家在对茄科作物西红柿(Solanumlycopersicum)和马铃薯(Solanumtuberosum)的大量易感基因(susceptibility genes,Sgenes)的研究中,利用RNA干扰(RNA interference, RNAi)技术,将西红柿和马铃薯中编码了CNGC2的同源基因SlDND1和StDND1沉默失活。研究表明,RNAi突变体Sldnd1的新叶片和老叶片在没有接种病原菌的情况下有自发的细胞坏死现象;而Stdnd1和拟南芥CNGC2突变体(也称作Atdnd1)都具有侏儒型表现型,并且也有自发的细胞坏死现象[64]。结果证实,作物西红柿和马铃薯的拟南芥CNGC2同源基因对晚疫病和白粉病具有广谱抗性[64]。
近年来研究者还发现,植物细胞内如叶绿体等细胞器在生物胁迫条件下能够诱导产生特异的Ca2+信号[65]。Nomura等通过烟草及拟南芥模式植物的研究认为外源PAMPs信号通过未知信号通路在细胞质钙离子浓度[Ca2+]cyt瞬时提高之后约1~2 min,叶绿体基质的Ca2+浓度也随之出现约10 min持续的增加[65]。定位于基粒膜上的钙敏感受体结合蛋白CAS (calcium-sensing receptor) 参与了叶绿体Ca2+信号的传递。PAMPs分子模式中,CAS膜蛋白通过参与叶绿体Ca2+信号的传递,引起了烟草和拟南芥突变体免疫反应的基础防御反应以及过敏反应 HR[66,67]。
钙离子信号产生后被下游信号组件包括钙调素CAM以及钙调素结合蛋白CML(calmodulin-like protein)级联有丝分裂原激活蛋白激酶MAPK(mitogen-activated protein kinase)、类钙调神经磷酸酶B亚基蛋白CBL(calcineurin B-like protein)、钙依赖型蛋白激酶CDPK(Ca2+-dependent protein kinases)等特异的解码。钙离子信号下游的其他信号如ROS被激活,NO随之产生[40,68,69],诱导基因表达。最终产生免疫应答,如过敏反应HR,胼胝质沉积(callose deposition)和幼苗生长抑制(seedling growth inhibition)[70]以及气孔关闭随之产生[71]。
3 展 望
在植物-微生物互作信号通路体系中,钙离子作为细胞第二信使将外源刺激转导形成特异的钙信号,随之将信号传递给下游解码钙信号的钙感受蛋白,最终完成信号通路对微生物刺激信号的响应。研究发现,倘若在整个信号通路体系细胞膜系统上相应调控Ca2+信号转导的通道蛋白缺失或失活,通路将不能实现对微生物刺激的反应应答,进而导致植物的特异生物学表现型(表1)。深入探索农作物中与Ca2+信号相关的同源蛋白,对农业育种及生产具有重要意义。迄今,植物-微生物互作体系中与Ca2+信号有关蛋白的研究已经取得了长足的进展。虽然调控Ca2+信号转导的通道蛋白已经相继得到鉴定和分离,但是研究结果尚不能完整诠释外源微生物刺激是如何准确的在细胞内通过已知钙通道蛋白产生特异Ca2+信号,细胞内Ca2+浓度又如何以时间、空间、频率、幅度等形式表达Ca2+信号并特异地调控信号通路下游细胞生理应答反应等问题。在研究的过程中,一方面在不同的发育阶段和不同的组织器官上外源微生物对不同种类植物的刺激具有差异性;另一方面各细胞信号转导通路之间存在着复杂、多样的信号系统相互作用,形成了信号转导网络(cross talk),这为深入研究特异的Ca2+信号带来了更多的挑战。研究者们通过分子克隆、定点突变等方法,利用膜片钳技术,对离子通道分子结构与生物学功能关系作深入研究;近年来,研究者们通过基因工程的方法将Ca2+生物荧光蛋白指示剂Yellow Cameleon (YC) 和aequorin(水母蛋白)转入待研究野生型或转基因植物体内,在植物细胞中建立能够稳定表达YC荧光蛋白和水母蛋白的高效、快捷、稳定的科学实验体系。通过构建的植物Ca2+生物荧光蛋白体系,结合钙离子拮抗剂如EGTA、U73122、TMB-8等化学物质[9],应用不同外源微生物激发子诱导植物产生钙离子信号的瞬时变化,在植物整体和细胞水平上对实时、定点、动态、可视地检测钙离子信号的瞬时变化进行分析,为进一步揭示Ca2+信号的分子机制进行努力。综上所述,对植物细胞Ca2+信号的研究,目前主要局限拟南芥、蒺藜苜蓿等模式植物种类中,通过基因工程建立植物-Ca2+生物荧光蛋白实验体系,研究粮油作物和园艺作物等的同源Ca2+通道蛋白,具有前沿性和实践意义。

表1 植物-微生物互相作中与钙离子信号有关的通道蛋白
[1] BRAY E A, BAILEY-SERRES J, WERRETILNYK E. Responses to abiotic stress[M].// BUCHANAN B B,etal. Biochemistry and Molecular Biology of Plants. Rockville:American Society of Plant Physiologists, 2000:1 158-1 203.
[2] EHRHARDT D W, WAIS R, LONG S R. Calcium spiking in plant root hairs responding to Rhizobium nodulation signals[J].Cell, 1996,85(5):673-681.
[3] KOSUTA S, HAZLEDINE S, SUN J,etal. Differential and chaotic calcium signatures in the symbiosis signaling pathway of legumes[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2008,105(28):9 823-9 828.
[4] SUN J, MILLER J B, GRANQVIST E,etal. Activation of symbiosis signaling byArbuscularmycorrhizalfungi in legumes and rice[J].EducationalResearcher, 2015,44(7):823-838.
[5] ALI R, MA W, LEMTIRI-CHLIEH F,etal. Death don’t have no mercy and neither does calcium: Arabidopsis CYCLIC NUCLEOTIDE GATED CHANNEL2 and innate immunity[J].PlantCell, 2007,19(3):1 081-1 095.
[6] DODD A N, KUDLA J, SANDERS D. The language of calcium signaling[J].AnnualReviewofPlantBiology, 2010,61(1):593-620.
[7] RANF S, ESCHEN-LIPPOLD L, PECHER P,etal. Interplay between calcium signaling and early signaling elements during defense responses to microbe-or damage-associated molecular patterns[J].PlantJournal, 2011,68(1):100-113.
[8] LECOURIEUX D, MAZARS C, PAULY N,etal. Analysis and effects of cytosolic free calcium increases in response to elicitors inNicotianaplumbaginifoliacells[J].PlantCell, 2002,14(10):2 627-2 641.
[9] THOR K, PEITER E. Cytosolic calcium signals elicited by the pathogen-associated molecular pattern flg22 in stomatal guard cells are of an oscillatory nature[J].NewPhytologist, 2014,204(4):873-881.
[10] GELLI A, HIGGINS V J, BLUMWALD E. Activation of plant plasma membrane Ca2+-permeable channels by race-specific fungal elicitors[J].PlantPhysiology, 1997,113(1):269-279.
[11] HARRISON M J. Signaling in theArbuscularmycorrhizalsymbiosis[J].AnnualReviewofMicrobiology, 2005,59(2):124-125.
[12] LUM M R, HIRSCH A M. Roots and their symbiotic microbes: strategies to obtain nitrogen and phosphorus in a nutrient-limiting environment[J].JournalofPlantGrowthRegulation, 2003,21(4):368-382.
[13] WALKER R, AGAPAKIS C M, WATKIN E,etal. Symbiotic nitrogen fixation in legumes: perspectives on the diversity and evolution of nodulation by rhizobium and burkholderia species[M]// BRUIJN F J D. Biological Nitrogen Fixation. New Jersey:JohnWiley&Sons,Inc, 2015:913-923.
[14] SMITH S E, SMITH F A. Fresh perspectives on the roles ofArbuscularmycorrhizalfungi in plant nutrition and growth[J].Mycologia, 2012,104(1):1-13.
[15] OLDROYD G E D. Speak, friend, and enter: signaling systems that promote beneficial symbiotic associations in plants[J].NatureReviewsMicrobiology, 2013,11(4):252-263.
[16] OLDROYD G E D, DOWNIE J A. Coordinating nodule morphogenesis with rhizobial infection in legumes[J].AnnualReviewofPlantBiology, 2008,59(1):519-546.
[17] MADSEN E B, MADSEN L H, RADUTOIU S,etal. A receptor kinase gene of the LysM type is involved in legume perception of rhizobial signals[J].Nature, 2003,425(6 958):637-640.
[18] RADUTOIU S, MADSEN L H, MADSEN E B,etal. Plant recognition of symbiotic bacteria requires two LysM receptor-like kinases[J].Nature, 2003,425(6 958):585-592.
[19] LIMPENS E, FRANKEN C, SMIT P,etal. LysM domain receptor kinases regulating rhizobial Nod factor-induced infection[J].Science, 2003,302(302):630-633.
[20] MAILLET F, POINSOT V, ANDRÉ O,etal. Fungal lipochitooligosaccharide symbiotic signals inArbuscularmycorrhiza[J].Nature, 2011,469(7 328):58-63.
[21] PEITER E, SUN J, HECKMANN A B,etal. TheMedicagotruncatulaDMI1 protein modulates cytosolic calcium signaling[J].PlantPhysiology, 2007,145(1):192-203.
[22] CATOIRA R, GALERA C, BILLY F D,etal. Four genes ofMedicagotruncatulacontrolling components of a nod factor transduction pathway[J].PlantCell, 2000,12(9):1 647-1 665.
[23] RIELY B K, LOUGNON G, ANÉ J M,etal. The symbiotic ion channel homolog DMI1 is localized in the nuclear membrane ofMedicagotruncatula, roots[J].PlantJournalforCell&MolecularBiology, 2007,49(2):208-216.
[24] CAPOEN W, SUN J, WYSHAM D,etal. Nuclear membranes control symbiotic calcium signaling of legumes[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2011,108(34):14 348-14 353.
[25] CHARPENTIER M, MARTINS T V, GRANQVIST E,etal. The role of DMI1 in establishing Ca2+oscillations in legume symbioses[J].PlantSignaling&Behavior, 2013,8(2):e22 894-e22 894.
[26] JIANG Y, LEE A, CHEN J,etal. Crystal structure and mechanism of a calcium-gated potassium channel[J].Nature, 2002,417(6 888):515-522.
[27] CHAKRAPANI S, PEROZO E. How to gate an ion channel: lessons from MthK[J].NatureStructural&MolecularBiology, 2007,14(3):180-182.
[28] PAU V P T, SMITH F J, TAYLOR A B,etal. Structure and function of multiple Ca2+-binding sites in a K+channel regulator of K+conductance (RCK) domain[J].ProceedingsoftheNationalAcademyofSciences, 2011,108(43):17 684-17 689.
[29] CHARPENTIER M, BREDEMEIER R, WANNER G,etal.LotusjaponicusCASTOR and POLLUX are ion channels essential for perinuclear calcium spiking in legume root endosymbiosis[J].PlantCell, 2008,20(12):3 467-3 479.
[30] VENKATESHWARAN M, COSME A, HAN L,etal. The recent evolution of a symbiotic ion channel in the legume family altered ion conductance and improved functionality in calcium signaling[J].PlantCell, 2012,24(6):2 528-2 545.
[31] EDWARDS A, HECKMANN A B, YOUSAFZAI F,etal. Structural implications of mutations in the pea SYM8 symbiosis gene, the DMI1 ortholog, encoding a predicted ion channel[J].MolecularPlant-MicrobeInteractions:MPMI, 2007,20(10):1 183-1 191.
[32] CHEN C, FAN C, GAO M,etal. Antiquity and function of CASTOR and POLLUX, the twin ion channel-encoding genes key to the evolution of root symbioses in plants[J].PlantPhysiology, 2008,149(1):306-317.
[33] CHABAUD M, GENRE A, SIEBERER B J,etal.Arbuscularmycorrhizalhyphopodia and germinated spore exudates trigger Ca2+, spiking in the legume and nonlegume root epidermis[J].NewPhytologist, 2011,189(1):347-355.
[34] MITRA R M, GLEASON C A, EDWARDS A,etal. A Ca2+/calmodulin-dependent protein kinase required for symbiotic nodule development: gene identification by transcript-based cloning[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2004,101(101):4 701-4 705.
[35] LÉVY J, BRES C, GEURTS R,etal. A putative Ca2+and calmodulin-dependent protein kinase required for bacterial and fungal symbioses[J].Science, 2004,303(5 662):1 361-1 364.
[36] HIRSCH S, KIM J, MUOZ A,etal. GRAS proteins form a DNA binding complex to induce gene expression during nodulation signaling inMedicagotruncatula[J].PlantCell, 2009,21(21):545-557.
[37] BONFANTE P, REQUENA N. Dating in the dark: how roots respond to fungal signals to establishArbuscularmycorrhizalsymbiosis[J].CurrentOpinioninPlantBiology, 2011,14(4):451-457.
[38] MUTHAMILARASAN M, PRASAD M. Plant innate immunity: an updated insight into defense mechanism[J].JournalofBiosciences, 2013,38(2):433-449.
[39] JONES J D G, DANGL J L. The plant immune system[J].Nature, 2006,444(7 117):323-329.
[40] MA W, BERKOWITZ G A. Ca2+conduction by plant cyclic nucleotide gated channels and associated signaling components in pathogen defense signal transduction cascades[J].NewPhytologist, 2011,190(3):566-572.
[41] ZIPFEL C. Pattern-recognition receptors in plant innate immunity[J].CurrentOpinioninImmunology, 2008,20(1):10-16.
[42] FELIX G, DURAN J D, VOLKO S,etal. Plants have a sensitive perception system for the most conserved domain of bacterial flagellin[J].PlantJournal, 1999,18(3):265-276.
[43] GOMEZ-GOMEZ L, FELIX G, BOLLER T. A single locus determines sensitivity to bacterial flagellin inArabidopsisthaliana[J].PlantJournalforCell&MolecularBiology, 1999,18(3):277-284.
[44] KUNZE G, ZIPFEL C, ROBATZEK S,etal. The N terminus of bacterial elongation factor Tu elicits innate immunity inArabidopsisplants[J].PlantCell, 2004,16(12):3 496-3 507.
[45] ZIPFEL C, ROBATZEK S, NAVARRO L,etal. Bacterial disease resistance in Arabidopsis through flagellin perception[J].Nature, 2004,428(6 984):764-767.
[46] GOMEZ-GOMEZ L, BOLLER T. FLS2: an LRR receptor-like kinase involved in the perception of the bacterial elicitor flagellin in Arabidopsis[J].MolecularCell, 2000,5(6):1 003-1 011.
[47] ROUX M, SCHWESSINGER B, ALBRECHT C,etal.The Arabidopsis leucine-rich repeat receptor-like kinases BAK1/SERK3 and BKK1/SERK4 are required for innate immunity to hemibiotrophic and biotrophic pathogens[J].PlantCell, 2011,23(6):2 440-2 455.
[48] SUN Y, LI L, MACHO A P,etal. Structural basis for flg22-induced activation of the Arabidopsis FLS2-BAK1 immune complex[J].Science, 2013,342(6 158):624-628.
[49] CHINCHILLA D, ZIPFEL C, ROBATZEK S,etal. A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence[J].Nature, 2007,448(7 152):497-500.
[50] HEESE A, HANN D R, GIMENEZ-IBANEZ S,etal. The receptor-like kinase SERK3/BAK1 is a central regulator of innate immunity in plants[J].ProceedingsoftheNationalAcademyofSciences, 2007,104(29):12 217-12 222.
[51] WALTERS M. The plant innate immune system[J].JournalofEndocytobiosisandCellResearch, 2015,26:8-12.
[52] GRANT M, BROWN I, ADAMS S,etal. The RPM1, plant disease resistance gene facilitates a rapid and sustained increase in cytosolic calcium that is necessary for the oxidative burst and hypersensitive cell death[J].PlantJournal, 2000,23(4):441-450.
[54] QI Z, STEPHENS N R, SPALDING E P. Calcium entry mediated by GLR3.3, an Arabidopsis glutamate receptor with a broad agonist profile[J].PlantPhysiology, 2006,142(3):963-971.
[55] KANG S, KIM H B, LEE H,etal. Overexpression in Arabidopsis of a plasma membrane-targeting glutamate receptor from small radish increases glutamate-mediated Ca2+influx and delays fungal infection[J].Molecules&Cells,2006,21(3):418-427.
[56] HUA B G, MERCIER R W, ZIELINSKI R E,etal. Functional interaction of calmodulin with a plant cyclic nucleotide gated cation channel[J].PlantPhysiologyandBiochemistry, 2003,41(11): 945-954.
[57] CLOUGH S J, FENGLER K A, YU I,etal. The Arabidopsis dnd1 “defense, no death” gene encodes a mutated cyclic nucleotide-gated ion channel[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2000,97(16):9 323-9 328.
[58] BALAGUÉ C, LIN B, ALCON C,etal. HLM1, An essential signaling component in the hypersensitive response, is a member of the cyclic nucleotide-gated channel ion channel family[J].PlantCell, 2003,15(2):365-379.
[59] JURKOWSKI G I, SMITH R K, YU I C,etal. Arabidopsis DND2, a second cyclic nucleotide-gated ion channel gene for which mutation causes the “defense, no death” phenotype[J].MolecularPlant-MicrobeInteractions:MPMI, 2004,17(5):511-520.
[60] CHIN K, DEFALCO T A, MOEDER W,etal. The Arabidopsis cyclic nucleotide-gated ion channels AtCNGC2 and AtCNGC4 work in the same signaling pathway to regulate pathogen defense and floral transition[J].PlantPhysiology, 2013,163(2):611-624.
[61] YOSHIOKA K, MOEDER W, KANG H G,etal. The chimeric Arabidopsis CYCLIC NUCLEOTIDE-GATED ION CHANNEL11/12 activates multiple pathogen resistance responses[J].PlantCell, 2006,18(3):747-763.
[62] URQUHART W, GUNAWARDENA A H L A N, MOEDER W,etal. The chimeric cyclic nucleotide-gated ion channel ATCNGC11/12 constitutively induces programmed cell death in a Ca2+dependent manner[J].PlantMolecularBiology, 2008,65(6):747-761.
[63] CHEVAL C, ALDON D, GALAUD J P,etal. Calcium/calmodulin-mediated regulation of plant immunity[J].BiochimicaetBiophysicaActa(BBA) -MolecularCellResearch, 2013,1 833(7):1 766-1 771.
[64] SUN K, WOLTERS A M A, LOONEN A E H M,etal. Down-regulation of Arabidopsis DND1 orthologs in potato and tomato leads to broad-spectrum resistance to late blight and powdery mildew[J].TransgenicResearch, 2015,25(2):123-138.
[65] NOMURA H, SHIINA T. Calcium signaling in plant endosymbiotic organelles: mechanism and role in physiology[J].MolecularPlant, 2014,7(7):1 094-1 104.
[66] NOMURA H, KOMORI T, UEMURA S,etal. Chloroplast-mediated activation of plant immune signalling inArabidopsis[J].NatureCommunications, 2012,3:926.
[67] MANZOOR H, CHILTZ A, MADANI S,etal. Calcium signatures and signaling in cytosol and organelles of tobacco cells induced by plant defense elicitors[J].CellCalcium, 2012,51(6):434-444.
[68] BOUDSOCQ M, WILLMANN M R, MCCORMACK M,etal. Differential innate immune signalling via Ca2+sensor protein kinases[J].Nature, 2010,464(7 287):418-422.
[69] LECOURIEUX D, RANJEVA R, PUGIN A. Calcium in plant defence-signalling pathways[J].NewPhytologist, 2006,171(2):249-269.
[70] BOLLER T, FELIX G. A renaissance of elicitors: perception of microbe-associated molecular patterns and danger signals by pattern-recognition receptors[J].AnnualReviewofPlantBiology, 2009,60(1):379-406.
[71] MELOTTO M, UNDERWOOD W, KOCZAN J,etal. Plant stomata function in innate immunity against bacterial invasion[J].Cell, 2006,126(5):969-980.
(编辑:裴阿卫)
Regulation Molecular Mechanisms of Ca2+Signaling on Plant-Environmental Microorganism Interactions
GONG Xuefeng1, SONG Zhanfeng1*, MIAO Mingjun1, LI Yuejian2
(1 Horticulture Research Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China; 2 Sichuan Academy of Agricultural Sciences, Chengdu 610066, China)
Interactions between plant and environmental microorganism not only existed stress relationship but also possessed symbiotic relationship. Whether on plant-pathogen interaction system caused damage to plant or on plant symbiotic system provided nutrition for plant, the regulation molecular mechanism of Ca2+signaling in cell transduction pathways all played important roles. In this review, we focused on both interaction systems of regulation upstream mechanism of Ca2+signaling in the cell transduction pathway in details.
Ca2+signaling; symbiosis; pathogen; cell signaling transduction
1000-4025(2016)10-2128-09
10.7606/j.issn.1000-4025.2016.10.2128
2016-06-17;修改稿收到日期:2016-09-19
四川省财政创新能力提升工程专项资金,青年基金项目(2016QNJJ-026);四川省农作物育种攻关项目,突破性蔬菜(食用菌)新品种选育(2011N0098-7)
巩雪峰(1983-),女,博士,助理研究员,主要从事辣椒环境胁迫育种及分子生物学研究。E-mail:xuefenggong@qq.com
*通信作者:宋占锋,学士,副研究员,主要从事辣椒遗传育种研究。E-mail:289544274@qq.com
Q789
A
