杂交石竹授粉受精及其胚胎发育过程的观察
2016-12-17张赛阳郝鹏博杨秋生
张赛阳,栗 燕,郝鹏博,杨秋生
(河南农业大学 林学院,郑州 450002)
杂交石竹授粉受精及其胚胎发育过程的观察
张赛阳,栗 燕,郝鹏博,杨秋生*
(河南农业大学 林学院,郑州 450002)
以‘杂交石竹’为试验材料,利用荧光显微镜观察其授粉后花粉萌发、花粉管生长情况,采用石蜡切片法对其受精及胚胎发育过程进行观察研究。结果表明:(1)授粉后1 h母本柱头上少量花粉开始萌发;授粉后4 h大量花粉萌发,花粉管生长至柱头中部有胼胝质出现;授粉后6 h花粉管生长至子房组织并有少量与胚珠结合;授粉后15 h柱头中出现大量胼胝质,花粉管与胚珠结合数增多;授粉后24 h胚珠周围出现多条花粉管,其中1条花粉管进入胚珠,部分进入胚囊的花粉管卷曲盘绕生长并产生胼胝质;精细胞与极核的融合主要发生在授粉后17~48 h,与卵细胞融合主要于授粉后1~3 d。(2)杂交石竹胚发育经过原胚、球形胚、棒状形胚、心形胚、鱼雷形胚和子叶形胚阶段。(3)杂交障碍表现为:只有游离的胚乳核而无胚发育的胚囊、合子未分裂、两极核未融合、球形胚败育。研究表明,杂交石竹存在受精前和受精后障碍,这是导致其结实率低的主要原因。
杂交石竹;花粉萌发;花粉管生长;受精;胚胎发育;
石竹(Dianthuschinensis)原产中国,是优良的庭院花卉,可用于花坛、花境或盆栽观赏,也是制作花篮花束的切花材料。杂交石竹(Dianthushybridus)为石竹科石竹属多年生草本植物,由中国石竹(Dianthuschinensis)与美国石竹(Dianthusbarbatus)杂交而成,以种子繁殖为主,生长势强、一致性好、花色丰富、开花量大,在园林上应用广泛[1]。目前,国内外对香石竹杂交育种方面研究较多,而对杂交石竹少见报道,中国在杂交石竹品种选育方面研究相对落后,园林绿化应用的杂交石竹品种多数为国外育种公司培育。在杂交石竹制种过程中,经常遇到母本结实率低,多数形成空种荚或种荚中种子较少的问题。因此,探究杂交石竹授粉受精特性及胚胎发育对提高种子产量有重要意义。
本试验利用荧光显微镜对杂交石竹花粉萌发、花粉管生长过程进行观察,采用石蜡切片法对杂交受精及胚胎发育进程进行观察研究,试图探索其授粉受精特性及杂交不亲和原因,提高杂交制种产量,为杂交石竹育种及相关研究提供理论和技术依据。
1 材料和方法
1.1 材料
供试材料为杂交石竹(Dianthushybridus),田间试验于2015年4~6月在河南省济源市杂交石竹制种基地进行,室内试验在河南农业大学观赏植物实验室进行。
1.2 方法
1.2.1 花粉萌发及花粉管生长过程观察 于2015年5月盛花期,上午10:00采集当天散粉的父本花粉,授在母本柱头上,于授粉后1、4、6、15和24 h分别采集4~6个雌蕊,用FAA固定液(38%甲醛5 mL∶冰醋酸5 mL∶70%酒精90 mL)固定。取固定好的待观察材料,首先依次用70%酒精、50%酒精、30%酒精、蒸馏水分别浸泡2 h,然后用8 mol/L NaOH水浴(56 ℃)3~12 h,蒸馏水冲洗2~3次,每次10~20 min,之后用0.1%苯胺蓝溶液染色。Nikon荧光显微镜观察花粉萌发、花粉管生长情况。
1.2.2 受精过程及胚胎发育观察 于2015年5月盛花期,上午10:00采集当天散粉的父本花粉,授在母本柱头上,于授粉后17 h、1 d、2 d、3 d、5 d、12 d、15 d分别采集4~6个雌蕊,用FAA固定液固定。采用常规石蜡切片法,切片厚度8~10 μm,番红固绿染色,中性树胶封片,在Motic数码显微镜下观察受精和胚胎发育情况。
2 结果与分析
2.1 花粉萌发及花粉管生长过程观察
利用荧光显微镜对杂交石竹花粉萌发及花粉管生长过程进行观察研究,结果显示:授粉后1 h柱头附着大量花粉并有少量花粉开始萌发(图版Ⅰ,1);授粉后4 h大量花粉开始萌发,花粉管穿过柱头乳突细胞进入柱头(图版Ⅰ,2),授粉后4 h花粉管生长至柱头1/2处并出现胼胝质塞,同时观察到异常花粉粒出现较大胼胝质块,花粉管停止生长(图版Ⅰ,3);授粉后6 h花粉管已生长至子房组织并有少量与胚珠结合(图版Ⅰ,4);授粉后15 h柱头中出现大量胼胝质(图版Ⅰ,5),授粉后15 h花粉管与胚珠结合数增多(图版Ⅰ,6);授粉后24 h胚珠周围出现多条花粉管,其中一条花粉管进入胚珠(图版Ⅰ,7),授粉后24 h部分进入胚珠的花粉管卷曲盘绕生长并产生胼胝质反应(图版Ⅰ,8、9)。观察结果表明杂交石竹花粉萌发和花粉管生长均无明显阻碍,受精前障碍主要在于进入胚囊内的花粉管卷曲盘绕生长并产生胼胝质而无法完成受精。
2.2 受精过程观察
利用石蜡切片对杂交石竹受精过程进行观察,结果显示:授粉后17 h花粉管穿过珠心组织,经珠孔进入胚囊并与助细胞结合释放内容物,助细胞中内含物较多,染色呈现较深的红色(图版Ⅰ,10);授粉后1 d其中1个精细胞贴附在1个极核核膜上(图版Ⅰ,11),并与二极核细胞融合形成3核的初生胚乳核(图版Ⅰ,12);授粉后1 d在珠孔端观察到1个精细胞向卵核移动,进入卵细胞的细胞质(图版Ⅰ,13);精核贴附在卵核核膜上,进行核的融合(图版Ⅰ,14);授粉后2 d在胚囊中观察到合子和初生胚乳细胞,合子靠近珠孔端,初生胚乳核在胚囊的中心位置,受精卵的核比初生胚乳核小(图版Ⅰ,15)。通过大量石蜡切片观察发现,杂交石竹配子融合速度快,融合时间很短,但配子融合时间段相对较长,杂交石竹精细胞与极核的融合主要发生在授粉后17~48 h,与卵细胞融合过程主要于授粉后1~3 d。
2.3 胚胎发育观察
利用石蜡切片对杂交石竹胚胎发育进行观察,结果显示:授粉后2 d卵核受精形成合子,初生胚乳核开始分裂形成多个游离胚乳自由核(图版Ⅱ,1);授粉后3 d可以观察到合子分裂形成原胚,以及正在分裂的原胚和大量的游离胚乳核(图版Ⅱ,2、3);授粉后5 d原胚细胞继续分裂形成球形胚,球形胚周围存在游离胚乳自由核(图版Ⅱ,4);授粉后12 d,球形胚体积增大,细胞紧密排列,周围存在大量胚乳自由核(图版Ⅱ,5);授粉后12 d,在部分胚囊中观察到棒状形胚和心形胚(图版Ⅱ,6、7);授粉后15 d,观察到大量鱼雷形胚和子叶形胚(图版Ⅱ,8、9)。观察结果表明杂交石竹胚胎发育经历原胚、球形胚、棒状形胚、心形胚、鱼雷形胚和子叶形胚阶段。
同时对异常胚胎发育进行观察,结果显示:授粉后2 d观察到只有游离的胚乳核而无胚发育的胚囊(图版Ⅱ,10);授粉后3 d,观察到部分胚囊中有合子未分裂的现象,而在这个时期正常的胚胎已发育到原胚阶段(图版Ⅱ,11),同时观察到有两极核未融合的现象(图版Ⅱ,12),和只有游离的胚乳发育而无胚发育的胚囊(图版Ⅱ,13);授粉后5 d,败育的球形胚(图版Ⅱ,14);授粉后12 d,开始解体的球形胚,核膜界限变模糊(图版Ⅱ,15)。观察结果表明杂交石竹受精后障碍发生在受精过程和胚胎发育时期,表现为:合子未分裂、两极核未融合、只有游离的胚乳发育而无胚发育的胚囊、球形胚败育。
3 讨 论
杂交亲和性的障碍发生在生殖过程的不同阶段,主要包括受精前障碍和受精后障碍。被子植物中,授粉后花粉在柱头上的附着量、萌发及花粉管生长情况和受精后胚胎发育情况对杂交结实率影响很大,其中任何一个环节出现异常都有可能导致较低的结实率[2]。
王冲等[3]通过对君子兰种间杂交及自交亲和性研究,荧光显微观察发现在君子兰种间杂交花粉萌发与花粉管伸长均存在胼胝质现象,母本柱头表面出现大量胼胝质,而这些胼胝质阻碍花粉萌发和花粉管向下伸长。周旭红等[4]通过对不同倍性香石竹杂交花粉管生长荧光显微观察,发现花粉管先端沉积胼胝质而停止生长。栎属的2个种进行杂交时,柱头中出现的大量胼胝质使花粉管不能到达胚囊,导致杂交失败[5]。本试验观察到花粉能够在柱头上大量萌发,少量花粉粒中出现较大胼胝质块花粉管停止生长,小部分花粉管顶端胼胝质异常积累、膨大,母本柱头中观察到花粉管壁内出现大量胼胝质塞,花粉管能够顺利生长至柱头基部,并未观察到胼胝质阻碍花粉管生长的现象。王文鹏等[6]在夏蜡梅与光叶腊梅属间杂交未观察到胼胝质阻碍花粉管生长的现象,花粉萌发和花粉管生长阶段均无明显阻碍。花粉管中胼胝质栓塞的存在将花粉管后部内腔堵死,使内腔成为不连续系统,同时防止管内原生质倒流,从而保证花粉管的顶端生长[7]。当花粉管生长到达一定长度后,在后端形成胼胝质,当花粉管延长时,在一定的间隔位置多次形成胼胝质塞,因此胼胝质塞区随着花粉管生长而延长[8]。
胚珠周围出现多条花粉管,其中1条与胚珠结合,在双受精作用中,通常有阻止多条花粉管进入胚囊的机理,因此仅有1条花粉管携带的1对精细胞到达胚囊[8]。花粉管在它进入的助细胞中停止生长和释放精子,是由于当花粉管进入助细胞后,它周围的环境发生变化而触发的[8]。周旭红等[9]在不同倍性香石竹杂交受精过程及胚胎发育研究中,认为受精的子房频率低,是不同倍性香石竹杂交结实率低的重要原因。杨凤君等[10]在欧洲樱桃与草原樱桃杂交时,认为花粉管不能进入胚囊,雌雄配子不能相遇而导致不能结实。玉米等作物远缘杂交中发现,花粉管虽然能够进入胚囊,但并不一定能完成受精作用,出现胚囊不亲和现象[11]。Williams等[12]在杜鹃花种间杂交研究中发现,花粉管经珠孔进入胚囊后,因卷曲盘绕等过度生长情况,而无法完成受精。本试验观察到经珠孔进入胚囊的一条花粉管在珠孔附近卷曲盘绕生长并出现胼胝质,这一现象表明,虽然花粉管能够到达子房并进入胚囊,但不能完成双受精,存在受精前障碍,这可能是导致杂交石竹结实率低的重要原因之一。
Daston等[13]在玄参科龙面花属种间杂交时,观察到父本花粉管进入子房和胚珠,但授粉后子房并没有膨大,最终没有得到杂交种子,存在受精后障碍,受精后障碍也是导致不同倍性香石竹杂交结实率低的原因之一[9]。胚胎发育不良是引起种子败育的主要原因[14],较高比例的胚败育是影响结实率的另一个重要因素[15],Deng等[16]在菊花和细裂亚菊的属间杂交中发现较高比率的胚胎败育是结实率低的主要原因,而花粉活力和花粉管萌发对结实率的影响不大。本试验通过石蜡切片法对授粉后不同时间的杂交石竹子房进行观察,发现杂交障碍发生在受精过程和胚胎发育时期,表现为:两极核未融合、胚囊中合子未分裂、只有游离的胚乳核无胚发育的胚囊、球形胚败育。因此,受精后障碍也是导致杂交石竹结实率低的重要原因之一。
通过对杂交石竹授粉后花粉管生长及胚胎发育情况进行观察研究,发现杂交石竹存在受精前和受精后障碍,花粉管进入胚珠后卷曲盘绕生长并产生胼胝质、受精后合子未分裂、两极核未融合、胚败育,这几个因素共同作用,是导致结实率低的主要原因,但引起杂交石竹杂交生殖障碍的机理还不清楚。今后在杂交石竹制种过程中,应选择在花粉活力和柱头可授性较强时期内进行授粉,增加受精胚珠的概率,以期获得更多、更饱满的杂交种子,提高杂交结实率和制种生产效率。
[1] 宋利娜,许 超,辛海波,等.杂交石竹雄性不育株离体快繁技术研究[J].北京农学院学报,2015,30(3):92-95.
SONG L N,XU C,XIN H B,etal. A study on in vitro rapid propagation technique for male sterile lines ofDianthushybridus[J].JournalofBeijingUniversioyofAgriculture,2015,30(3):92-95.
[2] 孙春青,陈发棣,房伟民,等.野菊与菊花杂交中花粉活力和柱头可授性及胚胎发育研究[J].西北植物学报,2009, 29(7):1 335-1 341.
SUN C Q,CHEN F D,FANG W M,etal. Pollen viability, pistil receptivity and embryogenesis in the cross betweenDendranthemaindicumandD.grandiflorum[J].ActaBotanicaBoreali-OccidentaliaSinica,2009,29(7):1 335-1 341.
[3] 王 冲,雷家军,姜 闯,等.君子兰种间杂交及自交亲和性[J]. 中国农业科学,2011,44(18):3 822-3 829.
WANG C, LEI J J,JIANG C,etal. Study on cross-compatibility of interspecific hybridization and selfing inCliviaLindl[J].ScientiaAgriculturaSinica,2011,44(18):3 822-3 829.
[4] 周旭红,桂 敏,王继华,等.不同倍性香石竹杂交花粉管生长荧光显微观察及结实研究[J].西北植物学报,2012,32(1):67-74.
ZHOU X H,GUI M,WANG J H,etal. Pollen Tube growth after crossing between different ploidsDianthuscaryophyllusby Fluorescence Microscopy and seed setting[J].ActaBotanicaBoreali-OccidentaliaSinica,2012,32(1):67-74.
[5] BOAVIDA L C,SILVA J P,FEIJO J A. Sexual reproduntion in the cork oak (QuercussuberL).II.Crossing intra-and interspecific barriers[J].SexualPlantReproduction,2001,14:143-152.
[6] 王文鹏,周莉花,刘华江,等. 夏蜡梅与美国蜡梅属间杂交障碍的组织学机理[J].园艺学报,2013,40(10):1 943-1 950.
WANG W P ,ZHOU L H,LIU H J,etal. Histological reproductive barriers for intergeneric cross betweenSinocalycanthuschinensisandCalycanthusfloridusvar.oblongifolius[J].ActaHorticulturaeSinica,2013,40(10):1 943-1 950.
[7] ALEXANDER KRICHEVSKY, STANISLAV V. KOZLOVSKY, GUO W T,etal. How pollen tubes grow[J].DevelopmentBiology, 2007,(303):405-420.
[8] 胡适宜,朱 澂.,被子植物有性生殖图谱[M].北京:科学出版社,2000.
[9] 周旭红,桂 敏,陈 敏,等.不同倍性香石竹杂交受精过程及胚胎发育研究[J].西北植物学报, 2013, 33(1):1-6.
ZHOU X H,GUI M,CHEN M,etal. Fertilization and development of embryo in different interploidal crosses ofDianthuscaryophyllus[J].ActaBotanicaBoreali-OccidentaliaSinica,2013, 33(1):1-6.
[10] 杨凤军,臧忠婧,吴 瑕. 草原樱桃种内和种间授粉亲和性的荧光显微观察[J]. 果树学报, 2015,(5):909-913.
YANG F J,ZANG Z J,WU X. Fluorescent microscope observation on pollination compatibility of Ground cherry[Cerasusfruticosa(Pall.)]crossing with different cherry cultivars[J].JournalofFruitScience,2015,(5):909-913.
[11] 段桃利.玉米与其近缘种属杂交花粉管行为研究[D].四川雅安:四川农业大学,2008.
[12] WILLIAMS E G, KAUL V, ROUSE J L,etal. Overgrowth of pollen tubes in embryo sacs of Rhododendron following interspecific pollinations[J].AmerJBot,1986,(34):413-423.
[13] DASTON P M, MURRAY B G, HAMMETT K R W. Pollination systems hybridization barriers and meiotic chromosome behavior in Namesia hybrids[J].Euphytia,2006,151:173-185.
[14] 陈晓月,王金鑫,裴艳梅,等. 无核小枣与金丝小枣授粉受精过程的观察[J]. 河北农业大学学报. 2014, 37(6):28-32.
CHEN X Y, WANG J X, PEI Y M,etal. Observation of pollination and fertilization ofZiziphusjujubaMill.‘Jinsixiaozao’ andZ.jujubaMill.‘Wuhexiaozao’[J].JournalofAgriculturalUniversityofHebei, 2014, 37(6):28-32.
[15] 胡适宜.被子植物生殖生物学[M].北京:高等教育出版社,2005.
[16] DENG Y M, TENG N J, CHEN S M,etal. Reproductive barriers in theintergeneric hybridization betweenChrysanthemumgrandiflorum(Ramat)Kitam.andAjaniaprzewalskiiPoljak.Euphytica,2010,174(1):41-50.
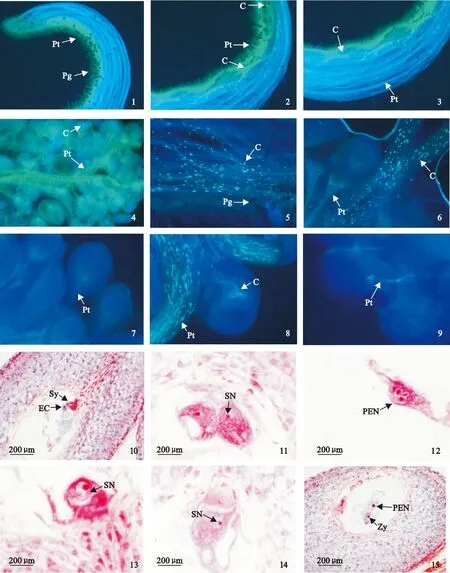
Pt.花粉管;Pg.花粉粒;C.胼胝质;Sy.助细胞;EC.卵细胞;SN.精核;PEN.初生胚乳核;Zy.合子1.柱头附着大量花粉、授粉后1 h少量花粉开始萌发,×100;2. 授粉后4 h大量花粉开始萌发,少量花粉粒出现较大胼胝质,花粉管穿过柱头乳突细胞进入柱头,×100;3.授粉后4 h花粉管生长至柱头1/2处并出现胼胝质塞,×100;4. 授粉后6 h花粉管已生长至子房组织并有少量与胚珠结合,×200; 5. 授粉后15 h柱头中出现大量间断胼胝质反应,×200;6. 授粉后15 h大量花粉管进入子房组织,花粉管与胚珠结合数增多,×200; 7. 授粉后24 h胚珠周围出现多条花粉管,其中1条花粉管进入胚珠,×200;8、9. 授粉后24 h部分进入胚囊的花粉管卷曲盘绕生长并产生胼胝质,×400;10.授粉后17 h花粉管经珠孔进入胚囊并进入助细胞释放内容物;11. 授粉后1 d1个精细胞贴附在1个极核核膜上;12. 授粉后1 d1个精细胞与二极核细胞融合形成3核的初生胚乳核;13. 授粉后1 d1个精细胞向卵核移动,进入卵细胞的细胞质;14. 授粉后1 d精核贴附在卵核核膜上;15. 授粉后2 d合子和初生胚乳细胞图版Ⅰ ‘杂交石竹’花粉萌发、花粉管生长及受精过程Pt. pollen tube; Pg. Pollen grain; C. Callose response; Sy. Synergid; EC. Egg cell; SN. Sperm nuclei; PEN. Primary endosperm nucleus; Zy. ZygoteFig.1. Stigma attached to a large number of pollens a small amount of pollens began to germinationed in 1 h after pollination, ×100; Fig.2. Many of pollen grains on the stigma began to germinationed in 4 h after pollination, pollen grains appear larger callose, pollen tube through the stigma papilla cells into stigma, ×100; Fig.3. The pollen tubes grew to stigma 1/2 and callose plug in 4 h after pollination, ×100; Fig.4. Pollen tubes grew to the ovary tissue and a small amount of them entered the ovule in 6 h after pollination, ×200; Fig.5. Stigma callose reactions occurred in 15 h after pollination, ×200;Fig.6. the large number of pollen tubes into the ovary tissue, pollen tubes increased within ovule, in 15 h after pollination, ×200; Fig.7.Many of pollen tubes had arisen ovule around, one of the pollen tube entered the ovule, ×200; Fig.8,9. Some pollen tubes had formed coiled overgrowth and generated callose reaction in the embryo sac, ×400; Fig.10. The pollen tube entered into one synergid and released contents 17 h after pollination; Fig.11. Sperm nucleus adhered to the nuclear membrane of the polar nuclei 1 d after pollination; Fig.12. Sperm nucleus fused with two polar nuclei and the primary endosperm nucleus 1 d after pollination; Fig.13. Sperm nucleus moved towards egg nucleus and entered the cytoplasm of egg nucleus 1 d after pollination; Fig.14. Sperm nucleus adhered to the nuclear membrane of the egg cell 1 d after pollination; Fig.15. Zygote and primary endosperm nucleus 2 d after pollinationPlate Ⅰ ‘Dianthus hybridus’ pollen germination, pollen-tube growth and fertilization

Zy.合子;EFN.胚乳自由核;PN.极核1.授粉后2 d,合子和游离胚乳核;2.授粉后3 d合子分裂形成原胚;3.正在分裂的原胚细胞和胚乳核;4.授粉后5 d,原胚细胞分裂形成球形胚;5.授粉后12 d,球形胚体积增大;6.授粉后12 d,棒状形胚;7. 授粉后12 d,心形胚;8.授粉后15 d,鱼雷形胚;9. 授粉后15 d,子叶形胚;10.授粉后2 d,无合子只有游离胚乳核;11.授粉后3 d,合子未分裂;12.授粉后3 d,两极核未融合;13.授粉后3 d,无胚发育的胚囊;14.授粉后5 d,败育的球形胚;15.授粉后12 d,正在解体的球形胚。图版Ⅱ ‘杂交石竹’胚胎发育情况(标尺=200 μm)Zy. Zygote; EFN. Endosperm free nuclei; PN. Polar nucleiFig.1. Formation of a zygote and endosperm free nuclei 2 days after pollination; Fig.2. Zygote division formed proembryon 2 days after pollination; Fig.3. Division of proembryo and endosperm free nuclei 2 days after pollination; Fig. 4. Proembryo division formed globular embryo 5 days after pollination; Fig.5. Globular embryo volume increase 12 days after pollination; Fig.6. Club-shaped embryo 12 days after pollination; Fig. 7. Heart embryo 12 days after pollination; Fig.8. Torpedo embryo 15 days after pollination; Fig.9. Cotyledonary embryo 15 days after pollination; Fig.10. Only the endosperm without embryo sac 2 days after pollination; Fig.11. Undivision of zygote 3 days after pollination; Fig.12. Degenerated endosperm free nuclei 3 days after pollination; Fig.13. No embryos of embryo sac 3 days after pollination; Fig.14. Degenerated globular embryo 5 days after pollination; Fig.15. The dissolution of globular embryo 12 days after pollination.Plate Ⅱ Embryogenesis after pollination in ‘Dianthus hybridus’(Bars=200 μm)
(编辑:潘新社)
Pollination,Fertilization and Embryonic Development of Dianthus hybridus
ZHANG Saiyang, LI Yan, HAO Pengbo, YANG Qiusheng*
(College of Forestry, Henan Agricultural University, Zhengzhou 450002,China)
With ‘Dianthushybridus’ as experiment material, we used fluorescence microscope to observe the pollen germination and pollen tube growth after pollination, to study the process of fertilization and embryo development with paraffin section method. The results showed that: (1) at 1 h after pollination, a small amount of pollens germinationed; At 4 h after pollination, a large number of pollens germinationed, pollen tube tips were found in the style middle, and callose response was found in pollen tubes; 6 h after pollination pollen tube grow to capital base and with a small amount of ovules; After 15 h stylar cannal has callose response, the pollen tube with the ovule number increased; At 24 h, many of pollen tubes have arisen around, one of the pollen tube enters the ovule, some pollen tubes have formed coiled overgrowth and generate callose reaction in the embryo sac. Sperm nucleus fused with polar nuclei mainly in 17-48 h after pollination, and the egg cell fusion process is mainly in 1-3 d after pollination. (2) The development of embryo through the proembryo, globular embryo, rod shaped embryo, heart-shaped embryo, torpedo embryo and cotyledon embryo stages. (3) Cross obstacle characterized by: only free endosperm nuclear and no embryo developmental embryo sac, zygote did not divided, sperm did not fused with polar nucleus, only free endosperm development without embryos of embryo sac, globular embryo aborted. The pre-fertilization and post-fertilization, obstacle are the main cause of low seed setting rate.
Dianthushybridus; pollen germination; pollen tube growth; fertilization; embryo abortion
1000-4025(2016)10-1984-06
10.7606/j.issn.1000-4025.2016.10.1984
2016-07-14;修改稿收到日期:2016-08-16
张赛阳(1990-),男,在读研究生,主要从事园林植物种质资源创新及育种。E-mail:zhangsaiyang1990@126.com
*通信作者:杨秋生,博士生导师,主要从事园林植物栽培教学和研究。E-mail:qsyang@henau.edu.cn
Q321+.8; Q944.58
A
