马尾松幼苗生长及生理特性对铝胁迫的响应
2016-12-17张盛楠刘亚敏刘玉民纪雨薇周文颖
张盛楠,刘亚敏,刘玉民,纪雨薇,周文颖
(西南大学 资源环境学院,三峡库区生态环境教育部重点实验室,重庆 400715)
马尾松幼苗生长及生理特性对铝胁迫的响应
张盛楠,刘亚敏,刘玉民*,纪雨薇,周文颖
(西南大学 资源环境学院,三峡库区生态环境教育部重点实验室,重庆 400715)
以马尾松幼苗为试验材料,采用水培法研究铝胁迫(Al3+浓度为0、0.2、0.4、0.8、1.6 mmol·L-1)对马尾松幼苗生长及其针叶中叶绿素、渗透调节物质(可溶性糖、可溶性蛋白、脯氨酸)、丙二醛(MDA)和超氧化物歧化酶(SOD)、过氧化物酶(POD)等保护酶活性的影响,为揭示马尾松铝毒害生理机制及提高马尾松的耐铝能力提供理论依据。结果显示:当Al3+处理浓度为0.2 mmol·L-1时对马尾松株高和基径生长的影响较小,但对马尾松根系生长有一定的促进作用;Al3+处理浓度大于0.2 mmol·L-1时对马尾松株高、基径和根长的生长均会产生一定的抑制作用,且这种抑制作用随着Al3+浓度的增大而增强。马尾松针叶中叶绿素含量和SOD、POD活性均随着Al3+处理浓度的增加呈先上升后下降的趋势;Al3+处理浓度大于0.2 mmol·L-1时马尾松针叶中可溶性糖、可溶性蛋白、脯氨酸等渗透调节物质均呈上升趋势,且随着Al3+浓度的升高而增大;Al3+处理浓度大于0.2 mmol·L-1时马尾松针叶中MDA含量也呈上升趋势,且随着Al3+浓度的增大而升高,说明大于0.2 mmol·L-1的Al3+处理可导致马尾松膜脂产生氧化。研究表明,马尾松幼苗具有一定的耐铝能力,在铝胁迫生境下可通过提高自身SOD和POD等保护酶的合成和主动积累脯氨酸、蛋白质和可溶性糖等渗透物质,产生适应性生理响应以维持自身的生理平衡来降低铝毒害作用。
铝胁迫;马尾松;生长;生理特性
土壤酸化在中国环境问题中日益突出,目前中国酸性土壤面积已高达2.0×106hm2[1-2]。在酸性土壤中,大量的重金属离子和铝离子被释放、活化,使酸性土壤中的植物极易受到毒害。大量研究表明铝毒害是酸性土壤中限制植物生长的主要因素之一[3-4],由于酸性土壤地区活性铝的存在,对中国南方地区的农林业生产和生态环境的建设造成严重的威胁,研究植物的耐铝性及铝胁迫下植株内部的生理特性变化,可以为提高植物缓解铝毒伤害提供理论依据。
马尾松(Pinusmassoniana)属松科(Pinaceae)松属(Pinus)植物,具有耐干旱、耐贫瘠、生长迅速、适应性强等优良特点,是中国南方造林的先锋树种。中国南方马尾松林的面积达1.13×107hm2,蓄积量为3.41×108m3[5]。但是随着土壤酸化的加剧,致使土壤中活性铝的含量增加,使马尾松的生长、生产受到了严重的影响,甚至导致中国南方酸性土壤地区的马尾松林大面积死亡[6],造成了不可估量的损失。如何提高马尾松的耐铝能力是目前马尾松产业发展亟需解决的重要科学问题,而揭示马尾松的铝毒害生理机制是解决这一问题的关键。但到目前为止关于铝胁迫对马尾松影响的研究多集中在种子萌发和根系生长等方面[7-8],有关马尾松植株生长及生理特性对铝胁迫的响应机制研究鲜见报道。因此,本研究以马尾松幼苗为试验材料,探讨铝胁迫对马尾松植株生长及针叶中光合色素、渗透调节物质、丙二醛及抗氧化酶活性的影响,旨在揭示马尾松对铝胁迫的生理响应机制,为提高马尾松的耐铝毒能力提供基础数据及理论依据。
1 材料和方法
1.1 材料及处理
供试材料为2013年11月福建省漳平五一国有林场提供的优质马尾松种子。2014年3月选择大小一致、圆润饱满的马尾松种子,经2%H2O2消毒10 min后,用蒸馏水反复冲洗20 min,25 ℃浸种24 h,均匀播于装有珍珠岩的育苗盘中,于恒温培养箱中25 ℃下催芽至露白,露白后置于光照培养室进行培养,定期浇等量蒸馏水。待马尾松幼苗针叶完全打开,选取长势一致的幼苗移栽到装有珍珠岩的塑料花盆中,定期给幼苗浇等量的1/5 Hoagland完全营养液,在光照培养室内培养1年。本试验采用水培方式进行,选择长势一致的1年生马尾松幼苗,洗净根系上的培养基质,用纱布包住茎,移栽固定于盖上有小孔的塑料杯(800 mL)中,采用含不同浓度Al3+的1/5 Hoagland完全营养液培养,每杯1株苗,10杯为一组,每个处理重复3组。试验设0(CK)、0.2、0.4、0.8和1.6 mmol·L-15个Al3+浓度梯度,Al3+以AlCl3(分析纯)形式加入,用稀盐酸和氢氧化钠溶液将pH调节为4.00±0.05,每5 d更换1次营养液。
1.2 测定指标与方法
1.2.1 生长指标 分别于铝胁迫第0 天(胁迫前)、第30 天和第60 天对马尾松的株高、基径、根长进行测量,各浓度随机选取6株幼苗(每组2株,共3组),计算出铝胁迫第30 天和第60 天马尾松株高、基径和根长的增长量。其中,株高用直尺测量,基径用游标卡尺测量。根长的测定参考郑纯辉[9]的方法。
1.2.2 生理指标 铝处理60 d后取各处理的马尾松针叶进行相应生理生化指标测定,各指标均进行3次重复取样测定。叶绿素含量的测定参照杨志晓等[10]方法;丙二醛(MDA)含量的测定采用硫代巴比妥酸法[11];超氧化物歧化酶(SOD)活性采用氮蓝四唑法[11]测定,过氧化物酶(POD)活性采用愈创木酚显色法[12]测定;脯氨酸(Pro)含量采用茚三酮比色法[13]测定;可溶性糖含量采用蒽酮比色法[12]测定;可溶性蛋白含量采用考马斯亮蓝G250染色法[12]测定。POD以每分钟内吸光度A470变化0.01为1个酶活性单位(U),SOD活性以每克鲜样品酶活力单位表示。
1.3 数据处理
利用Microsoft Excel 2003软件对数据进行处理和作图,统计分析运用SPSS 19.0统计软件,采用One-Way ANOVA进行单因素方差分析,采用LSD分析法进行多重比较。
2 结果与分析
2.1 铝胁迫对马尾松幼苗生长的影响
植物的生长状况是植物对铝胁迫最直观的响应。表1显示,在铝胁迫第30 天时,各浓度铝处理马尾松株高、基径和根长增量与相应对照均没有显著性差异(P>0.05);株高和基径增量随着Al3+浓度的增加呈下降趋势,根长增量在Al3+浓度为0.2 mmol·L-1时比对照有所增加(增幅为15.5%),但当Al3+浓度大于0.2 mmol·L-1时则呈下降趋势。当铝胁迫至第60 天时,马尾松株高增长量随着Al3+浓度的增大呈逐渐下降趋势,各处理比对照降低30.3%~52.9%,且除0.2 mmol·L-1Al3+处理外均达到显著水平(P<0.05);马尾松基径的增长量随着Al3+浓度的增大呈先升高后降低的趋势,但仅当Al3+浓度达1.6 mmol·L-1时才显著低于对照(降幅为51.2%),其余处理均与对照无显著差异;马尾松根长增长量随着Al3+浓度的增大也呈现出先上升后下降的趋势,在Al3+浓度为0.2 mmol·L-1时最高比对照增加13.6%,当Al3+浓度为1.6 mmol·L-1时最低,比对照降低24.7%,但各处理均与对照无显著性差异。以上结果表明本实验中低浓度(0.2 mmol·L-1)的铝处理对马尾松株高和基径生长的影响较小,对根系的生长有一定的促进作用;高浓度和长时间的铝处理则对马尾松的生长会产生一定的抑制作用,且在株高增量上表现得更明显。
2.2 铝胁迫对马尾松幼苗叶绿素含量的影响
叶绿素是植物进行光合作用的一类重要色素,其含量是衡量植物光合效率及其同化能力的指标之一[14-15]。各浓度铝胁迫对马尾松幼苗针叶的总叶绿素、叶绿素a和叶绿素b的含量均有不同程度的影响。其中,随着Al3+浓度的增加,马尾松针叶中总叶绿素、叶绿素a和叶绿素b的含量均呈先上升后下降的趋势,且均在Al3+浓度为0.4 mmol·L-1时达到最大,随后均呈下降趋势,但各处理组大多与对照组无显著差异(图1,A~C);而马尾松针叶中叶绿素a与叶绿素b的比值随着Al3+浓度的增加,整体呈先上升后下降的趋势,在Al3+浓度为0.8 mmol·L-1时达到最大值,且各铝胁迫处理明显高于对照9.0%~24.5%,并在除0.4 mmol·L-1浓度外的处理中均达到显著水平(图1,D)。
2.3 铝胁迫对马尾松幼苗膜脂过氧化水平的影响
植物在逆境下遭受伤害时,往往会发生膜脂过氧化作用,而丙二醛(MDA)是膜脂过氧化的终产物之一,MDA的含量可以反映植物膜脂过氧化作用的水平和对细胞膜的伤害程度。图2显示,马尾松幼苗针叶MDA含量在Al3+浓度为0.2 mmol·L-1时比对照显著降低35.4%(P<0.05),而随着Al3+处理浓度的增加而显著增大,并趋于稳定,比对照显著性升高26.1%~40.6%(P<0.05)。可见,马尾松针叶的膜脂过氧化作用在低Al3+浓度(0.2 mmol·L-1)时得到明显缓解,但在Al3+浓度大于0.2 mmol·L-1时显著增强,说明中高浓度铝处理加剧了马尾松的膜脂过氧化程度。

表1 铝胁迫下马尾松幼苗生长的变化
注:表中数值为平均值±标准偏差;同列不同字母表示不同Al3+浓度处理间在0.05水平存在显著性差异
Note:Data in the table are means ± SD. Different letters in the same column indicated significant difference at 0.05 level
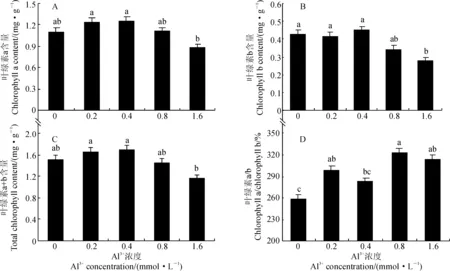
不同字母表示不同Al3+浓度处理下某指标在0.05水平差异显著;下同图1 铝胁迫下马尾松针叶叶绿素含量的变化Different letters indicated significant difference under the different concentrations of Al3+ at 0.05 level;The same as belowFig.1 The contents of chlorophyll in P. massoniana leaves under aluminum stress

图2 铝胁迫下马尾松针叶丙二醛含量的变化Fig.2 The content of MDA in P. massoniana leaves under aluminum stress
2.4 铝胁迫对马尾松幼苗渗透调节物质的影响
脯氨酸(Pro)、可溶性蛋白质和可溶性糖是植物体内重要的渗透调节物质,当植物生长在不利的外界环境时,植物体本身会主动积累脯氨酸、蛋白质和可溶性糖等渗透物质来维持自身体内的水分平衡和渗透平衡[16]。首先,马尾松针叶中Pro含量随着Al3+浓度的增加呈现出逐渐显著增加的趋势,且各浓度间差异达到显著水平(P<0.05),并当Al3+浓度为1.6 mmol·L-1时,针叶Pro含量急剧增加,达到对照的2.6倍(图3,A)。其次,马尾松针叶中可溶性蛋白质含量随着Al3+浓度的增大整体呈现显著上升趋势,各处理比对照显著增加16.6%~153.0%(P<0.05);但在Al3+浓度达0.8 mmol·L-1后,针叶可溶性蛋白质含量的增幅明显变缓,说明铝处理可以显著促进马尾松针叶中蛋白质的合成,但当浓度达一定值后这种促进作用趋于稳定(图3,B)。再次,可溶性糖能为细胞提供能量,保持细胞渗透势,减缓由胁迫造成的植物生理代谢不平衡问题[17]。马尾松针叶中可溶性糖含量随着Al3+处理浓度的增大总体呈上升趋势(Al3+浓度为0.2 mmol·L-1时除外),并在Al3+浓度为1.6 mmol·L-1时达到最大,此时比对照显著增加63.6%(P<0.05)(图3,C)。以上结果表明,在铝胁迫条件下,马尾松幼苗会主动积累脯氨酸、可溶性糖、蛋白质等渗透调节物质来维持细胞的水和渗透平衡,从而减轻铝胁迫对马尾松幼苗的伤害;但高浓度(1.6 mmol·L-1)的铝处理会破坏马尾松针叶细胞膜结构,从而破坏马尾松幼苗的正常渗透调节机能。

图3 铝胁迫下马尾松针叶脯氨酸、蛋白质和可溶性糖含量的变化Fig.3 The contents of proline, protein and soluble sugar in P. massoniana leaves under aluminum stress
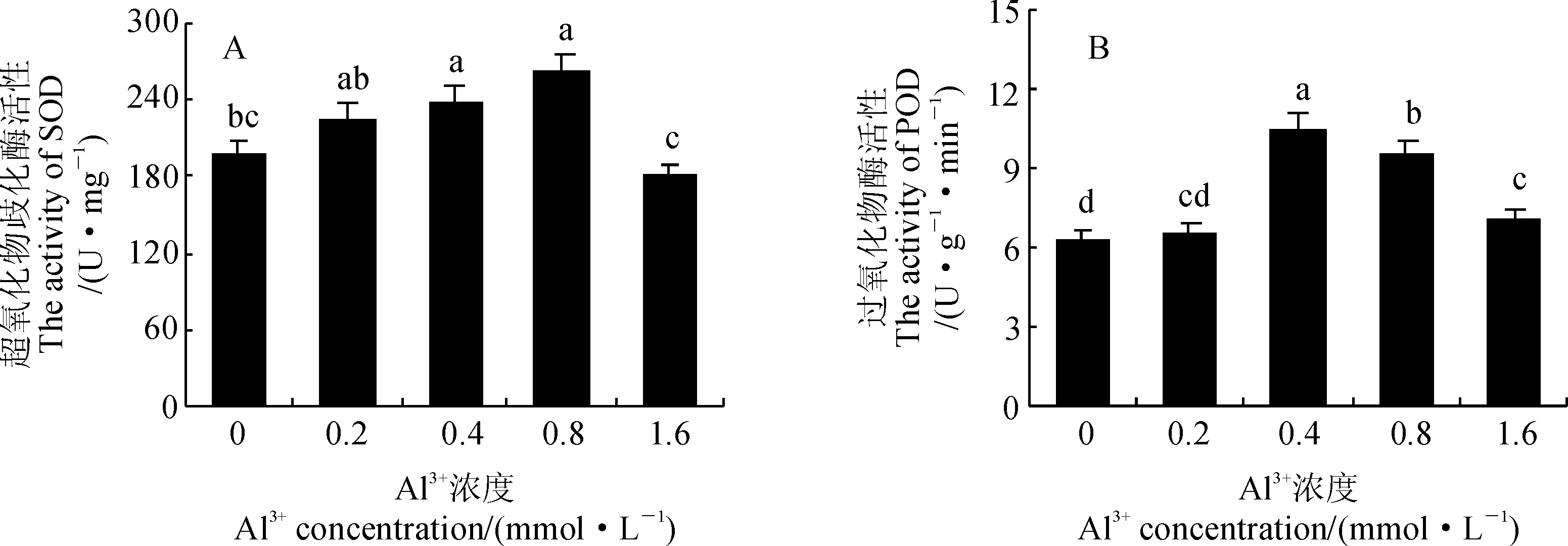
图4 铝胁迫下马尾松针叶SOD和POD活性的变化Fig.4 The activities of SOD and POD in P. massoniana leaves under aluminum stress
2.5 铝胁迫对马尾松幼抗氧化酶活性的影响
超氧化物歧化酶(SOD)是清除植物体内活性氧自由基的重要物质,不仅可以消除新陈代谢过程中产生的有害物质,还可以抵抗活性氧自由基对细胞膜的伤害;过氧化物酶(POD)可以催化歧化作用产生的过量H2O2,以维持植物体正常的生理代谢[18]。当Al3+处理浓度小于1.6 mmol·L-1时,马尾松针叶中SOD的活性随着Al3+处理浓度的增大呈上升趋势,并在0.4和0.8 mmol·L-1时显著高于对照(P<0.05);当Al3+处理浓度为1.6 mmol·L-1时,马尾松针叶中SOD活性急剧下降,显著低于其他铝处理组,但与对照无显著性差异(P>0.05)(图4,A)。马尾松针叶中POD的活性在Al3+处理浓度为0.2 mmol·L-1时与对照无显著差异(P>0.05);当Al3+处理浓度由0.2 mmol·L-1上升至0.4 mmol·L-1时,针叶中POD的活性大幅上升58.7%;此后,随着Al3+浓度的继续增大,POD的活性呈下降趋势,但仍显著高于对照13.0%~51.0%(P<0.05)(图4,B)。以上结果表明马尾松自身的抗氧化酶系统铝胁迫条件下会产生一定的应激响应,促进相关抗氧化酶的合成,以清除逆境胁迫所产生的过氧化物质;但当铝处理浓度超过一定范围时,其胁迫程度已经超出了马尾松抗氧化酶系统的自我调节能力,酶系统的应激响应相应减弱。
3 讨论与结论
植物的生长状况是评价植物在逆境胁迫下所受伤害程度及其耐受性的重要指标之一。研究表明铝胁迫对植株的生长有显著影响[19],并且有研究证实低浓度铝可维持细胞膜的稳定性、减少细胞内的外渗物质,有利于植物生长[20]。本研究发现当Al3+浓度为0.2 mmol·L-1时,马尾松根长的增长量大于对照,表明低浓度(0.2 mmol·L-1)的铝对马尾松根系的生长有一定的促进作用,与张美艳等[21]研究一致;但当Al3+浓度达到0.4 mmol·L-1时,马尾松根长、株高的增长量低于对照,生长受到一定的抑制,并且随着Al3+浓度的增加,铝胁迫对马尾松生长的抑制作用逐渐增强,当铝胁迫第60天、Al3+浓度为1.6 mmol·L-1时,铝胁迫对马尾松根长增量和株高增量的抑制作用均达到显著水平。
同时,植物生长依赖于光合作用,而叶绿素是植物体进行光合作用过程中最重要的色素,在光合作用中起到接收和转换能量的作用,其含量的多少与植物体光合作用的强弱密切相关[22]。很多研究表明,维持植物体本身的光合作用,有利于增强植物对逆境胁迫的耐受能力[23]。本研究结果表明,中低浓度铝处理(Al3+浓度≤0.4 mmol·L-1)能够在一定程度上促进马尾松针叶中叶绿素a、叶绿素b及总叶绿素含量的增加,高浓度的铝处理(Al3+浓度>0.4 mmol·L-1)则能降低马尾松针叶中叶绿素a、叶绿素b及总叶绿素含量,这与于力[24]对豇豆的研究结果一致。此外,铝处理也能显著提高马尾松体内叶绿素a与叶绿素b的比值。
此外,脯氨酸、可溶性蛋白质和可溶性糖是植物体内重要的渗透调节物质,它们在逆境胁迫下可以在植物体内大量积累,来维持植物体内的水分和渗透平衡[25]。在逆境胁迫下,植物体会大量积累脯氨酸以保持植物细胞的含水量和膨压势,维持植物的正常生长和代谢[26]。此外,植物体为避免逆境胁迫对核酸等物质造成破坏,会诱导产生可溶性蛋白以维持植物细胞的正常代谢[27]。本试验中,随着Al3+浓度的增大,马尾松针叶中脯氨酸含量升高且在各处理组间差异性显著,同时可溶性蛋白质含量也呈现整体上升趋势,但蛋白质含量增长得较为缓慢,表明铝胁迫会破坏马尾松针叶的渗透平衡,且脯氨酸在维持逆境胁迫下马尾松针叶的水分和渗透平衡中占主导地位。在逆境胁迫下可溶性糖可以为其他渗透调节物质的合成提供能量和碳源[28]。本研究中马尾松针叶可溶性糖含量在Al3+浓度为0.2 mmol·L-1时最小,后随着Al3+浓度的增加呈整体增加的趋势,可能是由于0.2 mmol·L-1Al3+铝处理没有对马尾松的生长产生抑制作用,所以其脯氨酸、蛋白质等渗透物质没有大量合成,此时不需要植物体合成大量的可溶性糖为其提供能量和碳源;但是,随着Al3+浓度的继续增加,铝胁迫对马尾松的生长产生抑制作用逐渐增强,马尾松为维持自身正常生长需大量合成脯氨酸、蛋白质等渗透物质,此时植物体合成大量可溶性糖为脯氨酸、蛋白质等渗透物质的合成提供能量和碳源。
综上所述,马尾松具有一定的耐铝性,低浓度的铝(0.2 mmol·L-1)胁迫对马尾松幼苗生长的影响较小,而当Al3+胁迫浓度高于0.2 mmol·L-1时会对马尾松幼苗产生一定的毒害作用,明显抑制马尾松幼苗的生长,且这种抑制作用随着Al3+浓度的增大而增强。同时,在铝胁迫生境下马尾松可通过提高SOD和POD的合成来降低铝胁迫的毒害与损伤,通过主动积累脯氨酸、蛋白质和可溶性糖等渗透物质来维持自身体内的水分平衡和渗透平衡,以降低其毒害作用。铝胁迫会对马尾松的抗逆性生理特性产生一定的影响,其自身产生的适应性生理响应可能是其缓解铝毒害的一种调节机制。
[1] GUO J H,LIU X J,ZHANG Y,etal.Significant acidification in major Chinese Croplands[J].Science,2010,327:1 008-1 010.
[2] 赵其国.我国红壤的退化问题[J].土壤,1995,(6):281-285.
ZHAO Q G.The degradation of red soil in our country[J].Soil,1995,(6):281-285.
[3] HALMAN J M,SCHABERG P G,HAWLEY G J,etal.Calcium and aluminum impacts on sugar maple physiology in a Northern Hardwood Forest[J].TreePhysiol.,2013,33(11):1 242-1 251.
[4] 张 健,李贤伟,胡庭兴.铝毒害与森林衰退研究评述[J].世界林业研究,1999,12(2):28-30.
ZHANG J,LI X W,HU T X.Research on aluminum toxicity and forest decline[J].WorldForestryResearch,1999,12(2):28-30.
[5] 罗应华,孙冬婧,林建勇,等.马尾松人工林近自然化改造对植物自然更新及物种多样性的影响[J].生态学报,2013,33(19):6 154-6 162.
LUO Y H,SUN D J,LIN J Y,etal.Effect of Close-to-Nature management on the natural regeneration and species diversity in a masson pine plantation[J].ActaEcologicaSinica,2013,33(19):6 154-6 162.
[6] 刘厚田,田仁生.重庆南山马尾松衰亡与土壤铝活化的关系[J].环境科学学报,1992,12(3):297-305.
LIU H T,TIAN R S.Chongqing NanshanPinusmassonianadecay relations with soil aluminum activation[J].ActaScientiaeCircumstantiae,1992,12(3):297-305.
[7] 赵志刚,丁贵杰,唐 敏.酸、铝胁迫对马尾松种子萌发与芽苗生长的影响[J].林业科学研究,2007,20(1):111-115.
ZHAO Z G,DING G J,TANG M.The effect of acid and aluminum stress on seed germination and seedling growth ofPinusmassoniana[J].ForestResearch,2007,20(1):111-115.
[8] 王水良,王 平,王趁义.铝胁迫对马尾松幼苗根系形态及活力的影响[J].生态学杂志,2010,29(11):2 097-2 101.
WANG S L,WANG P,WANG C Y.Effects of aluminum stress onPinusmassonianaseedlings root morphology and activity[J].ChineseJournalofEcology,2010,29(11):2 097-2 101.
[9] 郑纯辉,康跃虎,姚素梅,等.基于地理信息系统的植物根系分析方法[J].农业工程学报,2004,20(1):181-183.
ZHENG C H,KANG Y H,YAO S M,etal.Method of root analysis using GIS technology[J].TransactionsoftheCSAE, 2004,20(1):181-183.
[10] 杨志晓,丁燕芳,张小全,等.赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响[J].生态学报,2015,35(12):4 146-4 154.
YANG Z X,DING Y F,ZHANG X Q,etal.Impacts ofAlternariaalternatastress on characteristics of photosynthesis and chlorophyll fluorescence in two tobacco cultivars with different resistances[J].ActaEcologicaSinica,2015,35(12):4 146-4 154.
[11] 张承东,韩朔睽,魏钟波.硒对除草剂胁迫下水稻幼苗活性氧清清除系统响应的作用[J].环境科学,2002,23(4):93-96.
ZHANG C D,HAN S K,WEI Z B.Effect of selenium on the response of the active oxygen scavenging system in the leaves of paddy rice under the stress of herbicide[J].EnvironmentalScience,2002,23(4):93-96.
[12] 蒋时姣,钟 宇,刘海鹰,等.铝胁迫对柳杉组培苗生长及生理特性的影响[J].植物生理学报,2015,51(2):227-232.
JIANG S J,ZHONG Y,LIU H Y,etal.Effect of aluminum stress on the growth and some physiological characteristics inCryptomeriafortuneitisssue culture seedlings[J].PlantPhysiologyJournal,2015,51(2):227-232.
[13] 王 丹,宣继萍,郭海林,等.结缕草的抗寒性与体内碳水化合物、脯氨酸、可溶性蛋白季节动态变化的关系[J].草业学报,2011,20(4):98-107.
WANG D,XUAN J P,GUO H L,etal.Seasonal changes of freezing tolerance and its relationship to the contents of carbohydrates, proline, and soluble protein of Zoysia[J].ActaPrataculturaeSinica,2011,20(4):98-107.
[14] 赵天龙,解光宁,张晓霞,等.酸性土壤上植物应对铝胁迫的过程与机制[J].应用生态学报,2013,24(10):3 003-3 011.
ZHAO T L,XIE G N,ZHANG X X,etal.Process and mechanism of plants in overcoming acid soil aluminum stress[J].ChineseJournalofAppliedEcology,2013,24(10):3 003-3 011.
[15] 俞 乐,刘拥海,周丽萍,等.干旱胁迫下结缕草叶片抗坏血酸与相关生理指标变化的品种差异研究[J].草业学报,2013,22(4):106-115.
YU L,LIU Y H,ZHOU L P,etal.A study on the changes of ascorbic acid and related physiological indexes in differene cultivars of Zoysia under drought stress[J].ActaPrataculturaeSinica,2013,22(4):106-115.
[16] 许 华,梁春虹,赵美棠,等.2种鼠尾草对NaCl胁迫的耐受性比较及其生理机制研究[J].西北植物学报,2016,36(3):558-564.
XU H,LIANG C H,ZHAO M T,etal.Comparation of tolerance under NaCl stress between twoSalviaplants and study of the physiological mechanisms[J].ActaBot.Boreal.-Occident.Sin.,2016,36(3):558-564.
[17] 李 力,刘玉民,王 敏,等.3种北美红枫对持续高温干旱胁迫的生理响应机制[J].生态学报,2014,34(22):6 471-6 480.
LI L,LIU Y M,WANG M,etal.Physiological response mechanism of three kinds ofAcerrubrumL. under continuous high temperature and drought stress[J].ActaEcologicaSinica,2014,34(22):6 471-6 480.
[18] 贾新平,邓衍明,孙晓波,等.盐胁迫对海滨雀稗生长和生理特性的影响[J].草业学报,2015,24(12):204-212.
JIA X P,DENG Y M,SUN X B,etal.Impacts of salt stress on the growth and physiological characteristics ofPaspalumvaginatum[J].ActaPrataculturaeSinica,2015,24(12):204-212.
[19] 林咸永,章永松,罗安程.不同小麦基因型耐铝性的差异及筛选方法的研究[J].植物营养与肥料学报,2001,7(1):64-70.
LIN X Y,ZHANG Y S,LUO A C.Differences of aluminum tolerance on wheat genotypes and its screening techniques[J].PlantNutritionandFertilizerScience,2001,7(1):64-70.
[20] 刘 鹏,徐根娣,姜雪梅,等.铝对大豆种子萌发的影响[J].种子,2003,(1):30-32.
LIU P,XU G D,JIANG X M,etal.The effect of aluminum on germination of soybean seed[J].Seed,2003,(1):30-32.
[21] 张美艳,薛世明,钟 声,等.酸性条件下鸭茅种子萌发对铝胁迫的耐受响应[J].中国草地学报,2013,35(3):97-102.
ZHANG M Y,XUE S M,ZHONG S,etal.Response of seed germination of Orchardgrass to Al stress in acid condition[J].ChineseJournalofGrassland,2013,35(3):97-102.
[22] 郭有燕,刘宏军,孔东升,等.干旱胁迫对黑果枸杞幼苗光合特性的影响[J].西北植物学报,2016,36(1):124-130.
GUO Y Y,LIU H J,KONG D S,etal.Effect of drought stress on photosynthesis characteristics ofLyciumruthenicumseedlings[J].ActaBot.Boreal.-Occident.Sin.,2016,36(1):124-130.
[23] DUAN J J,GUO S R.Effects of exogenous sperm iidine on tolerance of cucumber seedlings under NaCl stress[J].ChinaVegetables,2005,12:8-10.
[24] 于 力.豇豆(VignaunguiculataL.)铝毒害及耐性机理[D].南京:南京农业大学,2012.
[25] MAHAJAN S,TUTEJA N.Cold, salinity and drought stresses: an overview[J].ArchivesofBiochemistryandBiophysics,2005,444(2):139-158.
[26] ASPINALL D,PALEG L G.The Physiology and Biochemistry of Drought Resistance in Plant[M].Sydney:Academic Press,1981:205-241.
[27] ASHRAF M,FOOLAD M R.Roles of glycine betaine and proline in improving plant abiotic stress resistance[J].EnvironmentalandExperimentalBotany,2007,59(2):206-216.
[28] ARBIND K C,DHARMENDRA S,MIR A L.Selection of pigeonpea genotypes for tolerance to aluminium toxicity[J].PlantBreeding,2011,130(4):492-495.
[29] EVANDRO N S,SÉRGIO L F,ADILTON V F,etal.Photosynthetic changes and protective mechanisms against oxidative damage subjected to isolated and combined drought and heat stresses inJatrophaCurcasplants[J].JournalofPlantPhysiology,2010,167(14):1 157-1 164.
[30] 杜润峰,郝文芳,王龙飞.达乌里胡枝子抗氧化保护系统及膜脂过氧化对干旱胁迫及复水的动态响应[J].草业学报,2012,21(2):51-61.
DU R F,HAO W F,WANG L F.Dynamic responses on anti-oxidative defense system and lipid peroxidation ofLespedezadavuricato drought stress and re-watering[J].ActaPrataculturaeSinica,2012,21(2):51-61.
[31] 潘 昕,邱 权,李吉跃,等.干旱胁迫对青藏高原6种植物生理指标的影响[J].生态学报,2014,34(13):3 558-3 567.
PAN X,QIU Q,LI J Y,etal.Physiological indexes of six plant species from the tibetan plateau under drought stress[J].ActaEcologicaSinica,2014,34(13):3 558-3 567.
[32] 郭慧娟,胡 涛,傅金民.苏打碱胁迫对多年生黑麦草的生理影响[J].草业学报,2012,21(1):118-125.
GUO H J,HU T,FU J M.Effects of saline sodic stress on growth and physiological responses ofLoliumperennr[J].ActaPrataculturaeSinica,2012,21(1):118-125.
[33] 夏 钦,何丙辉,刘玉民,等.高温胁迫对粉带扦插苗形态和生理特征的影响[J].生态学报,2010,30(19):5 217-5 224.
XIA Q,HE B H,LIU Y M,etal.Effects of high temperature stress on themorphological and physiological characteristics inScaevolaalbidacutting seedlings[J].ActaEcologicaSinica,2010,30(19):5 217-5 224.
[34] 张露婷,吴 江,梅 丽,等.喜树种源耐盐能力评价及耐盐指标筛选[J].林业科学,2011,47(11):66-72.
ZHANG L T,WU J,MEI L,etal.Saline tolerance ofCamptothecaacuminataprovenances and the index selection for saline tolerance[J].ScientiaSilvaeSinicae,2011,47(11):66-72.
[35] 胡雪华,李 蕴,邹天才.车前对铝胁迫生理响应的研究[J].热带亚热带植物学报,2014,22(5):495-501.
HU X H,LI Y,ZOU T C.Studies on physiological responses to aluminum stress ofPlantagoasiatica[J].JournalofTropicalandSubtropicalBotany,2014,22(5):495-501.
(编辑:裴阿卫)
Impacts of Aluminum Stress on the Growth and Physiological Characteristics of Pinus massoniana Seedlings
ZHANG Shengnan, LIU Yamin, LIU Yumin*, JI Yuwei, ZHOU Wenying
(College of Resources and Environment,Key Laboratory of Eco-environments in Three Gorges Region(Ministry of Education),Southwest University,Chongqing 400715,China)
ThePinusmassonianaseedlings were treated with different Al3+concentrations in order to investigate the effects of aluminum stress on growth and physiological characteristics including chlorophyll, osmo regulation substance(soluble sugar, protein, proline), MDA and protective enzyme(superoxide dismutase, peroxidase) activities in leaves, which were experimented and studied to provide theoretical basis for revealing aluminum toxicity physiological mechanism and improving the Al-tolerant ability ofP.massoniana. The results showed the treatment of 0.2 mmol·L-1Al3+had no significant impact to the seedling height and basal diameter but some promotion on its root length; above 0.2 mmol·L-1Al3+, the growth of the seedling height, basal diameter, root length were inhibited, and the higher the concentration is, the stronger the inhibition is; The content of chlorophyll and the activities of SOD and POD in leaves climbed with the increase of Al3+concentration before they declined; above 0.2 mmol·L-1Al3+, with the addition of Al3+concentration, the contents of osmo regulation substances, such as soluble sugar, soluble protein and proline presented the upward trend; above 0.2 mmol·L-1Al3+, the content of MDA changed the same as the osmo regulation substances. It proved thatP.massonianamembrane lipid could produce oxidation with the treatment of Al3+.P.massonianaseedlings had a certain Al-tolerant ability. They could produced physiological adaptive response to balance and reduce the aluminum toxicity by increasing the synthesis of SOD and POD, and accumulating proline, protein and soluble sugar.
aluminum stress;Pinusmassoniana;growth;physiological characteristics
1000-4025(2016)10-2022-08
10.7606/j.issn.1000-4025.2016.10.2022
2016-07-05;修改稿收到日期:2016-09-17
国家自然科学基金面上项目(31170546);重庆市自然科学基金(cstc2015jcyjA80029);重庆市林业重点科技攻关项目(渝林科技2016-11);中央高校基本科研专项重点项目(XDJK2014B026,XDJK2015C176);重庆市社会事业与民生保障专项(cstc2016shmszx0374)
张盛楠(1992-),女,在读硕士研究生,主要从事植物生理生态研究。E-mail:154457415@qq.com
*通信作者:刘玉民,副教授,硕士研究生导师,主要从事植物生理生态和栽培生理等方面的研究。E-mail:yuminliu@163.com
Q945.78
A
