小麦旗叶早衰性状的QTL定位
2016-12-17吴洪启刘天相李婷婷李春莲王中华
吴洪启,刘天相,李婷婷,赵 朋,李春莲,王中华,权 力
(西北农林科技大学 农学院,陕西杨陵 712100)
小麦旗叶早衰性状的QTL定位
吴洪启,刘天相,李婷婷,赵 朋,李春莲,王中华,权 力*
(西北农林科技大学 农学院,陕西杨陵 712100)
为小麦旗叶早衰性状的精细定位和基因克隆奠定基础,该试验以普通小麦(TriticumaestivumL.)‘宁春4号’和‘宁春27号’杂交得到的128个F10代RIL群体为研究材料,利用307对多态性SSR标记对小麦旗叶早衰性状进行了QTL定位,并通过构建整合图谱的方法进行了标记加密。结果表明,共检测到1个控制旗叶早衰性状的加性QTL,位于2A染色体长臂的gwm526和gwm382标记区间内,可解释49.88%的表型变异。经遗传图谱整合后发现,gwm526和gwm382标记之间存在124个SNP标记。
小麦;旗叶;早衰;QTL;整合图谱
衰老是植物生命周期的最后阶段,对植物适应和选择环境以及自身生理功能恢复等方面都有积极意义。但早衰会引起作物器官提前进入衰老期,导致生理功能衰退,最终降低作物产量。小麦早衰是指小麦生育后期功能叶片衰老与籽粒充实不同步进行,即功能叶片衰老进程早于籽粒充实[1]。而小麦生长后期主要通过叶片的光合作用供给籽粒养料,对籽粒产量形成的贡献高达80%;其中,旗叶是所有叶片中光合效率最高的,其净光合产物几乎都运输到籽粒中去,对小麦籽粒产量的贡献可达三分之一[2-3]。小麦花后旗叶早衰现象的产生缩短了籽粒灌浆时期,并降低了灌浆速率,最终导致籽粒产量下降;与正常品种相比,早衰小麦无论是群体生物产量还是群体籽粒产量均减少20%以上[4]。而且小麦早衰品系旗叶绿色面积和叶色消退提前4~8 d;在花后10 d 时穗及上部3 叶运向籽粒的同化物减少5%,自存部分则多5%;在花后20 d 内,由于叶片早衰造成的籽粒产量损失率约为5%~6%[5]。因此,延长小麦旗叶功能期,防止早衰,对小麦旗叶早衰性状相关基因的定位,可为选育抗早衰的高产小麦品种提供理论依据。
目前,小麦旗叶相关性状的QTL定位工作主要集中于旗叶的长、宽及叶面积等,并获得了控制相应性状的QTL[6-11]。而关于小麦旗叶早衰性状的研究,主要集中在外部形态、生理生化及环境因素对旗叶早衰的影响方面[12-16]。在分子水平上对小麦旗叶早衰的研究相对较少。虽然卫宪云等[17]利用 RIL群体及其分子标记遗传图谱,对小麦早衰和与早衰相关的生理性状进行了 QTL 定位分析,但是没有检测到早衰级别的加性QTL。本研究利用‘宁春4号’与‘宁春27号’杂交创建的128个重组自交系材料,采用SSR分子标记对其进行检测,获得了控制小麦旗叶早衰性状的加性QTL;并通过基于R语言的LPmerge软件将SSR标记和SNP标记遗传图谱进行整合,构建更加密集的遗传图谱,为进一步QTL的精细定位和基因克隆奠定基础。
1 材料与方法
1.1 材 料
供试材料为‘宁春4号’(母本,水地春小麦品种)与‘宁春27号’(父本,旱地春小麦品种)杂交创建的128个F10代重组自交系(Recombinant inbred lines,RILs),由宁夏农林科学院创制并保存。两亲本是在不同生态环境下育成的具有代表性的优良品种,在旗叶早衰性状上差异明显。其中,‘宁春4号’花后旗叶叶绿素降解慢,叶片后期功能强,具有抗早衰性状,而‘宁春27号’花后叶绿素降解快,叶片后期出现早衰、脱落。旗叶早衰性状在RIL群体中具有分离。
1.2 方 法
1.2.1 田间种植和性状调查 2014~2015年度将RIL群体及其亲本种植在陕西杨陵西北农林科技大学试验田。采用完全随机区组设计,行长1.5 m,行距25 cm,株距10 cm,每个株系4行种植,田间管理同一般大田生产。于开花后28 d左右观察记录每个株系小麦旗叶的早衰程度,记录时选择长势一致的小麦来统计;参照Bennett等[18]方法,以分值来表示小麦旗叶早衰程度。分为1、1.5、2、2.5和3等5个分值级别,其中,1分代表旗叶全部为深绿色,1.5分代表旗叶全部为绿色,2分代表旗叶全部为浅绿色,2.5分代表旗叶部分为黄色、大部分为浅绿色,3分代表旗叶部分为浅绿色、大部分为黄色。
1.2.2 DNA提取和分子标记分析 利用SDS法[19]提取幼苗期128个RIL家系及其亲本DNA。利用1%琼脂糖凝胶电泳检测DNA提取质量,采用分光光度计(Nano Drop 2000)检测DNA浓度,并将其稀释为工作液浓度(100 ng/μL),于-20 ℃冰箱保存备用。
SSR引物由上海英潍捷基贸易有限公司合成,总共1 001对标记引物,覆盖小麦21对染色体;引物序列信息从Grain Gene网站(http://wheat.pw.usda .gov/GG2/index.shtml)中获取。在两亲本间进行多态性标记筛选,将多态性标记在RIL群体中进行检测。将与母本‘宁春4号’相同的带型记作2,与父本‘宁春27号’相同的带型记作0,缺失带型记作-1。9K SNP标记信息来自J.T.Eckard等[20]的定位结果(http://link.springer.com/article/10.1007/s11032-014-0116-1);90K SNP标记信息来自Wang等[21]的定位结果(http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4265271)。
1.2.3 遗传连锁图的构建和QTL定位 利用IBM SPSS statistic软件对RIL群体旗叶早衰性状表型进行正态性分析。根据SSR标记扩增结果,结合表型数据,利用QTL IciMapping 4.1作图软件对各株系的标记基因型进行连锁分析,并采用Kosambi作图函数将重组率转换为遗传距离(cM)。在此基础上,在BIP模块中将扫描步长设为1 cM,显著性水平设为0.05,排列检验次数设为1 000,用于确定LOD临界值,最终采用复合区间作图法(ICIM)进行QTL检测以及Mapchart 2.2作图软件绘制遗传图谱。QTL的命名参考Mccouch等[22]的方法,按照性状名称缩写和所在染色体位置及同一条染色体上QTL个数进行命名,将旗叶早衰命名为QFlea,如QFlea-2A.1表示位于2A染色体上控制旗叶早衰且位于第一个标记区间的QTL。
1.2.4 整合图谱的构建 根据SSR标记定位结果,选择9K和90K芯片数据中2A染色体上的SNP标记。利用基于R语言的LPmerge软件[23],其中K值为1~3,不设权重,将SSR标记和SNP标记遗传图谱进行整合,结果中包含有3个整合图谱,最后根据RMSE值(均方根误差)大小,选择RMSE值最小、K值最大的整合图谱,再利用Mapchart 2.2作图软件绘制出整合图谱。
2 结果与分析
2.1 亲本及RIL群体表型变异分析
从表1可知,旗叶早衰分值在亲本以及RIL群体中具有明显的变化(P<0.001)。其中,父本‘宁春27号’的旗叶早衰分值是母本‘宁春4号’的3倍,说明两亲本在这个性状上差异明显,由它们杂交创制的RIL群体可有效用于小麦旗叶早衰性状的遗传图谱构建。在RIL群体中旗叶早衰分值变化范围为1~3,平均值为1.9,而且表现出连续的正态分布趋势(图1),因此,该表型数据可以进行QTL定位分析。
2.2 遗传连锁图谱的构建
在亲本‘宁春4号’和‘宁春27号’中进行多态性标记检测,从1 001对覆盖于小麦21对染色体上的SSR标记中共筛出307对多态性标记,多态性比率为30.67%。利用这些多态性标记引物在RIL群体中进行扩增,获得了128个株系的标记基因型;利用QTL IciMapping 4.1作图软件对各株系的标记基因型进行连锁分析,共有291对多态性SSR标记构建到21对染色体的遗传图谱中,占总多态性标记的94.8%,总遗传距离为2 576.09 cM,标记间平均遗传距离为8.85 cM。其中,2A染色体上有17个SSR标记,占总标记的5.84%,总遗传距离为151.42 cM,标记间平均遗传距离为8.91 cM。
2.3 旗叶早衰性状的QTL分析
利用构建的遗传图谱对小麦旗叶早衰性状进行了QTL分析,结果(表2,图2)表明,在2A染色体长臂的gwm526和gwm382标记区间(区间长度为18.11 cM)有1个控制旗叶早衰性状的主效QTL,暂定名为QFlea-2AL。QFlea-2AL可解释49.88%的表型变异,加性效应值为-0.46,表明该QTL抗旗叶早衰性状的等位基因来自母本‘宁春4号’。
2.4 整合图谱的构建
J.T.Eckard等[20]的整合图谱中,2A染色体上有210个SNP标记和4个SSR标记,总遗传距离为225.32 cM,标记间平均遗传距离为1.05 cM;Wang等[21]的整合图谱中,2A染色体上有2 090个SNP标记,总长为620.45 cM,标记间平均遗传距离为0.30 cM。由图3,A可知,整合图谱中共有228个标记,包含210个SNP标记和18个SSR标记,总遗传距离为215.14 cM,标记间平均遗传距离为0.94 cM;QFlea-2AL所在的定位区域内包含17个SNP标记。为进一步加密标记,整合了Wang等[19]定位结果中2A染色体上的SNP标记,构建了一张总长为620.45 cM,标记间平均遗传距离为0.27 cM的整合图谱,由于图谱的长度达到了软件的上限值,只展示了82.8~184.8 cM遗传距离间的分子标记;同时QFlea-2AL所在的定位区域内SNP标记数量增加到124个(图3,B)。因此,整合图谱的构建为我们寻找和开发新的标记提供了捷径,从而为后续的精细定位奠定基础。

表1 亲本及RIL群体表型变异

表2 旗叶早衰性状的加性QTL分析
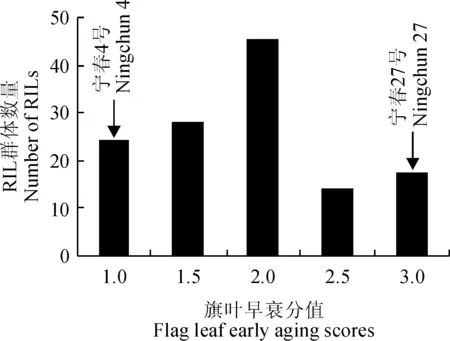
图1 RIL群体旗叶早衰表型频率分布Fig.1 Phenotypic frequency distribution of flag leaf early aging

图2 QFlea-2AL 在连锁图谱上的分布Fig.2 Distribution of QFlea-2AL on linkage map
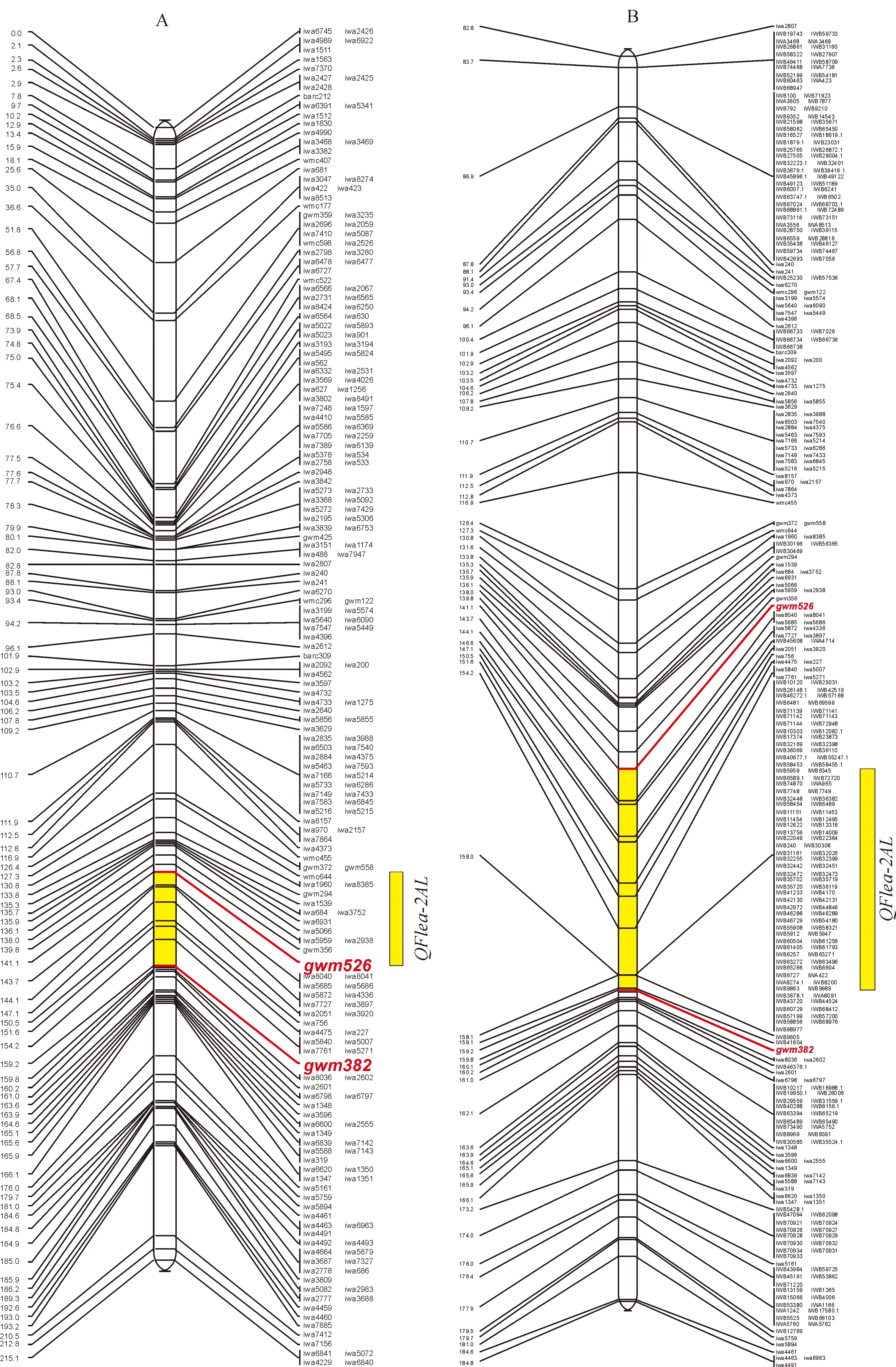
A. SSR标记和9K SNP标记整合后的整合图谱;B. SSR标记与9K和90K SNP标记整合后的整合图谱;所有标记均来自2A染色体图3 QFlea-2AL在整合图谱上的分布A. Integration map of SSR and 9K SNP; B. Integration map of SSR and 9K SNP and 90K SNP;All makers come from 2A chromosomeFig.3 Distribution of QFlea-2AL on integration map
3 讨 论
作图亲本间的遗传差异是构建遗传连锁图谱的基础,直接关系到遗传连锁图谱构建的准确性和适用性[24]。本研究所用亲本材料‘宁春4号’和‘宁春27号’是在不同生态环境下育成的具有代表性的优良品种,在旗叶早衰性状上表型差异明显,而且该性状在RIL家系中具有分离,表明了由它们杂交创制的128个F10代RIL株系可有效用于小麦旗叶早衰性状遗传连锁图谱的构建。小麦旗叶早衰是一个复杂的生物学性状,会引起生理生化指标和形态的变化,而其最典型的形态变化是花后旗叶叶绿素含量的快速下降导致叶色由绿色转变为黄色、红色或橙色,最终导致叶片脱落和死亡[1,4,25]。李宏伟等[4]研究表明,早衰小麦的叶绿素含量在花后20 d左右就开始下降,在花后25 d时不到花期的1/2,在花后33 d接近于0,与早衰小麦相比,正常小麦叶绿素含量下降推迟1周左右。因此,本研究选择在花后28 d左右开始调查小麦旗叶早衰程度,并参照Bennett等[18]方法,将小麦旗叶早衰程度分为五个级别。经统计分析,小麦旗叶早衰在RIL群体及其亲本间的分布近似于正态分布,但未出现超亲现象,推测小麦旗叶早衰性状可能只受加性效应的控制,使得后代的表型介于双亲之间;同时外界环境对其具有较大的影响[12-16],需要在多个环境或多个地点进行调查统计才能确定该性状是否有超亲现象。
分子标记连锁遗传图谱的构建是进行QTL定位分析的前提。卫宪云等[17]利用 RIL群体及其分子标记遗传图谱,对小麦早衰和相关的生理性状进行QTL分析,检测到了控制4个生理性状的7个QTL,但没有检测到早衰级别、叶绿素含量、CAT活性和MDA含量等4个性状的加性QTL,分析认为它们之间可能存在QTL互作关系。本研究利用307对SSR多态性标记对小麦旗叶早衰性状进行QTL分析,最终只获得了1个控制小麦旗叶早衰性状的QFlea-2AL,但其贡献率为49.88%,推测可能是一个主效QTL,对小麦旗叶早衰性状起着主导作用,也可能该性状与其它早衰生理性状的QTL存在互作关系,导致只检测到1个QTL。但构建的连锁遗传图密度不够,有待进一步加密。SNP基因芯片技术的出现为构建高密度遗传图谱奠定了基础。J.T.Eckard等[20]利用9K SNP芯片和26个SSR标记在小麦早代育种群体中构建了总长为3 080 cM、标记间平均遗传距离为2.5 cM的整合图谱。Wang等[21]利用90K SNP芯片在8个小麦DH群体中构建了一张标记间平均遗传距离为0.09 cM的SNP整合图谱。而基于R语言的QTL软件中包含的方法及其相应的算法影响着整合图谱的准确性[26-27]。Jeffrey[23,28]利用大麦的SNP数据将他的整合图谱算法与MergeMap进行了比较,发现整合效果优于MergeMap,并进一步优化了整合图谱算法,将其命名为Lpmerge。因此,本研究采用LPmerge软件将SSR定位结果与J.T.Eckard等和Wang等在2A染色体上的定位结果进行整合,发现QFlea-2AL所在的gwm526~gwm382标记间包含有124个SNP标记,推测这些SNP标记可能也存在于本试验的RIL群体中,这为后续QFlea-2AL的精细定位奠定了基础。但小麦早衰是一个复杂的过程,受品种的基因型、生理生化反应以及外界环境等因素影响,需要在多个环境中进行检测才能确定QFlea-2AL是否为稳定表达的QTL。
[1] 陈朝儒, 奚亚军, 王竹林, 等. 冬小麦持绿和灌浆特征及其抗早衰特性评价[J]. 西北植物学报, 2011,31(4):715-723.
CHEN C R, XI Y J, WANG ZH L,etal. Characteristics of stay-green and grain-filling and the evaluation of anti-senescence properties of winter wheat[J].ActaBotanicaBoreali-OccidentaliaSinica, 2011,31(4):715-723.
[2] 郑丕尧. 作物生理学导论[M]. 北京:北京农业大学出版社, 1992:121-127.
[3] SIMON M R. Inheritance of flag-leaf angle, flag-leaf area and flag-leaf area duration in four wheat crosses[J].TheoreticalandAppliedGenetics, 1999, 98(2):310-314.
[4] 李宏伟, 王淑霞, 等. 早衰和正常小麦近等基因系旗叶光合特性与产量比较研究[J]. 作物学报, 2006,32(11):1 649-1 655.
LI H W, WANG S X,etal. Comparative study on physiological traits related with grain filling and photosynthesis of flag leaf in early aging and normal near-isogenic lines of common wheat[J].ActaAgronomicaSinica, 2006,32(11):1 649-1 655.
[5] 黄志仁, 龚 荐, 封福如.用14CO2示踪研究小麦叶片早衰对籽粒产量的影响[J]. 作物学报, 1981,7(1):27-34.
HUANG Z R, GONG J, FENG F R. A study on the effuluences of the senenscence of wheat leaves to the grain yields by the tracer of14CO2[J].ActaAgronomicaSinica, 1981,7(1):27-34.
[6] 赵 朋, 徐 凤, 等. 春小麦旗叶长度、宽度及叶绿素含量QTL分析[J]. 麦类作物学报, 2015,35(5):603-608.
ZHAO P, XU F,etal. Quantitative trait loci analysis of flag leaf length,width and chlorophyll content of spring wheat[J].JournalofTriticeaeCrops, 2015,35(5):603-608.
[7] 闫 雪, 史雨刚, 梁增浩, 等. 小麦旗叶形态相关性状的QTL定位[J]. 核农学报, 2015,29(7): 1 253-1 259.
YAN X, SHI Y G, LIANG Z H,etal. QTL mapping for morphological traits of flag leaf in wheat[J].JournalofNuclearAgriculturalSciences, 2015,29(7): 1 253-1 259.
[8] 常 鑫, 李法计, 张兆萍, 等. 小麦旗叶长、宽及面积的QTL分析[J]. 西北植物学报, 2014,34(5): 896-901.
CHANG X, LI F J, ZHANG Z P,etal. Mapping QTLs for flag leaf length, width and area in wheat[J].ActaBotanicaBoreali-OccidentaliaSinica, 2014,34(5): 896-901.
[9] KELLER M, KELLER B, SCHACHERMAYR G,etal. Quantitative trait loci for resistance against powdery mildew in a segregating wheat×spelt population[J].TheoreticalandAppliedGenetics, 1999,98(6): 903-912.
[10] JIA H Y, WAN H S,etal. Genetic dissection of yield-related traits in a recombinant inbred line population created using a key breeding parent in Chinese’s wheat breeding[J].TheoreticalandAppliedGenetics, 2013,126(8):2 123-2 139.
[11] XUE S L, XU F, LI G Q,etal. Fine mappingTaFLW1,a major QTL controlling flag leaf width in bread wheat (TriticumaestivumL.)[J].TheoreticalandAppliedGenetics, 2013,126(8):1 941-1 949.
[12] 杨东清, 王振林, 尹燕枰, 等. 外源ABA和6-BA对不同持绿型小麦旗叶衰老的影响及其生理机制[J]. 作物学报, 2013,39(6): 1 096-1 104.
YANG D Q, WANG Z L,YIN Y P,etal. Effects of exogenous ABA and 6-BA on flag leaf senescence in different types of stay-green wheat and relevant physiological mechanisms[J].ActaAgronomicaSinica, 2013,39(6): 1 096-1 104.
[13] 薛远赛, 孟祥浩, 等. 盐胁迫下不同小麦品种(系)旗叶衰老特性分析[J]. 中国农学通报, 2015,31(24):37-41.
XUE Y S, MENG X H,etal. Flag leaf senescence characteristic of different wheat varieties(lines) under salt stress[J].ChineseAgriculturalScienceBulletin, 2015,31(24):37-41.
[14] 李友军, 郅娟娟, 牛凯丽, 等. 不同水分和氮素形态对郑麦 9023花后旗叶衰老及产量的影响[J]. 水土保持学报, 2010,24(4):251-256.
LI Y J, ZHI J J, NIU K L,etal. Effect of different irrigation times and nitrogen forms on flag leaf senescence and yield of winter wheat Zhengmai 9023 [J].JournalofSoilandWaterConservation, 2010,24(4):251-256.
[15] 冯 波, 王法宏, 等. 施氮水平对不同栽培模式小麦旗叶衰老及产量的影响[J]. 中国农学通报, 2010,26(8):189-193.
FENG B, WANG F H,etal. Effect of nitrogen application on senescence of flag leaf and grain yield in wheat in different planting models[J].ChineseAgriculturalScienceBulletin, 2010,26(8):189-193.
[16] 翟冬峰, 刘为更, 白 娜, 等. 早衰小麦近等基因系农艺性状及光合特性变化研究[J]. 作物杂志, 2014,11(1):19-22.
ZHAI D F, LIU W G, BAI N,etal. Changes of agronomic traits and photosynthetic characteristics in early aging wheat near-isogenic lines[J].Crops, 2014,11(1):19-22.
[17] 卫宪云, 李斯深, 等. 小麦早衰及其相关生理性状的QTL分析[J]. 西北植物学报, 2007,27(3):485-489.
WEI X Y, LI S S,etal. QTL mapping for premature senescence and related physiological traits in wheat[J].ActaBotanicaBoreali-OccidentaliaSinica, 2007,27(3):485-489.
[18] BENNETT D, IZANLOO A, EDWARDS J,etal. Identifcation of novel quantitative trait loci for days to ear emergence and fag leaf glaucousness in bread wheat (TriticumaestivumL.) population adapted to southern Australian conditions[J].TheoreticalandAppliedGenetics, 2012,124(4):697-711.
[19] SOMERS D J, ISAAC P, EDWARDS K. A high-density microsatellite consensus map for bread wheat(TriticumaestivumL.)[J].TheoreticalandAppliedGenetics, 2004,109(6):1 105-1 114.
[20] ECKARD J T, GONZALEZ-HERNANDEZ J L, CHAO S,etal. Construction of dense linkage maps “on the fly” using early generation wheat breeding populations[J].Mol.Breeding, 2014,34(3):1 281-1 300.
[21] SHICHEN WANG, DEBBIE WONG,etal. Characterization of polyploid wheat genomic diversity using a high-density 90000 single nucleotide polymorphism array[J].PlantBiotechnologyJournal, 2014,12(6):787-796.
[22] MCCOUCH S R, CHO Y G,etal. Report on QTL nomenclature[J].RiceGeneticsNewsletters, 1997,14(11):11-13.
[23] ENDELMAN J B. LPmerge: an R package for merging genetic maps by linear programming[J].Bioinformatics, 2014,30(11): 1 623-1 624.
[24] 高 尚, 莫洪君, 石浩然, 等. 利用SNP基因芯片技术进行小麦遗传图谱构建及重要农艺性状QTL分析[J]. 应用与环境生物学报, 2016,22(1): 85-94.
GAO S, MO H J, SHI H R,etal. Construction of wheat genetic map and QTL analysis of main agronomic traits using SNP genotyping chips technology[J].Chin.J.Appl.Environ.Biol., 2016,22(1): 85-94.
[25] 李亚婷, 朱 荣, 李 昱, 等. 小麦早衰研究综述[J]. 农业科学研究, 2015,36(3): 57-62.
LI Y T, ZHU R, LI Y,etal. Research review on the early senescence of wheat[J].JournalofAgriculturalSciences, 2015,36(3): 57-62.
[26] 胡文明, 汤在祥, 等. 基于R/qtl不同方法对玉米株高QTL定位结果的比较[J]. 江苏农业学报, 2013,29(1): 8-13.
HU W M, TANG Z X,etal. Comparison of different methods for mapping QTL of maize plant height with R/qtl[J].JiangsuJournalofAgriculturalSciences, 2013,29(1): 8-13.
[27] YONGHUI W, TIMOTHY J, STEFANO LONARDI. On the accurate construction of consensus genetic maps[J].ComputSystBioinformaticsConf., 2008,7:285-296.
[28] ENDELMAN J B. New algorithm improves fine structure of the barley consensus SNP map[J].BMCGenomics, 2011,12: 407.
(编辑:宋亚珍)
QTL Mapping for Early Aging of Flag Leaf in Wheat
WU Hongqi, LIU Tianxiang, LI Tingting, ZHAO Peng, LI Chunlian, WANG Zhonghua, QUAN Li*
(College of Agronomy, Northwest A&F University, Yangling, Shaanxi 712100,China)
In order to provide basis for fine mapping and gene cloning on early aging of flag leaf in wheat, we used 128 RILs from the cross of common wheat (TriticumaestivumL.) between Ningchun 4 and Ningchun 27 as the plant materials in our experiment. QTL mapping for early aging of flag leaf was done by using 307 polymorphic SSR markers and marker encryption was completed by building integration maps. An additive QTL for early aging of flag leaf was detected in flanking markergwm526~gwm382 on chromosome 2AL, which explained 49.88% phenotypic variance. There were 124 SNP markers betweengwm526 andgwm382 marker found by building integration maps.
wheat; flag leaf; early aging; QTL; integration map
1000-4025(2016)10-1962-06
10.7606/j.issn.1000-4025.2016.10.1962
2016-06-30;修改稿收到日期:2016-08-02
国家自然科学基金(31471568);陕西省重点科技创新团队计划(2014KCT-25);西北农林科技大学唐仲英育种基金
吴洪启(1991-),男,硕士,主要从事作物生物技术与育种研究。E-mail:wuhongqi567@163.com
*通信作者:权 力,副教授,硕士生导师,主要从事作物根系发育的生物化学和分子生物学基础研究。E-mail:lquan@nwsuaf.edu.cn
Q343.1+7
A
