血清miR-96、miR-326在多发性硬化复发、缓解期表达水平的变化
2016-12-17叶励超蔡若蔚黄玉婷林若庭陈继兴
叶励超 蔡若蔚 黄玉婷 林若庭 陈继兴
(福建医科大学附属第二医院神经内科,福建 泉州 362000)
血清miR-96、miR-326在多发性硬化复发、缓解期表达水平的变化
叶励超 蔡若蔚 黄玉婷1林若庭 陈继兴
(福建医科大学附属第二医院神经内科,福建 泉州 362000)
目的 探讨血清miR-96、miR-326表达水平与缓解-复发型多发性硬化(RRMS)的关系并评价其临床意义。方法 RRMS患者57例,其中复发期(急性期)组32例,缓解期组25例,正常对照组30例;用荧光定量PCR检测血清miR-96,miR-326相对表达量。结果 与RRMS复发期组和正常对照组比较,缓解期组血清miR-96相对表达量明显增高(P<0.001);与RRMS缓解期组和正常对照组比较,复发期组血清miR-326相对表达量明显增高(P<0.001)。RRMS缓解期组血清miR-96相对表达量与扩大的残疾功能状态评分(EDSS)无相关性(r=0.22,P=0.30),RRMS复发期组血清miR-326相对表达量与EDSS评分无相关性(r=-0.18,P=0.31)。结论 血清miR-96、miR-326与RRMS的炎症活动密切相关,可作为监测RRMS活动性的候选生物标记物。
多发性硬化;微小RNA;miR-96;miR-326
多发性硬化(MS)是一种自身免疫性疾病,以中枢神经系统白质受累为主,临床特点是病灶的空间多发性和时间多发性。复发缓解型(RR)是MS最常见的类型,以神经系统症状急性加重,伴完全或不完全缓解为特征。由于MS致病原因仍不清楚,临床表现多样及治疗反应不一,因此,各国学者都期待找出一种或几种可靠的生物学标志物,能够有助于监测 MS的病情进展及反映 MS 对于治疗的效果,但结果却不尽如人意〔1〕。微小RNA(miRNA)是一类长度21~25个核苷酸的非编码小分子组成的单链RNA,在转录后水平发挥重要的调节作用,参与人类生命活动及疾病进程的调控,例如细胞增殖、发育、分化、代谢、凋亡、血管生成、炎症和免疫〔2〕。miRNA表达和功能异常与癌症、神经变性和自身免疫疾病有关。在MS患者的病灶、血液、脑脊液及外周血单个核细胞中发现多种miRNA表达异常,提示其参与了MS的病理生理过程〔3~6〕。本研究通过检测RRMS患者复发期与缓解期血清miR-96与miR-326表达水平,探讨其与MS炎症活动的相关性。
1 资料与方法
1.1 一般资料 2011年1月至2015年7月我院神经内科确诊RRMS 57例,排除合并肝肾疾病、肿瘤、糖尿病、急性感染、心脑血管疾病及其他自身免疫性疾病患者。RRMS诊断参照2010年修订的McDonald诊断标准〔7〕。RRMS复发期(急性期)组:32例,男9例,女23例;年龄21~60岁,平均(37.3±9.2)岁;病程10~98个月,平均(55.8±15.2)个月;扩大的残疾功能状态评分(EDSS)2.5~8.0分,平均(5.3±1.3)分。RRMS缓解期组:25例,男7例,女18例;年龄20~58岁,平均(38.4±7.9)岁;病程12~120个月,平均(60.4±18.6)个月;EDSS 1.0~7.0分,平均(3.1±1.2)分。正常对照组:健康体检者30例,男8例,女22例;年龄18~60岁,平均(38.5±8.7)岁。本研究通过医院伦理委员会批准,研究对象均签署知情同意书。
1.2 方法 两组患者皆于清晨空腹抽取肘静脉血2 ml,低温快速离心,30 min内分装200 μl血清于冻存管中,-80℃保存。
1.2.1 纯化miRNA和总RNA 将放于-80℃冰箱的血清样本200 μl,放在冰上,标本融化后加入3倍体积的 Trizol LS (Invitrogen,美国)震荡混匀,再加入0.5 ml氯仿震荡混匀,置于低温离心机,4℃以12 000 r/min 离心15 min,取上清,加入1.5 倍体积的无水乙醇,按照miRNeasy mini kit试剂盒(QIAGEN,德国)说明书步骤完成提取,获得的RNA溶解于200 μl无 RNase双蒸水中备用。
1.2.2 检测miRNA 使用miRcute miRNA cDNA第一链合成试剂盒、miRcute miRNA荧光定量检测试剂盒(TIANGEN,中国)分别进行miRNA逆转录和荧光定量PCR。反应体系为20 μl,包括第一链合成cDNA、miRcute miRNA premix及引物(应用Primer 5.0软件设计引物,引物序列见表1)。反应条件:94℃预变性2 min;然后94℃ 20 s、60℃ 35 s,进行35~45个循环反应。以miR-16作为内参。血清miR-96、miR-326 相对表达量计算公式为2-△△CT。每个样品测定3次取平均值,同时做空白组以提高实验可靠性。
1.3 统计学方法 使用SPSS10.0软件行Pearson检验。

表1 相关基因定量PCR 引物设计
2 结 果
2.1 3组血清miR-96、miR-326的相对表达水平比较 与RRMS复发期组和正常对照组比较,缓解期组血清miR-96相对表达量明显增高(P<0.001)。与RRMS缓解期组和正常对照组比较,复发期组血清miR-326相对表达量明显增高(P<0.001),见表2。
2.2 血清miR-96、miR-326相对表达量与RRMS严重程度相关性 RRMS缓解期组血清miR-96相对表达量与EDSS评分无相关性(r=0.22,P=0.30),RRMS复发期组血清miR-326相对表达量与EDSS评分无相关性(r=-0.18,P=0.31),见图1和图2。

表2 3组血清miR-96、miR-326相对表达量
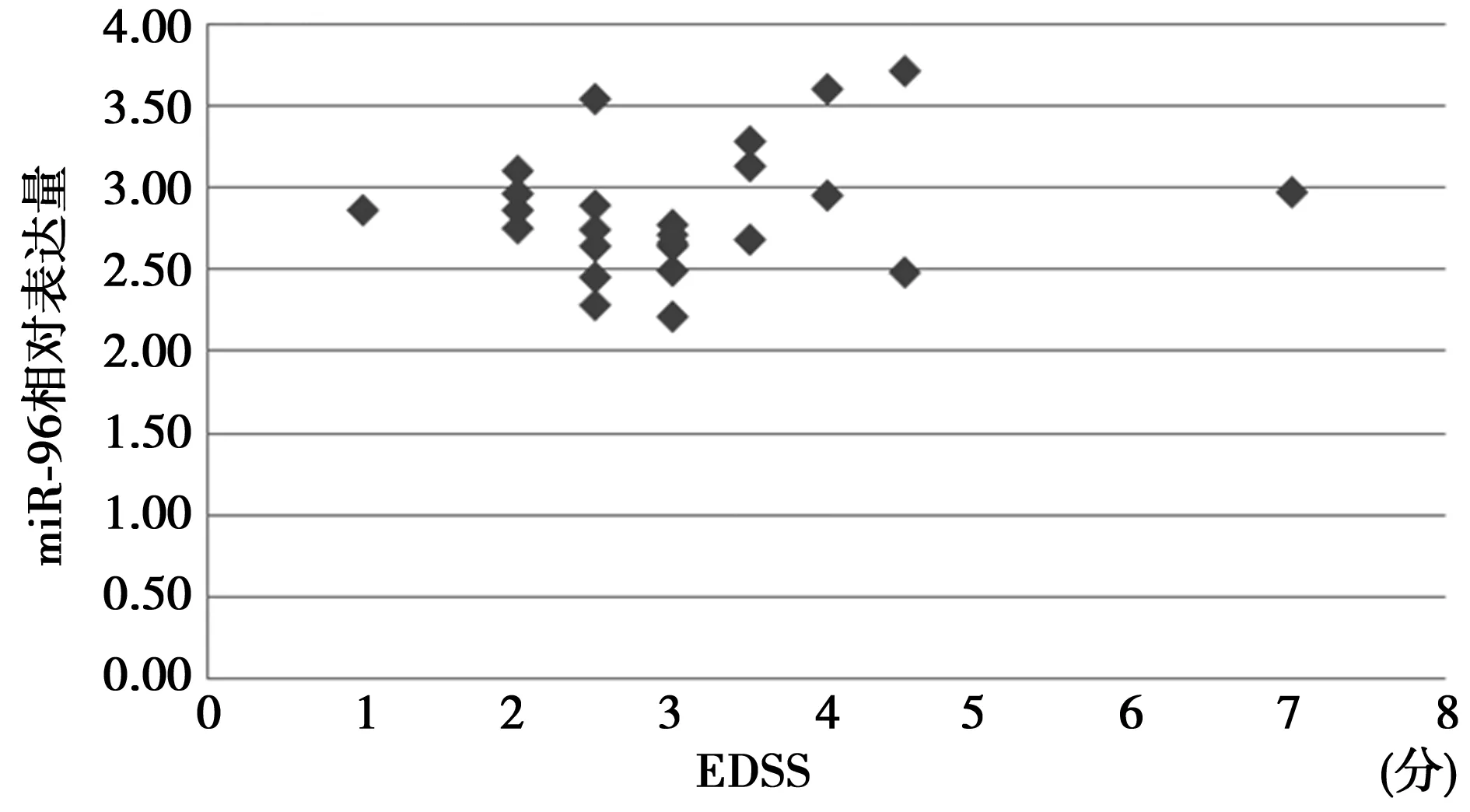
图1 RRMS缓解期组血清miR-96相对表达量与EDSS评分相关性

图2 RRMS复发期组血清miR-326相对表达量与EDSS评分相关性
3 讨 论
MS是一种免疫介导的中枢神经系统慢性炎性脱髓鞘疾病,病因尚不明确,但CD4+T细胞在发病机制中扮演着至关重要的角色。表观遗传学研究发现miRNA表达异常与MS等自身免疫性疾病存在明确关联,MS发病过程中存在特异性miRNA 表达模式,miRNA通过影响巨噬细胞、T细胞和B细胞等免疫细胞的分化和激活调控免疫功能,这可能是导致MS发病的启动因素〔8~12〕。许多miRNA在血液、脑脊液等体液中存在一定的表达丰度且理化特性稳定,能够作为疾病的生物标志物,循环miRNA 也因此成为MS研究的热点〔13,14〕。国外学者通过检测RRMS患者外周血单个核细胞miRNA的表达水平,发现100多种miRNA明显表达异常,其中一部分是 MS 潜在生物学标志物〔15〕。
miR-96属于miR-183家族成员,定位于人类染色体7q32。本研究与Otaegui等〔16〕研究结果一致,该团队进一步利用基因处理工具寻找特异性miRNA 的靶基因及其可能参与的信号通路,结果发现miR-96调节的靶基因主要参与经典免疫相关通路(如白细胞介素信号通路、Ⅰ组代谢型谷氨酸受体通路等)和 Wnt信号通路的调控。在MS发病过程中,前者参与谷氨酸介导的毒性和中枢神经系统T细胞的激活,后者参与效应T细胞的发育和调节T细胞的活化。miR-96表达增加可以抑制相关靶基因转录后蛋白表达,从而干扰相关免疫通路,减轻MS炎症反应〔17〕。因此,血清miR-96有可能作为RRMS缓解期的一种潜在生物标记物。
高表达的 miRNA-326 可以抑制靶基因产物 Ets-1(一种调节Th17分化的负性因子)的表达,促进原始 CD4+T 细胞向 Th17 细胞的分化,加重 MS 患者病情。Du等〔18〕证实实验性自身免疫性脑脊髓炎小鼠外周血中Th17 细胞数目异常增高,并且与miRNA-326 表达水平呈正相关。RRMS复发期患者外周血淋巴细胞miRNA-326与miR-26a 表达水平明显升高,根据ROC曲线分析,miR-326有近100%的敏感性和特异性鉴别RRMS复发与缓解〔19〕。因此,血清miRNA-326表达水平可以反映RRMS复发期炎症活动情况。EDSS评分反映的是患者神经功能缺损程度和日常生活能力,而血清miR-96、miR-326表达水平间接反映MS炎症活动情况。但是Kacperska等〔14〕发现miR-92a表达水平与RRMS复发期患者EDSS评分存在负相关关系。综上,血清miR-96、miR-326与RRMS的炎症活动密切相关,可作为监测RRMS活动性的候选生物标记物。
1 Bielekova B,Martin R.Development of biomarkers in multiple sclerosis〔J〕.Brain,2012;127:1463-78.
2 Li M,Marin-Muller C,Bharadwaj U,etal.MicroRNAs:control and loss of control in human physiology and disease〔J〕.World J Surg,2011;33:667-84.
3 Fenoglio C,Ridolfi E,Galimberti D,etal.MicroRNAs as active players in the pathogenesis of multiple sclerosis〔J〕.Int J Mol Sci,2012;13(10):13227-39.
4 Keller A,Leidinger P,Steinmeyer F,etal.Comprehensive analysis of microRNA profiles in multiple sclerosis including next-generation sequencing〔J〕.Mult Scler,2014;20:295-303.
5 Sondergaard HB,Hesse D,Krakauer M,etal.Differential microRNA expression in blood in multiple sclerosis〔J〕.Mult Scler,2013;19:1849-57.
6 Martinelli-Boneschi F,Fenoglio C,Brambilla P,etal.MicroRNA and mRNA expression profile screening in multiple sclerosis patients to unravel novel pathogenic steps and identify potential biomarkers〔J〕.Neurosci Lett,2012;508:4-8.
7 Polman CH,Reingold SC,Banwell B,etal.Diagnostic criteria for multiple sclerosis:2010 revisions to the McDonald criteria〔J〕.Ann Neurol,2011;69:292-302.
8 Zhang J,Cheng Y,Cui W,etal.MicroRNA-155 modulates Th1 and Th17 cell differentiation and is associated with multiple sclerosis and experimental autoimmune encephalomyelitis〔J〕.J Neuroimmunol,2013;266:56-63.
9 Chen F,Hu SJ.Effect of microRNA-34a in cell cycle,differentiation,and apoptosis:a review〔J〕.J Biochem Mol Toxicol,2012;26(2):79-86.
10 Sievers C,Meira M,Hoffmann F,etal.Altered microRNA expression in B lymphocytes in multiple sclerosis:towards a better understanding of treatment effects〔J〕.Clin Immunol,2012;144:70-9.
11 Jernas M,Malmestrom C,Axelsson M,etal.MicroRNA regulate immune pathways in T-cells in multiple sclerosis (MS)〔J〕.BMC Immunol,2013;14:32.
12 Fenoglio C,Cantoni C,De Riz M,etal.Expression and genetic analysis of miRNAs involved in CD4+cell activation in patients with multiple sclerosis〔J〕.Neurosci Lett,2011;504:9-12.
13 Gandhi R,Healy B,Gholipour T,etal.Circulating microRNAs as biomarkers for disease staging in multiple sclerosis〔J〕.Ann Neurol,2013;73(6):729-40.
14 Kacperska MJ,Jastrzebski K,Tomasik B,etal.Selected extracellular microRNA as potential biomarkers of multiple sclerosis activity-preliminary study〔J〕.J Mol Neurosci,2015;56(1):154-63.
15 Keller A,Leidinger P,Lange J,etal.Multiple sclerosis:microRNA expression profiles accurately differentiate patients with relapsing-remitting disease from healthy controls〔J〕.PLoS One,2009;4:e7440.
16 Otaegui D,Baranzini SE,Armananzas R,etal.Differential micro RNA expression in PBMC from multiple sclerosis patients〔J〕.PLoS One,2009;4:e6309.
17 Singh RP,Massachi I,Manickavel S,etal.The role of miRNA in inflammationand autoimmunity〔J〕.Autoimmun Rev,2013;12:1160-5.
18 Du C,Liu C,Kang J,etal.MicroRNA miR-326 regulates TH-17 differentiation and is associated with the pathogenesis of multiple sclerosis〔J〕.Nat Immunol,2009;10:1252-9.
19 Honardoost MA,Kiani-Esfahani A,Ghaedi K,etal.miR-326 and miR-26a,two potential markers for diagnosis of relapse and remission phases in patient with relapsing-remitting multiple sclerosis〔J〕.Gene,2014;544 (2):128-33.
〔2015-03-18修回〕
(编辑 苑云杰)
福建省教育厅科技项目(No.JB13075);泉州市技术研究与开发项目(No.2015Z33)
叶励超(1973-),男,硕士,副主任医师,主要从事神经免疫和脑血管病研究。
R774.6
A
1005-9202(2016)22-5519-03;
10.3969/j.issn.1005-9202.2016.22.011
1 检验科
