PNU上调大鼠皮质星形胶质细胞内源性Cryab抑制Aβ聚集
2016-12-17任真奎官志忠禹文峰
任真奎 杨 梅 官志忠 禹文峰
(贵州医科大学医学分子生物学重点实验室,贵州 贵阳 550004)
PNU上调大鼠皮质星形胶质细胞内源性Cryab抑制Aβ聚集
任真奎 杨 梅 官志忠 禹文峰
(贵州医科大学医学分子生物学重点实验室,贵州 贵阳 550004)
目的 探讨PNU激活星形胶质细胞α7胆碱能受体(α7 nAChRs)上调内源性B-晶状体蛋白(Cryab)并抑制β淀粉样蛋白(Aβ)集聚的现象及其机制。方法 分离24 h内新生乳鼠大脑皮质培养原代星形胶质细胞并鉴定;体外制备Aβ1~42寡聚体;将细胞分为对照组、PNU组、PNU+α7 nAChRs阻断剂(MLA)组、Aβ1~42组、PNU+ Aβ1~42组、PI3K信号通路阻断剂LY294002+PNU+ Aβ1~42组。用蛋白印迹法检测细胞内Cryab、P-Akt(ser473)、Aβ寡聚体的表达水平。结果 (1)PNU可以显著上调星形胶质细胞内源性Cryab蛋白(P<0.05);应用MLA阻断α7 nAChRs后,PNU上调内源性Cryab蛋白的作用被显著抑制(P<0.05);使用LY294002阻断PI3K信号通路后,PNU上调内源性Cryab蛋白的作用被显著抑制(P<0.01);(2)PNU能够显著上调磷酸化Akt蛋白水平(P<0.05);应用MLA阻断α7 nAChRs后,PNU上调磷酸化Akt蛋白的作用被显著抑制(P<0.01);使用LY294002阻断PI3K信号通路后,PNU上调磷酸化Akt蛋白的作用被显著抑制(P<0.01);(3)在细胞裂解液及培养基中,PNU显著增强星形胶质细胞对Aβ聚集的抑制作用(P<0.01);使用LY294002阻断PI3K信号通路后,PNU增强星形胶质细胞抑制Aβ聚集的功能显著减弱(P<0.01)。结论 PNU通过激活星形胶质细胞α7 nAChRs上调内源性Cryab从而抑制Aβ集聚;PI3K/Akt信号通路可能参与PNU激活星形胶质细胞α7 nAChRs上调内源性Cryab蛋白抑制Aβ集聚的过程。
星形胶质细胞;阿尔茨海默病;α7胆碱能受体;PNU;B-晶状体蛋白;β淀粉样蛋白
β淀粉样蛋白(Aβ)聚集是阿尔茨海默病(AD)核心发病机制,Aβ的聚集不仅可以导致神经细胞凋亡,也可以破坏突触结构和功能,从而导致记忆和认知功能障碍〔1〕。Aβ的聚集能够激活星形胶质细胞释放细胞因子、炎性因子从而导致脑内的神经炎症〔2〕。
α7胆碱能受体(α7 nAChRs)广泛分布于大脑皮质和海马的神经元、星形胶质细胞和小胶质细胞〔3〕。在 AD 的发病机制中,α7 nAChRs通过与Aβ相互作用而扮演了重要的病理角色〔4〕。近年来的研究表明,α7 nAChRs可能是拮抗Aβ神经毒性的一个重要靶点〔5〕。B-晶状体蛋白(Cryab)在大脑内具有许多重要的生理功能:抗炎、抗凋亡和神经保护等〔6〕。在AD大脑中,星形胶质细胞表达的Cryab蛋白明显上调,并且这些上调的Cryab蛋白紧密地分布在Aβ蛋白沉积周围〔7〕。Cryab蛋白能够通过与Aβ蛋白直接结合等方式有效地阻止Aβ蛋白的聚集及其细胞毒性作用〔8〕。
PNU是α7 nAchR激动剂中特异性较高的合成物,与其他nAchR亚单位结合微乎其微,与α7 nAChR结合,提高和改善AD动物模型的认知和记忆功能〔9〕。PNU通过激活星形胶质细胞α7 nAChR提高细胞的存活与抗凋亡〔10〕,但在星形胶质细胞模型中,PNU是否能增强星形胶质细胞对Aβ聚集的抑制及其机制尚不清楚。
我们前期研究结果证实,用PNU激活星形胶质细胞a7 nAChRs能够显著增强星形胶质细胞对 Aβ聚集的抑制,但具体调控机制不清楚。基于Cryab蛋白的特性,推测星形胶质细胞内源性Cryab蛋白可能是PNU介导Aβ聚集的中间环节。
1 材料与方法
1.1 主要仪器和试剂 胎牛血清及DMEM培养基购于Gibco公司(美国);Aβ1~42肽、六氟异丙醇、二甲基亚砜(DMSO)、PNU、methyllycaconitine (MLA) 购于Sigma公司(美国);青-链霉素及胰蛋白酶购于Hyclone公司(美国);6E10抗体购自BioLegend公司(美国);鼠抗Cryab(αB-crystallin)单克隆抗体购自Abcam公司(美国);辣根过氧化物酶(HRP)标记的抗兔、抗鼠二抗;鼠抗β-肌动蛋白(β-actin) 单克隆抗体;磷脂酰肌醇子-激酶- 蛋白激酶B(PI3K/Akt)信号通路的抑制剂LY294002及相关位点的抗体购于CST公司(美国);抗体稀释液、封闭液、聚丙烯酰胺凝胶购自碧云天公司;高效显影胶片、显影液、定影液购自柯达公司;电化学增强发生法(ECL-Plus)试剂及聚乙烯二氟(PVDF)膜购于Millipore公司(美国);二喹啉甲酸(BCA)蛋白浓度测定试剂盒购自Thermo公司(美国);倒置显微镜(Olympus);-80℃冰箱(美国Thermo公司);高速离心机(德国Eppendorf公司);ELX 800酶标仪 (美国 Bio-tec公司);CO2培养箱(日本SANYO公司)。
1.2 Aβ1~42寡聚体的制备 参照Klein〔11〕体外制备Aβ1~42寡聚体的方法,将预冷的六氟异丙醇(HFIP)加入Aβ1~42粉末中,使其充分溶解后常温孵育60 min。随后为使HFIP挥发完全,将其放在常温下通风橱过夜。将干燥的肽膜于-80℃保存,使用时取出用DMSO溶解,再用含十二烷基硫酸钠(SDS)的硝酸盐缓冲液(PBS)稀释后,4℃存放2 w,冰冻高速离心(10 min、14 000 g/min),上清液即为寡聚体。
1.3 星形胶质细胞培养传代及鉴定 参照McCarthy等〔12,13〕的方法并改进,取24~48 h内新生SD乳鼠的大脑皮质(贵州医科大学动物实验中心提供),动物合格证号:SCXK(黔)2012-0001,将其大脑皮质剪成泥状,消化漂洗后,加入含1%双抗(青霉素100 U/ml,链霉素100 U/ml)、10%FBS的高糖DMEM培养基,吹打成细胞悬液,接种至培养瓶,5%二氧化碳、37℃恒温培养。24 h后换液,之后每3天换1次液直至细胞铺满瓶底。培养8~9 d,纯化并传3~4代。胶质纤维酸性蛋白(GFAP)细胞免疫荧光法对星形胶质细胞进行染色,鉴定细胞纯度。
1.4 分组及细胞处理 将培养好的星形胶质细胞纯化、传代并鉴定后,以5×105的密度种入六孔板内。将细胞分为对照组、PNU组、PNU+MLA组、Aβ1~42组、PNU+ Aβ1~42组、PNU+ LY294002+ Aβ1~42组。PNU+MLA组预先加入MLA处理2 h,随后加入PNU;PNU+ LY294002+ Aβ1~42组,预先加入LY294002处理2 h,随后加入PNU孵育18 h,换液后,用DMEM培养基吹洗3次,加入终浓度为1 μmol/L的Aβ1~42寡聚体继续在37℃ 、5% CO2培养箱中培养24 h。
1.5 蛋白印迹法 从六孔板中收集细胞,加入细胞裂解液(100 μl/孔),4℃、12 000 r/min离心20 min后取上清,将提取的蛋白质用BCA蛋白定量试剂盒定量后分装保存(-80℃),用Western印迹方法检测Cryab、P-Akt(ser473)及Aβ蛋白表达水平。12%的梯度胶电泳,蛋白样品分离后转移至PVDF膜,5%胎牛血清(BSA)室温封闭1 h,Tris盐酸缓冲液(TBS-T)漂洗(3次×10 min),加入相应一抗,4℃孵育过夜,TBS-T漂洗(3次×10 min)后加入HRP标记二抗室温孵育1 h,TBS-T漂洗(3次×10 min)后曝光。用ImageJ软件分析曝光结果,以β-actin为内对照。
1.6 统计学方法 应用SPSS22.0软件,两组间比较采用t检验,多组间采用one-way ANOVA分析。
2 结 果
2.1 PNU显著增强星形胶质细胞对Aβ聚集的抑制作用 在原代星形胶质细胞培养模型上,用α7 nAChRs 激动剂PNU处理细胞,能够显著增加星形胶质细胞对细胞内(Aβ1~42组86.22±8.56,PNU+Aβ1~42组53.13±11.56)和细胞培养液内(Aβ1~42组100.74±3.98,PNU+Aβ1~42组54.63±13.58)Aβ聚集的抑制作用,见图1。
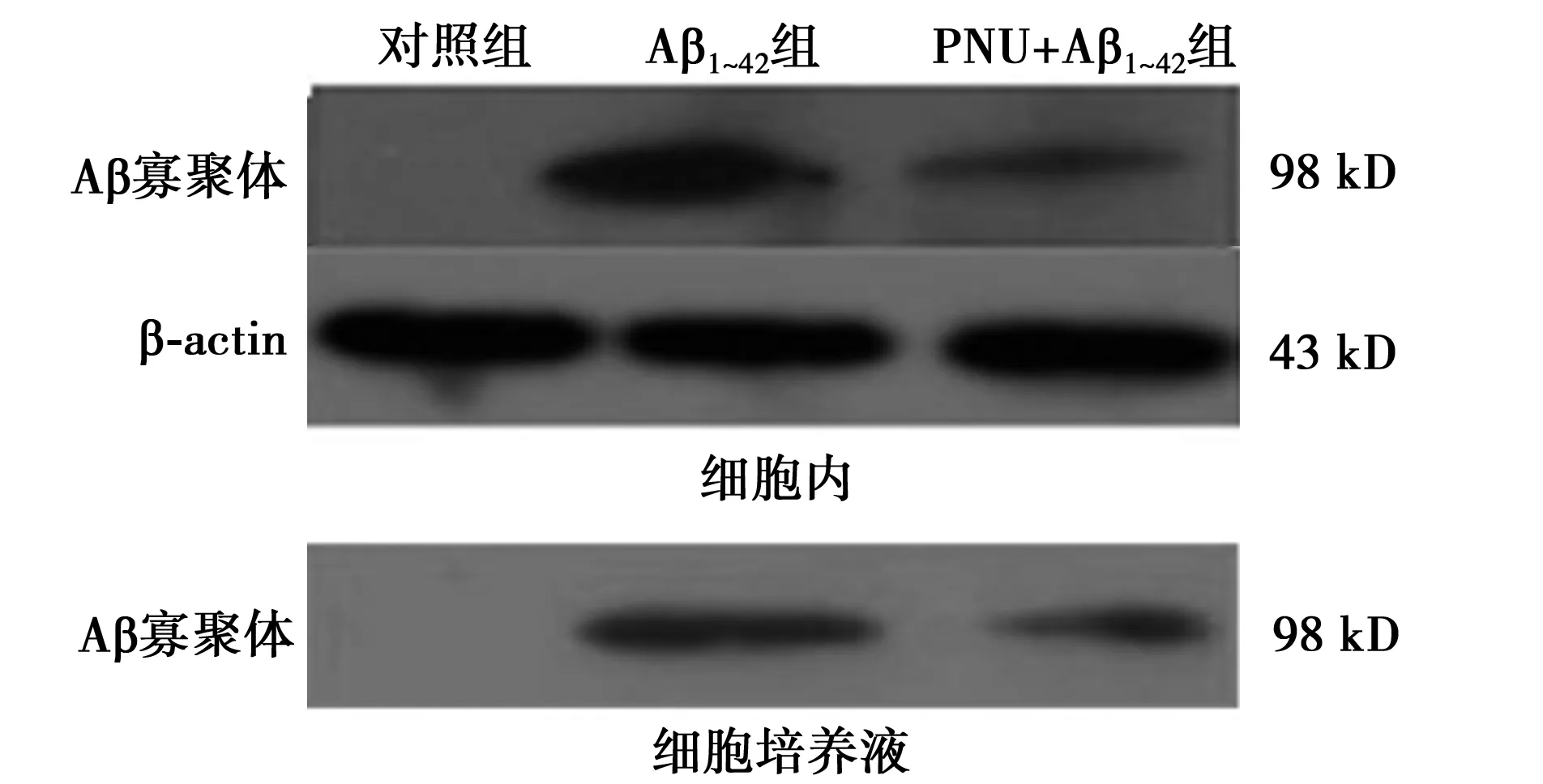
图1 PNU增强星形胶质细胞对Aβ聚集的抑制作用
2.2 PNU显著上调星形胶质细胞内源性Cryab蛋白表达水平 课题组前期结果显示,PNU以5 μmol/L刺激星形胶质细胞后对Cryab蛋白的上调作用最为明显。以5 μmol/L PNU处理星形胶质细胞在不同的时间段(6,12,18,24 h),对Cryab蛋白的上调效应表现出时间依赖性,0、6、12、18、24 h Cryab蛋白表达量分别为102.71±13.08,223.99±25.32,336.57±60.78,427.32±26.73,340.65±55.40,18 h达到稳定阶段,选择该时间、浓度(18 h、5 μmol/L)作为后继研究。PNU刺激后 Cryab的表达量升高。见图2。
2.3 PNU通过激活α7 nAChRs而上调Cryab蛋白水平 PNU刺激星形胶质细胞后α7nAChRs的表达上调。本研究选取α7nAChRs的特异性阻断剂 MLA,以50、100、150 nmol/L MLA预先处理星形胶质细胞2 h后,再加入5 μmol/L PNU共同孵育18 h。不加PNU、MLA时Cryab蛋白表达量为95.54±9.14;加PNU 5 μmol/L及0、50、100、150 nmol/L MLA后Cryab蛋白表达量依次为128.92±15.65,81.01±20.15,75.71±3.03,84.28±6.63。MLA刺激星形胶质细胞后PNU上调内源性 Cryab的效应受到抑制。见图3。

图2 PNU上调内源性Cryab蛋白

图3 PNU通过激活α7 nAChRs而上调内源性Cryab蛋白
2.4 PI3K/Akt信号通路参与PNU激活α7 nAChRs上调星形胶质细胞内源性Cryab蛋白 不加PNU,P-Akt蛋白表达量为93.67±3.84。以5 μmol/L PNU处理星形胶质细胞在不同时间段(5,10,20,30 min),对P-Akt(ser473)蛋白的上调效应表现出时间依赖性并且20 min达到稳定阶段,0、10、20、30 min时P-Akt蛋白表达量分别为110.66±9.80,97.55±17.93,132.98±13.23,138.40±24.292 0 min被选择作为后继实验。该上调作用被PI3K/Akt信号通路的抑制剂LY294002或α7 nAChRs的阻断剂MLA抑制。不加PNU、LY294002时,P-Akt表达量为98.08±5.61,仅加PNU 5 μmol/L时P-Akt表达量为143.99±6.64,PNU及LY294002共同作用时,P-Akt表达量为57.85±8.930。不加PNU、MLA时,P-Akt表达量为98.10±6.34,仅加PNU时,P-Akt表达量为144.03±14.53;PNU及MLA共同作用时,P-Akt表达量为75.20±12.96。见图4,图5。
不加PNU、LY294002时,Cyab表达量为91.72±7.27;仅予PNU时为Cryab表达量为134.29±20.74,LY294002预先处理星形胶质细胞2 h,再加入PNU共同孵育18 h,星形胶质细胞内源性Cryab的表达受到抑制(93.40±16.30)。见图6。

图4 PNU上调P-Akt(ser473)蛋白表达
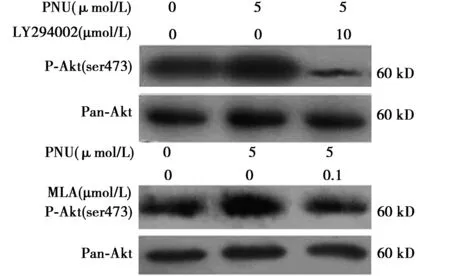
图5 LY294002或MLA能抑制P-Akt(ser473)蛋白表达
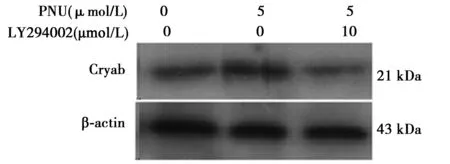
图6 LY294002能抑制内源性Cryab蛋白表达
2.5 PNU显著增强星形胶质细胞对Aβ聚集的抑制作用与PI3K/Akt信号通路的激活相关 与Aβ1~42组相比,PNU+ Aβ1~42组的Aβ蛋白显著下调(P<0.01);与PNU+ Aβ1~42组相比,PNU+ Aβ1~42+ LY294002组的Aβ蛋白显著上调(P<0.01)。说明PNU激活α7 nAChRs之后,通过PI3K/Akt信号通路上调Cryab,从而抑制Aβ的集聚。见表1,图7。
表1 LY294002处理星形胶质细胞后Aβ寡聚体表达的检测
与Aβ1~42组相比:1)P<0.01;与PNU+ Aβ1~42组相比:2)P<0.01
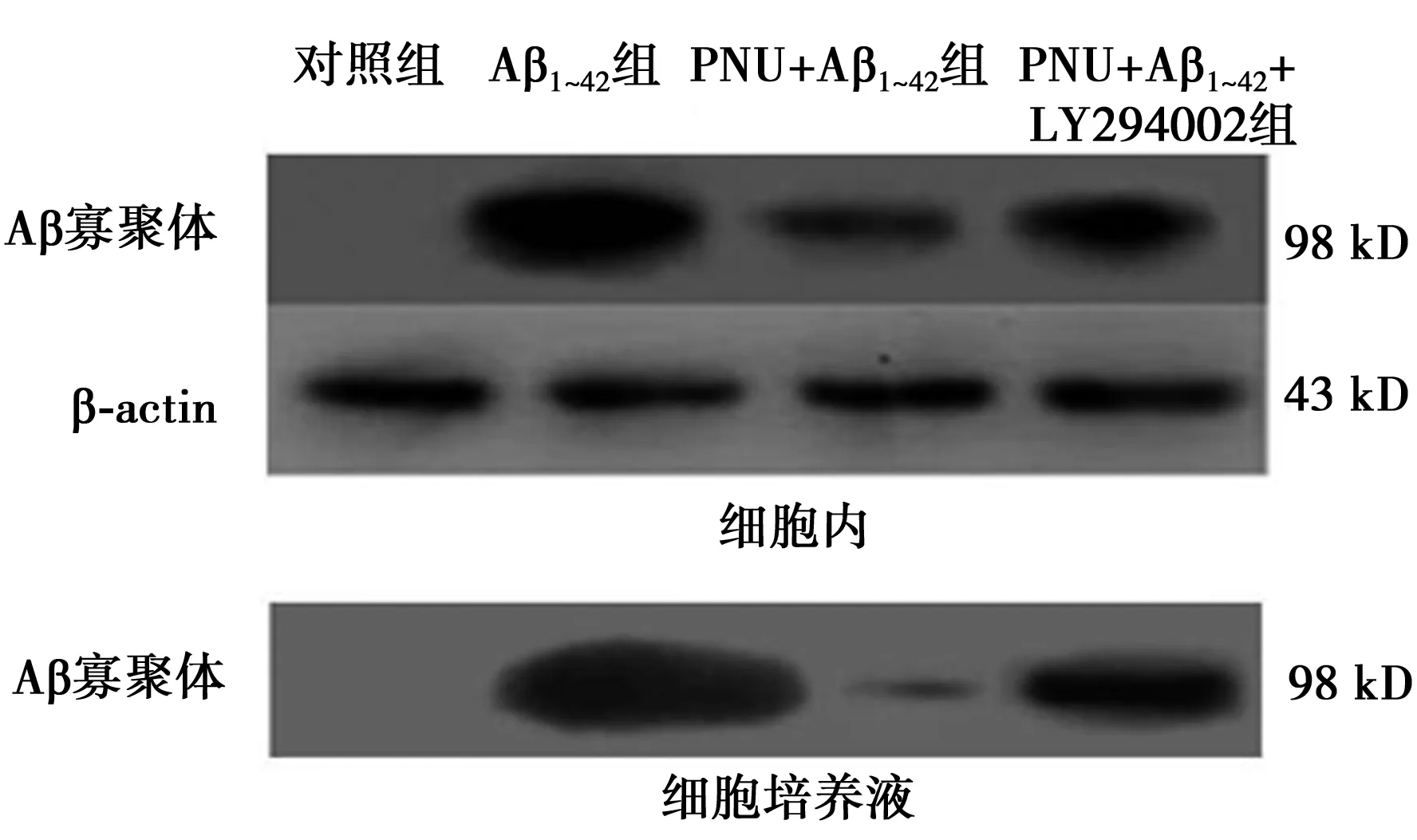
图7 PNU通过激活PI3K/Akt信号通路而抑制β-淀粉样蛋白的集聚
3 讨 论
在中枢神经系统中星形胶质细胞数量最多而且参与重要的生理功能:防止神经元损伤、提供代谢、营养支持和调节突触活动〔14〕。星形胶质细胞在Aβ聚集和沉积过程中具有双重病理角色。一方面,激活的星形胶质细胞能够通过大量分泌细胞因子,炎性因子和一氧化氮等神经毒性物质而导致AD脑内的神经炎症发生〔15〕;另一方面,活化的星形胶质细胞也能够表达与Aβ降解有关的酶,对Aβ进行有效地吞噬和降解〔16〕。基于以上事实,促进星形胶质细胞对Aβ聚集和沉积的抑制功能可能成为治疗 AD 的一个重要方向。
α7胆碱能受体是配体门控离子通道家族中的成员。它由五个跨膜亚基组成,有一个大的胞外氨基端,4个跨膜结构域和一个胞质域〔17,18〕。α7 nAChRs广泛分布于大脑皮质和海马的神经元、星形胶质细胞和小胶质细胞〔3〕。在 AD 的发病机制中,α7 nAChRs 通过与Aβ的相互作用而扮演了重要的病理角色〔4〕。近年来的研究表明,α7 nAChRs可能是拮抗Aβ神经毒性的一个重要靶点。在神经元细胞中,α7nAChRs能够通过激活多条细胞内信号通路而拮抗 Aβ导致的神经细胞凋亡〔19〕。在前期结果中,用PNU处理星形胶质细胞后发现α7 nAChRs的表达上调,并且能显著抑制Aβ聚集。本研究发现PNU通过激活α7nAChRs而上调Cryab蛋白水平,由此可推测PNU是通过激活星形胶质细胞的α7 nAChRs后上调内源性Cryab从而抑制Aβ的聚集。
PI3K/AKT 信号通路参与了α7 nAChRs的神经保护功能,在AD研究中发现,Akt在海马神经元中表达减少,继而导致神经元凋亡〔20〕。本实验结果说明PNU激活α7 nAChRs后,使PI3K/Akt信号通路激活引起细胞内相应的效应。进一步的研究发现LY294002能抑制PNU上调内源性Cryab蛋白表达。这些结果表明,PNU通过α7 nAChRs上调星形胶质细胞内源性Cryab蛋白与PI3K/Akt信号通路的激活相关。上调Akt能对抗Aβ诱导的神经元凋亡和tau蛋白磷酸化〔21〕。PNU处理星形胶质细胞后能明显抑制Aβ的聚集,并且该作用能被LY294002阻断,说明PNU通过α7 nAChRs抑制Aβ聚集与PI3K/Akt信号通路的激活相关,而且该过程可能有内源性Cryab蛋白的参与。因为在AD大脑中,星形胶质细胞表达的Cryab蛋白明显上调,并且这些上调的Cryab蛋白紧密地分布在Aβ蛋白沉积周围〔7〕。Cryab蛋白能够通过与Aβ蛋白直接结合等方式有效地阻止Aβ蛋白的聚集及其细胞毒性作用〔8〕。
1 Rijal-Upadnaya A,Capetillo-Zarate E,Kosterin I,etal.Dispersible amyloid beta-protein oligomers,protofibrils,and fibrils represent diffusible but not soluble aggregates:their role in neurodegeneration in amyloid precursor protein (APP) transgenic mice〔J〕.Neurobiol Aging,2012;33(11):2641-60.
2 Heneka MT,O′Banion MK.Inflammatory processes in Alzheimer′s disease〔J〕.J Neuroimmunol,2007;184(1-2):69-91.
3 Bourdin CM,Lebreton J,Mathe-Allainmat M,etal.Pharmacological profile of zacopride and new quaternarized fluorobenzamide analogues on mammalian alpha7 nicotinic acetylcholine receptor〔J〕.Bioorg Med Chem Lett,2015;25(16):3184-8.
4 Parri HR,Hernandez CM,Dineley KT.Research update:alpha7 nicotinic acetylcholine receptor mechanisms in Alzheimer′s disease〔J〕.Biochem Pharmacol,2011;82(8):931-42.
5 Ni R,Marutle A,Nordberg A.Modulation of α7 nicotinic acetylcholine receptor and fibrillar amyloid-β interactions in Alzheimer′s disease brain.〔J〕.J Alzheimers Dis,2013;33(3):1-4.
6 Bhat R,Steinman L.Innate and adaptive autoimmunity directed to the central nervous system〔J〕.Neuron,2009;64(1):123-32.
7 Wilhelmus MM,de Waal RM,Verbeek MM.Heat shock proteins and amateur chaperones in amyloid-Beta accumulation and clearance in Alzheimer′s disease〔J〕.Mol Neurobiol,2007;35(3):203-16.
8 Wilhelmus MM,Boelens WC,Otte-Holler I,etal.Small heat shock proteins inhibit amyloid-beta protein aggregation and cerebrovascular amyloid-beta protein toxicity〔J〕.Brain Res,2006;1089(1):67-78.
9 Vicens P,Heredia L,Torrente M,etal.Behavioural effects of PNU-282987 and stress in an animal model of Alzheimer′s disease〔J〕.Psychogeriatrics,2016〔Epub ahead of print〕.
10 Di Cesare-Mannelli L,Tenci B,Zanardelli M,etal.α 7 Nicotinic receptor promotes the neuroprotective functions of astrocytes against oxaliplatin neurotoxicity〔J〕.Neural Plasticity,2015;2015:396908.
11 Klein WL.Abeta toxicity in Alzheimer′s disease:globular oligomers (ADDLs) as new vaccine and drug targets〔J〕.Neurochem Int,2002;41(5):345-52.
12 McCarthy KD,de Vellis J.Preparation of separate astroglial and oligodendroglial cell cultures from rat cerebral tissue〔J〕.J Cell Biol,1980;85(3):890-902.
13 董莉莎,刘文丽,赵 鹏,等.氯化锰诱导原代星形胶质细胞的过度活化〔J〕.毒理学杂志,2016;30(1):10-3.
14 Sidoryk-Wegrzynowicz M,Wegrzynowicz M,Lee E,etal.Role of astrocytes in brain function and disease〔J〕.Toxicol Pathol,2011;39(1):115-23.
15 Li C,Zhao R,Gao K,etal.Astrocytes:implications for neuroinflammatory pathogenesis of Alzheimer′s disease〔J〕.Curr Alzheimer Res,2011;8(1):67-80.
16 Heurling K,Buckley C,Vandenberghe R,etal.Separation of beta-amyloid binding and white matter uptake of (18)F-flutemetamol using spectral analysis〔J〕.Am J Nucl Med Mol Imag,2015;5(5):515-26.
17 Paterson D,Nordberg A.Neuronal nicotinic receptors in the human brain〔J〕.Prog Neurobiol,2000;61(1):75-111.
18 Lotfipour S,Mandelkern M,Brody AL.Quantitative molecular imaging of neuronal nicotinic acetylcholine receptors in the human brain with A-85380 radiotracers〔J〕.Curr Med Imaging Rev,2011;7(2):107-12.
19 Kawamata J,Shimohama S.Stimulating nicotinic receptors trigger multiple pathways attenuating cytotoxicity in models of Alzheimer′s and Parkinson′s diseases〔J〕.J Alzheimers Dis,2011;24(2):95-109.
20 王昊飞.α7胆碱能受体激动剂DMXB对Aβ损伤认知功能的影响及其分子机制〔D〕.南京:南京医科大学,2009.
21 Xu J,Zhang R,Zuo P,etal.Aggravation effect of isoflurane on Abeta(25-35)-induced apoptosis and tau hyperphosphorylation in PC12 cells〔J〕.Cell Mol Neurobiol,2012;32(8):1343-51.
〔2016-05-11修回〕
(编辑 袁左鸣)
PNU inhibiting Aβ aggregation via upregulation endogenous Cryab in rat astrocytes
REN Zhen-Kui,YANG Mei,GUAN Zhi-Zhong,et al.
Key Lab of Medical Molecular Biology,Guizhou Medical University,Guiyang 550004,Guizhou,China
Objective To investigate the possible mechanism of PNU on amyloid β (Aβ)aggregation via activation α7 nAChRs as well as upregulation endogenous Cryab.Methods Primary culture astrocytes were separated from neonatal SD rat cerebral cortex;Aβ1-42oligomers were prepared in vitro.Astrocytes were divided into control,PNU,MLA,Aβ1-42,PNU + Aβ1-42,PNU + LY294002 + Aβ1-42groups.The protein levels of Cryab,phosphorylated-Akt (ser473)and Aβ oligomers in the cells were detected by Western blot.Results (1)PNU significantly increased endogenous Cryab in astrocytes(P<0.05).The effect of upregulation endogenous Cryab by PNU was significantly inhibited by α7 nAChR antagonist-MLA (P<0.05).After PI3K signaling pathway was blocked by LY294002,the effect of upregulation endogenous Cryab by PNU was significantly inhibited(P<0.01).(2)PNU significantly increased phosphorylated-Akt in astrocytes (P<0.05).The effect of up regulation phosphorylated-Akt by PNU was significantly inhibited by α7 nAChR antagonist-MLA(P<0.01).After PI3K signaling pathway was blocked by LY294002,the effect of upregulation phosphorylated-Akt by PNU was significantly inhibited (P<0.01).(3)In cell lysis solution and medium,PNU significantly enhanced astrocyte to inhibit Aβ aggregation (P<0.01).After PI3K signaling pathway was blocked by LY294002,the effect of inhibition Aβ aggregation by PNU was significantly inhibited(P<0.01).Conclusions PNU could significantly inhibit Aβ aggregation via activated α7 nAChRs as well as upregulation endogenous Cryab in astrocytes.PI3K/Akt signaling pathway is likely to be invoved in this process.
Astrocytes;Alzheimer’s disease;α7nAChRs;PNU;αB-crystallin;β-amyloid
国家自然科学基金(81360199);教育部科学技术研究项目(213032A);贵州省国际科技合作计划项目(黔科合外G字〔2013〕7026号);贵州省教育厅项目(2015年贵州省普通高等学校地方病和少数民族疾病防控创新团队)
禹文峰(1971-),男,教授,主要从事神经分子生物学研究。
任真奎(1988-),男,硕士,主要从事神经分子生物学研究。
R34
A
1005-9202(2016)22-5506-04;
10.3969/j.issn.1005-9202.2016.22.006
