硫辛酸对骨质疏松大鼠骨代谢的影响及机制研究
2016-12-16贾乐生郑刚夏凡杨爽
贾乐生,郑刚,夏凡,杨爽
(沈阳医学院附属中心医院骨外三科,沈阳 110024)
硫辛酸对骨质疏松大鼠骨代谢的影响及机制研究
贾乐生,郑刚,夏凡,杨爽
(沈阳医学院附属中心医院骨外三科,沈阳 110024)
目的探讨氧化应激及抗氧化剂硫辛酸在大鼠骨质疏松发生中的作用及可能的机制。方法选用8周龄Wistar雌性大鼠24只,随机分为对照组、骨质疏松组和硫辛酸干预组,采用双侧卵巢切除法建立骨质疏松大鼠模型,硫辛酸组采用60 mg/kg硫辛酸腹腔注射,干预共8周;检测骨密度,全血碱性磷酸酶(ALP),骨钙素,钙、磷水平,股骨组织MDA、SOD和GSH⁃Px含量;Western blotting方法测定股骨组织护骨素(OPG)和细胞核因子κB受体活化因子配基(RANKL)蛋白含量,Real⁃time PCR方法测定股骨组织OPG和RANKLmRNA表达水平。结果骨质疏松组大鼠骨密度,股骨组织中SOD、GSH⁃Px、OPGmRNA及蛋白表达低于对照组大鼠(P<0.05);血清骨钙素,ALP水平,股骨组织中MDA、RANKLmRNA及蛋白水平都显著高于对照组大鼠(P<0.05)。硫辛酸组大鼠骨密度和股骨组织中SOD、GSH⁃Px、OPGmRNA及蛋白表达高于骨质疏松组大鼠(P<0.05);血清骨钙素,ALP水平,股骨组织中MDA、RANKLmRNA及蛋白表达水平都显著低于骨质疏松组大鼠(P<0.05)。结论氧化应激可能通过OPG/RANKL通路促进了大鼠骨质疏松的发生,而抗氧化剂硫辛酸可缓解骨质疏松的进展。
骨质疏松;硫辛酸;氧化应激;护骨素;细胞核因子κB受体活化因子配基
网络出版地址
随着中国人口老龄化,老年人常见疾病——骨质疏松症引起广泛关注,中国40岁以上人群骨质疏松总体患病率达13.2%[1]。骨质疏松症是一种全身代谢性疾病,主要特征骨量减少,骨组织显微结构退化,可导致骨脆性增加及骨折危险性增加[2]。引起骨质疏松的因素很多,如遗传、营养、生活习惯等[3⁃4]。近期有研究[5]发现氧化应激在骨质疏松症发病中起重要作用,可加重骨组织破坏。氧化应激引起骨质疏松可能与一氧化碳、核因子κB、护骨素(os⁃teoprotegerin,OPG)/细胞核因子κB受体活化因子配基(receptor activator of nuclear factor⁃κB ligand,RANKL)等相关,但目前具体机制还不清楚。硫辛酸为公认的抗氧化剂,其在骨质疏松中是否有保护作用有待进一步探讨。本实验通过建立骨质疏松大鼠模型,探讨氧化应激在骨质疏松中作用,并选用抗氧化剂硫辛酸干预,探讨其对骨质疏松大鼠骨代谢的影响以及可能机制。
1 材料与方法
1.1实验动物与分组
健康Wistar大鼠24只,雌性,8周龄,体质量(253.3±18.5)g,由中国医科大学实验动物中心提供。适应性饲养1周后,随机分为3组,假手术组(对照组)、骨质疏松组和硫辛酸组,每组8只。
1.2骨质疏松模型的建立及处理
骨质疏松组和硫辛酸组大鼠3%戊巴比妥钠(0.1 mL/g)腹腔注射麻醉,下腹部备皮,开腹找到子宫,结扎卵巢动脉,完整切除双侧卵巢,建立骨质疏松模型,对照组仅切除卵巢周围小块脂肪组织,其他操作同骨质疏松模型组。硫辛酸组大鼠腹腔注射硫辛酸注射液(60 mg/kg),骨质疏松组腹腔注射生理盐水,1周注射6 d,共干预8周。8周后大鼠麻醉后腹主动脉取血,取双侧股骨,-80℃保存待测。
1.3指标检测
1.3.1骨密度检测:取出标本室温下解冻,小心剔除右侧股骨两端软组织,将待测的骨置于双能X线骨密度检测仪测试台上(Prodigy型,GE公司),应用小动物软件(Hologic,Bedford,MA,美国)程序扫描,整段股骨进行骨密度分析测定。
1.3.2全血碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素、钙和磷检测:采用生物化学方法,使用贝克曼全自动生化分析仪进行检测。
1.3.3丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH⁃Px)检测:取出股骨,0.9%氯化钠溶液1∶10稀释匀浆,4℃离心(3 000 r/min,15 min)。MDA、SOD、GSH⁃Px和总蛋白测定具体操作严格按照试剂盒(上海碧云天生物技术有限公司)说明书进行。
1.3.4Real⁃time PCR方法检测OPG和RANKL mRNA表达:采用Trizol一步法提取总RNA。反转录合成cDNA,反应体系扩增,使用SYBR Green相对定量的方法。采用Primer 3软件设计PCR引物,以β⁃actinmRNA为内参照,引物序列如下:RANKL上游引物,5’⁃GACAGGCACGGACTCGTA⁃3’,下游引物,5’⁃CGCTCATGCTAGTCGTCTA⁃3’;OPG上游引物,5’⁃TACAGCATCACTACGTAGGAC⁃3’,下游引物,5’⁃ACGTCATGCGATCACATATCG⁃3’;β⁃actin上游引物,5’⁃GAAATCGTGCGTGACATTA⁃3’,下游引物,5’⁃TAGGAGCCAGGGCAGTAA⁃3’。运用2-ΔΔCt方法,比较各组mRNA的相对表达量。
1.3.5OPG和RANKL蛋白检测:采用Western blot⁃ting方法,取股骨组织样品,加入预冷的蛋白裂解液匀浆,组织匀浆机粉碎,12 000 r/min冷冻离心,取上清分装用于分析。取等量的核蛋白,在12%SDS-聚丙烯酰胺中电泳分离蛋白,然后将蛋白条带转移至PVDF膜上,5%脱脂奶粉中封闭过夜,TTBS洗3次,加入兔抗大鼠(OPG、RANKL)Ⅰ抗抗体,4℃孵育过夜,TTBS洗3次,加入辣根过氧物酶螯合的羊抗兔抗体(Ⅱ抗)于室温下孵育2 h,洗膜后用ECL发光体,采用图像分析系统进行分析。
1.4统计学分析
2 结果
2.13组大鼠体质量比较
实验开始前对照组[(250.6±13.7)g]、骨质疏松组[(259±22.4)g]和硫辛酸组[(250.2±19.6)g]大鼠体质量无统计学差异(P>0.05)。实验8周,骨质疏松组大鼠体质量(402.4±15.9)g,显著高于对照组[(375.9±10.8)g]和硫辛酸组大鼠[(383.6±18.1)g](P<0.05),而硫辛酸组和对照组大鼠体质量无统计学差异(P>0.05)。
2.23组大鼠骨密度及血骨钙素、钙、磷水平比较
实验8周后,骨质疏松组大鼠的骨密度显著低于对照组大鼠,而血中骨钙素和ALP水平显著高于对照组大鼠(P<0.05);硫辛酸组大鼠骨密度高于骨质疏松组大鼠,而骨钙素和ALP水平显著低于骨质疏松组大鼠(P<0.05),见表1。
2.33组大鼠MDA、SOD、GSH⁃Px含量比较
实验8周后,骨质疏松组大鼠的股骨组织中MDA水平显著高于对照组大鼠,而SOD和GSH⁃Px水平显著低于对照组大鼠(均P<0.05);硫辛酸组大鼠MDA低于骨质疏松组大鼠,而SOD和GSH⁃Px水平显著高于骨质疏松组大鼠(均P<0.05),见表2。
2.43组大鼠OPG和RANKLmRNA表达水平比较
实验8周后,骨质疏松组大鼠的股骨组织中OPGmRNA水平显著低于对照组大鼠,而RANKL mRNA水平显著高于对照组大鼠(均P<0.05);硫辛酸组大鼠OPGmRNA高于骨质疏松组大鼠,而RANKLmRNA水平低于骨质疏松组大鼠(P< 0.05),见表3。

表1 实验8周3组大鼠骨密度及血骨钙素、ALP、钙、磷水平变化(x±s,n=8)Tab.1 Levels of BMD,steocalcin,ALP,Ca,and P among 3 groups at 8 weeks(x±s,n=8)

表2实验8周3组大鼠MDA,SOD,GSH⁃Px含量比较(x±s,n=8)Tab.2 Comparison of MDA,SOD,and GSH⁃Px levels among 3 groups at 8 weeks(x±s,n=8)
2.53组大鼠OPG和RANKL蛋白水平比较
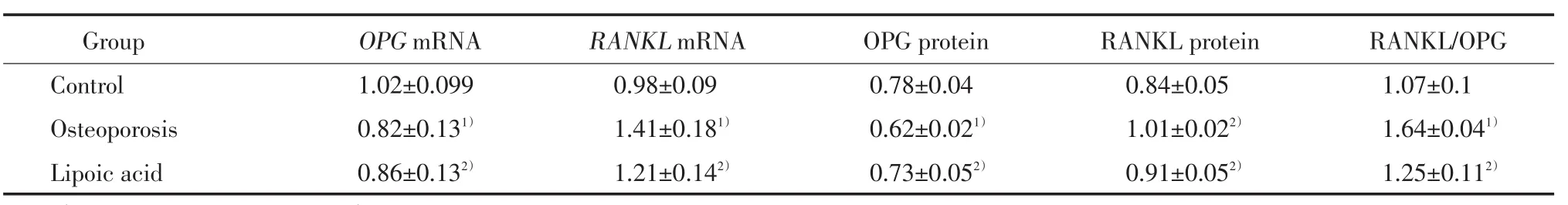
表3OPG和RANKL mRNA和蛋白表达水平比较(x±s,n=8)Tab.3 Comparison of OPG and RANKL mRNA and protein among 3 groups at 8 weeks(x±s,n=8)
实验8周后,骨质疏松组大鼠的OPG蛋白显著低于对照组大鼠,而RANKL水平显著高于对照组大鼠(P<0.05);硫辛酸组大鼠OPG高于骨质疏松组大鼠,而RANKL水平低于骨质疏松组大鼠(P<0.05);RANKL/OPG比值骨质疏松组显著高于对照组,硫辛酸组低于骨质疏松组(P<0.05),见表3、图1。

图1 实验8周3组大鼠OPG和RANKL蛋白水平比较Fig.1 Comparison of OPG and RANKL protein levels among 3 groups in 8 weeks
3 讨论
本次实验发现骨质疏松组MDA水平显著高于对照组,而SOD和GSH⁃Px水平显著低于对照组,骨质疏松组氧化抗氧化水平失衡,氧化损伤增高同时抗氧化系统减弱,可见氧化损伤与骨质疏松密切相关,另有研究[6]也表明活性氧参与骨质疏松的病理过程。本次试验增加抗氧化剂硫辛酸的干预,发现硫辛酸组的MDA水平较骨质疏松组下降,而SOD和GSH⁃Px水平较骨质疏松组升高,同时骨钙素水平降低,骨密度增高,可见使用抗氧化剂可能改善骨质疏松大鼠骨的氧化应激状态,进而改善骨质疏松的进展。
有研究[7]表明OPG/RANKL通路是破骨细胞分化过程中的一个重要信号传导通路,有报道[8]认为当氧化应激水平增高时,RANKL表达水平会增高,OPG表达水平下降,OPG/RANKL比值降低,RANKL与RANK结合增多,而OPG与RANK结合反而减少,破骨细胞的形成、分化、成熟会被促进,骨吸收增加,最终导致骨组织损伤,出现骨质疏松。本研究发现骨质疏松组RANKL表达水平增高,OPG表达水平降低,RANKL/OPG比值升高,同时骨组织中氧化应激水平显著升高,同上述报道一致,本研究还增加了抗氧化剂硫辛酸的干预,发现硫辛酸干预组同骨质疏松组比较RANKL表达水平降低,OPG表达水平升高,RANKL/OPG比值降低,进一步印证氧化应激在骨质疏松形成中的作用。
综上所述,氧化应激可能通过OPG/RANKL通路促进了骨质疏松的发生,而抗氧化剂硫辛酸可缓解骨质疏松的进展。本次实验采用大鼠骨质疏松模型进行研究,若在人群中推广需要更多的临床数据证实。氧化应激在骨质疏松形成中的具体机制也有待于进一步研究。
[1]韩亚军,帖小佳,伊力哈木·托合提.中国中老年人骨质疏松症患病率的Meta分析[J].中国组织工程研究,2014,18(7):1129-1134.DOI:10.3969/j.issn.2095⁃4344.2014.07.024.
[2]DANIELSON L,ZAMULKO A.Osteoporosis:a review[J].S D Med,2015,68(11):503-505,507⁃509.
[3]NAVARRO MDEL C,SAAVEDRA P,JÓDAR E,et al.Osteoporosis and metabolic syndrome according to socioeconomicstatus,contribu⁃tion of PTH,vitamin D and body weight:the Canarian osteoporosis poverty study(COPS)[J].Clin Endocrinol,2013,78(5):681-686.DOI:10.1111/cen.12051.
[4]林琳,齐铮琴,金海红,等.卵巢早衰患者骨量变化的相关研究[J].中国医科大学学报,2011,40(7):655-657.DOI:21⁃1227/ R.20110705.1001.004.
[5]WU Q,CHEN JT.The effects of oxidative stress on the development of osteoporosis[J].Chin J Osteoporps,2010,16(3):222-224. DOI:10.3969/j.issn.1006⁃7108.2015.01.021.
[6]WILSON C.Bone:oxidative stress and osteoporosis[J].Nat Rev Endocrinol,2014,10(1):3.DOI:10.1038/nrendo.2013.225.
[7]GURBAN CV,MEDERLE O.The OPG/RANKL system and zinc ions are promoters of bone remodeling by osteoblast proliferation in⁃postmenopausal osteoporosis[J].Rom J Morphol Embryol,2011,52(Suppl 3):1113-1119.
[8]KOBAYASHI Y,UDAGAWA N,TAKAHASHI N.Action of RANKL and OPG for osteoclastogenesis[J].Crit Rev Eukaryot Gene Expr,2009,19(1):61-72.
(编辑武玉欣)
Effects of Lipoic Acid on Bone Metabolism in Osteoporosis Rat and Its Mechanism
JIA Lesheng,ZHENG Gang,XIA Fan,YANG Shuang
(Department of Orthopeadic Surgery,The Central Hospital Affiliated to Shenyang Medical College,Shenyang 110024,China)
ObjectiveTo investigate the effects of oxidative stress and lipoic acid(antioxidant)on bone metabolism and explore the underlying mechanism.MethodsA total of 24 Wistar rats aged 8 weeks were randomly divided into three groups.Osteoporosis rats model was established by bilateral ovaries deleted.Rat in lipoic acid group was injected with lipoic acid(60 mg/kg)for 8 weeks.The bone mineral density(BMD),steo⁃calcin,ALP,Ca,P,MDA,SOD and GSH⁃Px were detected.The levels of OPG and RANKL in serum were measured by Western blotting.OPG andRANKLmRNA were detected by real⁃time PCR.ResultsThe level of BMD level in blood,SOD,GSH⁃Px,OPGmRNA and protein level in femur of osteoporosis group were significantly lower than the control group(P<0.05).On the other hand,steocalcin,ALP,MDA,RANKLmRNA and protein level were significantly higher than the control group(P<0.05).The level of BMD level in blood,SOD,GSH⁃Px,OPGmRNA and protein level of lipoic acid group were significantly higher than the osteoporosis group(P<0.05).The steocalcin,ALP,MDA,RANKLmRNA and protein level were significantly lower than the osteoporosis group(P<0.05).ConclusionOxidative stress may increase osteoporosis through the upregulation of OPG/RANKL pathway in rats,and antioxidant lipoic acid can alleviate the progress of osteoporosis.
osteoporosis;lipoic acid;oxidative stress;osteoprotegerin;receptor activator of nuclear factor⁃kB ligand
R68
A
0258-4646(2016)12-1133-03
10.12007/j.issn.0258⁃4646.2016.12.017
贾乐生(1974-),男,副主任医师,硕士. E-mail:happylifejia@foxmail.com
2016-04-07
网络出版时间:
