MDM2与MDMX抑制剂的研究进展
2016-12-15张一帆杨文思饶建军徐剑豪胡中平宫春杰
张一帆,杨文思,徐 威,饶建军,徐剑豪,胡中平,宫春杰
(湖北工业大学生物工程与食品学院 湖北省工业发酵协同创新中心 教育部发酵工程重点实验室,湖北 武汉 430068)
MDM2与MDMX抑制剂的研究进展
张一帆,杨文思,徐 威,饶建军,徐剑豪,胡中平,宫春杰
(湖北工业大学生物工程与食品学院 湖北省工业发酵协同创新中心 教育部发酵工程重点实验室,湖北 武汉 430068)
癌细胞中肿瘤抑制因子p53经常会因为基因的突变或者负调控因子(如鼠双微体蛋白MDM2与MDMX)的过表达失去活性。MDM2与MDMX的抑制剂可重新激活p53活性,进而诱导细胞凋亡,抑制肿瘤细胞的繁殖。因此,MDM2与MDMX抑制剂的研究已成为当前的研究热点。对MDM2与MDMX抑制剂以及双效抑制剂的研究进展进行了综述。
MDM2;MDMX;p53;抑制剂;抗肿瘤药物
肿瘤抑制因子p53在维持基因组稳定性、诱导细胞凋亡、防止恶性转化、调控DNA修复等方面发挥着重要的作用[1]。在肿瘤细胞中,p53的功能普遍受到损害,p53的基因突变是人类癌症中最常见的基因突变[2]。通常p53的基因突变会直接导致其抑制癌症功能的丧失。研究表明,超过50%的肿瘤细胞中检测到p53基因的突变或缺失,而其它肿瘤细胞中则检测到未激活的p53基因[3]。目前,常见的两种p53的抑制因子是鼠双微体(MDM)蛋白,即鼠双微体2(MDM2)和鼠双微体X(MDMX,也称作MDM4)[4-5]。MDM2和MDMX是p53的负调控因子,能够促进肿瘤细胞的发生和发展[4,6],是目前被普遍认知的肿瘤蛋白,可以负调控p53蛋白的活性和稳定性[7]。研究表明,利用各种高通量筛选技术获得的抑制剂可以阻断p53-MDM2和p53-MDMX之间的相互作用,从而抑制肿瘤的发生[4,8]。随着小分子抑制剂Nutlin-1、Nutlin-2、Nutlin-3等的发现,各类MDM2和MDMX抑制剂相继被报道。近年来,各类MDM2和MDMX的专一抑制剂以及双效抑制剂已成为研究的热点。
1 p53与MDM2、MDMX的相互作用
p53基因是第一个被鉴定和报道的肿瘤抑制因子基因,最初被认为是一个肿瘤基因,但后续研究获得的遗传学数据和功能数据表明它是一个肿瘤抑制因子[9]。p53蛋白作为一个转录因子,可以激活细胞中6或7个基因的转录,如MDM2、CylinG、GADD45、Bax等的表达[10]。人类p53蛋白包括393个氨基酸,并被划分为4个结构与功能结构域:(1)N-末端的前42个氨基酸为转录激活结构域,可与转录辅因子结合调控基因的表达,有机体内实验表明氨基酸F19、L22和W23是转录激活过程中的必需氨基酸[11]。(2)DNA结合结构域,位于102至292氨基酸残基之间,该区可抵御蛋白酶的作用,并包含一个单独折叠的结构域,其中包含1个锌离子。(3)p53蛋白的寡聚区,位于324至355氨基酸残基之间,该区负责p53四聚体形成[12]。(4)C-末端的26个氨基酸残基形成开放结构域,该区对蛋白酶敏感,通过9个残基与DNA及RNA结合,该结构域对催化单链DNA或RNA形成双链起辅助作用[13]。
MDM2作为一个p53下游基因的调控因子,主要调控p53蛋白的稳定性和活性。 并以很强的亲和力结合在p53转录激活结构域的N-末端,从而参与细胞生长抑制、诱导凋亡及细胞周期调控等[14]。MDM2和p53间的相互作用及调控通过一个反馈回路自动调控,即p53可转录诱导MDM2的表达,反之,MDM2调节p53的泛素化[15]。此外,MDM2具有E3泛素化连接酶的活性,通过使蛋白酶降解,促进p53的泛素化,参与细胞生长抑制、凋亡、细胞周期调控等过程[16-17]。在许多人类肿瘤中,如肺癌、乳腺癌及结肠癌中,都有mdm2基因的过表达[18-19]。与MDM2相反,MDMX没有E3泛素化连接酶的活性,但它可以抑制p53的活性,并促进MDM2对p53的降解[20]。MDMX导致癌症的发生主要是通过抑制p53基因的表达[21-22]。通过抑制MDM2及MDMX与p53间的相互作用,激活p53途径被认为是切实可行的新的肿瘤治疗方法[23-24]。
2 MDM2抑制剂
利用小分子抑制剂干扰p53与MDM2、MDMX的相互作用,重新激活p53活性已成为科学家广泛认可的方法[23,25]。Nutlin系列小分子抑制剂的发现为小分子抑制剂的开发提供了一个范例。其中,Nutlin-3a表现出与MDM2的结合能力,破坏了p53-MDM2间的相互作用,并重新激活了p53蛋白活性[25-26]。Nutlin-3a在多种异种移植小鼠模型中表现出了抗癌活性[27-28]。Nutlin系列抑制剂的发现激发了人们对小分子抑制剂的研究热情[23,28-29]。以此为范例,多种小分子抑制剂被发现报道。
2.1 MI-888
Ding等[30]利用吲哚酮可模拟p53的Trp23这一特点,设计了一系列吲哚酮螺环化合物,发现MI-888的前导化合物具有MDM2抑制活性(图1a,抑制常数Ki=8.46 μmol·L-1)。研究人员以此前导化合物为基础,通过优化结构[31]、改善PK性质[32]等一系列措施,得到具有高活性和cis-cis构型的化合物MI-888(图1b,抑制常数Ki=0.44 nmol·L-1)[33]。它对MDM2的亲和力极强,不仅可模拟p53的3个关键氨基酸与MDM2相互作用,还可诱导MDM2的N-端10~25无序序列重新折叠,从而增加额外疏水作用。同时,它对人体分化脂肪肉瘤细胞系DDLPS具有较好的抑制活性(IC50约为0.067~0.404 μmol·L-1)[34]。MI-888能够在体外、白血病和实体肿瘤异种移植肿瘤组织中有效地激活野生型p53,阻遏依赖p53的细胞周期并导致细胞凋亡。

图1 MI-888前导化合物(a)和MI-888(b)的结构
2.2 RG-7112
RG-7112(图2b)是由Nutlin-3a(图2a)经结构优化得到的,即将Nutlin-3a咪唑环上的4、5位氢以甲基取代,同时将Nutlin-3a所含的3个苯环中不含氯原子的苯环A的对位甲氧基以叔丁基代替、用乙氧基代替异丙氧基,用甲磺酰丙基取代的哌嗪代替亲水性的羰基哌嗪侧链,以阻止其结构中咪唑环与苯环的代谢失活。RG-7112的抑制活性比Nutlin-3a强4倍[35]。RG-7112在临床研究中展示了其与MDM2的强大结合能力,能有效诱导细胞凋亡,尤其是在MDM2蛋白过表达的肿瘤细胞中[25]。第一个被报道的临床病例是脂肪肉瘤患者,该肿瘤以mdm2基因过表达为特征。Burgess等[36]对20名患者登记并完成预处理,其中18名患者是带有野生型p53肿瘤患者,另外2名是p53突变型肿瘤患者,研究表明肿瘤细胞内的p53、p21、MIC-1(一种由p53分泌的蛋白产物)的浓度提高,与预处理的细胞相比,MDM2 mRNA的表达增加了,而Ki-67阳性细胞有小幅度的减少。其中1名患者有一定的确定性反应,14名患者病情稳定,所有患者都经历过至少1种不良反应,主要为恶心(14例)、呕吐(11例)、虚弱无力(9例)、腹泻(9例)、血小板减少(8例)。其中有8名患者有明显的不良反应,主要为嗜中性白血球减少症和血小板减少症。

图2 RG-7112前导化合物Nutlin-3a(a)和RG-7112(b)的结构
2.3 AMG-232
AMG-232(图3b)是一种哌啶酮类物质,是在AM-8553(图3a)的基础上进行一系列改进,包括N-烷基的取代,充分利用药物与MDM2蛋白表面浅缝的相互作用,引入磺酰基等并进行构象控制而得到的。目前该抑制剂正用于治疗癌症的临床试验,是一个极其有效的MDM2蛋白抑制剂,有着显著的药物代谢动力学特征并在SJSA-1(人骨肉瘤细胞系)中表现出显著的抗肿瘤活性(ED50=9.1 mg·kg-1)[37]。AMG-232对p53野生型肿瘤细胞的选择性高达2 500倍[38]。
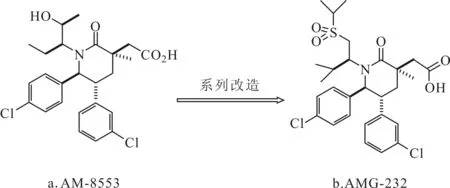
图3 AM-8553(a)和AMG-232(b)的结构
3 MDMX抑制剂
大多数对MDM2有效的抑制剂对MDMX过表达的抑制效果都是有限的,大多数小分子抑制剂的工作原理和Nutlin-3a的工作原理相同,均是通过与MDM2 的N-末端口袋相结合,从而抑制其与p53的结合。尽管MDMX和MDM2与p53结合的N-末端结构域相似,但是许多小分子与MDM2的结合相对MDMX具有更强的亲和力[39],最近也有一些特异性结合MDMX的小分子抑制剂进入了临床前的测试。
3.1 SJ-172550
SJ-172550(图4)是第一个从化学库中通过生化和细胞高通量筛选确定的MDMX的小分子抑制剂,该化合物能够可逆地结合MDMX并杀死由于MDMX过表达而形成的成视网膜癌细胞,当与MDM2抑制剂相结合时,SJ-172550的作用会增强,一系列生化和结构模型研究表明,SJ-172550结合于MDMX 与p53结合的口袋,从而取代p53,这种先导化合物为MDMX抑制剂的进一步优化提供了方向,最终可被用于治疗各种由于MDMX过表达引起的小儿癌症和成人肿瘤[40]。

图4 SJ-172550的结构
3.2 WK298
WK298(图5)是另一种小分子抑制剂,它与MDMX的结合系数EC50=20μmol·L-1。对其结构进行研究获得了其模拟p53与MDMX结合的信息,结合有小分子抑制剂的MDMX晶体结构首次被报道。Popowicz等[41]发现WK298的氯代吲哚恰好插入MDMX的W23口袋,其吲哚NH与His54形成氢键。WK298虽不能使MDMX 的L26 口袋完全打开,但可使L26 口袋被诱导为“开放/闭合”的过渡态构象,从而契合氯代苯基。对比p53-MDMX和WK298-MDMX共晶结构可发现,WK298 插入到F19 口袋的苯基近乎垂直于p53的Phe19,与MDMX 的疏水作用较弱。然而,WK298的N,N-二甲基丙胺可覆盖MDMX的Phe19 区域,与Met61、Tyr66 可产生额外的疏水作用[42]。

图5 WK298的结构
4 MDM2/MDMX双效抑制剂
最近还发现几种具有更高生物效率并能同时作用MDM2和MDMX的化合物,它们通过不同的方式有效地与MDM2/MDMX的N-末端相结合,作用方式有:抑制MDM2泛素化连接酶的活性[43];破坏MDM2-MDMX异源二聚体[2];抑制MDM2与MDMX的转录[44-46];使MDM2自泛素化[47-48];通过吸引p53从而防止其与MDM2或MDMX结合[49]。
4.1 pDI
由于大多数抑制剂对MDMX的抑制效果并不理想,在评估可行性和生物效应的基础上,还要同时破坏p53、MDMD2和MDMX的结合。Hu等[50]采用噬菌体展示技术发现了一个多肽抑制剂(LTFEHYWAQLTS),并命名为pDI,pDI区别于p53(QETFSDLWKLLP),但仍保留有p53的3个疏水残基Phe19、Trp23和Leu26。pDI能有效抑制p53和MDM2(IC50= 10 nmol·L-1)、MDMX (IC50= 100 nmol·L-1)的结合,是一种有效的MDM2/MDMX双效抑制剂。支架蛋白(硫氧化还原蛋白)的表达表明了这个肽序列通过腺病毒破坏p53与MDM2/MDMX的相互作用,导致过表达MDM2/MDMX的肿瘤细胞中的p53有效激活,使细胞周期停滞和细胞凋亡。瘤内注射腺病毒同样引起小鼠移植瘤细胞生长受到抑制。这些结果显示了同时把MDM2和MDMX作为目标进行癌症治疗的可能性,并为设计p53结构激活剂提供了新的结构模型。
4.2 RO-5963
RO-5963是一种吲哚类物质,能有效抑制MDM2与MDMX。RO-2443在体外显示了对MDM2与MDMX抑制活性的有效性,但是其较差的水溶性使得其在胞内的活性评估变得没有意义,在其基础上进一步化学优化得到了RO-5963,RO-5963效价较RO-2443稍微提高,但是RO-5963溶解度大幅提高。与Nutlin-3a相比,它们对p53-MDM2的抑制活性相似,RO-5963的IC50约为17 nmol·L-1,Nutlin-3a 的IC50约为19 nmol·L-1;但是RO-5963对p53-MDMX的抑制活性却比Nutlin-3a高约40倍,RO-5963的IC50约为24 nmol·L-1、Nutlin-3a的IC50约为930 nmol·L-1。RO-5963进入MDMX过表达的乳腺癌细胞,使p53含量稳定,使p21和mdm2的转录水平增加,最后结果符合RO-5963诱导体内的MDMX/MDMX和MDMX/MDM2在MCF7中形成二聚体,可能会干扰MDM2连接酶活性,并使 MDMX泛素化。通过干扰p53-MDM2结合和自身调节的反馈循环,RO-5963能够有效地抑制p53和MDMX、MDM2的结合。在人工培养的肿瘤细胞中,相比于MDM2,RO-5963能更有效地破坏p53与MDMX的结合[51]。
4.3 ATSP7041
ATSP7041是一种有高效选择性并对MDM2/MDMX有较好抑制作用的双效抑制剂,能有效地激活p53通路。ATSP7041与MDM2和MDMX具有毫微摩尔级的亲和力,在肿瘤细胞系的血清里面展示了其亚微摩尔级的细胞活性,显示了高效的选择性,精准的作用机制。高分辨率X-射线晶体结构显示其与目标蛋白质MDMX分子相互作用,像钉子一样与目标分子的多个关键氨基酸紧密结合在一起。ATSP7041在MDM2/MDMX过表达的异种移植肿瘤模型中显示出对肿瘤生长强有力的抑制作用,具有良好的药代动力学和组织分布特性,总的来说,ATSP7041在体内外展示了其装订肽的理念,可以开发与治疗相关的蛋白-蛋白相互作用的抑制剂,可能为癌症治疗提供一个可行的模式[52]。
5 结语
近年来,随着p53-MDM2及p53-MDMX的复合体结构研究的深入及计算机辅助药物设计的不断发展,抗肿瘤药物研究进入到一个新纪元,相信未来人们对肿瘤等问题的研究会越来越透彻。通过设计不同针对p53-MDM2/MDMX作用机制药物的联合运用,定能为临床治疗带来非常好的疗效。由于有些药物对MDM2/MDMX的特异性不同,有些还存在副作用,随着对MDM2/MDMX双效抑制剂的不断深入研究,相信会有更多高效且副作用小的抑制剂被发现,使人们对肿瘤的认识和治疗上升到一个新的阶段。总之,目前关于MDM2、MDMX在肿瘤发生机制,二者的抑制剂在治疗中的作用及其对预后影响的认识都是很有限的,有待进一步研究。
[1] HARRIS S L,LEVINE A J.The p53 pathway:positive and negative feedback loops[J].Oncogene,2005,24(17):2899-2908.
[2] HAUPT S,BUCKLEY D,PANG J M,et al.Targeting MDMX to treat breast cancers with wild-type p53[J].Cell Death & Disease,2015,6(7):e1821.
[3] HOLLSTEIN M,SIDRANSKY D,VOGELSTEIN B,et al.p53 mutations in human cancers[J].Science,1991,253(5015):49-53.
[4] WADE M,LI Y C,WAHL G M.MDM2,MDMX and p53 in oncogenesis and cancer therapy[J].Nature Reviews Cancer,2013,13(2):83-96.
[5] MARINE J C.MDM2 and MDMX in cancer and development[J].Current Topics in Developmental Biology,2011,94:45-75.
[6] TOLEDO F,WAHL G M.Regulating the p53 pathway:invitrohypotheses,invivoveritas[J].Nature Reviews Cancer,2006,6(12):909-923.
[7] NOGUCHI T,OISHI S,HONDA K,et al.Affinity-based screening of MDM2/MDMX-p53 interaction inhibitors by chemical array:identification of novel peptidic inhibitors[J].Bioorganic & Medicinal Chemistry Letters,2013,23(13):3802-3805.
[8] TSUGANEZAWA K,NAKAGAWA Y,KATO M,et al.A fluorescent-based high-throughput screening assay for small molecules that inhibit the interaction of MDMX with p53[J].Journal of Biomolecular Screening,2013,18(2):191-198.
[9] VOGELSTEIN B,LANE D,LEVINE A J.Surfing the p53 network[J].Nature,2000,408(6810):307-310.
[10] KO L J,PRIVES C.p53:puzzle and paradigm[J].Genes & Development,1996,10(9):1054-1072.
[11] HSU Y S,TANG F M,LIU W L,et al.Transcriptional regulation by p53.functional interactions among multiple regulatory domains[J].The Journal of Biological Chemistry,1995,270(12):6966-6974.
[12] JEFFREY P D,GORINA S,PAVLETICH N P.Crystal structure of the tetramerization domain of the p53 tumor suppressor at 1.7 angstroms[J].Science,1995,267(5203):1498-1502.
[13] LEE S,ELENBAAS B,LEVINE A,et al.p53 and its 14 kDa C-terminal domain recognize primary DNA damage in the form of insertion/deletion mismatches[J].Cell,1995,81(7):1013-1020.
[14] PIETTE J,NEEL H,MARECHAL V.MDM2:keeping p53 under control[J].Oncogene,1997,15(9):1001-1010.
[15] WU X,BAYLE J H,OLSON D,et al.The p53-MDM-2 autoregulatory feedback loop[J].Genes & Development,1993,7(7A):1126-1132.
[16] HAUPT Y,MAYA R,KAZAZ A,et al.MDM2 promotes the rapid degradation of p53[J].Nature,1997,387(6630):296-299.
[17] KUBBUTAT M H,JONES S N,VOUSDEN K H.Regulation of p53 stability by MDM2[J].Nature,1997,387(6630):299-303.
[18] MOMAND J,JUNG D,WILCZYNSKI S,et al.The MDM2 gene amplification database[J].Nucleic Acids Research,1998,26(15):3453-3459.
[19] FREEDMAN D A,WU L,LEVINE A J.Functions of the MDM2 oncoprotein[J].Cellular and Molecular Life Sciences,1999,55(1):96-107.
[20] MARINE J C,DYER M A,JOCHEMSEN A G.MDMX:from bench to bedside[J].Journal of Cell Science,2007,120(Pt3):371-378.
[21] MOMAND J,ZAMBETTI G P,OLSON D C,et al.The MDM-2 oncogene product forms a complex with the p53 protein and inhibits p53-mediated transactivation[J].Cell,1992,69(7):1237-1245.
[22] SHVARTS A,STEEGENGA W T,RITECO N,et al.MDMX:a novel p53-binding protein with some functional properties of MDM2[J].The EMBO Journal,1996,15(19):5349-5357.
[23] CHENE P.Inhibiting the p53-MDM2 interaction:an important target for cancer therapy[J].Nature Reviews Cancer,2003,3(2):102-109.
[24] BOTTGER A,BOTTGER V,GARCIA-ECHEVERRIA C,et al.Molecular characterization of the HDM2-p53 interaction[J].Journal of Molecular Biology,1997,269(5):744-756.
[25] VASSILEV L T,VU B T,GRAVES B,et al.Invivoactivation of the p53 pathway by small-molecule antagonists of MDM2[J].Science,2004,303(5659):844-848.
[26] EFEYAN A,ORTEGA-MOLINA A,VELASCO-MIGUEL S,et al.Induction of p53-dependent senescence by the MDM2 antagonist Nutlin-3a in mouse cells of fibroblast origin[J].Cancer Research,2007,67(15):7350-7357.
[27] TOVAR C,ROSINSKI J,FILIPOVIC Z,et al.Small-molecule MDM2 antagonists reveal aberrant p53 signaling in cancer:implications for therapy[J].Proceedings of the National Academy of Sciences of the United States of America,2006,103(6):1888-1893.
[28] VASSILEV L T.MDM2 inhibitors for cancer therapy[J].Trends in Molecular Medicine,2007,13(1):23-31.
[29] CHEN L,YIN H,FAROOQI B,et al.p53 alpha-helix mimetics antagonize p53/MDM2 interaction and activate p53[J].Molecular Cancer Therapeutics,2005,4(6):1019-1025.
[30] DING K,LU Y,NIKOLOVSKA-COLESKA Z,et al.Structure-based design of potent non-peptide MDM2 inhibitors[J].Journal of the American Chemical Society,2005,127(29):10130-10131.
[31] DING K,LU Y,NIKOLOVSKA-COLESKA Z,et al.Structure-based design of spiro-oxindoles as potent,specific small-molecule inhibitors of the MDM2-p53 interaction[J].Journal of Medicinal Chemistry,2006,49(12):3432-3435.
[32] SHANGARY S,QIN D,MCEACHERN D,et al.Temporal activation of p53 by a specific MDM2 inhibitor is selectively toxic to tumors and leads to complete tumor growth inhibition[J].Proceedings of the National Academy of Sciences of the United States of America,2008,105(10):3933-3938.
[33] ZHAO Y,LIU L,SUN W,et al.Diastereomeric spirooxindoles as highly potent and efficacious MDM2 inhibitors[J].Journal of the American Chemical Society,2013,135(19):7223-7234.
[34] DOS-SANTOS O,LAGARDE P,PEROT G,et al.1017 human dedifferentiated liposarcomas growth inhibition by SAR299155,a potent and selective disruptor of the MDM2-p53 interaction[J].Eur J Cancer,2012,48:S245-S246.
[35] VU B,WOVKULICH P,PIZZOLATO G,et al.Discovery of R-G-7112:a small-molecule MDM2 inhibitor in clinical development[J].ACS Medicinal Chemistry Letters,2013,4(5):466-469.
[36] BURGESS A,CHIA K M,HAUPT S,et al.Clinical overview of MDM2/X-targeted therapies[J].Frontiers in Oncology,2016,6:7.
[37] SUN D,LI Z,REW Y,et al.Discovery of AMG232,a potent,selective,and orally bioavailable MDM2-p53 inhibitor in clinical development[J].Journal of Medicinal Chemistry,2014,57(4):1454-1472.
[38] NEOCHORITIS C G,WANG K,ESTRADA-ORTIZ N,et al.2,30-Bis(10H-indole) heterocycles:new p53/MDM2/MDMX antagonists[J].Bioorganic & Medicinal Chemistry Letters,2015,25(24):5661-5666.
[39] MOELLERING R E,CORNEJO M,DAVIS T N,et al.Direct inhibition of the NOTCH transcription factor complex[J].Nature,2009,462(7270):182-188.
[40] REED D,SHEN Y,SHELAT A A,et al.Identification and characterization of the first small molecule inhibitor of MDMX[J].The Journal of Biological Chemistry,2010,285(14):10786-10796.
[41] POPOWICZ G M,CZARNA A,WOLF S,et al.Structures of low molecular weight inhibitors bound to MDMX and MDM2 reveal new approaches for p53-MDMX/MDM2 antagonist drug discovery[J].Cell Cycle,2010,9(6):1104-1111.
[42] 李春红,杜宏金,温小安,等.MDM2 与 MDM4 抑制剂的研究进展[J].中国药科大学学报,2015,46(1):1-15.
[43] HERMAN A G,HAYANO M,POYUROVSKY M V,et al.Discovery of MDM2-MDMX E3 ligase inhibitors using a cell-based ubiquitination assay[J].Cancer Discovery,2011,1(4):312-325.
[44] HUANG M,ZHANG H,LIU T,et al.Triptolide inhibits MDM2 and induces apoptosis in acute lymphoblastic leukemia cells through a p53-independent pathway[J].Molecular Cancer Therapeutics,2013,12(2):184-194.
[45] QIN J J,WANG W,VORUGANTI S,et al.Inhibiting NFAT1 for breast cancer therapy:new insights into the mechanism of action of MDM2 inhibitor JapA[J].Oncotarget,2015,6(32):33106-33119.
[46] WANG H,MA X,REN S,et al.A small-molecule inhibitor of MDMX activates p53 and induces apoptosis[J].Molecular Cancer Therapeutics,2011,10(1):69-79.
[47] SEO S K,HWANG C S,CHOE T B,et al.Selective inhibition of histone deacetylase 2 induces p53-dependent survivin downregulation through MDM2 proteasomal degradation[J].Oncotarget,2015,6(28):26528-26540.
[48] ZHANG H,GU L,LIU T,et al.Inhibition of MDM2 by nilotinib contributes to cytotoxicity in both Philadelphia-positive and negative acute lymphoblastic leukemia[J].PLoS One,2014,9(6):e100960.
[49] ISSAEVA N,BOZKO P,ENGE M,et al.Small molecule RITA binds to p53,blocks p53-HDM-2 interaction and activates p53 function in tumors[J].Nature Medicine,2004,10(12):1321-1328.
[50] HU B,GILKES D M,CHEN J.Efficient p53 activation and apoptosis by simultaneous disruption of binding to MDM2 and MDMX[J].Cancer Research,2007,67(18):8810-8817.
[51] GRAVES B,THOMPSON T,XIA M,et al.Activation of the p53 pathway by small-molecule-induced MDM2 and MDMX dimerization[J].Proceedings of the National Academy of Sciences of the United States of America,2012,109(29):11788-11793.
[52] CHANG Y S,GRAVES B,GUERLAVAIS V,et al.Stapled alpha-helical peptide drug development:a potent dual inhibitor of MDM2 and MDMX for p53-dependent cancer therapy[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(36):e3445-e3454.
Research Progress on Inhibitors of MDM2 and MDMX
ZHANG Yi-fan,YANG Wen-si,XU Wei,RAO Jian-jun,XU Jian-hao,HU Zhong-ping,GONG Chun-jie
(IndustrialFermentationCollaborativeInnovationCentreofHubei,FermentationEngineeringKeyLaboratoryoftheMinistyofEducation,SchoolofBiologicalEngineeringandFoodScience,HubeiUniversityofTechnology,Wuhan430068,China)
Genemutationofp53oroverexpressionofitsrepressorssuchasMDM2andMDMXoftenleadtoinactivationofp53incancercells.InhibitorsofMDM2andMDMXcanrestoretheactivityofp53thatinvolvedinapoptosisinductionandcellgrowthinhibition.InhibitorsofMDM2andMDMXhavebeenattractingagreatdealofattentions.TheresearchprogressoninhibitorsanddualinhibitorsofMDM2andMDMXisreviewedinthispaper.
MDM2;MDMX;p53;inhibitor;antitumordrug
湖北工业大学大学生创新创业训练计划项目(201510500063)
2016-06-06
张一帆,男,湖北孝感人;通讯作者:宫春杰,博士,讲师,研究方向:分子生物学,E-mail:gongcj606@163.com。
10.3969/j.issn.1672-5425.2016.11.012
张一帆,杨文思,徐威,等.MDM2与MDMX抑制剂的研究进展[J].化学与生物工程,2016,33(11):57-62.
TQ 460
A
1672-5425(2016)11-0057-06
