透骨消痛胶囊抑制脂多糖诱导软骨细胞炎症反应的机制研究
2016-12-15邵翔陈后煌陈达马玉环郑文伟叶蕻芝李西海
邵翔 陈后煌 陈达 马玉环 郑文伟 叶蕻芝 李西海
·实验研究·
透骨消痛胶囊抑制脂多糖诱导软骨细胞炎症反应的机制研究
邵翔 陈后煌 陈达 马玉环 郑文伟 叶蕻芝 李西海
目的 探讨透骨消痛胶囊抑制脂多糖(LPS)诱导的软骨细胞炎症反应作用机制。方法 对4周龄雄性SD大鼠采用机械-Ⅱ型胶原酶消化法获取膝关节软骨细胞并进行体外培养,将软骨细胞分为空白组、模型组以及透骨消痛胶囊组,空白组加入含10%胎牛血清(FBS)的低糖型Dulbecco改良Eagle培养基(DMEM/LOW)2 mL,模型组加入含10 ng/mL LPS、10%FBS的DMEM/LOW培养基 2 mL,透骨消痛胶囊组加入含10 ng/mL LPS、透骨消痛胶囊(300 μg/mL)、10%FBS的DMEM/LOW培养基 2 mL。干预8 h后,实时荧光定量聚合酶链式反应(qPCR)检测各组微小RNA(miRNA)-140表达变化,免疫荧光观察各组带有血小板凝血酶敏感蛋白样模体的解整链蛋白金属蛋白酶(ADAMTS)4、基质金属蛋白酶(MMP)-3表达变化,Image J分析各组平均光密度。结果 与空白组相比,模型组MMP-3表达升高(P<0.05)、ADAMTS4表达明显升高(P<0.01);与模型组相比,透骨消痛胶囊组MMP-3表达下降(P<0.05)、ADAMTS4表达明显下降(P<0.01)。与空白组相比,模型组软骨细胞miRNA-140表达明显降低(P<0.05);与模型组相比,透骨消痛胶囊组软骨细胞miRNA表达明显升高(P<0.05)。结论 透骨消痛胶囊能促进miRNA-140表达,降低ADAMTS4、MMP-3分泌,抑制炎症反应介导的软骨基质降解,从而延缓骨关节炎软骨退变。
软骨细胞;微小RNA-140;骨关节炎;基质金属蛋白酶-3;炎症反应
Academy of Integrative Medicine, Fujian University of Traditional Chinese Medicine1, Fuzhou 350122, China; College of Pharmacy, Fujian University of Traditional Chinese Medicine2, Fuzhou 350122, China; Fujian Key Laboratory of Integrative Medicine on Geriatrics, Fujian University of Traditional Chinese Medicine3, Fuzhou 350122, China
骨关节炎(OA)是一种以软骨退变、软骨下骨重建异常、骨质增生为主要特征的慢性进行性关节疾病[1],好发于老年且发病年龄呈低龄化趋势[2],随着病程的进展,患者可出现功能障碍。炎症反应在OA病程进展中起着至关重要的作用,炎性因子高表达可直接导致软骨代谢稳态失衡,发生软骨基质降解、关节软骨退变。微小RNA(miRNA)-140特异性表达于软骨组织中,在OA软骨中表达明显降低[3]。OA属中医“痹症”、“痿证”范畴,其核心病机为本痿标痹,肝肾亏虚、筋骨失养则筋脉拘挛、关节不利,治疗时应以补肾柔肝为主,辅以活血祛风。研究[4-6]显示,福建中医药大学附属第二人民医院院内制剂透骨消痛胶囊(批准文号:闽制字Z20100006)可通过抑制软骨细胞凋亡以增强其自噬作用,促进软骨基质成分表达,从而保护关节软骨,具有补肾柔肝、活血祛风的功效,临床效果良好。本研究以大鼠软骨细胞为研究对象,观察经透骨消痛胶囊干预后软骨细胞基质金属蛋白酶(MMP)-3、带有血小板凝血酶敏感蛋白样模体的解整链蛋白金属蛋白酶(ADAMTS)4、miRNA-140等表达变化,探讨透骨消痛胶囊抑制OA炎症反应的作用机制。
1 材料与方法
1.1 实验动物
实验动物为4周龄无特定病原体(SPF)级雄性SD大鼠,体重200~250 g,由上海斯莱克实验动物有限责任公司提供。由福建中医药大学实验动物中心提供清洁级实验动物环境设施。实验动物处置按照2006年科技部《关于善待实验动物的指导性意见》执行。
1.2 实验试剂与仪器
实验试剂:透骨消痛胶囊(原方由巴戟天12 g、白芍12 g、川芎6 g和肿节风6 g组成);脂多糖(LPS)、Ⅱ型胶原酶(美国sigma公司);磷酸盐缓冲液(PBS)、低糖型Dulbecco改良Eagle培养基(DMEM/LOW)、0.25%胰蛋白酶(美国Hyclone公司);胎牛血清(FBS,美国Gibco公司);激光共聚焦培养皿(中国NEST公司); MMP-3抗体、ADAMTS4抗体(美国Santa cruz公司);Ⅱ型胶原抗体(美国abcam公司);二氨基联苯胺(DAB)显色试剂盒、免疫组化试剂盒(中国博士德公司);六孔板、细胞培养瓶(美国Corning公司);荧光染料GOXRB ALEXA FLUOR 488、4’,6-二脒基-2-苯基吲哚(DAPI,美国Thermo fisher公司);miRNA提取试剂盒、miRNA逆转录试剂盒、miRNA-140引物、U6引物(美国Taqman公司);白细胞介素(IL)-1β酶联免疫吸附测定(ELISA)试剂盒(美国R&D公司);牛血清白蛋白(BSA)(中国碧云天公司);封闭山羊血清(中国索莱宝公司)。
仪器:激光扫描共聚焦显微镜(德国Carl Zeiss公司);CO2恒温培养箱(美国Thermo fisher公司);LX-800酶标仪(美国Bio-tek公司);实时荧光定量聚合酶链式反应(qPCR)仪(美国Applied Biosystems公司)。
1.3 软骨细胞提取
取4周龄SPF级雄性SD大鼠双侧膝关节,无菌条件下取关节表面软骨,置于无菌培养皿中PBS充分漂洗3次,使用手术刀片切成1 mm3方块,再用PBS清洗1次,吸干残液,加入0.2%Ⅱ型胶原酶4 mL,放入37℃的培养箱中消化,每隔2 h收集上清液并重新加入0.2%Ⅱ型胶原酶4 mL,上清液以1 000 rpm离心5 min,弃上清液,收集软骨细胞沉淀,重复3次。用含10%FBS的DMEM/LOW培养基重悬软骨细胞,接种于培养瓶中。将培养瓶置于5%CO2培养箱中37℃培养,48 h后倒置显微镜下观察软骨细胞贴壁情况,隔天换液,待软骨细胞铺满培养瓶底部80%后,进行传代培养。采用Ⅱ型胶原免疫组化染色法对第2代软骨细胞进行鉴定,软骨细胞质内出现明显棕黄色颗粒提示软骨细胞提取成功。
1.4 实验分组
将软骨细胞分为空白组、模型组、透骨消痛胶囊组。空白组中加入含10%FBS的DMEM/LOW培养基 2 mL,模型组中加入含10 ng/mL LPS、10%FBS的DMEM/LOW 培养基2 mL,透骨消痛胶囊组中加入含10 ng/mL LPS、透骨消痛胶囊(分别为100 μg/mL、200 μg/mL、300 μg/mL)、10%FBS的DMEM/LOW 培养基2 mL。干预8 h后取软骨细胞培养液,室温下以3 000 rpm离心10 min,取细胞培养液。IL-1β是OA病程中最主要的炎性因子之一,其高表达会导致MMP、ADAMTS等表达升高,因此本实验采用IL-1β作为检测模型建立以及药物干预浓度确立的指标。ELISA检测各组细胞培养液中IL-1β水平可见,模型组IL-1β分泌量明显高于空白组(P<0.01),透骨消痛胶囊(300 μg/mL)组IL-1β分泌量明显低于模型组(P<0.01)(图1)。故本实验透骨消痛胶囊组选取透骨消痛胶囊300 μg/mL联合LPS 10 ng/mL进行干预。

图1 各组软骨细胞培养液中IL-1β水平
注:★表示与空白组相比,P<0.01;☆表示与模型组相比,P<0.01
1.5 免疫荧光检测软骨细胞MMP-3、ADAMTS4表达
将软骨细胞4 × 104/mL接种于激光共聚焦培养皿中,分组干预8 h后,无菌PBS冲洗3次,-20℃预冷,加无水甲醇4℃固定30 min,之后无菌PBS冲洗3次,加入0.25%聚乙二醇辛基苯基醚(TritonX)-100破膜10 min,PBS冲洗3次。加入含10%羊血清的5%BSA 2 mL作为封闭液室温封闭1 h,移除培养皿内封闭液后分别加入MMP-3抗体(与封闭液体积比1∶100)或ADAMTS4抗体(与封闭液体积比1∶150)0.8 mL作为第一抗体,4℃过夜孵育, PBS漂洗4次后加入5 μg/mL山羊抗兔IgG(H+L)1.5 mL配合荧光染料作为第二抗体,37℃避光孵育1 h,PBS漂洗4次,加入1 mg/mL的DAPI 1 mL,室温避光孵育5 min,PBS漂洗5次后加入PBS 500 μL,分别于激光扫描共聚焦显微镜下观察拍照。
1.6 qPCR检测软骨细胞miRNA-140表达
将软骨细胞4 × 104/mL接种于六孔板,分组干预8 h后PBS漂洗3次,加600 μL裂解/结合缓冲液(lysis/binding buffer),反复吹打后转移至1.5 mL离心(EP)管,加入60 μL miRNA匀浆液添加剂(microRNA homogenate additive),混匀。加入苯酚-氯仿(体积比5∶1)溶液600 μL,混匀。室温下以1 000 rpm离心5 min,将上层水相移入新EP管,加入上层水相体积1/3的100%乙醇,混匀。转移至带有滤筒的1.5 mL EP管,以10 000 rpm离心15 s,滤液中加入500 μL洗涤液(wash solution),混匀。转移至带有滤筒的1.5 mL EP管,室温下以10 000 rpm离心15 s。弃滤液,滤膜中央加50 μL洗涤液洗脱,检测miRNA浓度。将提取的miRNA进行逆转录,逆转录产物按荧光定量试剂盒说明进行qPCR检测。
1.7 统计方法
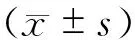
2 结果
2.1 各组软骨细胞MMP-3和ADAMTS4表达
在激光扫描共聚焦显微镜下,MMP-3、ADAMTS4阳性可见绿色荧光。激光扫描共聚焦显微镜下观察干预后各组软骨细胞MMP-3可见,空白组微量绿色荧光,模型组绿色荧光亮度明显较强,透骨消痛胶囊组绿色荧光亮度稍低(图2a~c)。激光扫描共聚焦显微镜下观察干预后各组软骨细胞ADAMTS4,各组软骨细胞均可见绿色荧光,其中模型组绿色荧光亮度最强,空白组、透骨消痛胶囊组绿色荧光亮度稍低(图2d~f)。Image J分析各组平均光密度,结果显示模型组MMP-3表达高于空白组(P<0.05)且ADAMTS4表达明显高于空白组(P<0.01);透骨消痛胶囊组MMP-3表达低于模型组(P<0.05)且ADAMTS4表达明显低于模型组(P<0.01)(图2g、h)。
2.2 各组软骨细胞miRNA-140表达
模型组软骨细胞miRNA-140表达量低于空白组(P<0.05);透骨消痛胶囊组软骨细胞miRNA-140表达量高于模型组(P<0.05);空白组与透骨消痛胶囊组软骨细胞miRNA表达量之间未见明显差异(图3)。
3 讨论
炎症介导的软骨稳态失衡导致的软骨退变是OA主要病理改变[7-8]。OA时,IL-1β可促进一氧化氮(NO)、MMP、ADAMTS等炎性因子产生,加速软骨基质降解,导致关节软骨破坏[9]。因此,本研究采用LPS诱导软骨细胞分泌IL-1β建立体外炎症软骨细胞模型,预实验结果显示,使用10 ng/mL LPS诱导8 h后软骨细胞可大量分泌IL-1β。
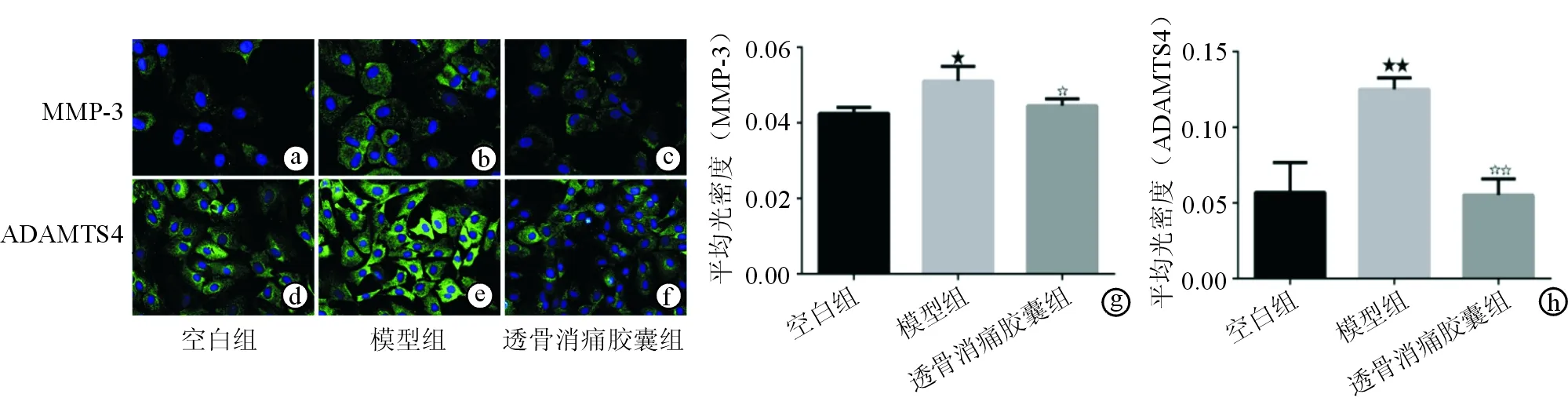
图2 各组软骨细胞MMP-3、ADAMTS4表达情况(×200) a.空白组软骨细胞MMP-3表达情况 b. 模型组软骨细胞MMP-3表达情况 c. 透骨消痛胶囊组软骨细胞MMP-3表达情况 d. 空白组软骨细胞ADAMTS4表达情况 e. 模型组软骨细胞ADAMTS4表达情况 f. 透骨消痛胶囊组软骨细胞ADAMTS4表达情况 g. 各组软骨细胞MMP-3平均光密度统计分析 h. 各组软骨细胞ADAMTS4平均光密度统计分析
注:★表示与空白组相比,P<0.05;☆表示与模型组相比,P<0.05;★★表示与空白组相比,P<0.01;☆☆表示与模型组相比,P<0.01

图3 各组软骨细胞miRNA-140表达情况
注:★表示与空白组相比,P<0.05;☆表示与模型组相比,P<0.05
MMP-3属于MMP家族一员,具有降解多种胶原(包括Ⅱ型、Ⅹ型胶原等)及蛋白多糖的作用,同时还能促使其他MMP产生。关节软骨中MMP-3表达明显升高,可加快软骨退变病理进程[10]。ADAMTS4具有降解聚蛋白多糖的作用[11],在OA患者中表达量明显升高[12]。本研究结果显示,透骨消痛胶囊能降低LPS诱导的软骨细胞MMP-3、ADAMTS4表达,提示其具有降低炎性因子表达、抑制软骨基质降解、保护关节软骨的作用。
miRNA-140特异性表达于软骨组织中,在维持软骨稳态、调控软骨分化及维持软骨细胞功能等方面具有重要作用[13],OA患者miRNA-140表达明显降低。miRNA-140高表达可显著抑制IL-1β产生,同时IL-1β可抑制miRNA-140的表达[14],这与本研究结果一致。研究[15]发现,miRNA-140对于ADAMTS5、MMP-13有负反馈调节作用,可通过该作用维持关节软骨稳态。炎性因子与miRNA-140之间存在互相调节的作用,但其机制还有待于进一步研究。本研究结果显示,透骨消痛胶囊可升高LPS干预建立的炎症软骨细胞模型miRNA-140表达量。
综上,透骨消痛胶囊能促进miRNA-140表达,减少ADAMTS4、MMP-3分泌,抑制炎症反应介导的软骨基质降解,从而延缓OA软骨退变。
[ 1 ] 李西海,梁文娜,叶蕻芝,等. 细胞自噬与骨关节炎软骨退变[J]. 国际骨科学杂志, 2013, 34(2):107-108.
[ 2 ] Kroman SL, Roos EM, Bennell KL, et al. Measurement properties of performance-based outcome measures to assess physical function in young and middle-aged people known to be at high risk of hip and/or knee osteoarthritis: a systematic review[J]. Osteoarthritis Cartilage, 2014, 22(1):26-39.
[ 3 ] Tsezou A. Osteoarthritis year in review 2014: genetics and genomics[J]. Osteoarthritis Cartilage, 2014, 22(12):2017-2024.
[ 4 ] Li X, Liu F, Liang W, et al. Tougu Xiaotong capsule promotes chondrocyte autophagy by regulating the Atg12/LC3 conjugation systems[J]. Int J Mol Med, 2014, 34(2):545-552.
[ 5 ] Chen J, Liu G, Weng X, et al. Tougu Xiaotong formula induces chondrogenic differentiation in association with transforming growth factor-beta1 and promotes proliferation in bone marrow stromal cells[J]. Int J Mol Med, 2015, 35(3):747-754.
[ 6 ] Liao N, Huang Y, Ye J, et al. Protective effects of Tougu Xiaotong capsule on tumor necrosis factor-alpha-injured UMR-106 cells[J]. Exp Ther Med, 2015, 10(5):1908-1914.
[ 7 ] Greene MA, Loeser RF. Aging-related inflammation in osteoarthritis[J]. Osteoarthritis Cartilage, 2015, 23(11):1966-1971.
[ 8 ] Martin-Millan M, Castaneda S. Estrogens, osteoarthritis and inflammation[J]. Joint Bone Spine, 2013, 80(4):368-373.
[ 9 ] Mobasheri A, Kalamegam G, Musumeci G, et al. Chondrocyte and mesenchymal stem cell-based therapies for cartilage repair in osteoarthritis and related orthopaedic conditions[J]. Maturitas, 2014, 78(3):188-198.
[10] Shibakawa A, Yudoh K, Masuko-Hongo K, et al. The role of subchondral bone resorption pits in osteoarthritis: MMP production by cells derived from bone marrow[J]. Osteoarthritis Cartilage, 2005, 13(8):679-687.
[11] Verma P, Dalal K. ADAMTS-4 and ADAMTS-5: key enzymes in osteoarthritis[J]. J Cell Biochem, 2011, 112(12):3507-3514.
[12] Peng S, Zheng Q, Zhang X, et al. Detection of ADAMTS-4 activity using a fluorogenic peptide-conjugated Au nanoparticle probe in human knee synovial fluid[J]. ACS Appl Mater Interfaces, 2013, 5(13):6089-6096.
[13] Papaioannou G, Inloes JB, Nakamura Y, et al. let-7 and miR-140 microRNAs coordinately regulate skeletal development[J]. Proc Natl Acad Sci USA, 2013, 110(35):E3291-E3300.
[14] Miyaki S, Sato T, Inoue A, et al. MicroRNA-140 plays dual roles in both cartilage development and homeostasis[J]. Genes Dev, 2010, 24(11):1173-1185.
[15] Liang ZJ, Zhuang H, Wang GX, et al. MiRNA-140 is a negative feedback regulator of MMP-13 in IL-1beta-stimulated human articular chondrocyte C28/I2 cells[J]. Inflamm Res, 2012, 61(5):503-509.
(收稿:2016-07-30;修回:2016-09-05)
(本文编辑:李圆圆)
·敬告读者·

近期有不法分子仿制冒充本刊网站,诱骗作者在虚假网站上进行投稿,然后骗取钱财。为此,本刊特声明如下:1.本刊官方网站为:http://gjgkx.paperopen.com,其他地址的网站均为虚假钓鱼网站,请读者、作者仔细甄别!2.本刊唯一官方投稿邮箱为intjorthop@163.com。3.本刊版面费均需要通过邮局汇款,从未要求作者往银行账户直接打款。《国际骨科学杂志》编辑部
Mechanism of Tougu Xiaotong capsule inhibits lipopolysaccharide-induced inflammation in chondrocytes
SHAO Xiang1, CHEN Hou-huang1, CHEN Da1, MA Yu-huan2, ZHENG Wen-wei2, YE Hong-zhi3, LI Xi-hai1.
LIXi-haiE-mail:lixihai79dahai@163.com
Objective To explore the mechanism of Tougu Xiaotong capsule (TXC) inhibiting lipopolysaccharide (LPS)-stimulated inflammation in chondrocytes. Methods The chondrocytes harvested from the knee joints of 4-week-old SD rats were cultured in vitro and divided into 3 groups: the sham group, model group and TXC group. The sham group was cultured in 2 mL low-glucose Dulbecco Modified Eagle Medium (DMEM/LOW) containing 10% fetal bovine serum (FBS); the model group was cultured in 2 mL DMEM/LOW containing 10% FBS and 10 ng/mL LPS; the TXC group was cultured in 2 mL DMEM/LOW containing 10% FBS, 10 ng/mL LPS and 300 μg/mL TXC. After chondrocytes being treated for 8 h, the microRNA (miRNA)-140 expression was detected by quantitative real-time polymerase chain reaction (qPCR), and the expressions of a disintegrin and metalloproteinase with thrombospondin motifs (ADAMTS)4 and matrix metalloproteinase (MMP)-3 were observed by immunofluorescence staining, the average optical density of each group was analyzed by Image J. Results Compared with the sham group, the expression of MMP-3 (P<0.05) and ADAMTS4 (P<0.01) in the model group were significantly increased. Compared with the model group, the expression of MMP-3 (P<0.05)and ADAMTS4 (P<0.01) in the TXC group were significantly decreased. The expression of miRNA-140 in the model group was lower than that in the control group (P<0.01) and the TXC group (P<0.01). Conclusion TXC may delay the cartilage degeneration in osteoarthritis (OA) by promoting the expression of miRNA-140 to reduce the secretion of inflammatory cytokines such as ADAMTS4 and MMP-3 and thus inhibit the inflammation-mediated cartilage matrix degradation.
Chondrocyte; microRNA-140; Osteoarthritis; Matrix metalloproteinase-3; Inflammation
国家自然科学基金面上项目(81573998)、福建省自然科学基金(2016J01395) 、福建省中青年教师教育科研项目(科技A类)优秀人才(JA14150)
350122, 福建中医药大学中西医结合研究院(邵翔、陈后煌、陈达、李西海); 350122, 福建中医药大学药学院(马玉环、郑文伟); 350122, 福建省中西医结合老年性疾病重点实验室(叶蕻芝)
李西海 E-mail: lixihai79dahai@163.com
10.3969/j.issn.1673-7083.2016.06.014
