AM真菌、水分和施磷水平对丹参生长及品质的影响
2016-12-15齐俊香杨晓宇王紫月杜天舒李建恒
齐俊香,杨晓宇,王紫月,杜天舒,李建恒
(河北大学 药学院,河北 保定 071002)
AM真菌、水分和施磷水平对丹参生长及品质的影响
齐俊香,杨晓宇,王紫月,杜天舒,李建恒
(河北大学 药学院,河北 保定 071002)
利用盆栽实验考察不同水分和施磷水平下接种AM真菌对丹参幼苗生长及品质的影响.通过测定丹参生长量、全氮、全磷、丹参酮ⅡA和丹参多糖的含量来研究丹参幼苗的生长及品质.结果发现,相同水分及施磷水平下,接菌株的株高、根长、根冠比、全氮、全磷、丹参酮ⅡA和丹参多糖的含量显著高于未接菌株.相同水分不同施磷水平下,随施磷量的增加,丹参株高、根长、根冠比、全氮、全磷、丹参酮ⅡA和丹参多糖的含量均先升高后下降,在第二施磷水平(P2)为0.15 g/kg时达到最大,全氮和全磷质量分数最大分别为1.842%和0.354%.不同水分相同施磷水平下,接种株丹参酮ⅡA和丹参多糖的含量显著高于未接菌株,70%田间持水量下丹参酮ⅡA和丹参多糖含量较高.70%田间持水量及施磷质量分数为0.15 g/kg时接种株的丹参酮ⅡA和丹参多糖质量分数最大,分别为0.252%和6.166%,较对照组分别提高0.016%和1.516%.
AM真菌;丹参;磷;丹参酮ⅡA;多糖
丹参(SalviamiltiorrhizaBge.)又名紫丹参,属多年生草本植物,中药丹参在中国应用历史悠久,其根与根茎是主要用药部位,传统中医药记载丹参的药理作用甚广,具有活血祛瘀、通经止痛、清心除烦等作用[1-2],常被用于治疗月经不调、闭经及冠心病等症状.丹参主要药用成分包括脂溶性化合物(如丹参酮ⅡA)和水溶性化合物(如丹酚酸B),此外,还含有多糖与甾醇等活性成分[3].丹参在预防及治疗某些常见病、慢性病中有着不可替代的作用,临床需求量越来越大.目前,由于人工种植过程中种植资源退化严重,抗病性差,导致丹参品质参差不齐,使得丹参的产量和品质下降[4].因此,考察不同种植条件与丹参品质间的相关性,有利于选择丹参合理栽培条件,为菌根生物技术提高丹参产量与品质方面提供理论参考.
丛枝菌根(arbuscular mycorrhiza,简称AM)真菌是自然界分布最为广泛的一种土壤有益微生物,它能与大部分的陆生植物形成良好共生关系.植物根系被AM真菌包围,在土壤中产生巨大的菌丝网络,增大了植物根系与土壤水分、养分的接触面积,有利于植物根系对水分和矿质元素的吸收,特别是对移动性较差的磷的吸收.AM真菌能明显提高植株抗旱性、抗病性、抗逆能力,提高植株产量和品质等作用[5-6],促进植物有效成分的积累等[7],但土壤养分会直接影响AM真菌对植物的侵染效果[8].
磷是所有植物生长的必需营养元素,是细胞核、细胞质、核甘酸和酶的组成成分[9].由于土壤中的磷多以有机态存在而无法被植物直接利用,AM真菌侵染植物后,能够增强植物根系产生的酸性或碱性磷酸酶的活性,同时AM真菌自身也能分泌酸性或碱性磷酸酶,进而活化土壤有机磷来改善植物对磷的吸收[10-11].Singh[7]等研究证明了接种AM真菌能改善茶叶品质,增强茶叶对养分的吸收,提高了茶苗叶中的糖、咖啡因和总多酚等物质的含量.贺学礼等[12]研究证明不同水肥条件下接种AM真菌能促进丹参根系对水分和矿质元素的吸收和利用.本实验考察不同水分和施磷水平下接种AM真菌对丹参生长、全氮、全磷含量及药用成分的影响,为实现中药现代化种植及提高中药临床疗效提供理论依据.
1 材料与方法
1.1 仪器与试剂
P3000高效液相色谱仪(北京创新通恒科技有限公司);紫外-可见分光光度计(北京普析通用仪器有限责任公司).
葡萄糖、体积分数95%乙醇、苯酚、浓硫酸、氯仿、正丁醇、过氧化氢、氢氧化钠、磷酸二氢钾、钼酸铵、偏钒酸铵、硼酸、甲基红、溴甲酚绿、2,4-二硝基酚、盐酸、甲醇、丹参酮ⅡA标准品.
1.2 实验材料
丹参(SalviamiltiorrhizaBge.)种子于2014年4月购自河北安国药材市场;AM真菌优势菌种(双网无梗囊霉)经三叶草扩繁,含孢子、菌丝以及侵染根段的根际土作为菌剂,每10 g菌剂含有60个孢子.
所用土壤取自保定农田,采集深度约为20 cm;过2 mm筛后按土沙质量比2∶1混匀;实验所用花盆规格为21.5 cm×16 cm×20.5 cm,施加肥料分别为CO(NH2)2、NaH2PO4和K2SO4;最大田间持水量为21%.
1.3 实验设计
实验分为土壤持水量、接种AM真菌和施磷量共3个因素.土壤水分设2个水平,35%的田间持水量(WHC)和70%的WHC;相同水分下施磷量设3个水平,分别为0.07、0.15和0.23 g/kg,分别用P1、P2和P3表示,相同水分及相同施磷条件下设接菌和未接菌(CK)2种处理,共12组,每组重复4次,共48盆.
2014年4月10日播种.每盆装约3 kg土(非灭菌),每盆加0.963 g CO(NH2)2和1.005 g K2SO4.接菌组的每个处理加入40 g菌剂,分2层施加,未接菌组加入等量的灭菌菌剂.出苗约2周后定苗,每盆3棵,待其生长2个月,2014年7月5日对植株开始进行水分处理,通过称重法控制土壤持水量.实验期间对丹参进行日常管理,2014年9月5日收获.
1.4 测定方法
土壤pH测定用pH计,碱解N测定用碱解扩散法,速效P测定用NaHCO3浸提-钼锑抗比色法,有机质测定用重铬酸钾容量法,速效K测定用比浊法[13].待幼苗收获后,用卷尺测量丹参的株高、主根长.全N含量用凯氏定氮法,全P含量用钒钼黄比色法测定[14].收获后,将根部于105 ℃条件下烘15 min杀青,在75 ℃条件下烘干至恒重,粉碎过筛后,丹参酮ⅡA含量用高效液相色谱法测定[1],利用4因素3水平正交实验优化丹参多糖提取条件,并进行方差分析和直观分析,丹参多糖含量测定用苯酚-硫酸法[15].每个处理重复4次.
2 结果与分析
2.1 土壤因子测定结果
土壤pH为8.18,有机质为13.94 g/kg,碱解氮为62.47 mg/kg,速效磷为18.56 mg/kg,速效钾为105.285 mg/kg.与相关文献对照,符合丹参的生长条件.
2.2 水分和施磷水平对丹参生长量的影响
由表1可知,P1~P2水平下,接菌株株高、根长和根冠比(35%根长除外)显著高于未接菌株;在P3水平及35% WHC时,接菌株株高低于未接菌株,但差异不显著(P>0.05);接菌株根长高于未接菌株,但差异不显著(P>0.05);接菌株根冠比显著高于未接菌株.在P3水平及70% WHC时,AM真菌显著降低丹参株高、根长和根冠比,这表明土壤水分和施磷量均会影响AM真菌的侵染效果.
相同水分及不同施磷水平下,各处理丹参的株高、根长和根冠比均随着施磷水平的增加先升高后降低,在P2时含量最大,且P2显著高于P1和P3,接菌株大于未接菌株(70% P3除外).除35% WHC中未接菌株根冠比、根长和未接菌株株高的P1与P3水平之间差异不显著以外,其他各施磷水平间均差异显著(P<0.05).表明施磷量过低或过高均不利于丹参正常生长.
不同水分及相同施磷水平下,与35% WHC相比,70% WHC下丹参株高、根长与根冠比显著提高.说明水分胁迫会阻碍丹参的根系发育,AM真菌能降低水分胁迫对丹参生长的阻碍作用.
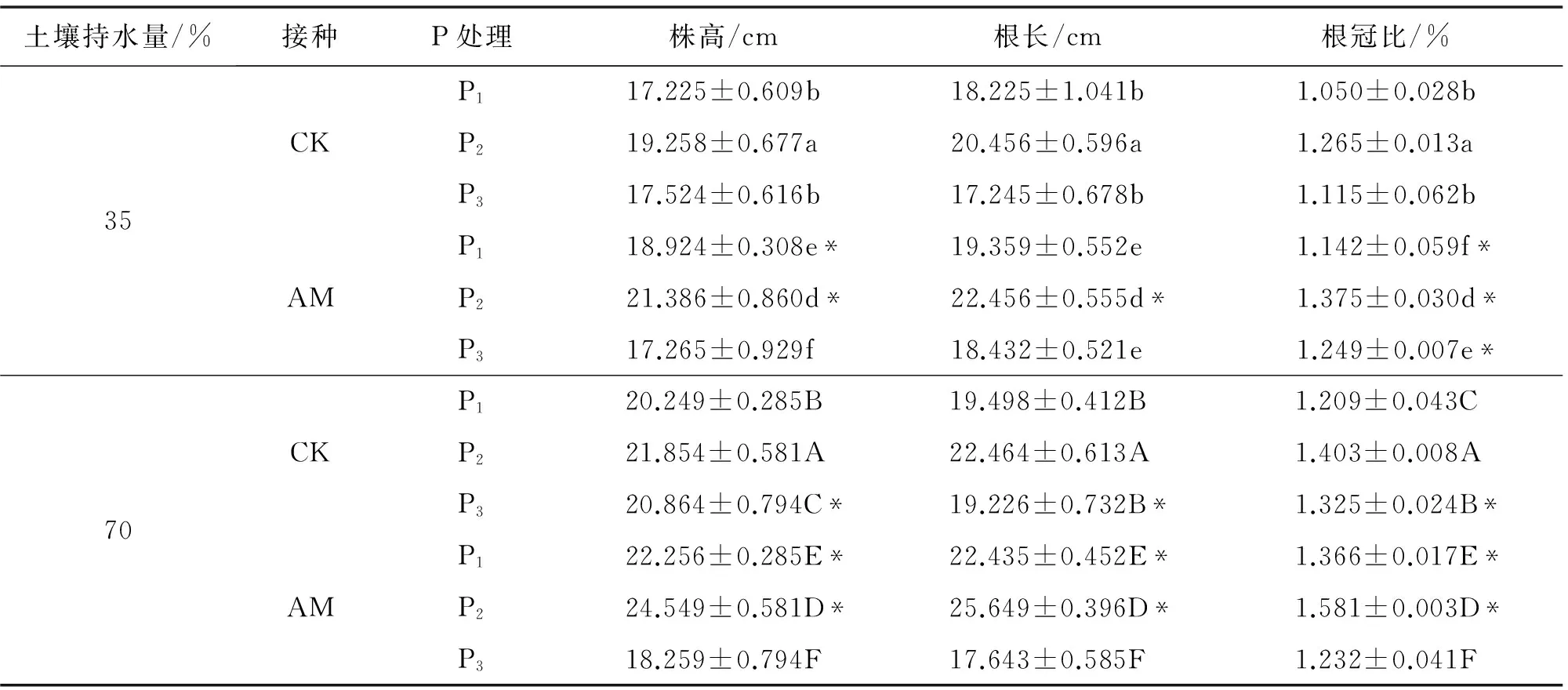
表1 AM真菌、水分及施磷水平对丹参生长的影响
数据为“平均值±标准差”;* 表示同一水分和磷水平下接菌株与未接菌株差异显著;不同大写字母表示在70%水分下不同处理在5%水平下差异显著;不同小写字母表示在35%水分下不同处理在5%水平下差异显著;显著性差异均在5%水平下分析比较.其他表同此.
2.3 水分和施磷水平对丹参全氮及全磷含量的影响
由表2可知,P1~P2下,与未接菌株相比,接种AM真菌显著提高了植株全氮和全磷质量分数;在P3水平下,丹参全氮质量分数在35% WHC时接菌株处理低于未接菌株,而在70% WHC时丹参全磷质量分数接菌株显著低于未接菌株;相同水分及不同施磷水平下,全氮、全磷质量分数均随着施磷水平的增大先升高后降低,在P2时质量分数最大,说明磷能促进丹参对矿质元素及养分的吸收和运输,但磷的浓度过高会影响丹参对矿质元素的吸收.
不同水分及相同施磷水平下,与35% WHC相比,70% WHC下植株的全氮和全磷的质量分数显著提高.表明水分胁迫会抑制丹参的根系吸收矿质元素,70%水分更有利于丹参吸收矿质元素.
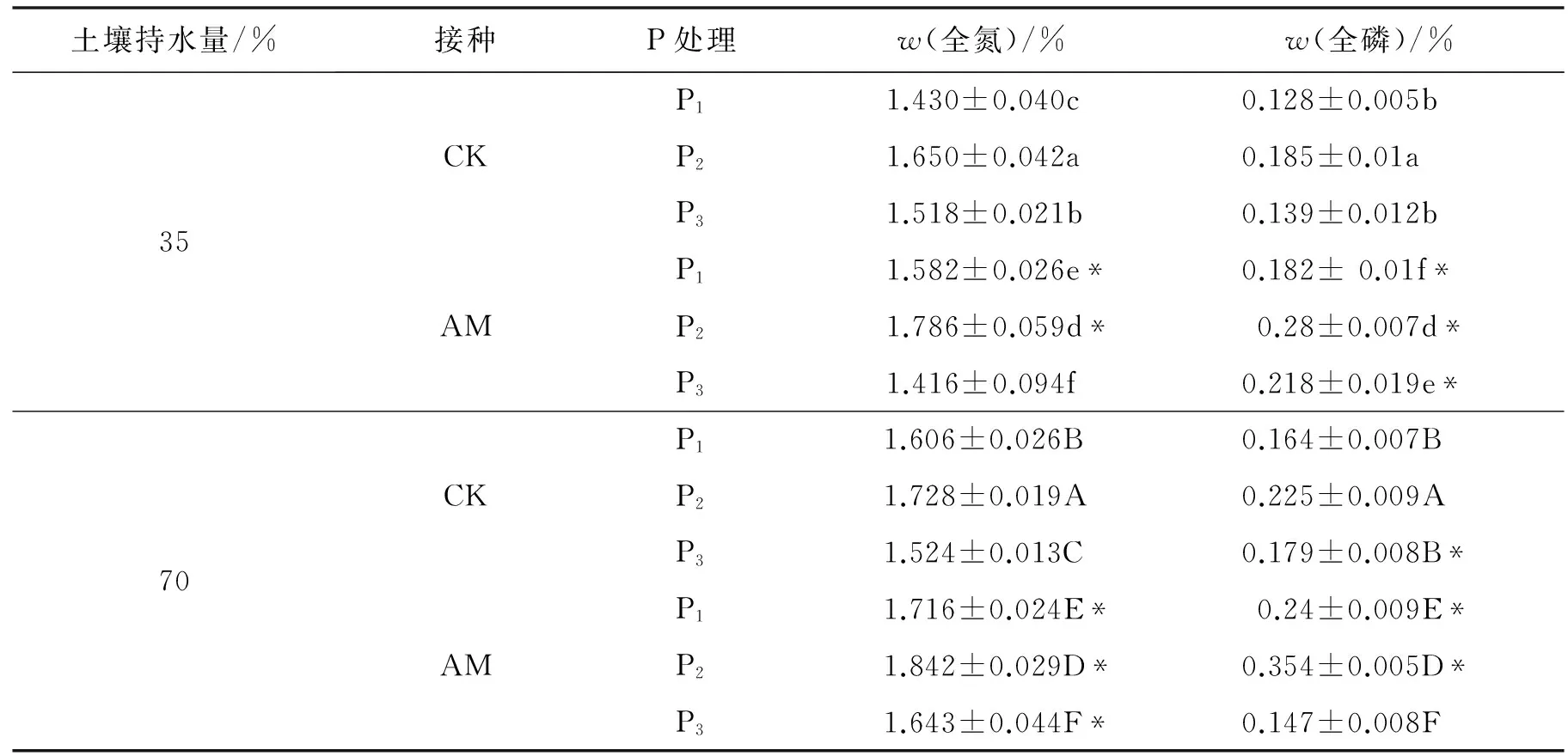
表2 AM真菌、水分及施磷水平对丹参全氮和全磷质量分数的影响
2.4 水分和施磷水平对丹参酮ⅡA含量的影响
由表3可知,同一水分及施磷水平下,与未接种株相比,接种株丹参酮ⅡA的质量分数均高于未接菌株(35%P3除外),且在P2及70% P1时差异显著(P<0.05).同一水分及不同施磷水平下,丹参酮ⅡA的质量分数均随施磷水平的增加先升高后降低,P2时质量分数最大,且显著高于P1和P3.不同水分及相同施磷水平下,70% WHC下丹参酮ⅡA质量分数较高,说明水分胁迫影响丹参酮ⅡA累积.分析70% WHC、P2水平下接菌株样品的高效液相色谱图(图1,2),得到丹参酮ⅡA质量分数最大为0.252%,符合中国药典的规定(大于0.2%).
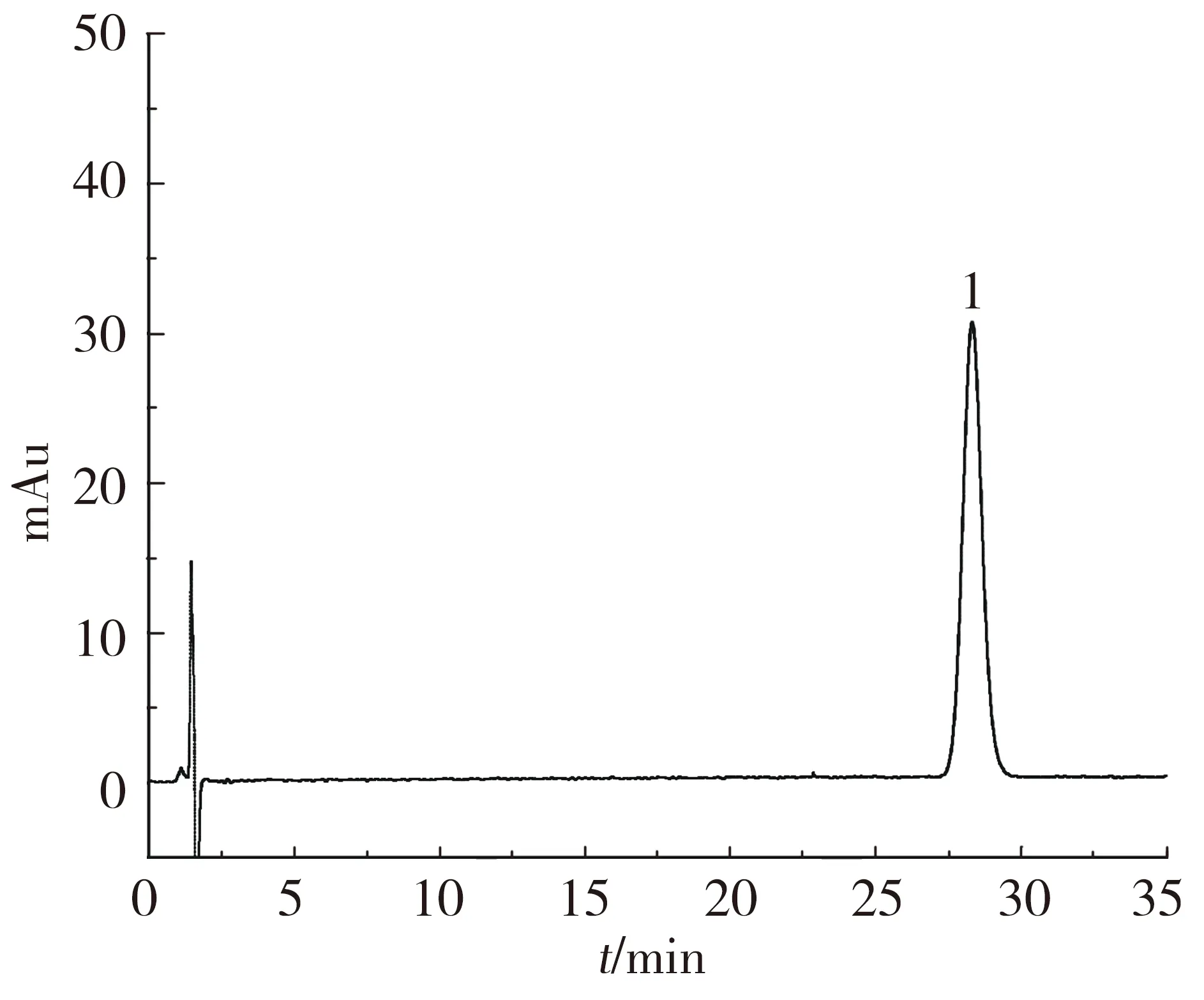
图1 丹参酮ⅡA标准品溶液色谱Fig.1 Tanshinone ⅡA HPLC of standard
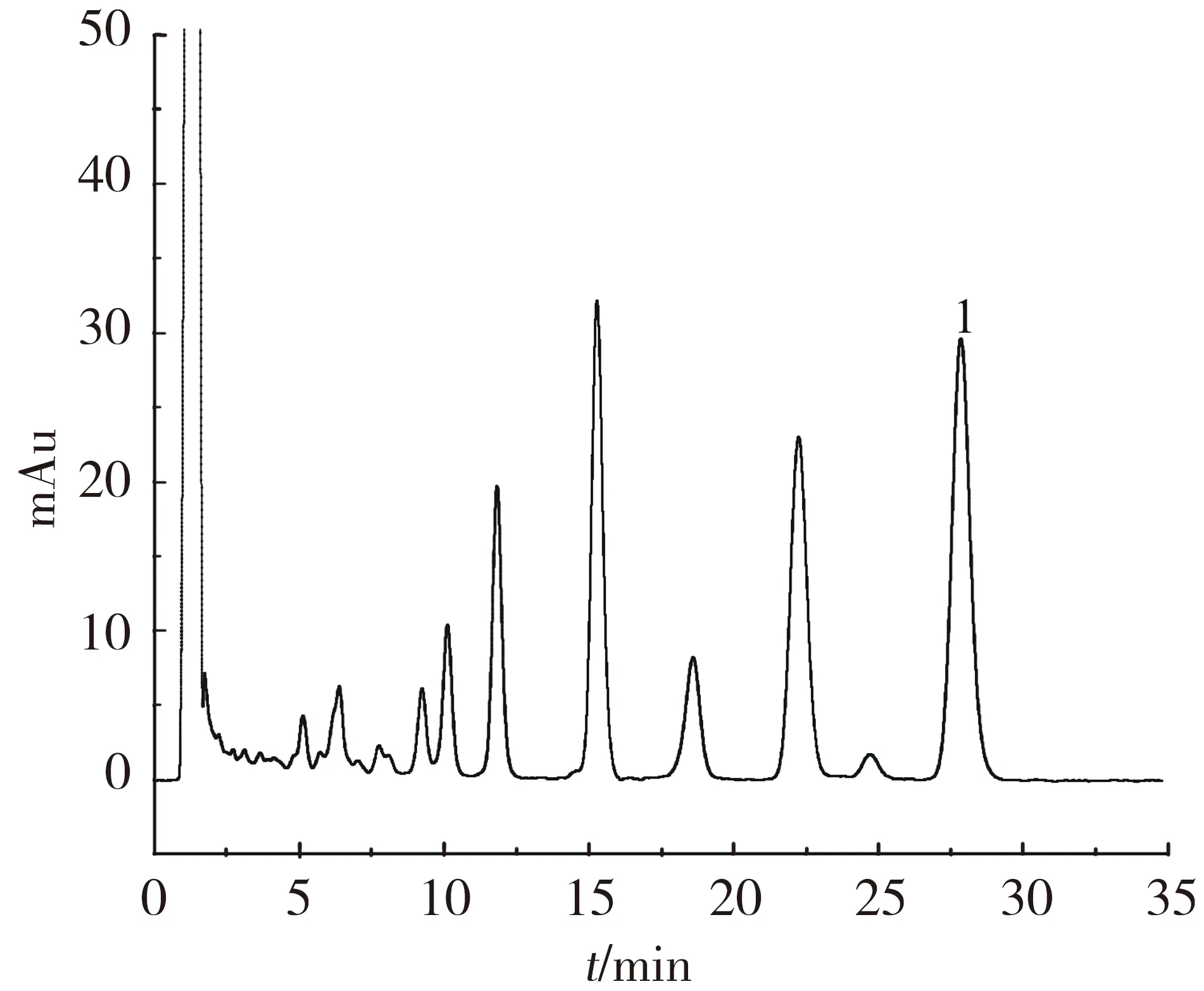
图2 丹参酮ⅡA样品溶液的色谱Fig.2 Tanshinone ⅡA HPLC of sample

土壤持水量/%接种P处理w(丹参酮ⅡA)/%土壤持水量/%接种P处理w(丹参酮ⅡA)/%35P10.224±0.014dAMP20.234±0.002d*P30.158±0.005eP10.213±0.004bCKP20.221±0.004aP30.196±0.004c*70P10.23±0.003E*AMP20.252±0.004D*P30.214±0.005FP10.219±0.003BCKP20.236±0.008AP30.208±0.003C
2.5 水分和施磷水平对丹参多糖含量的影响
本实验研究了温度、时间、料液比、醇浓度4个因素对提取丹参多糖的影响,每个因素设3个水平,利用4因素3水平正交实验设计优化丹参多糖的提取.根据表4选择L9(34)正交表做实验,重复2次,结果如表5,并进行直观分析和方差分析(表6).按优化后的提取工艺条件(A2B3C1D2)对不同处理下的接种株和未接种株丹参样品进行提取,结果如表7.
相同水分及施磷水平下,接菌株多糖的质量分数均高于未接菌株,表明AM真菌有利于丹参根部多糖的积累.相同水分及不同施磷水平下,丹参多糖的质量分数均会随着施磷水平的增大先升高再降低,在P2水平时质量分数最高,说明磷水平过高或过低均影响丹参多糖的积累.不同水分及相同磷水平下,与35% WHC相比,70% WHC下的丹参多糖的质量分数显著提高.这与丹参酮ⅡA的变化规律基本一致.在70% WHC下,P2时接菌株根部多糖质量分数最大为6.166%.

表4 实验因素水平表
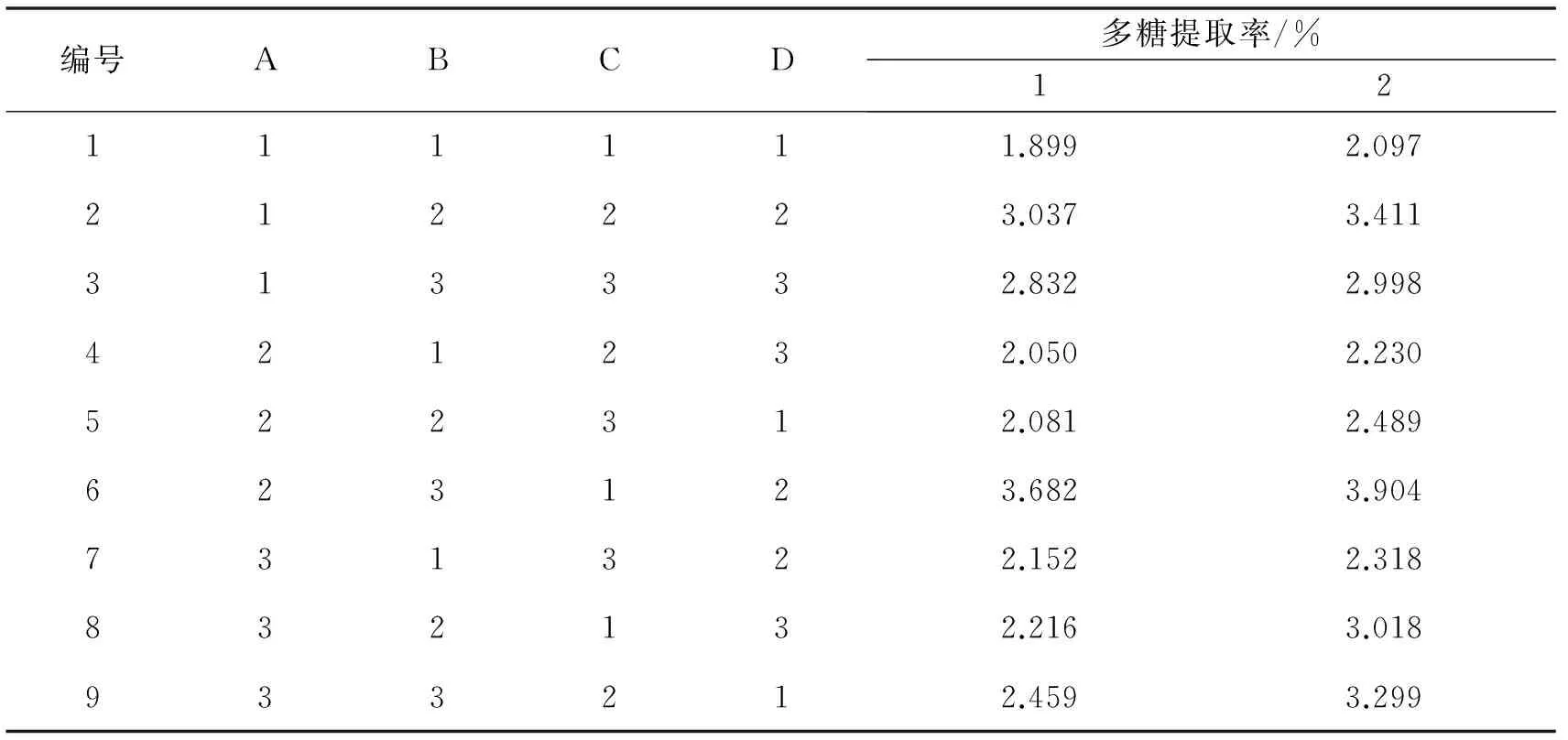
表5 正交实验的安排及结果
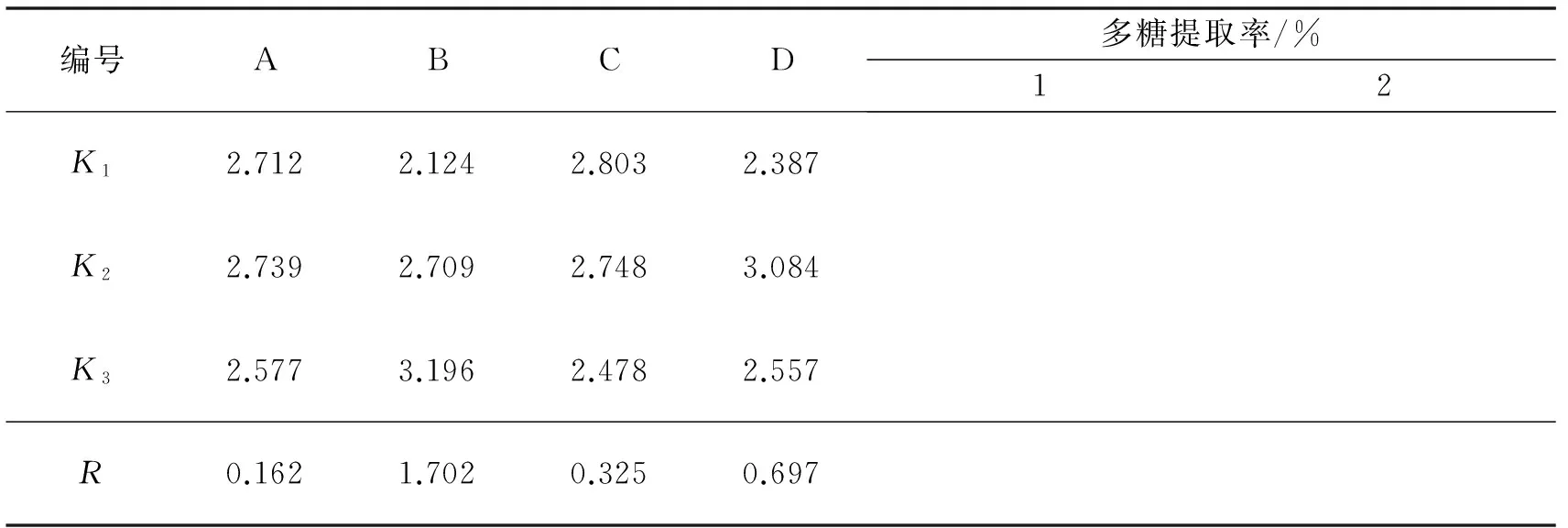
续表5
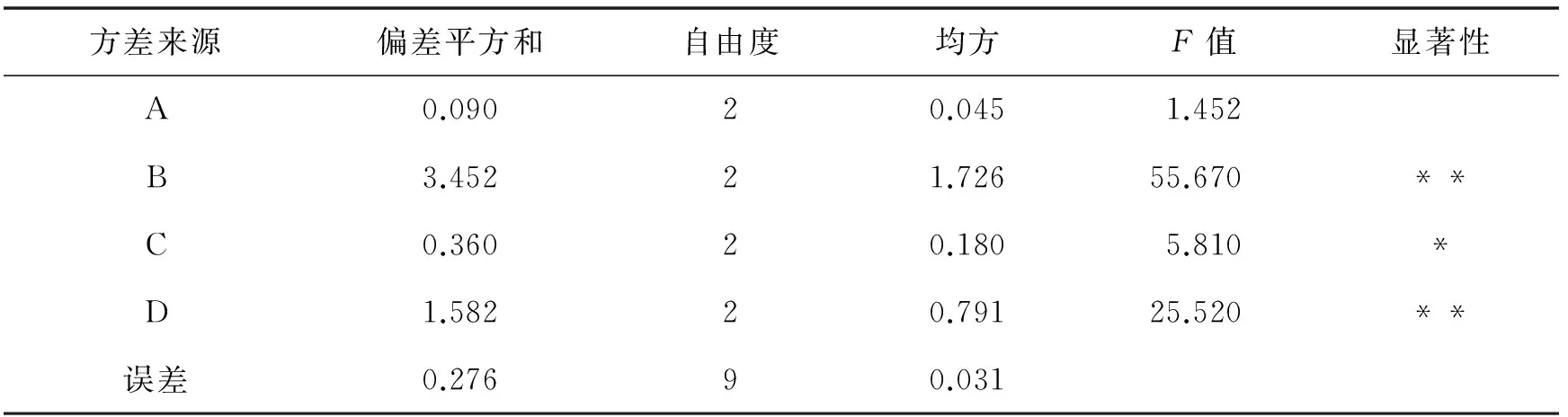
表6 方差分析
F0.01(2,9)=8.02,F0.05(2,9)=4.26,* 表示显著,** 表示极显著.
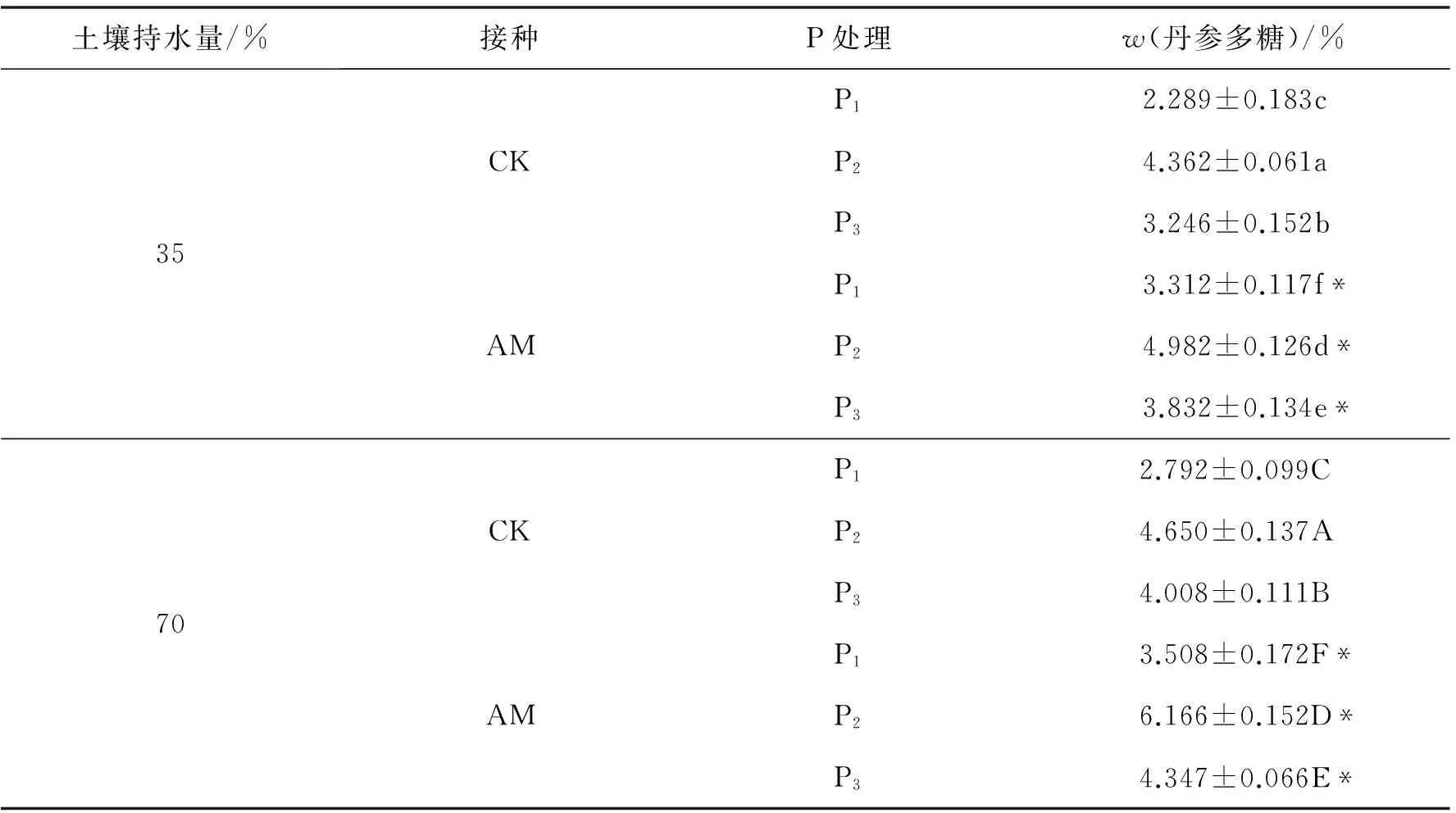
表7 不同水分和施磷水平下接种AM真菌对丹参多糖的影响
3 讨论
实验结果表明,AM真菌能很好地侵染丹参根系,接种AM真菌能促进丹参对N、P等矿质元素的吸收和药用成分的积累.Janos[16]等研究了接种AM真菌可以明显促进荔枝对养分的吸收和促进幼苗生长.贺学礼[17]等研究表明,AM真菌提高了黄芩生长量,促进对N、P、K元素的吸收和黄芩苷含量的积累.本实验中,与未接种株相比,接种AM真菌显著提高丹参生长量,也促进丹参对N、P元素的吸收及丹参酮ⅡA和多糖的累积.这可能是AM真菌与丹参形成共生体后,植物根系被AM真菌包围,在土壤中产生巨大的菌丝网络,增大了植物根系与土壤中水分和养分的接触面积,有利于根系吸收所需土壤水分和矿质元素,改善丹参体内营养状况,从而有利于丹参健康生长.
丹参酮ⅡA和丹参多糖均为丹参的药用成分.其含量的高低是衡量丹参药材品质的主要标准.本实验中,在70% WHC,施磷量为P2时接菌株丹参酮ⅡA和丹参多糖含量最高,丹参酮ⅡA和丹参多糖质量分数分别为0.252%和6.166%.本实验中,土壤氮磷质量比为0.149∶0.15,这与韩建萍[18]等认为的当氮肥与磷肥的质量比为1∶1时有利于丹参酮ⅡA累积结果基本一致.高磷或低磷均会影响丹参根系发育以及丹参对矿质元素的吸收,这可能是磷水平过低或过高会影响AM真菌与丹参的共生关系[8],磷水平过低不足以使丹参正常生长,也不能充分提供AM菌生长需要的磷营养,使菌根生长受限制;磷水平过高降低丹参根细胞膜通透性,抑制AM真菌生长发育[19],进而影响丹参吸收N、P及其他矿质元素,而这些元素可能影响丹参生长及丹参酮ⅡA和丹参多糖的含量.本实验中,与35% WHC相比,以70% WHC下,丹参各部分生长量、全氮、全磷含量以及丹参酮ⅡA和丹参多糖含量较高,这也许是水分胁迫降低AM真菌对丹参根系的侵染进而影响丹参吸收磷及其他养分[12],而这些养分可能会影响丹参生长及丹参酮ⅡA和丹参多糖的合成;也可能是土壤水分直接影响丹参吸收矿质元素及丹参酮ⅡA和丹参多糖的积累[20].
结果表明,AM真菌、土壤水分及施磷水平在丹参的生长量的增加、矿质元素的吸收以及药用成分的累积方面有积极作用,改善丹参品质,这将对实现中药现代化种植具有重要意义.
[1] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010: 70.
[2] 张湘东,许定舟,李金华,等.丹参多糖的免疫调节活性研究[J].中药材,2012,35(6):949-952.DOI:10.13863/j.issn1001-4454.2012.06.032. ZHANG X D,XU D Z,LI J H,et al.Study on the immunocompetence of polysaccharide extracted from root ofSalviamiltiorrhiza[J].Journal of Chinese Medicinal Materials,2012,35(6):949-952.DOI:10.13863/j.issn1001-4454.2012.06.032.
[3] 吴巧攀,乔洪翔,何厚洪,等.银杏叶渣中多糖的提取及其抗氧化活性研究[J].中国现代应用药学,2014,31(1): 9-13.DOI:10.13748/j.cnki.issn1007-7693.2014.01.012. WU Q P,QIAO H X,HE H H,et al.Extraction of polysaccharides from residue ofGinkgobilobaleaves and study on its anti-oxidant activity[J].Chinese Journal of Modern Applied Pharmacy,2014,31(1):9-13.DOI:10.13748/j.cnki.issn1007-7693.2014.01.012.
[4] 郭宝林,冯毓秀,赵杨景.丹参种质资源研究进展[J].中国中药杂志,2002,27(7):492-495. GUO B L,FENG Y X,ZHAO Y J.Review of germplasm resources studies onSalviamiltiorrhiza[J].China Journal of Chinese Materia Medica,2002,27(7):492-495.
[5] DUPRE H,JONER E J,LEYVAL C,et al.Role and influence of mycorrhizal fungi on radiocesium accumulation by plants[J].J Environ Radioact,2008,99(5):785-800.DOI:10.1016/j.jenvrad.2007.10.008.
[6] BENNETT A E,BEVER J D,DEANE B M.Arbuscular mycorrhizal fungal species suppress inducible plant responses and alter defensive strategies following herbivory[J].Oecologia,2009,160:771-779.DOI:10.1007/s00442-009-1338-5.
[7] SINGH S,PANDEY A,KUMAR B,et al.Enhancement in growth and quality parameters of tea [Camelliasinensis(L.) O.Kuntze]through inoculation with arbuscular mycorrhizal fungi in an acid soil[J].Biol Ferti Soils,2010,46(5): 427-433.DOI:10.1007/s00374-010-0448-x.
[8] 冯海燕,冯固,王敬国,等.植物磷营养状况对丛枝菌根真菌生长及代谢活性的调控[J].菌物系统,2003,22(4):589-598.DOI:10.13346/j.mycosystema.2003.04.016. FENG H Y,FENG G,WANG J G,et al.Regulation of P statua in host plant on alkaline phosphatase(ALP) activity in intraradical hyphae and development of extraradical hyphae of AM fungi[J].Mycosystema,2003,22(4):589-598.DOI:10.13346/j.mycosystema.2003.04.016.
[9] 滕华容.AM真菌与施磷量对柴胡生长和化学成分交互效应的研究[D].杨凌:西北农林科技大学,2005. TENG H R.Effect of AM fungi on the gowth and chemical composition ofBupleurumchinenseDC.under different phosphor applied amount[D].Yangling:North West Agriculture and Forestry University,2005.
[10] 陈梅梅,陈保冬,王新军,等.不同磷水平土壤接种丛枝菌根真菌对植物生长和养分吸收的影响[J].生态学报,2009,29(4):1980-1986. CHEN M M,CHEN B D,WANG X J,et al.Influences of arbuscularmycorrhizal fungi (AMF) on the growth and ecological stoichiometry of clover and ryegrass grown in monoculture or in m ixture at different phosphorus (P) levels[J].Acta Ecologica Sinica,2009,29(4):1980-1986.
[11] 孙向伟,王晓娟,陈牧,等.生态环境因子对AM真菌孢子形成与分布的作用机制[J].草业学报,2011,20(1):214-221. SUN X W,WANG X J,CHEN M,et al.Effects of eco-environmental factors on the production and distribution of arbuscular mycorrhizal fungal spores[J].Acta Prataculturae Sinica,2011,20(1):214-221.
[12] 贺学礼,马丽,孟静静,等.不同水肥条件下AM真菌对丹参幼苗生长和营养成分的影响[J].生态学报,2012,32(18):5721-5728.DOI: 10.5846/stxb201108181216. HE X L,MA L,MENG J J,et al.Effects of AM fungi on the growth and nutrients ofSalviamiltiorrhizaBge.under different soil water and fertilizer conditions[J].Acta ecologica sinica,2012,32(18): 5721-5728.DOI: 10.5846/stxb201108181216.
[13] WU Q S,HE X H,ZOU Y N,et al.Spatial distribution of glomalin-related soil protein and its relationships with root mycorrhization,soil aggregates,carbohydrates,activity of protease and β-glucosidase in the rhizosphere ofCitrusunshiu[J].Soil Biology and Biochemistry,2012,45:181-183.DOI:10.1016/j.soilbio.2011.10.002.
[14] 高俊凤.植物生理学实验技术[M].西安:世界图书出版公司,2000.
[15] 徐光域,颜军,郭晓强,等.硫酸-苯酚定糖法的改进与初步应用[J].食品科学,2005,26(8):342-346. XU G Y,YAN J,GUO X Q,et al.The betterment and apply of phenol-sulphate acid method[J].Food Science,2005,26(8):342-346.
[16] JANOS D P,SCHROEDER M S,SCHAFFER B,et al.Inoculation with arbuscular mycorrhizal fungi enhances growth ofLitchichinensisSonn.trees after propagation by air-layering[J].Plant and Soil,2001,233(1):85-94.
[17] 贺学礼,马丽,王平,等.AM真菌和施P量对黄芩生长、养分吸收和微量元素的影响[J].中国中药杂志,2011,36(16): 2170-2175. HE X L,MA L,WANG P,et al.Effects of AM fungi on growth and microelement ofScuteliariabaiealensisunder different applied phosphorous levels[J].China Journal of Chinese Materia Medica,2011,36(16):2170-2175.
[18] 韩建萍,梁宗锁.氮、磷对丹参生长及丹参素和丹参酮ⅡA积累规律研究[J].中草药,2005,36(5):756-759. HAN J P,LIANG Z S.Regulation of Salvia miltiorrhizae growth and danshensu and tanshionⅡAaccumulation under nitrogen and phosphorus[J].Chinese Traditional and Herbal Drugs,2005,36(5):756-759.
[19] BRAUNBERGER P G,MILLER M H,PETERSON R L.Effect of phosphorus nutrition on morphological characteristics of vesicular arbuscular mycorrhizal colonization of maize[J].New Phytologist,1991,119:107-113.
[20] 刘大会,郭兰萍,黄璐琦,等.土壤水分含量对丹参幼苗生长及有效成分的影响[J].中国中药杂志,2011,36(3):321-325. LIU D H,GUO L P,HUANG L Q,et al.Effects of soil water content on the seedlings growth and active ingredients ofSalviamiltiorrhizaBge[J].China Journal of Chinese Materia Medica,2011,36(3):321-325.
(责任编辑:赵藏赏)
Effect of AM fungi,moisture,and phosphorus levels on the growth and quality ofSalviamiltiorrhizaBge.
QI Junxiang,YANG Xiaoyu,WANG Ziyue,DU Tianshu,LI Jianheng
(College of Pharmaceutical Sciences,Hebei University,Baoding 071002,China)
Pot experiments were conducted to study the effects of AM fungi on growth and quality ofSalviamiltiorrhizaunder different soil moisture and phosphorus levels.The plant height,root length,root shoot ration,total N,total P,tanshinone ⅡAand polysaccharide were determinated to evaluate the quality ofS.miltiorrhizaseedlings.The results showed that inoculation of AM fungi significantly increased the plant height,root length,root shoot ratio,total N,total P,tanshinone ⅡAand polysaccharide content ofS.miltiorrhizaunder the same soil moisture and phosphorus level.Under the same soil moisture and different phosphorus levels,plant height,root length,root shoot ratio,total N,total P,tanshinone ⅡAand polysaccharide content ofS.miltiorrhizaincreased first and then decreased with increasing phosphorus application rate,and they reached the maximum at second phosporus levels (P2) was 0.15 g/kg.The content of total N,total P respectively was 1.842% and 0.354%.Under different soil moisture and the same phosphorus levels,tanshinone ⅡAand polysaccharide of inoculated plants were significantly higher than non-inoculated plants.The content of tanshinone ⅡAand polysaccharide was higher at 70% WHC.With at 70% WHC and phosphorus application rate of 0.15 g/kg they reached the maximum.The maximum content of tanshinone ⅡAand polysaccharides respectively was 0.252% and 6.166%,which respectively increased 0.016% and 1.516% compared with the control group.
AM fungi;SalviamiltiorrhizaBge.;phosphorus;tanshinone ⅡA;polysaccharides
10.3969/j.issn.1000-1565.2016.05.010
2015-10-25
河北大学科研基金资助项目(3333112)
齐俊香(1992—),女,河北衡水人,河北大学在读硕士研究生,主要从事天然植物有效成分研究. E-mail:714548328@qq.com
李建恒(1964-),男,河北徐水人,河北大学药学院教授,博士,主要从事天然植物有效成分研究. E-mail:lijianheng@hbu.cn
R282.71
A
1000-1565(2016)05-0509-08
