丁苯酞注射液对小鼠的急性毒性和慢性毒性试验研究
2016-12-15田小超何伟亮刘斯文刘素云
田小超,何伟亮,刘斯文,杨 蓉,刘素云*
(1.河北医科大学第二医院心内科,河北 石家庄 050000;2.河北省人民医院神经内科,河北 石家庄 050051;3.河北省医学科学情报研究所查新室,河北 石家庄 050071)
·论 著·
丁苯酞注射液对小鼠的急性毒性和慢性毒性试验研究
田小超1,何伟亮2,刘斯文3,杨 蓉1,刘素云1*
(1.河北医科大学第二医院心内科,河北 石家庄 050000;2.河北省人民医院神经内科,河北 石家庄 050051;3.河北省医学科学情报研究所查新室,河北 石家庄 050071)
目的观察丁苯酞注射液的急性毒性和长期毒性。方法采用Bliss法观察丁苯酞注射液对C57BL/6小鼠的急性毒性;连续30 d尾静脉重复给药,观察其对小鼠的长期毒性,分为丁苯酞注射液低、中、高3个剂量组(分别为40、80、160 mg/kg) 和生理盐水对照组,对一般生理指标、血清丙氨酸转氨酶、血清天冬氨酸转氨酶、血清尿素氮、血清肌酐和组织病理学进行检查。 结果急性毒性试验结果显示丁苯酞注射液对小鼠的半数致死量(LD50)为545.1 mg/kg;连续30 d 尾静脉重复给药的慢性毒性结果显示仅高剂量组天冬氨酸转氨酶升高,其他生化指标、动物摄食量和体质量、脏器系数及组织病理学检查与对照组相比差异均无统计学意义(P>0.05)。结论合理使用丁苯酞注射液不会对靶动物产生不良反应。
毒性试验;丁苯酞注射液;小鼠
丁苯酞(dl-3-n-butylphthalide,NBP)为近几年来我国自主研发的国家Ⅰ类新药[1]。临床上已经被列为急性脑梗死诊治指南的指导用药[2]。但有关NBP的不良反应时有报道,主要表现为肝功能异常、胸闷、皮炎和胃肠道反应等[3-5]。随着NBP引起不良反应报道的日益增多,其安全性问题逐渐引起人们的关注。为探究NBP潜在的安全风险,提高其安全性和质量可控性,本研究应用C57BL/6小鼠对其进行急性毒性试验和长期毒性试验,以观察NBP产生的毒性反应症状和严重程度,旨在为NBP的安全性再评价提供重要的毒理学资料,也为临床安全用药及预防不良反应提供参考。
1 材料与方法
1.1 药品、动物与仪器 丁苯酞注射液(dl-3-n-butyphthalide,NBP,商品名:恩必普)由石药集团恩必普药业提供,批准文号:国药准字H20100041。实验动物: C57BL/6小鼠,SPF级,体质量20~25 g,由北京维通利华实验动物技术有限公司提供,合格证号: SCXX(京) 2006-0009。7020 全自动生化分析仪(日本日立公司)。
1.2 研究方法 按照国家食品药品监督管理局颁布的相关指导原则要求实施[6]。
1.2.1 小鼠经静脉给药急性毒性试验 采用Bliss法,60只小鼠,体质量20~25 g,分为6组,每组10只,单次静脉注射NBP溶液。根据少量小鼠进行预试验结果得到NBP的半数致死量(medial lethal dose,LD50)为630 mg/kg,故正式试验中NBP剂量分别为384.1、429.4、480.1、536.7、600.0、670.8 mg/kg,给药体积按0.02 mL/g,速度<0.5 mL/min,观察给药后小鼠出现中毒的症状和时间、表现程度以及小鼠死亡前的特征和死亡时间,并且对死亡小鼠进行剖检,观察主要脏器的改变。观察期为2周。
1.2.2 长期毒性试验 分别设NBP 低、中、高(40、80、160 mg/kg)3个剂量组和对照(0.9%生理盐水)组, 每组10只小鼠。均为尾静脉注射给药,每天给药1次,连续给药30 d。
1.3 观察指标 ①一般生理指标:记录死亡小鼠数,并及时了解其死亡原因,观察存活小鼠的精神状态、行为活动、粪便性状等状况。每3天测量体质量和摄食量。②检测血清丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转移酶(aspartate aminotransferase,AST):小鼠最后一次给药24 h后,心脏采血,应7020全自动生化分析仪测量血清ALT和AST含量。③检测血清尿素氮(blood urea nitrogen,BUN)、血清肌酐(serum creatinine,SCr):应用7020全自动生化分析仪测量血液中BUN和SCr的变化。④组织病理学检查:小鼠经解剖尸体后称取各脏器质量。一部分心脏、肝脏和肾脏置于10%中性甲醛溶液中固定,常规包埋、切片、苏木精-伊红(HE)染色后于光学显微镜下观察。

2 结 果
2.1 小鼠经静脉给药急性毒性试验 60只小鼠分别以384.1、429.4、480.1、536.7、600.0、670.8mg/kg静脉注射NBP溶液后,均出现了轻微到严重的毒性反应, 直至死亡。 主要的毒性反应为呕吐, 呼吸急促,自发活动减少,头部及四肢颤抖、痉挛等反应。≥480.1mg/kg的剂量组中的部分小鼠出现呼吸深慢、口鼻发绀、无自发活动等濒死症状,给药后3~20min内死亡,死亡发生率随剂量增加而增加,6个剂量组依次为0、0、10%、40%、80%、100%,死亡小鼠无明显的性别差异,对死亡小鼠进行尸解,未死亡小鼠在给药30min后逐渐恢复正常。14d观察期内存活小鼠体质量未见明显变化,笼旁观察未见明显异常,观察期结束时对小鼠麻醉后进行大体解剖,小鼠主要脏器心、脑、肺、肝、肾等无肉眼可见病变。
小鼠经静脉注射NBP的LD50为545.1mg/kg,LD50的95%可信区间为511.5~578.7mg/kg,见图1。

图1 小鼠静脉注射NBP的剂量与死亡率的关系
Figure 1 The relationship between the intravenous NBP dose and the mortality rate in mice
2.2 长期毒性试验观测指标结果 给药期间NBP各剂量组中均未出现小鼠死亡,但在首次给药后出现少动、步态不稳、 俯卧等现象,0.5~2 h后逐渐得到恢复,高剂量组在给药后还出现抽搐、狂躁不安等症状,其他未见明显异常。给药30 d后各组体质量,摄食量,血清ALT、BUN、SCr差异均无统计学意义(P>0.05)。NBP高剂量组AST值较对照组升高(P<0.05),而低、中剂量组与对照组差异无统计学意义(P>0.05)。见表1。
表1 NBP给药30 d后对各组观察指标的影响
Table 1 The effect of NBP on observation indexes in different groups on day 30 post-administration
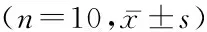

组别体质量(g)摄食量(g)ALT(U/L)AST(U/L)BUN(mmol/L)SCr(μmol/L)对照组 30.2±3.221.0±1.929.2±3.994.6±13.85.3±0.692.8±9.6低剂量组29.6±2.821.1±2.130.8±4.2102.6±16.45.2±0.796.5±10.8中剂量组28.9±3.121.4±2.133.5±5.1118.8±16.25.5±0.5101.2±9.9高剂量组29.3±2.622.0±1.635.3±8.7139.6±15.5*5.8±0.9105.6±19.3F0.3470.6032.17816.3081.4021.827P0.7910.6170.1080.0000.2580.160
*P<0.05与对照组比较(q检验)
2.3 病理组织学检查 小鼠经静脉连续给药30 d后,肉眼大体观检查各剂量组小鼠主要脏器的形态、外观与对照组比较,未见明显异常,脏器系数未见有明显的统计学改变。病理学检查方面,与对照组相比,各剂量组小鼠的心脏、肝脏和肾脏的组织未见明显的病理学改变。
3 讨 论
脑卒中是全球引起死亡的第二大疾病,仅次于心脏病,约全球总病死人数的11.13%[7],其发病率是随年龄增长而明显上升的。在我国,脑卒中患病率为260~719/10万人,类似于发达国家[8]。当前国内外经循证医学证实能够有效治疗缺血性脑卒中急性期的口服药物非常有限,仅有阿司匹林和氯吡格雷。因此,研究新的治疗缺血性脑血管病成为亟需解决的问题。NBP是一类新型抗脑缺血的药物,能够影响脑缺血的多个病理生理过程,具有神经保护、抗血小板凝集、促进血管再通等作用。研究显示NBP对轻至中度的脑缺血患者的临床有效率高达70%以上[9]。尽管在2005年NBP作为治疗缺血性脑卒中的药物,获得国家食品药品监督管理局的批准并上市,但近年来有关NBP引起的不良反应报道增多。因此,对其进行安全再评价显得尤为重要。
急性毒性试验可确定药物中毒的作用方式和反应情况,并且可以为慢性毒性试验观察指标及剂量分组提供重要的参考依据[10]。本研究着重考察了小鼠静脉注射NBP的急性毒性,结果发现C57BL/6小鼠静脉注射NBP的LD50为545.1 mg/kg, 大约为有效剂量(小鼠脑缺血模型的有效剂量为 20 mg/kg[11])的25倍以上,给药后存活小鼠仅出现一过性自发活动减少、俯卧少动等症状。表明NBP具有较高的安全性。
慢性毒性试验则可以深入评价毒物的毒性强度[12]。NBP导致的肝功能异常是文献报道中的主要不良事件[5]。ALT和 AST主要存在于线粒体和细胞核内, 它们参与体内转氨基作用,能够反映蛋白质合成和分解代谢的状况,进而反映肝功能的状态。当细胞及线粒体受损时,ALT和 AST释放入血,使其在血液浓度升高,活性就相应升高。因此,血ALT和 AST的升高表明肝功能受损[13]。本研究结果显示,只有高剂量组小鼠血清中AST高于对照组(P<0.05),其他剂量组与对照组差异无统计学意义;而各剂量组血清中ALT值与对照组差异无统计学意义。AST升高考虑可能与NBP浓度过高有关。表明在合理范围内应用NBP不会引起小鼠肝脏功能的损伤。
BUN和SCr是反映肾功能的重要指标[14-15]。检测血液中BUN和SCr值可观察肾脏功能的改变。本研究结果显示各剂量组BUN和SCr与对照组差异均无统计学意义(P>0.05), 表明长期应用NBP对小鼠肾脏没有毒性作用;此外,病理组织学检查发现各脏器亦无异常变化,提示NBP无明显不良反应,服用安全。
综上所述, 急性毒性试验和慢性毒性试验结果显示,在合理范围内NBP无急性不良反应或毒性较低,并且不会对受试小鼠产生慢性毒性作用,长期使用是安全的。
[1] 吴江,贾建平,崔丽英,等.神经病学[M].2版.北京:人民卫生出版社,2010:153-166.
[2] 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43(2):146-153.
[3] 唐鹏,刘玥,刘鹏,等.丁苯酞注射液治疗急性脑梗死的初步探讨[J].中华老年多器官疾病杂志,2014,13(8):583-586.
[4] 朱以诚,崔丽英,高山,等.丁苯酞注射液治疗急性脑梗死的多中心、随机、双盲双模拟、对照Ⅲ期临床试验[J].中华神经科杂志,2014,47(2):113-118.
[5] 王德任, 刘鸣, 吴波, 等.丁苯酞治疗急性缺血性卒中随机对照试验的系统评价[J].中国循证医学杂志,2010,10(2):189-195.[6] 《化学药物急性毒性试验技术指导原则》课题研究组.化学药物急性毒性试验技术指导原则[S].北京:国家食品药品监督管理局,2005:3-15.
[7] Mozaffarian D,Benjamin EJ,Go AS,et al. Heart disease and stroke statistics--2015 update:a report from the American Heart Association[J]. Circulation,2015,131(4):e29-322.
[8] Tan CS,Müller-Riemenschneider F,Ng SH,et al. Trends in stroke incidence and 28-day case fatality in a nationwide stroke registry of a multiethnic Asian population[J]. Stroke,2015,46(10):2728-2734.
[9] 刘明银,魏麓云.丁苯酞对神经系统保护作用研究进展[J].现代卫生医药,2014,30(1):212-215.
[10] 权晓弟,郝宝成,薛慧文,等.速康解毒口服液对小白鼠的急性毒性试验和亚慢性毒性试验[J].西北农业学报,2014,23(8):20-24.
[11] 张聪,李震中.正丁基苯酞对脑梗死后神经功能恢复作用的机制研究[D].石家庄:河北医科大学,2015.
[12] 丁中海,王喆,潘国隆,等.联苯胺对大型溞的急性和慢性毒性试验[J].应用与环境生物学报,2005,11(1):52-54.
[13] 刘霞,郭书翰,马雪,等.Lifeceramices对长期饮酒大鼠肝脏的保护作用[J].河北医科大学学报,2015,36(3):253-256.
[14] 黄文福,陈丽丽,陈海云.对比增强CT受检者的肾功能及免疫球蛋白变化[J].临床荟萃,2014,29(11):1268-1276.
[15] 赵帅,耿玉兰,代丽丽,等.血清中性粒细胞明胶酶相关脂质运载蛋白检测诊断急性肾损伤的临床价值[J].河北医科大学学报,2013,34(4):416-417.
(本文编辑:刘斯静)
Studies on the acute and chronic toxicity test of dl-3-n-butylphthalide in mice
TIAN Xiao-chao1, HE Wei-liang2, LIU Si-wen3, Yang Rong1, LIU Su-yun1*
(1.Department of Cardiology, the Second Hospital of Hebei Medical University, Shijiazhuang 050000, China; 2.Department of Neurology, Hebei General Hospital, Shijiazhuang 050051, China; 3.Department of Novelty Search,Hebei Medical Science and Information Research Institute, Shijiazhuang 050071, China)
Objective To explore the acute toxicity and chronic toxicity of dl-3-n-butylphthalide(NBP) in mice. Methods The Bliss method was used to observe the acute toxic symptoms and to obtain the toxic parameters medial lethal dose(LD50) of NBP in mice. Repeated administration of tail vein for 30 days, and the long-term toxicity to mice was observed. NBP is divided into low, medium and high dose group(40, 80 and 160 mg/kg respectvely), normal saline was used as control group. The changes of the blood chemistry(alanine transaminase, aspartate aminotransferase, blood urea nitrogen, serum creatinine), and histopathology were examined. Results The LD50 value of the NBP was 545.1 mg/kg. The elevating tendency of the levels of aspartate aminotransferase was observed in the high dose group of NBP. No significant changes were observed in clinical signs, other blood chemistry, and histopathology. Conclusion The rational use of NBP will not have adverse effects on the target animal.
toxicity tests; dl-3-n-butylphthalide; mice
2015-12-28;
2016-05-30
河北省食品药品监督局科技项目计划(QN2015019)
田小超(1986-),女,河北石家庄人,河北医科大学第二医院主治医师,医学硕士,从事心血管疾病诊治研究。
*通讯作者。E-mail:sxf67@sohu.com
R114
A
1007-3205(2016)11-1250-04
10.3969/j.issn.1007-3205.2016.11.003
