基于凝集素的唾液糖蛋白分离、分析及应用
2016-12-14孙凯博樊柳荫曹成喜
孙凯博, 尚 志, 孙 妍, 乔 智, 刘 莎, 樊柳荫, 曹成喜, 肖 华
(微生物代谢国家重点实验室, 上海交通大学生命科学技术学院生物分离与分析实验室, 上海 200240)
基于凝集素的唾液糖蛋白分离、分析及应用
孙凯博, 尚 志, 孙 妍, 乔 智, 刘 莎, 樊柳荫, 曹成喜, 肖 华*
(微生物代谢国家重点实验室, 上海交通大学生命科学技术学院生物分离与分析实验室, 上海 200240)
唾液中的糖蛋白丰度偏低,给分离、分析带来挑战。该文采用麦胚素(WGA)和橙黄网胞盘菌凝集素(AAL)分别富集糖蛋白,考察了高丰度蛋白质去除和不同酶解方式对糖蛋白分离、分析的影响。结果显示,WGA和AAL提取的唾液糖蛋白经胶内酶解可鉴定到的糖蛋白数量显著多于溶液内酶解的结果,也优于去除高丰度蛋白质后的鉴定结果。选择WGA结合胶内酶解进一步对比分析肺癌患者与健康人唾液糖蛋白的差异,通过免标记定量分析共鉴定到139个蛋白质,其中102个蛋白质存在糖基化位点,包括14个在癌症组和正常组之间存在显著差异(p<0.05)的糖蛋白,表明该策略可用于唾液糖蛋白的有效分离、分析和癌症标志物的发现。
凝集素;糖蛋白;唾液;标志物
唾液是一种重要的体液,可以反映人体的健康状况,同时因其易收集、低成本、无创性,近年来已被广泛应用于疾病生物标志物的研究,如口腔癌[1,2]、肺癌[3]和胃癌[4]。唾液的成分较为复杂,包含蛋白质[3]、核酸[5]、微生物、代谢物和外泌体[6]等。唾液中蕴含丰富的蛋白质,如黏蛋白、蛋白酶和细胞因子等,目前鉴定到的唾液蛋白质已经超过3 400种[7]。
糖基化是一种非常重要的蛋白质翻译后修饰,蛋白质的糖基化和癌症的发生、发展息息相关[8],如糖蛋白前列腺特异性抗原可作为前列腺癌的标志物[9]。唾液中存在糖蛋白,但因其丰度偏低,给分离、分析带来挑战。文献[10]报道,利用酰肼富集唾液糖蛋白后结合等电聚焦电泳和色谱、质谱可以鉴定到45个糖蛋白。目前,采用凝集素提取唾液糖蛋白并用于癌症检测的报道很少。
本课题组前期在唾液总蛋白质水平上发现了与肺癌相关的蛋白质,可以用于肺癌的检测[3]。本文通过建立麦胚素(WGA)和橙黄网胞盘菌凝集素(AAL)提取唾液糖蛋白的方法,考察高丰度蛋白质去除和不同酶解方式对唾液糖蛋白提取和鉴定的影响,发展唾液糖蛋白分离、分析的新方法,并将该策略用于肺癌患者与健康人唾液糖蛋白的对比分析,以期为唾液糖蛋白标志物研究奠定基础。
1 实验部分
1.1 仪器与试剂
maXis impact UHR-TOF MS四极杆飞行时间串联质谱接UltiMate3000 RSLC纳升液相色谱,配纳升电喷雾离子源(德国Bruker公司); 5810R冷冻离心机(德国Eppendorf公司);多功能酶标仪(美国GE公司); 2 mL凝集素亲和柱(美国Thermo公司);10 μL C18 ZipTip(德国Merk Millipore公司)。
土豆淀粉、硅藻土、N-乙酰-D-葡萄糖胺、L-岩藻糖、二硫苏糖醇(DTT)、碘乙酰胺(IAA)均为色谱纯,购于美国Sigma-Aldrich公司;WGA、AAL购于美国Vector Laboratories公司;蛋白酶抑制剂购于德国Roche公司;MOPS缓冲液(morpholineopropanesulfonic acid buffer)购于美国Invitrogen公司;胰蛋白酶(测序级)购于美国Promega公司;其他生化试剂均为国产色谱纯。
1.2 缓冲液的配制
富集唾液糖蛋白使用的结合缓冲液:20 mmol/L Tris-HCl缓冲液,150 mmol/L氯化钠,1 mmol/L二水合氯化钙,1 mmol/L四水合氯化锰,1 mmol/L六水合氯化镁,加入蛋白酶抑制剂,用超纯水定容至1 000 mL,调至pH=7.4。凝集素WGA的洗脱缓冲液:在结合缓冲液中加入0.5 mol/LN-乙酰-D-葡萄糖胺,用乙酸调至pH=3。凝集素AAL的洗脱缓冲液:在结合缓冲液中加入0.1 mol/L L-岩藻糖。上样缓冲液按照水∶乙腈∶甲酸=97.9∶2∶0.1(v/v/v)进行配制。
1.3 唾液样本的收集和处理
唾液样本按照上海交通大学伦理委员会批准的实验方案进行收集,所有样本提供者均签署了知情同意书。肺癌患者组和健康人对照组在性别和年龄等方面不存在显著性差异。
唾液样本在4 ℃下以4 497 r/min的转速离心25 min,弃掉沉淀,上清中加入蛋白酶抑制剂,分装后于-80 ℃冷冻保存。
1.4 唾液淀粉酶的去除
唾液淀粉酶的去除步骤在文献[6,11]基础上进行了优化。称取等重的淀粉和硅藻土,重悬在pH为7.4的磷酸缓冲液(PBS)中,将匀浆填装到含滤纸的注射器中制成淀粉柱。唾液与PBS按体积比1∶1混合稀释后加到淀粉柱上,用PBS冲洗淀粉柱,收集洗脱液并转移至3 kD超滤管中,在4 ℃下以7 638 r/min的转速离心浓缩至体积约为500 μL,用BCA (bicinchoninic acid)法检测蛋白质浓度。
1.5 凝集素富集糖蛋白
1.5.1 样品缓冲液的置换
取去除唾液淀粉酶的唾液蛋白质和唾液总蛋白质各900 μg,分别转移至3 kD超滤管中。加入3 mL结合缓冲液,在4 ℃下以7 638 r/min的转速离心60 min,重复上述操作一次。加入2 mL结合缓冲液,相同条件下超滤离心30 min,将样品转移至离心管中,用结合缓冲液稀释至1.6 mL。
1.5.2 糖蛋白的提取
按照凝集素制造商提供的步骤富集唾液中的糖蛋白。将1 mL结合在琼脂糖上的凝集素均匀装入2 mL凝集素亲和柱中,用结合缓冲液充分洗涤柱子。将唾液蛋白质样品加到亲和柱顶端,让其在重力作用下流出,重复5次,弃去流出样品。用结合缓冲液冲洗亲和柱,去除非特异性吸附的蛋白质。加入2 mL洗脱缓冲液洗脱特异性结合的糖蛋白,重复2次,合并洗脱液。将洗脱液转移至3 kD超滤管中,在4 ℃下以7 638 r/min的转速离心90 min;加入2 mL结合缓冲液,超滤离心至体积约为200 μL,测蛋白质浓度后分装,于-80 ℃冻存。
1.5.3 糖蛋白的聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分析
取WGA、AAL富集的糖蛋白、去除唾液淀粉酶的唾液蛋白质和唾液总蛋白质各1 μg,加2.5 μL溴酚蓝上样缓冲液,于70 ℃孵育,采用MOPS缓冲液在10%双(2-羟乙基)氨基(三羟甲基)甲烷(Bis-Tris)胶上进行垂直电泳,快速银染后采用光学扫描仪扫描图像。
1.6 胰蛋白酶酶解
1.6.1 溶液内酶解
取10 μg富集的糖蛋白冻干,重溶于90 μL 50 mmol/L碳酸氢铵中。加入10 μL 100 mmol/LDTT,于60 ℃反应45 min。加入11 μL 150 mmol/LIAA,室温避光反应45 min。加入0.5 μg胰蛋白酶,于37 ℃酶解过夜,经C18 ZipTip除盐后用上样缓冲液溶解,待测。
1.6.2 胶内酶解
取60 μg蛋白质做10% SDS-PAGE电泳,分3条泳道分析,每条泳道加20 μg蛋白质。考马斯亮蓝染色,用干净刀片将胶条切成小条,分成若干份。向每份中加入DTT至终浓度为20 mmol/L, 60 ℃水浴还原1 h,再加入IAA至终浓度为25 mmol/L,避光反应30 min后依次用50 mmol/L碳酸氢铵、乙腈洗涤,最后加入10 μg/L胰酶酶解过夜,次日用乙腈萃取。肽段样品干燥后,经C18 ZipTip除盐后用上样缓冲液溶解,待测。
1.7 液相色谱-质谱分析
肽段样品先是在C18反相色谱柱(100 μm×2 cm, 5 μm)上进行富集,然后洗脱到C18反相分析柱(75 μm×15 cm, 3 μm)上进行分离。流动相A是体积分数为0.1%的甲酸水溶液,流动相B是体积分数为0.1%的甲酸乙腈溶液;流速为400 nL/min。ESI正极模式;质谱电喷雾毛细管电压:1 900 V;气体流速:2.0 L/min;离子源温度:120 ℃;选择母离子m/z350~1 500进行CID(collision-induced dissociation)二级碎裂扫描;碰撞能量:20~70 eV;动态排除:0.25 min。
1.8 数据分析
使用Data Analysis 4.1软件提取离子峰,生成.mgf文件。在方法发展阶段,使用在线搜索引擎X!Tandem鉴定唾液糖蛋白数量,糖蛋白鉴定标准为:每个糖蛋白至少检出2个特征肽段,且至少有一处糖基化修饰位点。在采用免标记方法定量比较肺癌患者和健康人唾液糖蛋白差异时,使用Mascot 4.0搜索引擎搜索蛋白质数据库Human SwissProt(548 208条序列)。母离子质量容差为20 ppm(20×10-6),二级谱图质量容差为0.05 Da,设半胱氨酸的烷基化修饰为固定修饰,设天冬酰胺脱酰胺修饰和甲硫氨酸氧化为可变修饰,胰蛋白酶最大漏切位点数为2,蛋白质鉴定设置FDR(false discovery rate)小于1%,且每个蛋白质至少检出2个特征肽段。针对以上搜库结果,利用在线糖蛋白分析网站(http://www.cbs.tu.dk/services/NetNGlyc/)对每个蛋白质进行糖基化位点预测分析。
1.9 肺癌患者唾液糖蛋白分析
取6个健康人和6个肺癌患者的唾液各300 μg,分别混合制成正常唾液样本和癌症唾液样本。取混合后的唾液蛋白各900 μg,分别使用1 mL WGA提取糖蛋白,经胶内酶解后采用液相色谱-质谱结合免标记定量进行分析。
2 结果与讨论
2.1 实验流程
实验流程如图1所示。取6个健康人的等量唾液蛋白质混合后均分为两组,一组去除唾液淀粉酶,另一组不去除唾液淀粉酶。用凝集素WGA、AAL分别提取两组唾液样品中的糖蛋白,再分别进行胶内酶解和溶液内酶解,通过液相色谱-质谱分析鉴定唾液样本中的糖蛋白种类,以确定唾液糖蛋白分离、分析的最优化方法,并将方法应用于肺癌患者和健康人唾液糖蛋白的差异对比,以期找到肺癌相关的糖蛋白。
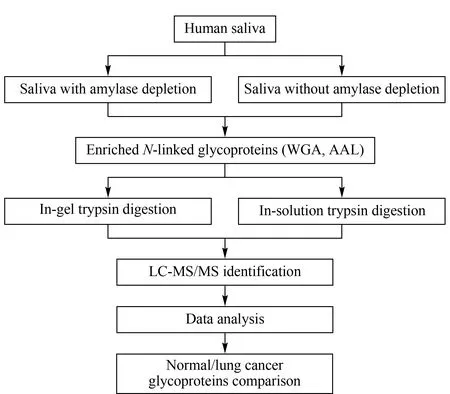
图 1 实验流程图Fig. 1 Workflow of the study WGA: wheat germ agglutinin; AAL: aleuria aurantia lectin.
2.2 WGA、AAL富集糖蛋白的对比
2.2.1 去除唾液淀粉酶
唾液淀粉酶是唾液中的高丰度蛋白质[12],本文采用亲和层析去除唾液淀粉酶,考察其对唾液糖蛋白鉴定的影响。据文献报道[11],淀粉作为固定相可以特异性地富集唾液淀粉酶,而其他蛋白质在淀粉柱上没有保留,本文加入有助滤作用的硅藻土,使唾液蛋白质样本较快流下,缩短处理时间。BCA法测定结果显示层析后唾液蛋白质的质量为起始唾液蛋白质质量的50%~60%。对除去唾液淀粉酶前后的唾液蛋白质进行SDS-PAGE分析,如图2所示,可以看出相对分子质量在51~64 kDa之间有一条明亮条带消失,证明唾液淀粉酶已被去除。
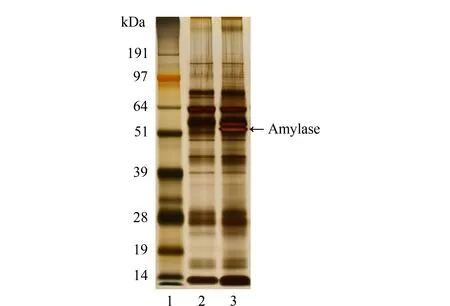
图 2 唾液总蛋白质与去除唾液淀粉酶的唾液蛋白质凝胶电泳图Fig. 2 Gel electrophoreogram for the whole salivary proteins and amylase-depleted salivary proteins Lanes: 1. marker; 2. amylase depleted salivary (ADS) proteins; 3. whole salivary (WS) proteins.
2.2.2 糖蛋白的鉴定
本文使用凝集素WGA、AAL富集N-连接糖蛋白,其中WGA选择性结合N-乙酰葡糖胺和唾液酸化的糖蛋白,AAL选择性结合岩藻糖基化的糖蛋白[13]。在去除高丰度蛋白质的唾液中,由WGA和AAL提取的糖蛋白分别占总蛋白质的12.91%和9.49%;在唾液总蛋白质中,由WGA和AAL提取的糖蛋白分别占总蛋白质的29.8%和19.5%。这主要是由于唾液淀粉酶具有糖基化位点,存在部分糖基化现象。对提取的糖蛋白进行凝胶电泳分析(见图3a),发现主要的唾液蛋白质都存在糖基化现象。
通过胶内酶解和溶液内酶解的方法分别对唾液糖蛋白进行了蛋白质组学分析,所有试验均进行了2次生物学重复,将2次结果取并集。如图3b所示,胶内酶解时,将黑框内染色较深的条带合并在一起,将剩余染色浅的条带合并在一起,分别进行液相色谱-质谱分析,溶液内酶解和胶内酶解所得蛋白质数量见图4。
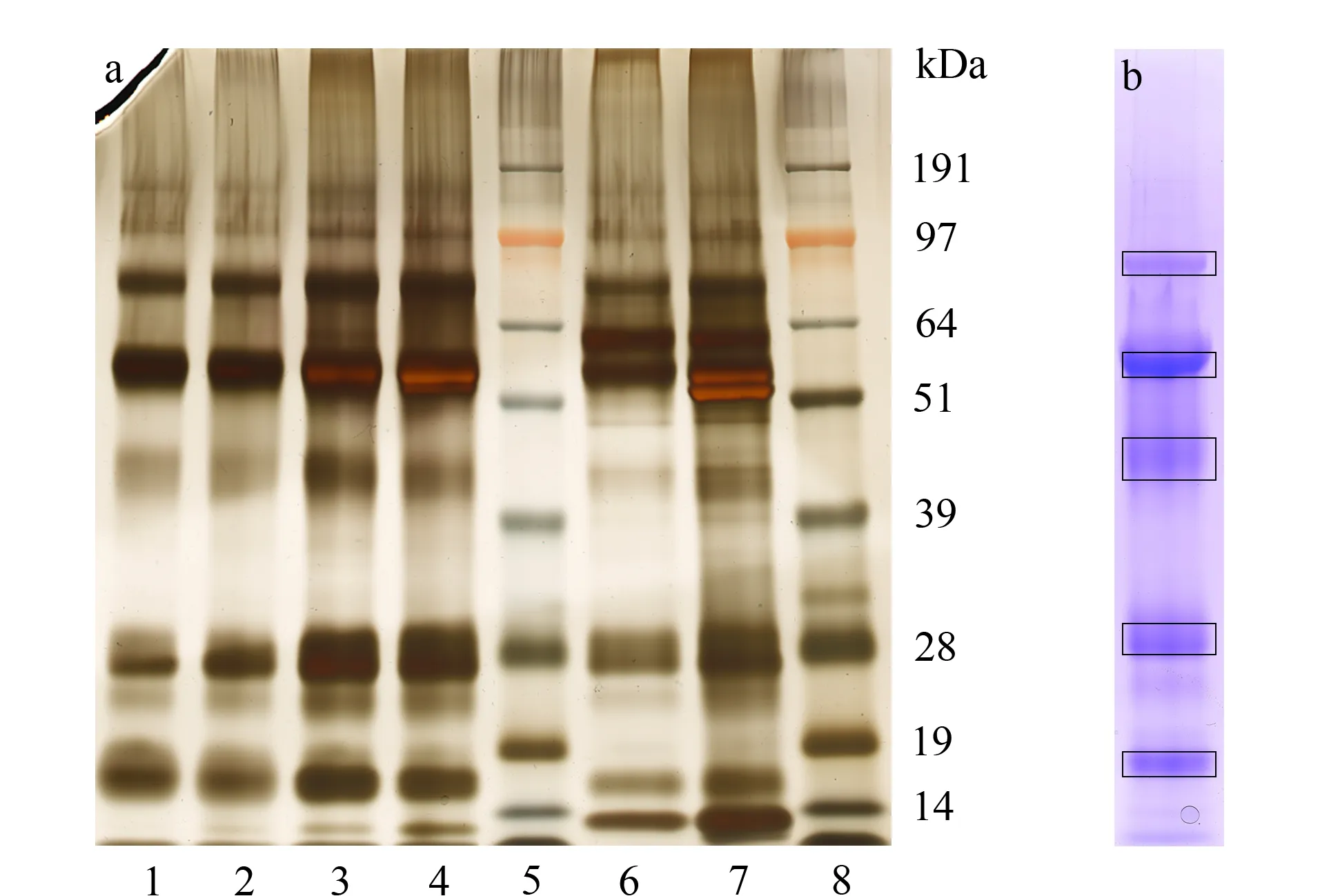
图 3 唾液糖蛋白、唾液总蛋白质及去除高丰度蛋白质的 唾液蛋白质凝胶电泳图Fig. 3 Gel electrophoreogram for salivary glycoproteins,salivary total proteins and amylase-depleted salivary proteins a. salivary glycoproteins extracted by different lectins. b. protein bands cutting for in-gel digestion. The deep staining bands with black frame were combined into one group, and the light staining bands were combined into another group. Lanes: 1. WGA ADS glycoproteins; 2. WGA WS glycoproteins; 3. AAL ADS glycoproteins; 4. AAL WS glycoproteins; 5. marker; 6. ADS proteins; 7. WS proteins; 8. marker.
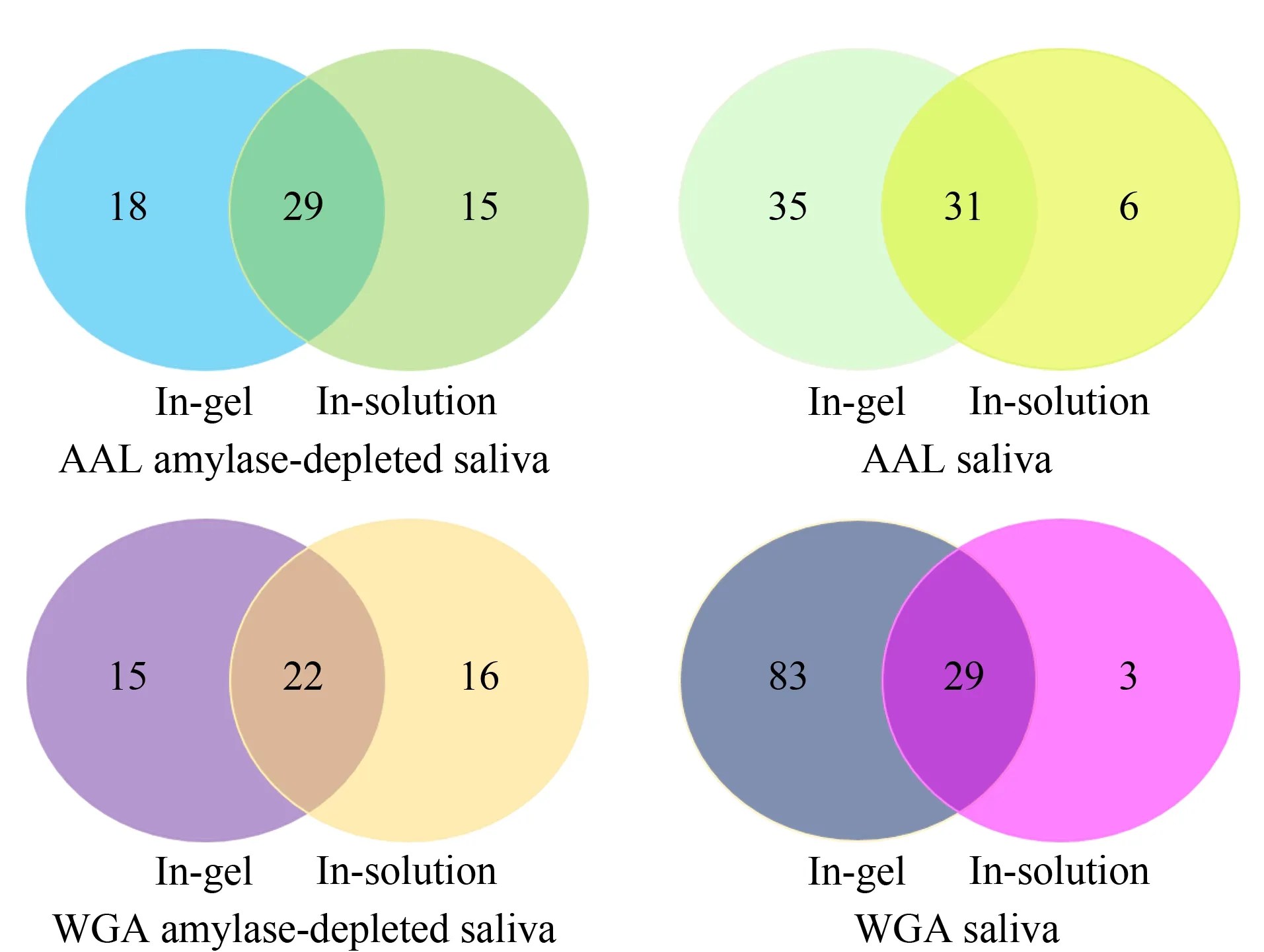
图 4 糖蛋白鉴定数量对比Fig. 4 Comparison of identified glycoprotein numbers
当采用溶液内酶解的方法时,去除高丰度蛋白质有助于增加糖蛋白的鉴定数量(平均增加18.8%)。当采用胶内酶解的方法时,去除高丰度蛋白质则不利于糖蛋白的发现,使用唾液总蛋白质可以富集到更多的糖蛋白。
对比糖蛋白的溶液内酶解和胶内酶解可以发现,胶内酶解所鉴定的蛋白质数量多于溶液内酶解,这可能是因为胶内酶解过程中SDS-PAGE对蛋白质样品进行了预分离,高丰度蛋白质条带和低丰度蛋白质条带的分别合并分析减少了高低丰度蛋白质间的互相干扰[14]。对比凝集素WGA和AAL富集唾液糖蛋白发现,由WGA提取唾液总蛋白质的情况下,胶内酶解鉴定的糖蛋白数量远多于AAL提取唾液总蛋白质并进行胶内酶解鉴定的糖蛋白数量。
综上所述,采用WGA提取唾液总蛋白质后再进行胶内酶解,有助于鉴定更多的糖蛋白,因此选择该实验方案进行后续研究。
2.3 肺癌患者和健康人唾液糖蛋白的对比分析
将6个肺癌患者和6个健康人的唾液分别混合,用WGA提取糖蛋白,经凝胶电泳分离后进行胶内酶解,然后基于液相色谱-质谱进行免标记定量分析和鉴定,进行3次技术重复。
采用凝集素WGA分别富集肺癌患者和健康人唾液中的糖蛋白,糖蛋白的提取率分别为15.8%(n=3)和12.9%(n=3),表明肺癌患者的唾液蛋白质糖基化程度更高。对富集的糖蛋白进行电泳分析,结果见图5,说明肺癌患者和健康人之间存在明显差异。
切胶酶解后进行免标记定量分析,经MaxQuant软件分析后做归一化处理计算显著性差异p值,当p值小于0.05时视为组间存在显著差异。从肺癌患者组鉴定出116个蛋白质(3次实验结果分别是82、97和85,三者交集为43),从健康人组鉴定出80个蛋白质(3次实验结果分别是48、57和63,三者交集为29)。通过蛋白糖基化位点分析,共鉴定出102个糖蛋白,高于文献利用酰肼富集鉴定的45个唾液糖蛋白(其中26个在本实验中得到鉴定)[10]。其中14个糖蛋白在肺癌组和健康人组之间存在显著丰度差异(p<0.05),结果见表1。
据文献[15]报道,α-抗胰凝乳蛋白酶是丝氨酸蛋白酶抑制剂,可以作为非小细胞肺癌早期检测标志物。此外,黏蛋白5B(mucin 5B)有多个N-连接糖基化位点[10],质谱数据表明其在第1 774位可能存在糖基化修饰,该蛋白质可通过调节巨噬细胞的活性防御细菌的侵入;簇集素蛋白(clusterin)作为细胞外分泌蛋白,参与细胞生长因子的活化,已有研究表明黏蛋白5B[16]和簇集素蛋白[17]均可作为肺癌的预后蛋白质标志物。这些结果表明唾液中的糖蛋白与肺癌息息相关,有望用于肺癌的特异性检测。
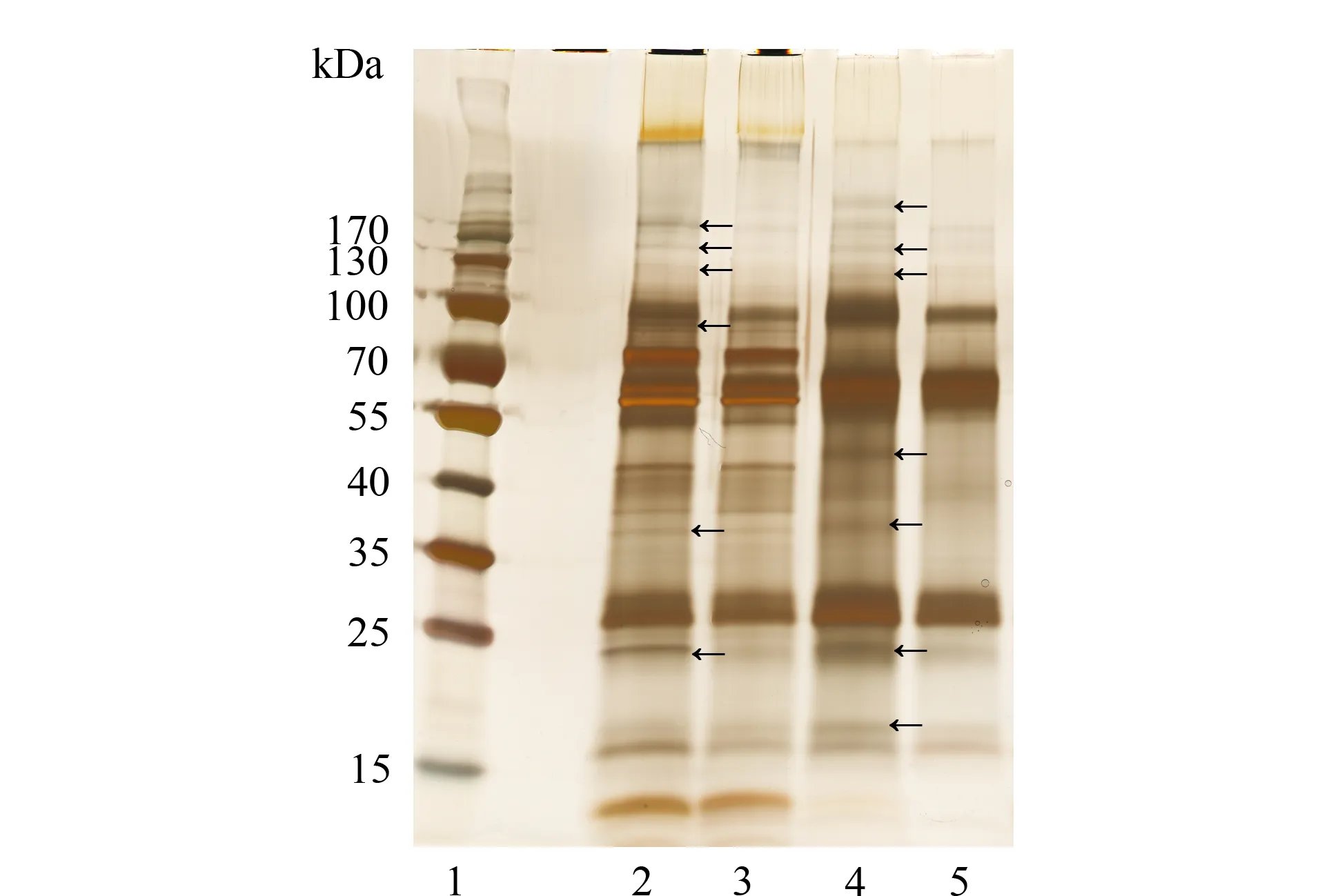
图 5 肺癌患者和健康人唾液蛋白质和糖蛋白的SDS-PAGE对比Fig. 5 SDS-PAGE comparison of salivary proteins and glycoproteins between lung cancer patients and normal subjects Black arrows indicate the different bands of whole salivary proteins and glycoproteins between lung cancer patients and normal subjects. Lanes: 1. marker; 2. lung cancer WS proteins; 3. normal WS proteins; 4. lung cancer WGA WS glycoproteins; 5. normal WGA WS glycoproteins.
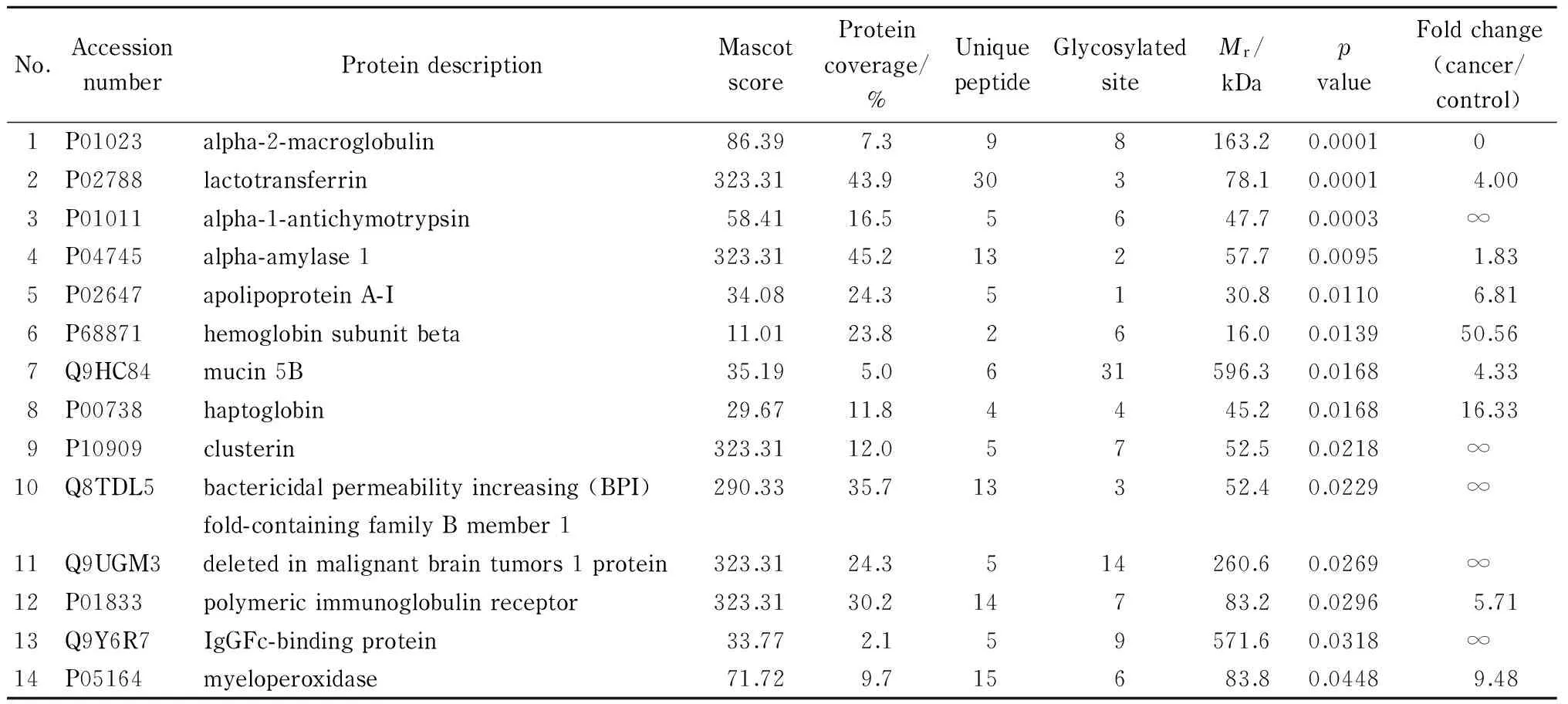
表 1 肺癌患者和健康人存在显著差异的糖蛋白
3 结论
本文基于凝集素建立了唾液糖蛋白的富集、分离和鉴定的新策略,并将其初步应用于癌症标志物的发现。结果表明,采用WGA富集唾液总蛋白质中的糖蛋白,通过胶内酶解后可以鉴定到102个唾液糖蛋白,优于酰肼富集方法[10],显著提高了唾液糖蛋白的鉴定水平。通过肺癌患者与健康人的对比,发现14个差异显著的糖蛋白,这些糖蛋白多与癌症相关,作为潜在的糖蛋白标志物,有待后续实验的进一步验证。本研究为唾液糖蛋白的分离、分析建立了新策略,有助于唾液糖蛋白的研究,为癌症生物标志物的发展奠定了基础。
[1] Xiao H, Langerman A, Zhang Y, et al. Oral Oncol, 2015, 51(11): 1011
[2] He H B, Shi X Z, Chen J, et al. Chinese Journal of Chromatography, 2012, 30(3): 245
和红兵, 石先哲, 陈静, 等. 色谱, 2012, 30(3): 245
[3] Xiao H, Zhang L, Zhou H, et al. Mol Cell Proteomics, 2012, 11(2): M111.012112
[4] Xiao H, Zhang Y, Kim Y, et al. Sci Rep, 2016(6): 22165
[5] Zhao X Y, Wang Y F, Yang F. Chinese Journal of Analytical Chemistry, 2016, 44(7): 1009
赵晓亚, 王跃飞, 杨帆, 等. 分析化学. 2016, 44(7): 1009
[6] Li S D, Hou X Q, Hong Z, et al. Progress in Chemistry, 2016, 28(2/3): 353
李思迪, 侯信亓, 洪昭, 等. 化学进展, 2016, 28(2/3): 353
[7] Sivadasan P, Gupta M K, Sathe G J, et al. J Proteomics, 2015, 127: 89
[8] Bai H H, Fan C, Shen B Q, et al. Chinese Journal of Chromatography, 2015, 33(3): 221
白海红, 范超, 沈丙权, 等. 色谱, 2015, 33(3): 221
[9] Liu Y X, Zhu X L, Chen Y H, et al. Chinese Journal of Analytical Chemistry, 2011, 39(3): 305
刘永霞, 朱小丽, 陈玉华, 等. 分析化学, 2011, 39(3): 305
[10] Ramachandran P, Boontheung P, Xie Y, et al. J Proteome Res, 2006, 5(6): 1493
[11] Deutsch O, Fleissig Y, Zaks B, et al. Electrophoresis, 2008, 29: 4150
[12] Camisasca D R, Da Ros Goncalves L, Soares M R, et al. J Proteomics, 2016. doi: 10.1016/j. jprot.2016.07.029
[13] Miyamoto S, Ruhaak L R, Stroble C, et al. J Proteome Res, 2016, 15(9): 3358
[14] Wisniewski J R, Zougman A, Nagaraj N, et al. Nat Methods, 2009, 6(5): 359
[15] Jin Y, Wang J, Ye X, et al. Br J Cancer, 2016, 114(5): 532
[16] Wakata K, Tsuchiya T, Tomoshige K, et al. BMJ Open, 2015, 5(7): e008366
[17] Panico F, Casali C, Rossi G, et al. Lung Cancer, 2013, 79(3): 294
Lectin based salivary glycoprotein separation,analysis and its application
SUN Kaibo, SHANG Zhi, SUN Yan, QIAO Zhi, LIU Sha,Fan Liuyin, CAO Chengxi, XIAO Hua*
(StateKeyLaboratoryofMicrobialMetabolism,LaboratoryofAnalyticalBiochemistryandBioseparation,SchoolofLifeSciencesandBiotechnology,ShanghaiJiaoTongUniversity,Shanghai200240,China)
The abundance of glycoproteins in saliva is relatively low, which brings great challenge to their separation and analysis. In the study, wheat germ agglutinin (WGA) and aleuria aurantia lectin (AAL) were utilized to extract salivary glycoproteins. The effects of high abundant protein removal and two digestion methods on glycoprotein analysis were investigated. Our data demonstrated that the number of identified glycoproteins using WGA and AAL with in-gel digestion was significantly higher than that of in-solution digestion, as well as high abundant protein removal method. The developed strategy was further applied to compare the salivary glycoproteins from lung cancer patients and normal subjects. According to label free quantification results, 139 proteins were found and 102 proteins with the glycosylation sites were predicted. Among them, 14 glycoproteins showed significant difference between the cancer and control ones (p<0.05). Our study demonstrated that the developed strategy could be applied to the efficient separation and analysis of salivary glycoproteins and would contribute to the cancer biomarker discovery.
lectin; glycoprotein; saliva; biomarker
10.3724/SP.J.1123.2016.08038
2016-08-30
国家自然科学基金项目(21275099,21305087,21475086); “863”项目(2014AA020545);国家青年千人计划项目(2013).
Foundation item: National Natural Science Foundation of China (Nos. 21275099, 21305087, 21475086); “863” Program (No. 2014AA020545); Recruitment Program of Global Youth Experts of China (2013).
O658
A
1000-8713(2016)12-1234-06
邹汉法研究员纪念专辑(上)·研究论文
* 通讯联系人.Tel:(021)34205682,E-mail:huaxiao@sjtu.edu.cn.
