奇异变形杆菌中赖氨酸-2-羟基异丁酰化蛋白的分析
2016-12-14董瀚阳郭振昌田姗姗翟贵金
董瀚阳, 郭振昌, 田姗姗, 翟贵金, 张 锴
(1. 天津市医学表观遗传重点实验室, 天津医科大学生物化学与分子生物学系,天津市医学表观遗传协同创新中心, 天津 300070)
奇异变形杆菌中赖氨酸-2-羟基异丁酰化蛋白的分析
董瀚阳, 郭振昌, 田姗姗, 翟贵金, 张 锴*
(1. 天津市医学表观遗传重点实验室, 天津医科大学生物化学与分子生物学系,天津市医学表观遗传协同创新中心, 天津 300070)
蛋白质的赖氨酸修饰广泛参与基因调控、转录、代谢等重要的生物过程。在真核细胞组蛋白上发现了一种新的赖氨酸修饰——2-羟基异丁酰化,这种修饰对于生殖细胞分化具有调控功能。该研究旨在探索这种修饰在原核生物非组蛋白中的特征。通过亲和富集、高效液相色谱-串联质谱鉴定和生物信息学分析,在奇异变形杆菌中鉴定到大量未见报道的2-羟基异丁酰化蛋白及其位点,进而考察了原核生物中2-羟基异丁酰化修饰蛋白的分布特征、分子网络和通路特点。研究表明,赖氨酸-2-羟基异丁酰化在原核生物中具有广泛的分布,其生物学意义值得进一步研究。
高效液相色谱-串联质谱;翻译后修饰;2-羟基异丁酰化;赖氨酸;奇异变形杆菌
蛋白质翻译后修饰(post-translational modifications, PTMs)通常由生物酶介导,发生在蛋白质氨基酸残基上的化学修饰。目前已发现400多种蛋白质修饰形式,如酪氨酸/丝氨酸/苏氨酸的磷酸化、天冬酰胺的糖基化、赖氨酸的泛素化等[1-6]。这些修饰改变了蛋白质氨基酸残基的物理、化学性质及蛋白质的空间结构,进而影响蛋白质的生物学功能。在各种蛋白质的氨基酸残基中,赖氨酸的修饰形式最为广泛[7],如赖氨酸甲基化、泛素化和乙酰化等,这些修饰过程参与基因转录、信号转导和能量代谢等重要生物过程的调控,一旦修饰和去修饰的动态平衡发生异常,就可能导致肿瘤等疾病的发生[8,9]。
尽管赖氨酸修饰分布广泛,但其丰度较低[10],因此赖氨酸修饰的富集是其鉴定的关键环节。近年来,随着蛋白质翻译后修饰富集技术的发展[7]及高效分离和高灵敏质谱检测技术的进步,很多新的赖氨酸修饰方法被报道[10],如赖氨酸的丙酰化[11]、丁酰化[12]、琥珀酰化[13]、巴豆酰化[14]等。最近在组蛋白上发现了一种新的赖氨酸修饰----2-羟基异丁酰化,它对精子细胞的分化起到重要的调控作用[15]。这种新修饰是否具有更广泛的分布和生物学意义值得进一步关注。
本文采用抗体亲和富集和蛋白质组学分析技术鉴定了原核细胞奇异变形杆菌(Proteusmirabilis)中赖氨酸2-羟基异丁酰化修饰,结合生物信息学工具,探索了这一修饰在原核生物中的分布规律和蛋白质特征,考察了这些修饰蛋白质间的关联。
1 实验部分
1.1 仪器、试剂与材料
EASY-nLC 1000液相色谱系统、Orbitrap Q-Exactive质谱仪、LEGEND MICRO21R冷冻离心机、(美国ThermoFisher Scientific公司); VCX 130超声破碎仪(美国SONICS公司); TS-2摇床(江苏海门其林贝尔仪器制造有限公司); PowerPacTMBasic电泳仪(美国BIO-RAD公司); SY-1220恒温水浴槽(美国精骐有限公司)。
2YT培养基(胰蛋白胨、酵母提取物、氯化钠)、磷酸盐缓冲液(PBS)、三氯乙酸(TCA)、丙酮、二硫苏糖醇(DDT)、碘乙酰胺(IAA)、半胱氨酸(上海生工生物工程有限公司); RIPA裂解液(上海碧云天生物科技研究所);胰蛋白酶(trypsin,北京华利世科技公司);抗2-羟基异丁酰化抗体琼脂糖凝珠、修饰多肽富集试剂盒(IP Buffer)(杭州景杰生物科技公司); C18 ZipTip(美国Millipore公司)。
1.2 奇异变形杆菌的培养、蛋白质的提取和修饰多肽的富集
用2YT培养基对奇异变形杆菌进行培养,将接种后的培养基置于37 ℃恒温摇床中,以220 r/min培养过夜,待细菌生长至对数生长期后,于4 ℃以5 000 g离心10 min,以获取菌体沉淀。
用PBS洗涤菌体,加入适量RIPA裂解液后,超声(运行10 s,停滞30 s,共25次)至菌液澄清;于4 ℃以21 000 g离心30 min,上清液即为菌体蛋白质溶液。加入与蛋白质溶液等体积的TCA以沉淀蛋白质,离心,去除上清液后,加入5倍蛋白质体积的冰丙酮进行清洗(共2次),加入适量0.1 mol/L NH4HCO3充分溶解蛋白质,蛋白质溶液的终浓度为1~2 g/L;加入2%蛋白质质量的胰蛋白酶,于37 ℃水浴中过夜酶解;酶解后加入终浓度为5 mmol/L的DTT于56 ℃孵育1 h后,冷却至室温,加入终浓度15 mmol/L IAA避光孵育45 min,再加入终浓度30 mmol/L半胱氨酸于室温孵育30 min;加入1%蛋白质质量的胰蛋白酶,于37 ℃振荡孵育4 h;充分酶解后离心,上清液即为多肽溶液。
称取1 mg多肽,加入200 μL预冷的IP Buffer充分溶解,按照修饰多肽富集试剂盒的步骤进行富集,富集到的多肽溶液用真空离心浓缩仪干燥,将抽干的多肽粉末于-20 ℃冰箱冷藏。
1.3 色谱、质谱条件
将上述多肽产物用C18 ZipTip除盐,用10 μL流动相A(0.1%(v/v)甲酸水溶液)溶解,采用C18毛细管柱(100 mm×50 μm, 2 μm,美国ThermoFisher Scientific公司)分离,流动相由初始5%的流动相B(含0.1%(v/v)甲酸、95%(v/v)乙腈的水溶液)在120 min内线性升至95%的流动相B,流速为0.3 μL/min,进样量为5 μL。
采用电喷雾离子(ESI)源进行质谱分析,具体参数如下:一级质谱的扫描范围为m/z350~1 800;分辨率(R)为70 000;采用Data dependent模式,选取10个相对丰度最高的离子进行二级质谱碎裂和扫描;采用HCD (higher energy collisional dissociation)裂解方式,归一化碰撞能量为27%,自动增益控制;动态排除时间为50 s。
1.4 数据分析
利用Maxquant对HPLC-MS/MS的数据结果进行搜索分析,搜索时采用奇异变形杆菌全蛋白Uniprot数据库,半胱氨酸的脲甲基化(carbamidomethylation)为固定修饰,2-羟基异丁酰化为可变修饰,肽段一级离子质量偏差设置为10×10-6(10 ppm),最大漏切位点设置为2个,碎片离子质量偏差设置为0.02 Da,以小于0.01的错误发现率(FDR)进行过滤。最后将鉴定到的赖氨酸2-羟基异丁酰化修饰蛋白通过DAVID 6.8、STRING10.0等在线生物信息学软件进行分析。
2 结果与讨论
2.1 HPLC-MS/MS分析
首先在未进行特异富集的情况下对奇异变形杆菌蛋白多肽直接进行HPLC-MS/MS分析,鉴定得到3个赖氨酸2-羟基异丁酰化修饰的蛋白质,修饰丰度极低。当采用泛抗体富集赖氨酸2-羟基异丁酰化多肽时(具体方法见图1),发现在212个蛋白质的327个赖氨酸位点上存在2-羟基异丁酰化修饰,表明抗体富集提高了修饰的鉴定率,同时也暗示其在原核生物中具有较为广泛的分布。
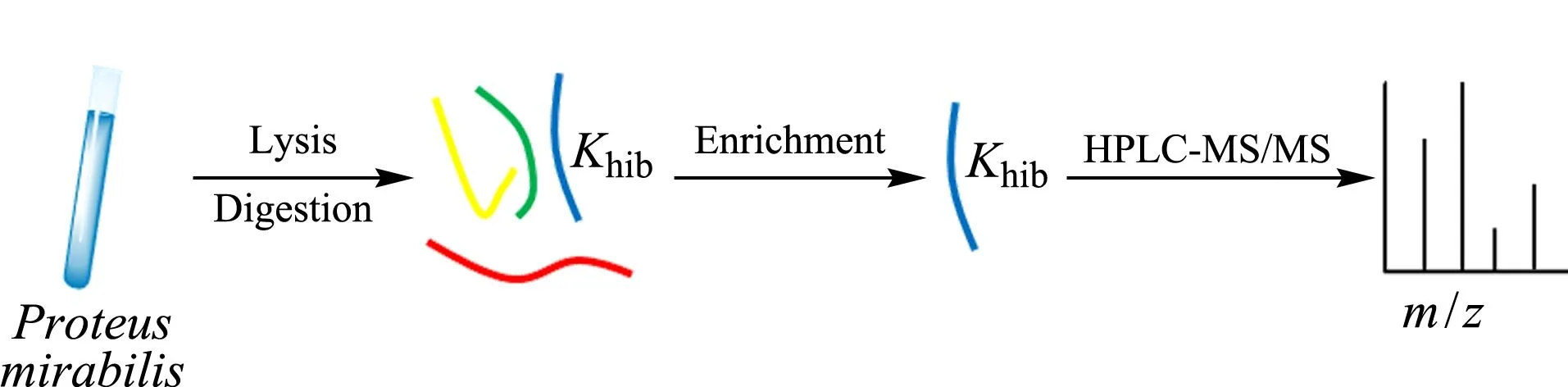
图 1 奇异变形杆菌全蛋白赖氨酸2-羟基异丁酰化的分析方法Fig. 1 Analytical method for global profiling of lysine 2-hydroxyisobutyrylation in Proteus mirabilis Khib : lysine 2-hydroxyisobutyrylation.
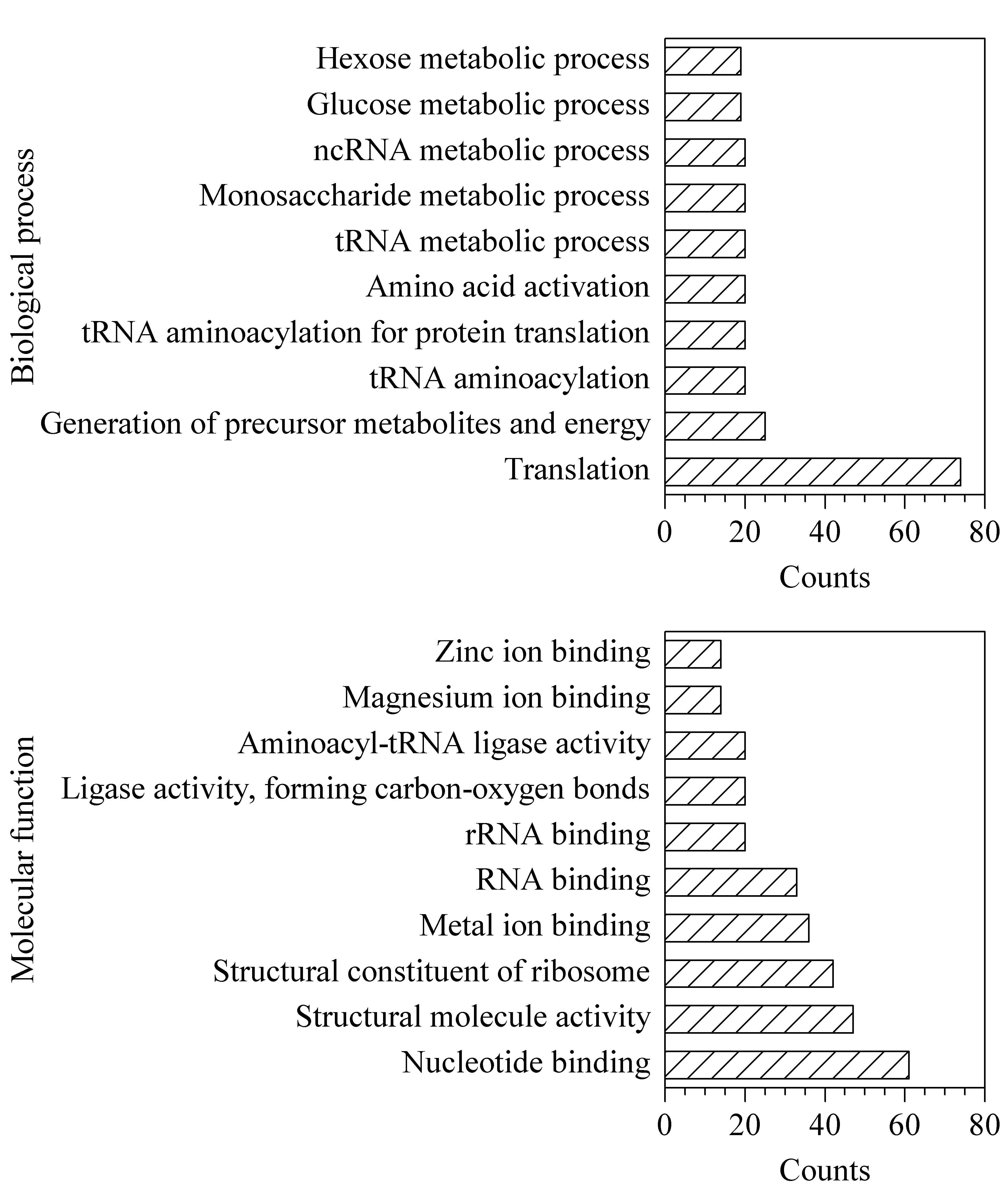
图 2 奇异变形杆菌2-羟基异丁酰化修饰蛋白的 生物过程和分子功能Fig. 2 Biological process and molecular function of 2-hydroxyisobutyrylated proteins in Proteus mirabilis
2.2 修饰蛋白的特征分析
为进一步探究2-羟基异丁酰化修饰蛋白在原核生物中的特点,利用DAVID软件进行GO(gene ontology)分析(见图2)。生物学过程分析结果表明,大多数的修饰蛋白与基因转录和RNA代谢相关;分子功能分析表明,大多数的修饰蛋白具有生物学活性;细胞组成分析显示,大部分2-羟基异丁酰化修饰的蛋白质主要存在于核糖体和胞浆内。GO分析结果说明2-羟基异丁酰化修饰在原核生物中分布广泛,具有潜在的生物学意义。
在蛋白质分布特征的基础上,运用STRING软件对蛋白质进行关联分析,探究2-羟基异丁酰化修饰蛋白之间的关系(见图3)。结果表明,这些修饰的蛋白质间关系密切,相互作用复杂。

图 3 奇异变形杆菌中2-羟基异丁酰化修饰蛋白间的 相互作用网络Fig. 3 Protein-protein interaction network of 2-hydroxyisobutyrylated proteins in Proteus mirabilis
为考察2-羟基异丁酰化修饰的潜在功能,分析了某些重要生物学通路(pathways)中关键分子的修饰情况。结果显示,很多重要代谢过程的催化酶中均存在2-羟基异丁酰化修饰位点,尤其在糖酵解、柠檬酸循环、丙酮酸代谢等能量代谢过程中分布广泛。丙酮酸代谢通路中关键分子的修饰情况见图4。在丙酮酸脱氢酶组分E1(aceE)、甲酸乙酰还原酶(pflB)、苹果酸脱氢酶(mdh)和延胡索酸还原酶亚基黄素蛋白(frdA)等成分中均发现大量未见报道的2-羟基异丁酰化修饰位点。在aceE的两个重要结构域中共鉴定到17个2-羟基异丁酰化修饰位点,表明E1的酶活性受2-羟基异丁酰化影响;此外,在mdh中,第81位精氨酸为酶活性结合位点,而与此相邻的82位赖氨酸也发生了2-羟基异丁酰化修饰,这种邻近功能位点上的修饰会影响该蛋白质的活性,从而调控苹果酸脱氢酶的功能;丙酮酸代谢过程中,其他重要酶(如乙醛酸激酶、延胡索酸还原酶和乙醛脱氢酶)中的结构域和关键活性位点均存在2-羟基异丁酰化修饰,表明2-羟基异丁酰化修饰在奇异变形杆菌的丙酮酸代谢酶中可能分布广泛且存在于重要的功能区域,其生物学意义值得进一步深入研究。
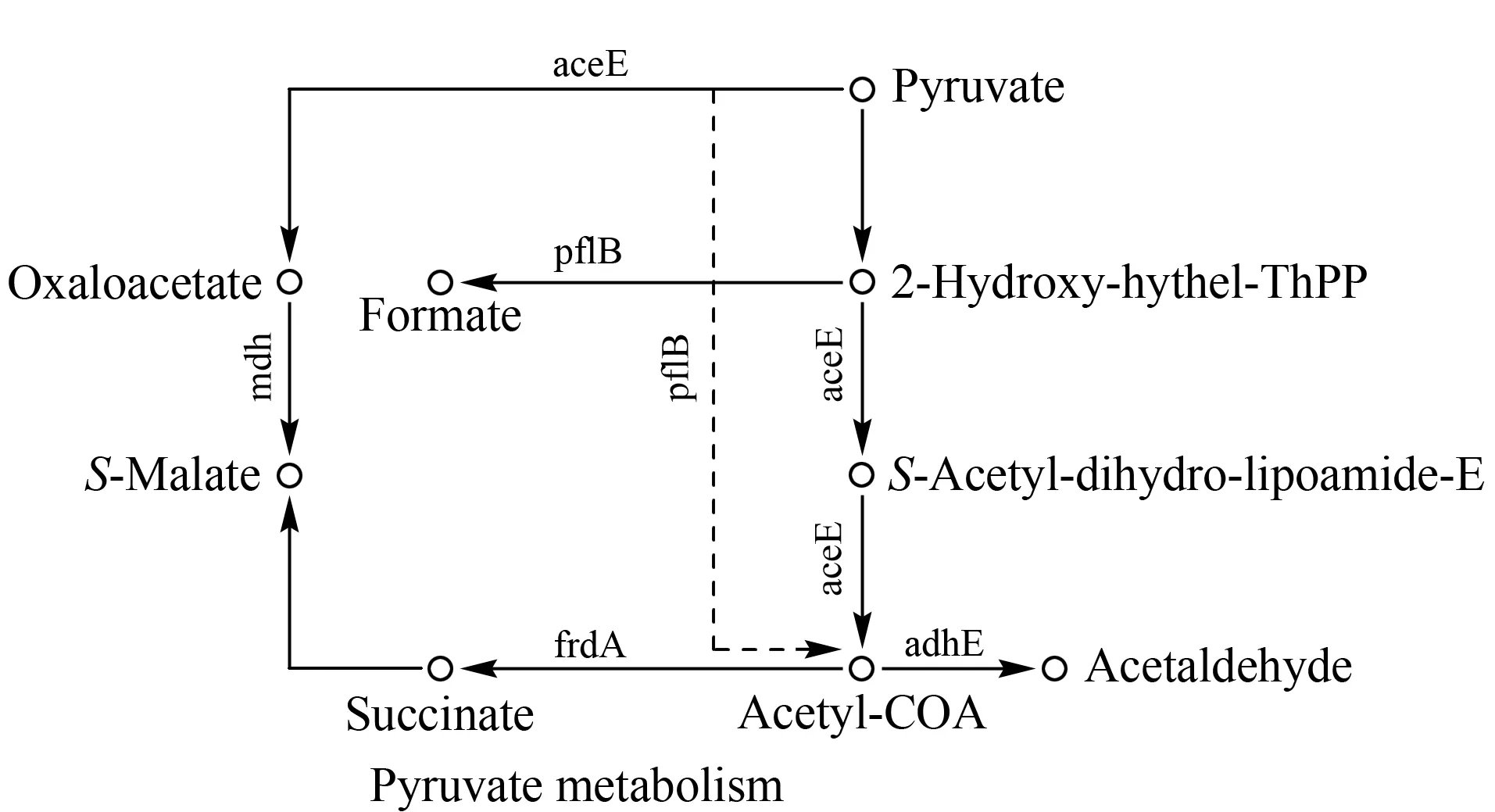
图 4 2-羟基异丁酰化修饰蛋白在丙酮酸代谢中的分布Fig. 4 Distribution of 2-hydroxyisobutyrylated proteins in pyruvate metabolism 2-Hydroxy-hythel-Thpp: 2-(α-hydroxyethyl) thiamine diphosphate; S-acetyl-dihydrolipoamide-E: dihydrolipoyllysine-residue acetyltransferase; aceE: pyruvate dehydrogenase E1 component; pflB: formate acetyltransferase; mdh; malate dehydrogenase; frdA: fumarate reductase flavoprotein subunit; adhE: aldehyde-alcohol dehydrogenase.
3 结论
本实验通过亲和富集和HPLC-MS/MS分析,在奇异变形杆菌中鉴定得到在原核生物中未见报道的212个赖氨酸2-羟基异丁酰化修饰的蛋白质和327个修饰位点。生物信息学分析表明,赖氨酸2-羟基异丁酰化修饰蛋白在奇异变形杆菌中分布广泛,存在于多种细胞器中,参与重要的生物学过程,修饰蛋白质间具有密切的联系和互作关系。重要代谢通路中的调控酶均具有这一修饰形式,表明赖氨酸2-羟基异丁酰化修饰在原核生物中具有潜在的生物学意义。
[1] Lee Y J, Lee J E, Choi H J, et al. Am J Physiol-Renal, 2011, 301(4): F883
[2] Huang F, Ramakrishnan S, Pokhrel S, et al. J Biol Chem, 2015, 290(48): 28760
[3] Mellergaard M, Skovbakke S L, Schneider C L, et al. J Biol Chem, 2014, 289(29): 20078
[4] Ibanez I, Diez-Guerra F J, Gimenez C, et al. Neuropharmacology, 2016, 107(376): 1768
[5] Ortiz R, Diaz J, Diaz N, et al. Oncotarget, 2016, 7(26): 40571
[6] Dubuissez M, Loison I, Paget S, et al. Mol Cell Biol, 2016, 36(13): 1881
[7] Huang H, Sabari B R, Garcia B A, et al. Cell, 2014, 159(2): 458
[8] Helin K, Dhanak D. Nature, 2013, 502(7472): 480
[9] Chi P, Allis C D, Wang G G. Nat Rev Cancer, 2010, 10(7): 457
[10] Huang H, Lin S, Garcia B A, et al. Chem Rev, 2015, 115(6): 2376
[11] Chen Y, Sprung R, Tang Y, et al. Mol Cell Proteomics, 2007, 6(5): 812
[12] Zhang K, Chen Y, Zhang Z H, et al. J Proteome Res, 2009, 8(2): 900
[13] Zhang Z H, Tan M J, Xie Z Y, et al. Nat Chem Biol, 2011, 7(1): 58
[14] Tan M J, Luo H, Lee S, et al. Cell, 2011, 146(6): 1015
[15] Dai L Z, Peng C, Montellier E, et al. Nat Chem Biol, 2014, 10(5): 365
Analysis of lysine 2-hydroxyisobutyrylation proteins inProteusmirabilis
DONG Hanyang, GUO Zhenchang, TIAN Shanshan, ZHAI Guijin, ZHANG Kai*
(1.TianjinKeyLaboratoryofMedicalEpigenetics,DepartmentofBiochemistryandMolecularBiology,TianjinMedicalUniversity,CollaborativeInnovationCenterofTianjinforMedicalEpigenetics,Tianjin300070,China)
Protein lysine modifications play important roles in gene regulation, transcription, metabolism and other biological processes. Lysine 2-hydroxyisobutyrylation on histones has recently been discovered as a novel protein modification, and this modification was associated with germ cell differentiation. The problem whether the novel modification may or may not exist in prokaryotes was investigated. A number of 2-hydroxyisobutyrylated proteins and sites were identified inProteusmirabilisusing affinity enrichment, high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS) and bioinformatics. The modified proteins were further characterized according to protein distribution properties, interaction networks and pathways. The results indicated that lysine 2-hydroxyisobutyrylation is widely distributed in prokaryotes, and may be significant in biological functions in prokaryotes.
high performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS); post-translational modifications (PTMs); 2-hydroxyisobutyrylation; lysine;Proteusmirabilis
10.3724/SP.J.1123.2016.08040
2016-08-31
国家重大科学研究计划(2012CB910601);国家自然科学基金项目(21275077);天津市应用基础与前沿技术研究计划项目(14JCYBJC24000).
Foundation item: National Basic Research Program of China (No. 2012CB910601); National Natural Science Foundation of China (No. 21275077); Tianjin Application Foundation and Advanced Technology Research Plan Program (No. 14JCYBJC24000)
O658
A
1000-8713(2016)12-1215-04
邹汉法研究员纪念专辑(上)·研究快报
* 通讯联系人.Tel:(022)83336833,E-mail:kzhang@tmu.edu.cn.
