表面分子印迹材料和技术在分离分析中的应用进展
2016-12-14侯会卿苏黎明黄嫣嫣金钰龙
侯会卿, 苏黎明, 黄嫣嫣, 金钰龙, 赵 睿*
(1. 中国科学院化学研究所, 中国科学院活体分析化学重点实验室, 北京 100190;2. 中国科学院大学, 北京 100049)
表面分子印迹材料和技术在分离分析中的应用进展
侯会卿1,2, 苏黎明1,2, 黄嫣嫣1,2, 金钰龙1,2, 赵 睿1,2*
(1. 中国科学院化学研究所, 中国科学院活体分析化学重点实验室, 北京 100190;2. 中国科学院大学, 北京 100049)
复杂体系的高选择性分析对分离新材料和新方法提出了迫切需求。分子印迹聚合物(MIPs)以其特异性高、化学稳定性好、制备简单且成本低等优点,在高选择性分离分析中展现出巨大的应用前景。但以本体聚合为代表的传统合成方法获得的MIPs存在识别位点位于聚合物内部难以识别、模板分子洗脱不彻底、传质速率慢、结合容量低等问题。表面印迹技术制备的核-壳型表面分子印迹材料是解决上述难题的有效途径。通过核体和壳层结构的设计和构建,表面分子印迹材料还可具备多功能、多响应的特性,适于现代分离分析对快速、高效、高选择性的要求。该文主要综述了近几年表面分子印迹技术在样品前处理、化学/生物传感分析及靶向药物递送领域的应用进展。
分子印迹聚合物;分离材料;表面印迹技术;核-壳结构;选择性分析;综述
分子印迹技术是以特定目标化合物为模板分子,通过使用适宜的功能单体与之预组装,形成最适空间适配,继而通过聚合反应将功能单体交联为一个整体,待去除模板分子后,形成尺寸、形状、识别基团可与模板分子相互匹配的空穴,从而制备出对目标模板分子具有选择性识别能力的高分子聚合物,即分子印迹聚合物(molecularly imprinted polymers, MIPs)。MIPs与模板分子间通过疏水作用、氢键、范德华力和静电作用等进行识别[1],具有构效预定性、特定识别性和广泛适用性等特点[2]。分子印迹材料与目标物的识别模式类似于抗体与抗原、受体与配体的相互作用。但相比于抗体或受体,分子印迹材料具有结构更稳定、易于大量制备、价格低廉的优势[3]。此外,对于不存在抗体的目标物,也可通过制备MIPs实现选择性识别。经过几十年的发展,分子印迹技术已成功应用于分离[4,5]、传感[6,7]、催化[8,9]和生物医药[10,11]等领域,显示出了巨大的应用价值和发展前景。
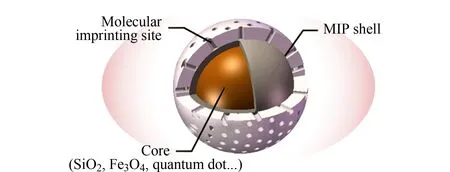
图 1 核-壳型表面分子印迹材料示意图Fig. 1 Illustration of the core-shell structure of the surface molecularly imprinted material
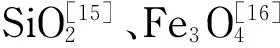
表面分子印迹技术所制备的核-壳型聚合物的大小根据其应用所需及聚合方法不同多为纳米级或微米级[25,26]。近年来,自由基聚合因其单体选择范围广、聚合条件温和、可耐受能力强而得到广泛应用。但是传统自由基聚合反应存在持续的引发、增长和终止反应,往往导致聚合不可控[27]。活性/可控自由基聚合通过降低反应体系中自由基的浓度和抑制双基终止来控制聚合产物的相对分子质量、相对分子质量分布、结构和功能[28]。原子转移自由基聚合(ATRP)法则主要通过过渡金属配合物的可逆氧化还原反应及卤原子的可逆转移实现可控聚合,是合成表面印迹聚合物壳层的常见方法之一[29]。通过二硫脂、三硫脂等具有较大链转移常数的链转移试剂来控制反应进行的可逆加成-断裂链转移(RAFT)聚合法,因具有适用单体范围广、反应过程无金属催化剂污染、反应条件温和等突出特点[30],越来越多地应用于表面分子印迹聚合物的合成[31]。
表面分子印迹材料提供了利于高选择性分离的界面,使分子识别过程向热力学和动力学的方向发展。表面分子印迹技术因其优异的性能已广泛应用于生化分离、环境分析、食品安全等领域[2,32-36]。本文针对表面分子印迹技术和材料的快速发展,对近年来该技术在样品前处理、高选择性化学/生物传感分析、药物递送等方面的应用进行了综述。
1 选择性分离与样品前处理
在复杂样品的分离分析中,样品前处理是其中的一个关键步骤[37]。表面分子印迹技术的发展为样品前处理提供了新的方向[38,39]。
固相萃取(SPE)是对样品进行分离、纯化及浓缩的预处理技术。将分子印迹技术与之结合,即以MIPs作为固体吸附剂,可以有效地提高对分析物的特异性识别能力,避免了复杂基质中干扰物的影响[40],有利于提高灵敏度、降低检出限,同时提高SPE的萃取效率。针对模板分子泄露造成干扰的问题,Hu等[41]利用2,2-双(4-羟基苯基)六氟丙烷(BPAF)代替双酚A(BPA)作为拟模板,以SiO2为核体材料合成了MIPs,将其作为SPE的吸附剂,成功地检测了水样中的BPA。将拟模板与表面印迹技术相结合,不仅避免了残留模板的干扰,而且在很大程度上提高了MIPs与目标物的结合速率与萃取效率。为提高材料的表面积和吸附容量,Yang等[42]在多壁碳纳米管(MWNTs)上合成了一层MIPs,将制备的MIPs/MWNTs用作固相萃取的吸附材料,成功地富集了猕猴桃根部的大黄素。针对MIPs与水相体系兼容的问题,本课题组以生物相容性高的聚甲基丙烯酸环氧丙酯(PGMA)微球为基质,采用表面引发原子转移自由基聚合(si-ATRP)法在其表面合成了可特异性识别2,4-二氯苯氧基乙酸的PGMA@MIPs(见图2),从而快速、高选择性地从水相基质中分离富集出有害物质[43]。Tan等[44]以丙烯酰胺为功能单体、甲基对硫磷为模板,在修饰有氨基的SiO2纳米粒子表面聚合,所得到的MIPs用于基质固相分散萃取的吸附剂,选择性地萃取梨和绿色蔬菜样品中的痕量甲基对硫磷,同时消除基质干扰。
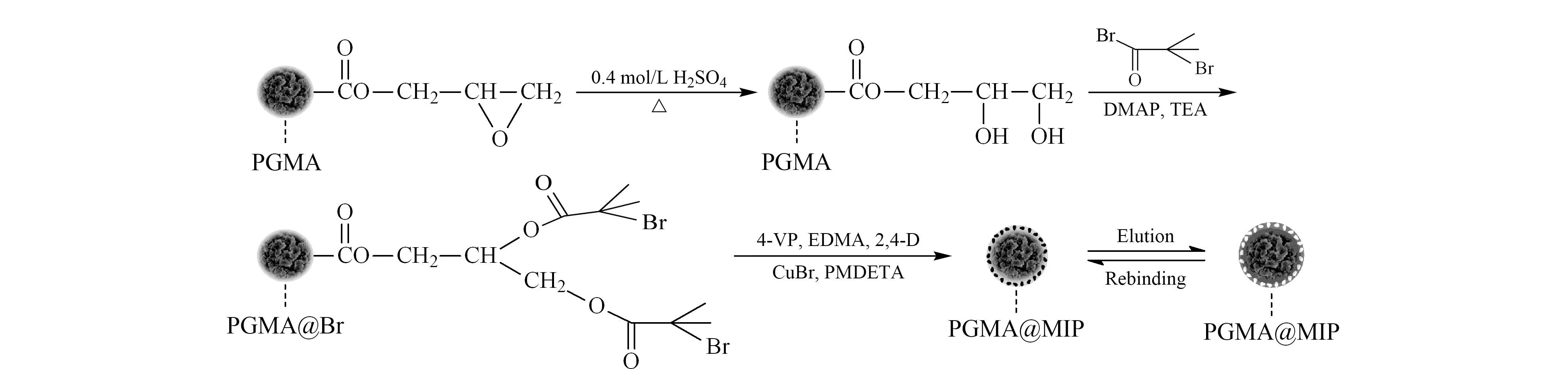
图 2 通过表面引发原子转移自由基聚合法合成大孔表面印迹聚合物PGMA@MIP的路线图[43]Fig. 2 Synthesis route diagram of macroporous surface imprinted PGMA@MIP particles prepared via surface initiated atom transfer radical polymerization method[43]PGMA: poly glycidyl methacrylate; DMAP: 4-dimethylaminopyridine; TEA: triethylamine; 2,4-D: 2,4-dichlorophenoxyacetic acid; EDMA: ethylene glycol dimethacrylate; 4-VP: 4-vinyl pyridine; PMDETA: N,N,N′,N″,N′′′-pentamethyldiethylenetriamine.
利用磁性材料的磁响应性能,将其与表面印迹技术相结合,所获得的磁性表面分子印迹材料具有快速响应和易于分离的特点。Yin等[45]以肉桂酸为模板,多巴胺为单体,在磁性MWNTs上进行表面印迹聚合,合成了一种对玄参样品中的肉桂酸、阿魏酸和咖啡酸同时具有突出磁响应特性、高吸附能力、高选择性及快速结合的新型磁性MIPs,并将其用作SPE吸附剂。Hao等[46]以17β-雌二醇为模板,以可提高印迹材料亲水性的明胶为功能单体,在修饰有醛基的磁性纳米粒子表面进行聚合,将得到的MIPs用作SPE吸附剂,以检测环境水样中的雌二醇。祁玉霞等[47]以甲基丙烯酸为功能单体,在Fe3O4磁性纳米微球表面进行聚合,制备对4-甲基咪唑(4-MI)有特异性识别能力的MIPs,并将其用作SPE的吸附剂,以选择性地富集地下水样中的4-MI。龚艳茹等[48]在硅胶表面接枝γ-(甲基丙烯酰氧)丙基三甲氧基硅烷(MPS),以异丙威为模板分子,甲基丙烯酸为单体,聚合得到表面印迹材料MIP-PMAA-MPS-SiO2,可分离富集油菜样品中的痕量异丙威。Hu等[49]以甲基三甲氧基硅烷和3-氨丙基三乙氧基硅烷为功能单体,在SiO2基质中掺杂Al3+以形成路易斯酸位点,同时与模板分子迪美唑形成金属配位相互作用,所制备的Fe3O4@SiO2@MIPs用作SPE的吸附剂,对实际样品中的迪美唑进行分离富集。郑鹏磊等[50]以青霉噻唑酸(PEOA)为模板分子,以甲基丙烯酸为功能单体,在SiO2基底表面进行聚合,制备得到可特异性识别PEOA的MIPs,将其用作萃取介质,用以快速分离分析猪肝中的致敏杂质PEOA。葛昊等[51]以罗丹明B(RhB)为模板分子,以纤维素和纳米Fe3O4制备得到的磁性纤维素微球(MCM)为基底,选用3种功能单体在MCM上进行聚合,得到可重复利用的MIP-MCM,其选择性吸附效果优异,受环境干扰小,在染料吸附处理领域具有潜在的应用前景。本课题组以超顺磁性的Fe3O4纳米颗粒为核,利用SiO2包被、氨基功能化修饰后,将RAFT聚合所需的链转移剂键合至表面,采用表面引发可逆加成-断裂链转移(si-RAFT)聚合法在磁球表面合成壳层规整的磁性MIPs纳米材料,实现了人体尿样中5种氟喹诺酮类药物分子的同时富集与检测[52](见图3)。
此外,表面分子印迹聚合物材料还应用于固相微萃取(SPME)中。Lan等[53]以雌二醇为模板、丙烯酸为功能单体,在Fe3O4@SiO2磁球表面进行聚合,得到的MIPs可通过电流的打开和关闭来控制雌二醇的吸附或解吸,将该MIPs用作SPME的吸附剂时,具有节省时间和不使用有机溶剂的特点,从而提高了从复杂基质中分离富集雌二醇的能力,有助于通过电磁控制实现前处理过程的全自动化。Shaikh等[54]将修饰有甲基丙烯酰胺(MA)的Fe3O4@SiO2复合物和N,N′-亚甲基双丙烯酰胺进行共聚合,制备的MIPs涂渍到不锈钢丝表面以制作SPME装置,用来选择性富集实际水样中超痕量硫丹Ⅰ和硫丹Ⅱ。Zhao等[55]制备了一种核-壳纳米环状结构的具有超顺磁性的MIPs,用作分散固相微萃取的吸附剂,可高效、快速地萃取鸡胸肉样品中的磺胺类药物。
物资管理作为是现代企业管理的重要组成部分,是施工企业管理的一个分支学科。当前,国内施工企业的项目材料管理基本停留在简单的出入库,对于当下动辄几亿元甚至几十亿元造价的施工项目来说这种管理方式工作效率低,控制难度大,成本费用高,信息反馈不及时,使得本来就有限的流动资金很难满足施工需要。

图 3 磁性表面分子印迹纳米颗粒及其在氟喹诺酮类药物萃取分离中的应用[52]Fig. 3 Surface imprinted magnetic nanoparticles and their application as solid phase extraction materials for fluoroquinolones[52]MIP: molecularly imprinted polymer; NIP: non-imprinted polymer; BPA: bisphenol A; SMO: sulfamethoxazole; GAT: gatifloxacin; ENRO: enrofloxacin; NOR: norfloxacin; PEF: pefloxacin; OFX: ofloxacin.
一直以来分子印迹技术在水溶性MIPs的设计和合成方面面临着巨大挑战。近几年,Zhang课题组[56,57]在表面印迹基础上通过“活性/可控”的聚合方式接枝多功能亲水性聚合物“刷子”,使制备得到的聚合物微球在水溶液体系中发挥更好的萃取效果,该研究促进了分子印迹材料在含水溶液复杂基质中分离分析的应用。Liu等[58]采用表面印迹技术合成MIPs,首先将SiO2微球装填至SPE管中,加入模板猪血清白蛋白(PSA)后,抽真空,使PSA进入SiO2孔道内部,再加入MA和甲基丙烯酸(MAA)功能单体进行聚合,最后将模板移除后得到MIPs。该方法制得的MIPs具有选择性好、吸附量高、吸附动力快及重现性好的特点,其成功地应用于消除PSA的类似物、人体血浆中含量最高的人血清白蛋白(HSA),从而提高了对低含量蛋白质的检测能力。Reubsaet等[59]采用si-RAFT聚合法,以N端保护的信号肽NLLGLIEAK九肽为模板,在多孔SiO2微球表面制备了MIPs膜,以此作为SPE的吸附剂,用于小细胞肺癌诊断标志物胃泌素释放肽前体(Pro-GRP)酶解产物的预处理。经该MIPs处理的血清样品,信号肽NLLGLIEAK被选择性富集,去除了其他多肽的干扰。李沁然等[60]首先利用戊二醛修饰硅胶颗粒表面,然后通过共价键合的方式将转铁蛋白的抗原决定基N端九肽固载于颗粒表面,最后采用RAFT聚合法使MAA和甲基丙烯酸羟乙酯在微球表面进行聚合,制备得到具有良好识别能力的MIPs。Li等[61]以HSA的组氨酸标签的抗原决定基为模板,并固定在SiO2纳米粒子的表面,以N-异丙基丙烯酰胺为主要单体,合成温敏性印迹壳层,洗脱模板后得到带有抗原决定基印迹位点的MIPs,可在45 ℃时吸附HSA,在4 ℃时释放HSA,在生物分子识别领域具有潜在应用价值。盖青青等[62]以牛血清白蛋白(BSA)和溶菌酶(Lyz)为双模板蛋白,采用ATRP法将3种功能单体在Fe3O4微球表面进行聚合,制备对BSA和Lyz有较好吸附量和选择性的MIPs。该方法为复杂生物样品中同时检测多种目标蛋白质提供了一种新途径。Liu等[63]通过化学电镀法在支撑微探针的表面镀一层金,利用硼亲和作用将模板碱性磷酸酶(ALP)固定在金层表面,通过多巴胺在探针表面聚合,制备得到ALP印迹微探针。该探针可插入单细胞,快速高效地萃取在癌细胞中过度表达的ALP,然后再修饰上有硼亲和配基的银基纳米拉曼探针标签,从而形成萃取探针-目标蛋白质-拉曼标签的三明治型复合结构,极大地增强了灵敏度,可在单分子水平下进行检测。该探针尺寸小,对细胞损伤小,萃取后细胞仍可存活。该单细胞分析技术在癌症诊断与预后、细胞质量控制、发育生物学、干细胞研究及脑科学等多个领域中具有重要的应用前景。Wang等[64]利用硼酸与顺式二羟基形成的响应型可逆硼酸酯键为固定锚点,分别以3种糖蛋白为模板,将其共价固定到修饰有硼酸的基质表面,再加入多巴胺和m-氨基苯硼酸(APBA)单体,使其在基质表面聚合,得到取向可控的印迹薄层。实验得到的MIPs具有开关响应的功能,可根据环境pH调控其对目标蛋白质的结合能力(见图4)。基于硼亲和作用的取向可控表面印迹是一种高效、通用且温和的蛋白质印迹方法。
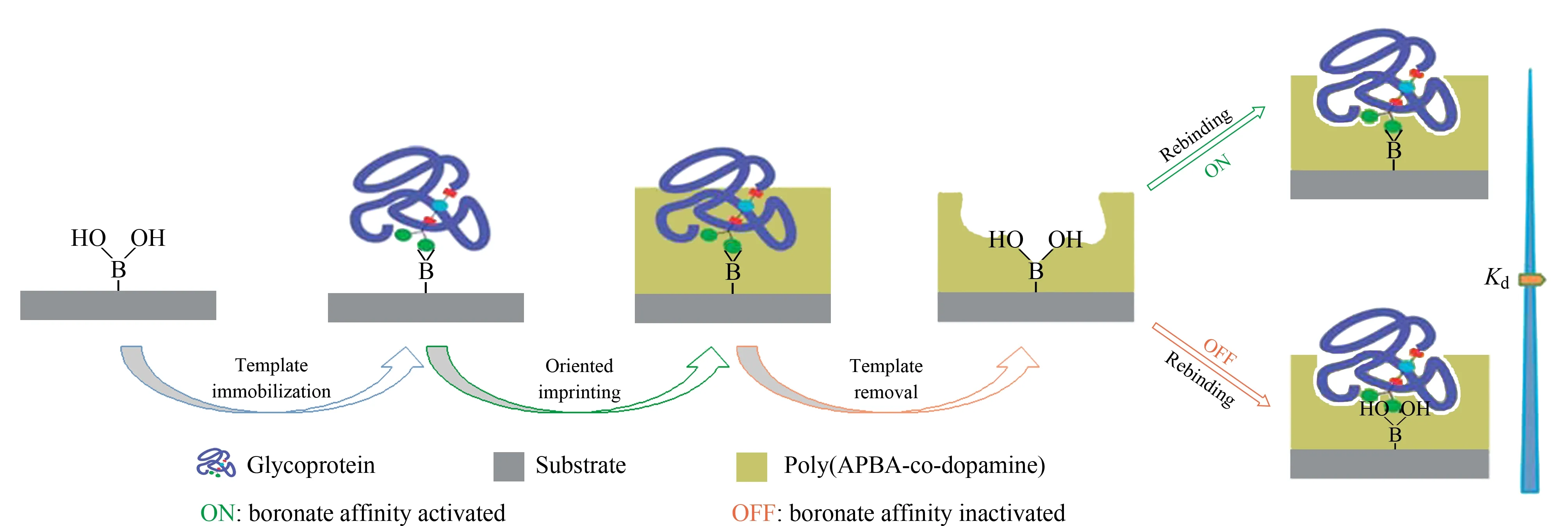
图 4 基于硼亲和作用的糖蛋白取向可控表面印迹原理图[64]Fig. 4 Schematic diagram of boronate affinity-based controllable oriented surface imprinting of glycoproteins[64]
2 化学/生物传感分析
利用分子印迹技术制备的MIPs与模板分子在官能团和空间结构上相匹配,对目标物有构效预知性和特异识别性,因而被广泛用作传感分析的识别元件[65],尤其在手性物质及异构体识别方面表现出优异的选择性。表面分子印迹技术制备的MIPs有效位点增多,且均位于或接近于表面,分布更加均匀,进一步改善了识别位点和模板分子的动力学过程,从而缩短了响应时间,降低了检出限,有利于目标物的高灵敏度、实时、在线传感分析。
将表面分子印迹分离材料与不同的传感技术结合,可发展出基于光、电、磁等不同物理化学响应的新方法。将手性分离和电化学传感结合,Wattanakit等[66]将表面活性剂Brij56与手性模板分子L-多巴胺(L-DOPA)加入铂盐溶液中,L-DOPA吸附在表面活性剂形成的溶质液晶相表面,随后电化学还原铂盐,并去除表面活性剂及模板分子,制备得到具有手性识别性能的介孔铂材料(见图5),以其作为电极,通过电化学检测,可实现多巴胺对映体的区分。利用该方法合成的材料有望应用在手性合成、对映体传感、手性分离与纯化等研究领域。Patra等[67]分别以维生素B6和5′-磷酸吡哆醛为模板,以大比表面积和高电催化活性的Fe/Cu双金属磁性纳米粒子为基底,利用电子转移来活化再生催化剂的ATRP法合成两种不同的MIPs。将其用作传感器的识别元件,可提高对模板的选择性,实现对脑脊液、血液等复杂样品中目标物的特异性检测,且无基质干扰。
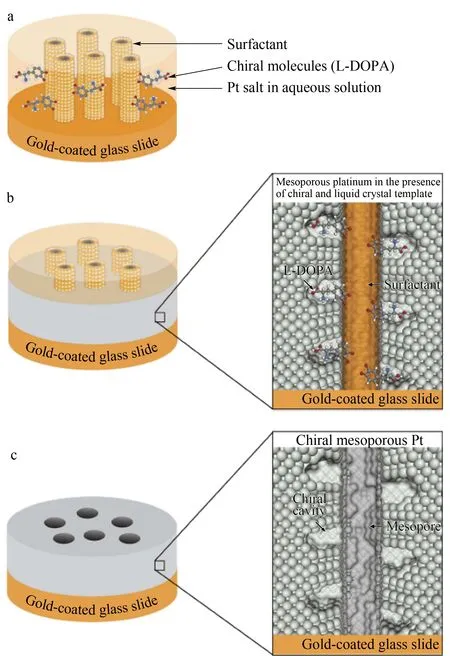
图 5 手性印迹介孔铂薄膜的构建[66]Fig. 5 Fabrication of chiral-imprinted mesoporous platinum films[66]a. interaction of the liquid crystal phase with the chiral template molecules; b. electrodeposition of platinum around the self-assembled structure; c. structure after template dissolution.
将表面分子印迹识别与荧光检测结合,可发挥各自高选择性、高灵敏度、快速、简便的优势。Zhou等[68]以多巴胺为模板,在石墨烯量子点上通过吡咯聚合,合成一种有强烈荧光发射的核-壳型MIPs,用于构建可特异性识别多巴胺的荧光传感器,当结合的多巴胺增多时,荧光强度降低。Shinde等[69]以接枝有尿素的硝基苯恶二唑荧光报告基团、4-乙烯基苯硼酸和甲基丙烯酸-2-氨基乙基酯盐酸盐为单体,在SiO2表面进行聚合,得到的聚合物可选择性识别细胞表面多糖末端的唾液酸残基,进而使环境响应型荧光分子发出强烈的荧光信号。唾液酸的过表达与包括癌症在内的很多疾病有关,因此该MIPs可实现肿瘤细胞的高灵敏检测。
传统传感器的酶、抗体等识别元件在固定化过程中存在构象改变、生物大分子在高交联聚合物中传质速度慢且重复利用性差等问题[2]。表面分子印迹技术则因印迹位点位于或接近于表面,很好地克服了前者所带有的弊端,MIPs作为识别元件不仅制备简单、成本低,而且具有稳定性好、可重复利用、选择性好、灵敏度高和寿命长[70]等特点,可用于生物大分子[71-75]、病毒[76]、细胞[77]等的高效印迹。
生物大分子印迹聚合物的制备和应用一直以来是分子印迹技术面临的一个挑战。以目标物的特征片段为模板进行表面印迹是解决上述难题的途径之一。Buchegger等[78]以细菌表面的脂多糖和脂磷壁酸为模板,利用纳米印刷技术在环氧树脂1002F薄膜上制备传感器层,用于细菌的石英晶体微天平免疫传感检测。Zhou等[79]以3-氨基苯硼酸为功能单体,在Fe3O4@SiO2纳米粒子上进行聚合,选用人免疫球蛋白G为模板,该蛋白质和人类免疫缺陷病毒1型(HIV-1)抗体(anti-HIV-1)具有相同的可结晶片段(Fc)和不同的抗原结合片段(Fab)。制备的MIPs可以超痕量选择富集anti-HIV-1,进一步通过免疫反应将修饰有辣根过氧化物酶的HIV-1(HRP-HIV-1)结合到MIPs上,形成具有三明治结构的电化学发光免疫传感器,为HIV-1感染病人的早期诊断提供一种便宜、简单且灵敏的方法。Cai等[80]利用电聚合法在碳纳米管阵列的顶端沉积了一层不导电的多元酚纳米薄层,将共沉积的目标蛋白质移去后作为传感器的平台。制备的传感器(见图6)可特异性识别人铁蛋白和人乳头瘤病毒衍生的E7蛋白,利用电化学阻抗谱进行检测,其灵敏度可达10-12g/L,另外还可指示Ca2+诱导的钙调蛋白的构象变化。
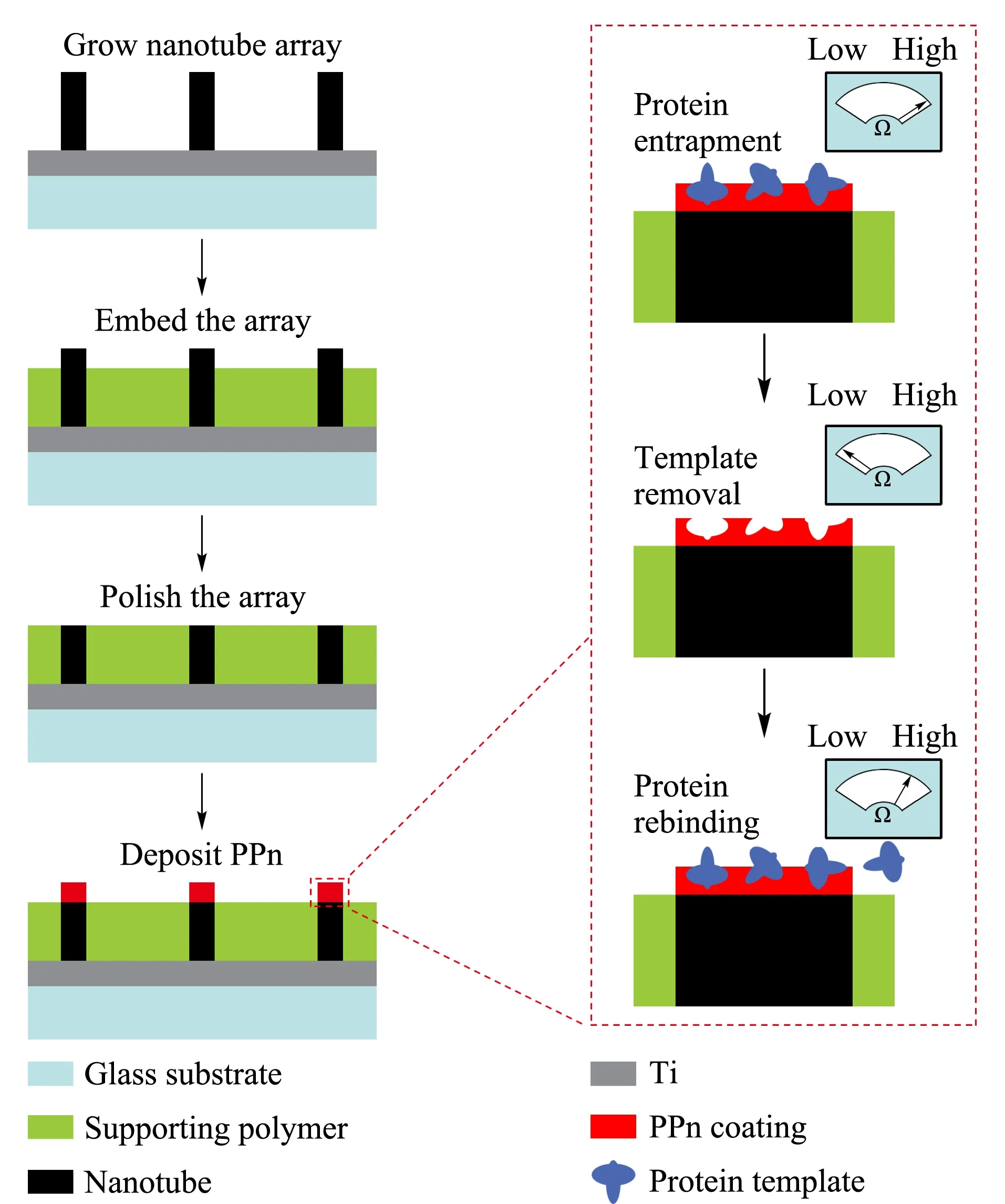
图 6 分子印迹蛋白纳米传感器的制造和目标蛋白 检测的示意图[80]Fig. 6 Schematic of nanosensor fabrication and template protein detection[80] The supporting polymer(SU8-2002) was spin-coated on a glass substrate containing nanotube arrays. Template proteins trapped in the polyphenol (PPn) coating were removed to reveal the surface imprints. Inset: hypothetical sensor impedance responses at critical stages of fabrication and detection.
不同于上述以生物大分子的特征片段为模板,Cumbo等[76]以整个病毒作为模板,利用SiO2纳米粒子作为载体材料,将其和有机硅烷的混合物孵育,然后进行缩聚,合成一种有机硅(倍半硅氧烷)识别薄层,最后将模板移除得到印迹聚合物。在水溶液中,该聚合物可在10-12mol/L的范围内特异性识别无包膜的二十面体植物病毒,且具有非常突出的选择性和亲和力。
针对蛋白质等生物分子在印迹过程中模板的固定和去除问题,金属离子与生物分子的螯合作用被广泛使用。Li等[81]以Lyz为模板,以乙烯基修饰的纳米粒子为基底,使温敏性的2-甲基-2-丙烯酸-2-(2-甲氧基乙氧基)乙酯(MEO2MA)单体和铜离子螯合单体在基底上发生共聚,制备的MIPs可高效印迹含有组氨酸标签的蛋白质。壳层温度只需增加4 ℃,便可释放出模板分子,该方法也成功印迹了含组氨酸的血红蛋白。Li等[82]通过组氨酸标签与镍之间的配位共价键作用,以修饰有6个组氨酸单元的多肽片段为模板,通过多巴胺的自聚,控制印迹壳层的厚度,制备的纳米粒子对目标蛋白质具有选择识别性,且模板利用率高。由于组氨酸标签良好的亲水性,该方法可以用于印迹不同极性的抗原决定基。
以具有疾病标志意义的生物分子为模板制备的表面分子印迹材料有望应用于生物医学的诊断中。Bi等[83]选用碱性磷酸酶为模板,用作临床检测阻塞性黄疸、原发性肝癌等疾病的指示剂,通过硼亲和作用将模板固定在修饰有硼酸盐的金层上,很好地保持了糖蛋白酶的活性,之后进行聚合反应合成MIPs壳层,将模板移除后转移到96孔板中。制备的MIPs对目标酶有很强的亲和能力,极大地排除了基质干扰,可直接检测活性,节约了检测时间、避免了酶释放时失活的可能性,具有潜在的应用前景。Panagiotopoulou等[84]发展了一种新型光聚合合成MIPs的方法,利用紫外光激发量子点,使其发射可见光诱发聚合反应,在量子点表面合成MIPs,其可特异性结合葡糖醛酸(GlcA)和N-乙酰神经氨糖酸(NANA)。该MIPs可靶向识别胞内及胞外的糖基化位点,用于多路人工免疫标记和人类角化细胞成像,为诊断和治疗方面的应用开辟了新途径。Bie等[85]以目标糖蛋白的多糖片段为模板、硼酸修饰的磁性纳米粒子为内核,利用硼亲和作用将多糖片段固定在内核表面,通过聚合形成MIPs薄层。在酸性条件下,硼酸酯键断裂,MIPs可快速释放模板分子。在复杂样品基质中,该MIPs不仅可以特异性识别整个糖蛋白,还可识别其特征片段,包括糖肽和多糖,可应用于蛋白质组学、糖组学和诊断学。
3 药物递送
以药物分子为模板,利用分子印迹技术合成的MIPs与药物间具有强相互作用,导致了药物的延迟释放,此外药物还可在特定的分子存在或环境改变(如pH、温度等)的条件下,以可控方式释放。MIPs因合成简单、可特异性结合和释放药物[86]的特点在药物递送方面表现出巨大的应用潜力,可应用于缓控释给药系统、药物载体、智能调节型给药系统、靶向给药系统以及捕获给药系统等[87]。表面分子印迹技术合成的MIPs进一步解决了MIPs中药物包埋过深无法释放、因位点不均导致药量不可控等问题,并进一步提高了有效载药量,使其在药物递送领域更具应用前景。
依据MIPs的磁响应特性来调控药物的释放。Griffete等[88]通过共沉淀制备得到磁性γ-Fe2O3纳米粒子,并利用丙烯酸与磁球表面裸露的铁离子配合来稳定磁球,以丙烯酰胺为功能单体,阿霉素(DOX)为模板进行聚合,合成得到Fe2O3@DOX-MIP纳米粒子,依靠交变磁场控制药物的释放,是多功能目标药物递送技术的新尝试。Hashemi-Moghaddam等[89]利用多巴胺在Fe3O4表面聚合得到磁性MIPs,进行活体实验时,可在外加磁场的调控下释放药物,从而抑制肿瘤生长,达到治疗乳腺癌的效果。
温敏型聚合物可根据温度的变化调节药物的释放。Li等[90]通过一锅溶胶-凝胶法制备SiO2亚微米微球,其表面修饰有ATRP引发基团,通过连续si-ATRP法聚合,在微球表面接枝含偶氮苯的MIPs壳层和聚(N-异丙基丙烯酰胺-甲基丙烯酸羟乙酯)(PNIPAAm-b-PHEMA)刷子,最后将SiO2内核移除,合成亲水性中空MIPs微球。在水溶液中,MIPs可特异性识别模板,结合能力强,对模板有明显的光及温度响应结合的特性。刷子的引入有助于提高MIPs的表面亲水性,使其在控制药物释放和智能生物分析方面具有较大的应用潜力。
pH敏感型MIPs则可根据环境pH的变化来释放药物。Zheng等[91]以5-氟脲嘧啶为模板分子,通过壳聚糖与甲基丙烯酸甲酯的表面印迹接枝共聚制备MIPs,其对模板分子表现出很强的特异性识别能力和亲和能力。药物在高pH环境中经一定时间后可体外释放。药物在胃液(pH 1.0)的刺激下并不会释放,在小肠液(pH 6.8)中会释放少许,而在结肠液(pH 7.4)中会突然全部释放,表现出很好的结肠特异性药物递送行为。Huang等[92]在Fe3O4@cellulose表面合成一层MIPs,用作抗疟药物青蒿脂的载体,通过调控pH控制药物的释放。Hemmati等[93]将N-乙烯基咪唑在Fe3O4@SiO2上进行聚合,制备得到可特异性识别槲皮素药物的MIPs,通过调控pH进行体外药物释放。门吉英等[94]以对苯乙烯磺酸钠(SSS)为功能单体,在交联聚乙烯醇(CPVA)微球上聚合,制备了茶碱(TP)分子表面印迹微球MIP-PSSS/CPVA。该印迹微球在模拟胃液中基本不释药;在小肠液中,累积释放率仅为1/5;在结肠液中则持续、缓慢地释药,表现出优良的pH敏感和时滞双重型结肠定位释药特性。
此外,还可依据光或时间进行调控。Zhang等[95]以蜂毒明肽为支架,设计得到与膜蛋白p32结构类似的多肽作为模板,以丙烯酰胺为单体,进行构象表位印迹。因膜蛋白p32在各种肿瘤细胞的表面过表达,因此该模板可以作为靶向识别肿瘤细胞的靶点。而由于聚丙烯酰胺是光敏试剂的有效载体,因此可在聚合前加入甲基蓝,得到的MIPs在光照后可产生活性氧杀伤肿瘤细胞,从而进行光动力治疗。这种构象表位印迹策略构建了一种新型肿瘤靶向药物递送系统。Wu等[96]利用两种分子模板合成MIPs,一种是肉豆蔻酸修饰的抗原片段,该抗原片段是所有幽门螺旋杆菌菌株都表达的外膜脂蛋白Lpp20暴露在外的抗原片段,所以该模板可用作靶向识别幽门螺旋杆菌的印迹位点;另一种是阿莫西林钠(AmoNA),用于形成药物印迹位点。制备的MIPs进行体外药物释放测试时,在1 h内突释;在活体荧光成像中,MIPs在已感染幽门螺旋杆菌的老鼠胃部停留时间延长;在活体幽门螺旋杆菌清除实验中,MIPs比阿莫西林具有更好的抗菌效果。因此这种双分子印迹纳米粒子对抗幽门螺旋杆菌的靶向治疗具有潜在的应用前景。
虽然利用MIPs作为药物载体取得了一些研究成果,但如何进一步提高MIPs的生物相容性、靶向性、安全性,特别是从分子水平上弄清其识别与释放机理,以提高MIPs制备的预知性和可控性是MIPs药物递送仍需面临的挑战。
4 结论
本文从高选择性分离分析的角度出发,综述了近几年表面分子印迹的新技术和新材料在样品前处理、高选择性传感分析及药物递送领域的应用进展。表面印迹技术因其印迹位点分布于或接近于聚合物表面,而极大程度地解决了传统MIPs内部位点难识别、模板分子洗脱不彻底、传质速率慢、结合容量低等问题,且随着内核支撑材料尺寸的不断减小,活性可控自由基聚合技术的引入,使得表面印迹技术获得了极大的发展。针对分离富集的应用,如何提高吸附容量仍需解决;针对生物应用,印迹材料与水相和生物体系的兼容性也是不容忽视的问题;在复杂样品的应用中,如何保证印迹位点不被基质中的杂质覆盖,在蛋白质等生物大分子的印迹中如何更好地保持其活性,如何更好地实现表面分子印迹材料对靶分子的靶向递送和可控释放等,都有待进一步的深入研究,也为拓展分离分析新材料和新方法提供了机遇。
[1] Advincula R C. Korean J Chem Eng, 2011, 28(6): 1313
[2] Chen L X, Xu S F, Li J H. Chem Soc Rev, 2011, 40(5): 2922
[3] Nestora S, Merlier F, Beyazit S, et al. Angew Chem Int Ed, 2016, 55(21): 6252
[4] Chen Y, Li D J, Bie Z J, et al. Anal Chem, 2016, 88(2): 1447
[5] Li L, Lu Y, Bie Z J, et al. Angew Chem Int Ed, 2013, 52(29): 7451
[6] Wan W, Biyikal M, Wagner R, et al. Angew Chem Int Ed, 2013, 52(27): 7023
[7] Xu D, Zhu W, Wang C, et al. Chem Commun, 2014, 50(91): 14133
[8] Chen Z Y, Xu L, Liang Y, et al. Adv Mater, 2010, 22(13): 1488
[9] Zheng C, Zhang X L, Liu W, et al. Adv Mater, 2013, 25(41): 5922
[10] Yang K G, Liu J X, Li S W, et al. Chem Commun, 2014, 50(67): 9521
[11] Chianella I, Guerreiro A, Moczko E, et al. Anal Chem, 2013, 85(17): 8462
[12] Ramstroem O, Andersson L I, Mosbach K. J Org Chem, 1993, 58(26): 7562
[13] Gao D M, Zhang Z P, Wu M H, et al. J Am Chem Soc, 2007, 129(25): 7859
[14] Wackerlig J, Schirhagl R. Anal Chem, 2016, 88(1): 250[15] Gao B J, Chen L L, Li Y B. J Chromatogr A, 2016, 1443: 10
[16] Mehdinia A, Dadkhah S, Kayyal T B, et al. J Chromatogr A, 2014, 1364: 12
[17] Liu Y X, Liu L, He Y H, et al. Biosens Bioelectron, 2016, 77: 886
[18] Qin Y P, Li D Y, He X W, et al. ACS Appl Mater Interfaces, 2016, 8(16): 10155
[19] Motlagh M G, Taher M A, Heydari A, et al. Materials Science and Engineering C, 2016, 63: 367
[20] Ton X A, Acha V, Bonomi P, et al. Biosens Bioelectron, 2015, 64: 359
[21] Uzuriaga-Sánchez R J, Khan S, Wong A, et al. Food Chem, 2016, 190: 460
[22] Hu X, Xie L W, Guo J F, et al. Food Chem, 2015, 179: 206
[23] Li H, Hu X, Zhang Y P, et al. J Chromatogr A, 2015, 1404: 21
[24] Xu C G, Uddin K M A, Shen X T, et al. ACS Appl Mater Interfaces, 2013, 5(11): 5208
[25] Blackburn W H, Lyon L A. Colloid Polym Sci, 2008, 286(5): 563
[26] Berndt I, Pedersen J S, Richtering W. Angew Chem Int Ed, 2006, 45(11): 1737
[27] Zhang H Q. Eur Polym J, 2013, 49(3): 579
[28] Hawker C J, Wooley K L. Science, 2005, 309(5738): 1200
[29] Yang Y Q, Niu H, Zhang H Q. ACS Appl Mater Interfaces, 2016, 8(24): 15741
[30] Chiefari J, Chong Y K, Ercole F, et al. Macromolecules, 1998, 31(16): 5559
[31] Li Q R, Yang K G, Liang Y, et al. ACS Appl Mater Interfaces, 2014, 6(24): 21954
[32] Whitcombe M J, Chianella I, Larcombe L, et al. Chem Soc Rev, 2011, 40(3): 1547
[33] Schirhagl R. Anal Chem, 2014, 86(1): 250
[34] Li D J, Chen Y, Liu Z. Chem Soc Rev, 2015, 44(22): 8097
[35] Chen L X, Wang X Y, Lu W H, et al. Chem Soc Rev, 2016, 45(8): 2137
[36] Ma R T, Shi Y P. Chinese Journal of Chromatography, 2016, 34(3): 223
马润恬, 师彦平. 色谱, 2016, 34(3): 223
[37] Psillakis E, Kalogerakis N. TrAC-Trends Anal Chem, 2003, 22(10): 565
[38] Chen S N, Li X, Zhao Y Y, et al. Chem Commun, 2014, 50(92): 14331
[39] Peng H L, Luo M, Xiong H, et al. J Chromatogr A, 2016, 1442: 1
[40] Yi L X, Fang R, Chen G H. J Chromatogr Sci, 2013, 51(7): 608
[41] Hu X L, Wu X, Yang F F, et al. Talanta, 2016, 148: 29
[42] Yang X, Zhang Z H, Li J X, et al. Food Chem, 2014, 145: 687
[43] Liu Y L, He Y H, Jin Y L, et al. J Chromatogr A, 2014, 1323: 11
[44] Tan L, Li W M, Li H, et al. J Chromatogr A, 2014, 1336: 59
[45] Yin Y L, Yan L, Zhang Z H, et al. J Sep Sci, 2016, 39(8): 1480
[46] Hao Y, Gao R X, Shi L, et al. J Chromatogr A, 2015, 1396: 7
[47] Qi Y X, Zhao L J, Ma M H, et al. Chinese Journal of Chromatography, 2015, 33(12): 1234
祁玉霞, 赵丽娟, 马梅花, 等. 色谱, 2015, 33(12): 1234
[48] Gong Y R, Wang Y, Dong J B, et al. Chinese Journal of Analytical Chemistry, 2014, 42(1): 28
龚艳茹, 王玥, 董佳斌, 等. 分析化学, 2014, 42(1): 28
[49] Hu C H, Deng J, Zhao Y B, et al. Food Chem, 2014, 158: 366
[50] Zheng P L, Luo Z M, Chang R M, et al. Chinese Journal of Chromatography, 2015, 33(9): 957
郑鹏磊, 罗智敏, 畅瑞苗, 等. 色谱, 2015, 33(9): 957
[51] Ge H, Huang H L, Xu M. Chemical Journal of Chinese Universities, 2016, 37(8): 1551
葛昊, 黄海龙, 徐敏. 高等学校化学学报, 2016, 37(8): 1551
[52] He Y H, Huang Y Y, Jin Y L, et al. ACS Appl Mater Interfaces, 2014, 6(12): 9634
[53] Lan H Z, Gan N, Pan D D, et al. J Chromatogr A, 2014, 1331: 10
[54] Shaikh H, Memon N, Bhanger M I, et al. J Chromatogr A, 2014, 1337: 179
[55] Zhao Y G, Zhou L X, Pan S D, et al. J Chromatogr A, 2014, 1345: 17
[56] Ma Y, Zhang Y, Zhao M, et al. Chem Commun, 2012, 48(50): 6217
[57] Zhao M, Zhang C, Zhang Y, et al. Chem Commun, 2014, 50(17): 2208
[58] Liu J X, Deng Q L, Tao D Y, et al. Sci Rep, 2014, 4: 5487
[59] Rossetti C, Qader A A, Halvorsen T G, et al. Anal Chem, 2014, 86(24): 12291
[60] Li Q R, Yang K G, Li S W, et al. Chinese Journal of Chromatography, 2014, 32(10): 1029
李沁然, 杨开广, 李森武, 等. 色谱, 2014, 32(10): 1029
[61] Li S W, Yang K G, Deng N, et al. ACS Appl Mater Interfaces, 2016, 8(9): 5747
[62] Gai Q Q, Qu F. Chinese Journal of Chromatography, 2015, 33(5): 475
盖青青, 屈锋. 色谱, 2015, 33(5): 475
[63] Liu J, Yin D Y, Wang S S, et al. Angew Chem Int Ed, 2016, 55(42): 13215
[64] Wang S S, Ye J, Bie Z J, et al. Chem Sci, 2014, 5(3): 1135
[65] Huynh T P, Kutner W. Biosens Bioelectron, 2015, 74: 856
[66] Wattanakit C, Come Y B S, Lapeyre V, et al. Nat Commun, 2014, 5: 3325
[67] Patra S, Roy E, Das R, et al. Biosens Bioelectron, 2015, 73: 234
[68] Zhou X, Ma P P, Wang A Q, et al. Biosens Bioelectron, 2015, 64: 404
[69] Shinde S, El-Schich Z, Malakpour A, et al. J Am Chem Soc, 2015, 137(43): 13908
[70] Greene N T, Shimizu K D. J Am Chem Soc, 2005, 127(15): 5695
[71] Bi X D, Liu Z. Anal Chem, 2014, 86(1): 959
[72] Tamahkar E, Kutsal T, Denizli A. Process Biochem, 2015, 50(12): 2289
[73] Li D Y, Zhang X M, Yan Y J, et al. Biosens Bioelectron, 2016, 79: 187
[74] Patra S, Roy E, Madhuri R, et al. Biosens Bioelectron, 2015, 63: 301
[75] Bhakta S, Seraji M S I, Suib S L, et al. ACS Appl Mater Interfaces, 2015, 7(51): 28197
[76] Cumbo A, Lorber B, Corvini P F X, et al. Nat Commun, 2013, 4: 1503
[77] Hu Y F, Xie L, Lu Y H, et al. ACS Appl Mater Interfaces, 2014, 6(22): 20550
[78] Buchegger P, Lieberzeit P A, Preininger C. Anal Chem, 2014, 86(3): 1679
[79] Zhou J, Gan N, Li T H, et al. Biosens Bioelectron, 2014, 54: 199
[80] Cai D, Ren L, Zhao H Z, et al. Nat Nanotechnol, 2010, 5(8): 597
[81] Li W, Sun Y, Yang C C, et al. ACS Appl Mater Interfaces, 2015, 7(49): 27188
[82] Li S W, Yang K G, Liu J X, et al. Anal Chem, 2015, 87(9): 4617
[83] Bi X D, Liu Z. Anal Chem, 2014, 86(24): 12382
[84] Panagiotopoulou M, Salinas Y, Beyazit S, et al. Angew Chem Int Ed, 2016, 55(29): 8244
[85] Bie Z J, Chen Y, Ye J, et al. Angew Chem Int Ed, 2015, 54(35): 10211
[86] Sellergren B, Allender C J. Adv Drug Deliver Rev, 2005, 57(12): 1733
[87] Zhang Y, Zhou J P. Chinese Pharmaceutical Journal, 2006, 41(21): 1605
张勇, 周建平. 中国药学杂志, 2006, 41(21): 1605
[88] Griffete N, Fresnais J, Espinosa A, et al. Nanoscale, 2015, 7(45): 18891
[89] Hashemi-Moghaddam H, Kazemi-Bagsangani S, Jamilib M, et al. Int J Pharm, 2016, 497(1/2): 228
[90] Li C X, Ma Y, Niu H, et al. ACS Appl Mater Interfaces, 2015, 7(49): 27340
[91] Zheng X F, Lian Q, Yang H, et al. Sci Rep, 2016, 6: 21409
[92] Huang H L, Wang X H, Ge H, et al. ACS Sustainable Chem Eng, 2016, 4(6): 3334
[93] Hemmati K, Masoumi A, Ghaemy M. Carbohyd Polym, 2016, 136: 630
[94] Men J Y, Gao B Q, Tang Z X, et al. Journal of Functional Polymers, 2014, 27(4): 372
门吉英, 高保娇, 唐志学, 等. 功能高分子学报, 2014, 27(4): 372
[95] Zhang Y, Deng C Y, Liu S, et al. Angew Chem Int Ed, 2015, 54(17): 5157
[96] Wu Z H, Hou J P, Wang Y Y, et al. Int J Pharmaceut, 2015, 496(2): 1006
Recent applications of surface molecularly imprinting materials and techniques for separation and analysis
HOU Huiqing1,2, SU Liming1,2, HUANG Yanyan1,2, JIN Yulong1,2, ZHAO Rui1,2*
(1.CASKeyLaboratoryofAnalyticalChemistryforLivingBiosystems,InstituteofChemistry,ChineseAcademyofSciences,Beijing100190,China; 2.UniversityofChineseAcademyofSciences,Beijing100049,China)
Novel techniques and materials are critical for the highly specific separation and analysis of complicated biosystems. Molecularly imprinted polymers (MIPs) featuring in high specificity, good chemical stability, easy preparation and low cost, have been applied successfully in many fields. However, classical MIPs still show limitations in incomplete template removal, slow mass transfer and low binding capacity, owing to the buried imprinting sites inside the polymers. The emergence of surface imprinting techniques provides a solution to the above problems. The surface location of the imprinting sites can increase efficient recognition sites, improve imprinting capacity, quicken mass transfer, facilitate the diffusion and elution. By rationally designing the core-shell structure, the surface molecularly imprinted materials show attractive potential in rapid, high efficiency and high selective separation. This review focuses on the recent developments in the applications of surface imprinting techniques, especially in the fields of sample preparation, chemical/biological sensing and targeted drug delivery.
molecularly imprinted polymers (MIPs); separation materials; surface imprinting technique; core-shell structure; selective analysis; review
10.3724/SP.J.1123.2016.09016
2016-09-05
国家自然科学基金(21375134,21475140,21675161);国家重点基础研究发展计划项目(“973”计划)(2015CB856303).
Foundation item: National Natural Science Foundation of China (Nos. 21375134, 21475140, 21675161); National Program on Key Basic Research Project of China (“973” Program) (No. 2015CB856303).
O658
A
1000-8713(2016)12-1206-09
邹汉法研究员纪念专辑(上)·专论与综述
* 通讯联系人.E-mail:zhaorui@iccas.ac.cn.
