固体微生物菌剂在克拉玛依石油污染土壤生物修复中的应用
2016-12-14顾贵洲宁春莹李法云
李 政, 顾贵洲, 宁春莹, 李法云, 杨 磊
(辽宁石油化工大学 生态环境研究院, 辽宁 抚顺 113001)
固体微生物菌剂在克拉玛依石油污染土壤生物修复中的应用
李 政, 顾贵洲, 宁春莹, 李法云, 杨 磊
(辽宁石油化工大学 生态环境研究院, 辽宁 抚顺 113001)
分析了克拉玛依石油污染土壤的理化性质,采用固体微生物菌剂对该土壤进行生物修复,考察了最优修复条件及修复过程中土壤微生物数量、酶活性和石油烃组分的变化。结果表明,克拉玛依石油污染土壤是以粉砂为主的灰漠土,含水率低,含油率高,弱碱性,土壤中三大营养元素(氮、磷、钾)的有效含量低,不利于微生物的生长繁殖。最优修复条件为土壤孔隙度55%、含水率25%、固体菌剂添加量5%、氮/磷摩尔比10、生物表面活性剂添加量0.5%,在此条件下经过60 d的生物修复,含油率由最初的4.07%下降到1.81%,降解率为55.53%,小于C27的正构烷烃得到了明显的降解,土壤中的微生物数量、酶活性(脱氢酶活性、过氧化氢酶活性和多酚氧化酶活性)均有所提高。在生物修复过程中,单靠改善外在环境条件进行生物刺激,无法有效去除石油烃,添加微生物菌剂进行生物强化是去除土壤中石油类污染物的关键因素。
固体微生物菌剂; 石油污染土壤; 生物修复; 生物强化; 生物刺激
在石油生产、贮运、炼制加工及使用过程中,由于事故、不正常操作及检修等原因会造成石油烃类的溢出和排放[1-2]。据调查,在油田石油污染严重区域,土壤中残余石油烃高于环境背景值500倍以上,含量可达5%~10%[3]。石油烃类进入土壤后,对土壤的理化性质产生很大影响,如会堵塞土壤颗粒的孔隙结构,从而使土壤的透气、透水性能降低;此外,石油烃类污染物能够与土壤中的无机氮(N)、磷(P)结合,导致土壤中有效N、P含量大量减少[4-5],土壤肥力受到严重影响;并且石油烃类物质中的多环芳烃(PAHs)具有致癌、致变、致畸等活性,能通过食物链在动、植物体内逐级富集,威胁人类的生存和健康[6-7]。
中国西北地区的克拉玛依油田,具有干旱少雨、植被覆盖少、土壤贫瘠的特点,生态系统异常脆弱,土壤一旦遭受石油污染很难自净。在石油污染土壤的治理方法中,生物修复技术被认为是最具有生命力的治理技术[8]。国内外学者在筛选石油降解菌株[9]、微生物对石油烃降解机理[10]和石油污染土壤生物修复工艺[11]方面开展了大量的研究,证明了利用生物修复技术治理石油污染土壤的可行性。目前,将高效降解菌富集液投加到石油污染土壤中进行生物强化是常用的修复技术之一。但液体菌剂存在不易运输、存放和使用的缺点,限制了微生物修复技术在原位场地修复中的应用。将固体微生物菌剂应用到石油污染土壤生物修复,并配合相应的生物刺激手段,包括为微生物生长提供所需的营养元素、优化其生长的环境条件等[12-13],在克拉玛依油田石油污染土壤生物修复中更有实际意义。笔者分析了克拉玛依石油污染土壤的理化性质,考察了最优修复条件和固体微生物菌剂对石油污染土壤的修复效果,测定了修复过程中土壤的含油率、微生物数量和土壤的酶活性的变化,为克拉玛依油田石油污染土壤原位生物修复奠定基础。
1 实验部分
1.1 材料和试剂
1.1.1 无机盐培养基(MSM)
分别将0.6 g Na2HPO4、0.2 g KH2PO4、4.0 g NaNO3、0.3 g MgSO4、0.01 g CaCl2、0.01 g FeSO4、0.5 g酵母粉按顺序逐一溶解,用蒸馏水定容至1000 mL。
1.1.2 菌源
所用菌源为前期实验筛选得到的石油降解混合菌群的菌悬液[14]。无菌条件下取一定量培养7 d的混合菌群的富集液,于22~30℃下5000 r/min离心10 min,收集菌体,用无菌的MSM清洗,5000 r/min再次离心10 min。反复清洗3次以上,制成菌悬液,测定OD600值,调整菌密度,最终使液体中石油降解菌数量为1.0×108CFU/mL。
1.1.3 土壤样品
克拉玛依油田采油二厂泄油池附近的石油污染土壤,经过破碎混匀过2 mm筛后使用。
1.1.4 生物表面活性剂
前期研究[15]发现石油降解混合菌群中的其中一株单菌为表面活性剂产生菌。经过提取纯化冷冻干燥获得生物表面活性剂固体粉末。
1.1.5 试剂
磷酸氢二钠、磷酸二氢钾、硝酸钠、硫酸镁、氯化钙、硫酸亚铁、无水硫酸钠、高锰酸钾、丙酮、正己烷、邻苯三酚(均为分析纯)、酵母粉,国药集团化学试剂有限公司产品;氯代三苯基四氮唑(TTC,纯度大于98%),Amresco公司产品;氮肥(尿素,有效氮质量分数46.8%)、磷肥(过磷酸钙,有效磷质量分数16.4%),中化集团公司产品。
1.1.6 其他材料
麦麸和草炭土购于当地农贸市场。膨松剂为长3~5 mm的干草屑,取自校园草坪,经晾晒粉碎后使用。
1.2 固体微生物菌剂的制备
将麦麸和草炭土以质量比为1混合均匀作为载体,高温灭菌后冷却到22~30℃。将50 mL菌悬液、50 mL MSM、300 mL无菌水和1000 g上述载体混合均匀,通入无菌空气,于22~30℃下培养3 d,无菌室内风干,得到石油降解菌数量约为1.0×106CFU/g的固体菌剂。
1.3 石油污染土壤生物修复条件的优化
N、P营养,水分含量和石油污染程度是石油降解菌生长繁殖的限制因素[16],因此在石油污染生物修复过程中采取投加适量的氮磷营养、定期补充适量的水分和投加生物表面活性剂改善原油的疏水性等措施,来促进降解菌的生长繁殖,从而提高石油污染土壤的修复效率;同时考虑原位修复时外在可调控因素,选择土壤孔隙度、含水率、菌剂用量、N/P比和生物表面活性剂用量5个不同因素进行实验,对修复条件进行优化。
实验在直径为18 cm、高为15 cm的盆钵中进行。每组实验用土1000 g,每1组3个平行样。将盆钵置于22~30℃下,间隔10 d取样,测定土壤的含油率。为了保证样品的均质和维持土壤中的好氧环境,采样前将土壤上下翻动混匀。
1.4 石油污染土壤生物修复实验
选择优化后的生物修复条件进行实验,测定土壤的含油率、微生物数量(细菌、真菌、放线菌和石油降解菌)和土壤酶活性(脱氢酶活性、过氧化氢酶活性和多酚氧化酶活性)。
采用稀释平板法[17]测定土壤中细菌、真菌、放线菌数量。参照最大或然数[18](Most probable number, MPN)测定土样中石油降解菌数量。参照文献[19]方法测定土壤酶活性。采用氯代三苯基四氮唑(TTC)还原法测定脱氢酶活性,以1 g干土1 h生成的甲臜(TPF)为脱氢酶的一个活性单位;采用高锰酸钾滴定法测定过氧化氢酶活性,酶活性以1 g干土1 h内消耗的0.1 mol/L KMnO4体积(以mL计)表示;采用邻苯三酚比色法测定多酚氧化酶活性,1 g干土1 h内生成的没食子素的量为多酚氧化酶的1个活性单位。
1.5 土壤理化性质的测定
参照土壤农业化学分析方法[20]测定土壤的基本理化性质。采用超声波-红外分光光度法[21]测定土壤中石油烃含量,以含油率(质量分数)表示。
1.6 石油烃气相色谱分析
采用GC-FID (CP3800)分析石油烃组分。进样量为1 μL,分流比1/2, CP5960毛细管色谱柱(30 m×0.53 mm×0.25 μm)。色谱柱初温35℃,保持2 min,10 ℃/min程序升温至350℃,保持10 min;载气为N2;进样口温度20℃,保持0.1 min,以175 ℃/min线速程序升温,终止温度350℃;检测器温度350℃。
2 结果与讨论
2.1 克拉玛依油田石油污染土壤的基本性质
用于生物修复实验的克拉玛依油田石油污染土壤的理化性质列于表1,石油污染土壤微生物数量和酶活性测定结果列于表2。未经污染的原生灰漠土是新疆主要的农业土壤,具有“白(有机碳含量低)、板(板结,土壤结构差)、干(保水保肥性差)”的特点[22]。由表1可知,实验所用土壤仍具有原生灰漠土的特性,如土壤颗粒主要以粉砂为主,孔隙度和含水率较低,容易板结,保水能力差;但也具有自身的特点,土壤含油率6.15%高于国家标准0.3%[23],有机质含量较高,含油率对有机质含量贡献较大。另外,土壤中重金属离子Cu、Zn、Pb、Cd含量均低于国家标准[23],说明土壤未遭受重金属离子的污染;土壤为弱碱性,土壤中N、P、K营养元素的有效含量不高,不利于微生物的生长繁殖。
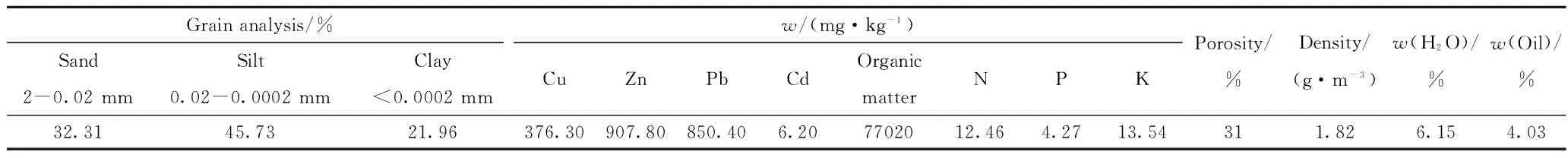
表1 克拉玛依油田石油污染土壤样品的理化性质
由表2可知,土壤中细菌的数量最多,放线菌和真菌次之,石油降解菌数量最少。土壤中脱氢酶活性、过氧化氢酶活性和多酚氧化酶活性分别为1.39 mg/(g·h)、0.56 mL/(g·h)和0.30 mg/(g·h)。

表2 克拉玛依油田石油污染土壤中的微生物数量和酶活性
2.2 克拉玛依油田石油污染土壤生物修复条件优化
2.2.1 土壤孔隙度
研究表明,添加膨松剂改善土壤的孔隙度能够提高土壤的保水和通气能力,促进降解菌生长繁殖,强化微生物降解作用[24]。将土壤样品与一定量膨松剂混合均匀,调整土壤的孔隙度分别为50%、55%、60%、65%,接种质量分数为5%的固体菌剂,并作同等条件下土壤孔隙度为原始值(31%)的对照实验。定期补充水分保持土壤含水率为20%,间隔10 d翻动土壤,同时取样测定土壤中的含油率,结果示于图1。

图1 不同孔隙度石油污染土壤的含油率随培养时间的变化
由图1可以看出,当土壤的孔隙度为原始值31%,即不添加膨松剂时,土壤中的石油烃降解不明显,60 d修复之后土壤含油率仅下降0.58%;添加膨松剂改变土壤的孔隙度后,土壤中的石油烃得到明显降解,孔隙度为55%、60%和65%的土壤经过60d修复土壤含油率变化明显,由最初的4.05%下降到2.5%以下,降解率均达到40%以上;但随着膨松剂添加量的增多,土壤孔隙度变大,导致土壤的持水性变差,水分补充的频率变高。综合考虑,选择孔隙度为55%的土壤为最适修复条件。
2.2.2 土壤含水率
将土壤样品与一定量膨松剂混合均匀,调整土壤的孔隙度为55%,接种质量分数为5%的固体菌剂,定期补充水分保持土壤含水率分别为15%、20%、25%、30%、35%,间隔10d翻动土壤,同时取样测定土壤中的含油率,结果示于图2。

图2 不同含水率石油污染土壤中含油率随培养时间的变化
土壤含水率对土壤中微生物影响显著,是影响石油降解菌生长繁殖的限制因素[16]。贾建丽等[25]也发现,水分是石油污染土壤微生物多态性的关键限定性因子,是制约石油污染土壤微生物多态性的重要因素。由图2可知,当土壤含水率低于20%时,土壤含油率在生物修复的第30 d才得到较大幅度的下降,而当土壤含水率高于20%时,土壤含油率在生物修复的第20 d就得到较大幅度的下降,可见含水率影响降解菌对石油烃的利用速率。随着土壤含水率的提高,土壤中石油烃含量逐渐降低,当含水率为25%时,经过60 d的生物修复,土壤含油率由4.05%降低为2.42%,石油烃降解率达到40.25%;继续提高含水率,含油率降低不明显,同时考虑原位修复时当地干旱少雨、水资源短缺,保持土壤中较高的含水率很难实现,因此,选择土壤含水率25%为最适修复条件。
2.2.3 菌剂用量
将土壤样品与一定量膨松剂混合均匀,调整土壤的孔隙度分别为55%,分别接种质量分数为3%、5%、7%、9%的固体菌剂,同时作同等条件不添加菌剂的对照实验,定期补充水分保持土壤含水率为25%,间隔10 d翻动土壤,同时取样测定土壤中的含油率,结果示于图3。
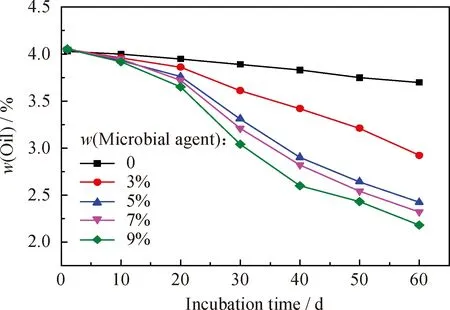
图3 不同菌剂用量下石油污染土壤中含油率随培养时间的变化
由图3可以看出,不添加菌剂的石油污染土壤的含油率变化不大,表明其中的石油烃降解不明显,而所有添加菌剂的土壤样品的石油烃得到明显降解,说明菌剂加入可以明显改善土壤的修复效果。随着菌剂添加量的增大,土壤的含油率逐渐降低,石油烃的降解率升高;当添加5%的固体菌剂修复石油污染土壤60 d后,土壤的含油率由最初的4.05%降低到2.40%,降解率为40.74%;而当菌剂添加量继续增大,土壤的含油率虽然也逐渐降低,但幅度变小,而且菌剂添加量较大会增加成本,从经济上会造成不必要的浪费。综合考虑,选择固体菌剂添加量为5%。
2.2.4 土壤的n(N)/n(P)
将一定量的氮肥、磷肥溶解后添加到石油污染土壤样品中,使土壤有效P质量分数为200 mg/kg,通过调整氮肥含量使土壤中n(N)/n(P)分别为5、10、15、20,然后与一定量膨松剂混合均匀,调整土壤的孔隙度为55%,接种质量分数为5%的固体菌剂,定期补充水分保持土壤含水率为25%,间隔10 d翻动土壤,同时取样测定土壤中的含油率,结果示于图4。
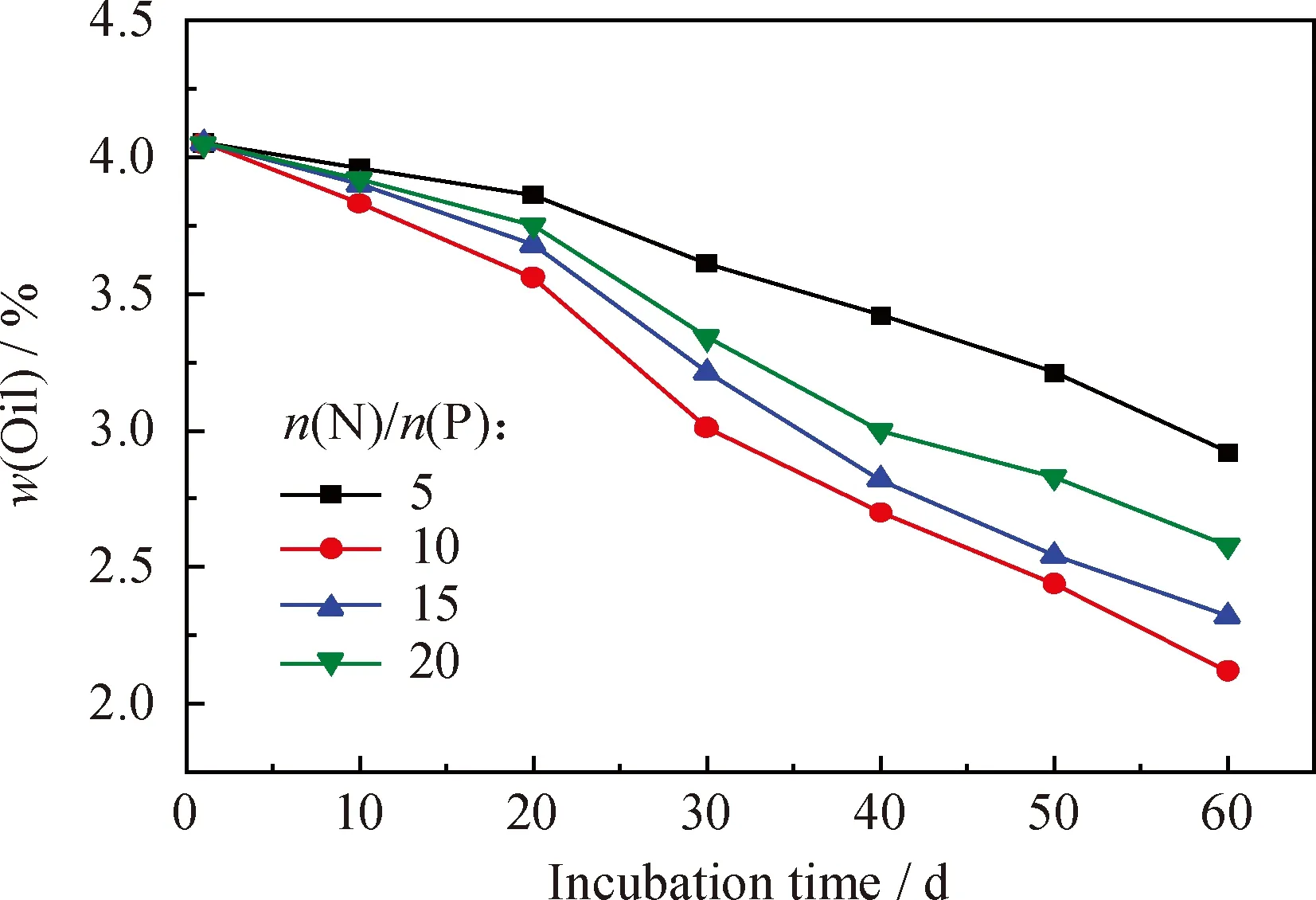
图4 不同n(N)/n(P)的石油污染土壤的含油率随培养时间的变化
N、P是微生物新陈代谢和繁殖所必须的营养物质。降解石油的细菌细胞化学组成可以用C106H180O45N16P1表示[26],因此石油污染土壤生物修复的最佳可生物利用的n(C)∶n(N)∶n(P)为100∶15∶1。当土壤受到石油烃的污染以后,碳源过量,对比微生物降解所需最佳n(C)∶n(N)∶n(P),土壤中生物可利用的N、P元素严重不足,限制微生物的生长繁殖[27-28]。因此在进行石油污染土壤修复时,需要添加相应营养元素来满足土壤中微生物的营养需求,增强土壤微生物活性,从而加快石油烃的分解。由图4可知,经过60 d的生物修复,n(N)/n(P)为10的实验组土壤含油率减少最明显,由初始的4.03%降低为2.12%,石油烃降解率为47.39%。n(N)/n(P)过低或者过高均不利于土壤中石油烃的降解,这是因为n(N)/n(P)过低时,其中的N、P营养不能达到微生物生长繁殖所需要的比例,限制微生物的代谢;n(N)/n(P)过高,N、P营养过剩会对微生物产生毒害作用[29]。因此,选择n(N)/n(P)为10为最适修复条件。
2.2.5 生物表面活性剂用量
将一定量的氮肥、磷肥溶解后添加到土壤中,调整土壤的n(N)/n(P)为10,然后与一定量膨松剂混合均匀,调整土壤的孔隙度为55%,接种质量分数为5%的固体菌剂,分别添加质量分数为0.1%、0.3%、0.5%、0.7%的生物表面活性剂,并作同等条件下不添加表面活性剂的对照实验,定期补充水分保持土壤含水率为25%,间隔10 d翻动土壤,同时取样测定土壤中的含油率,结果示于图5。
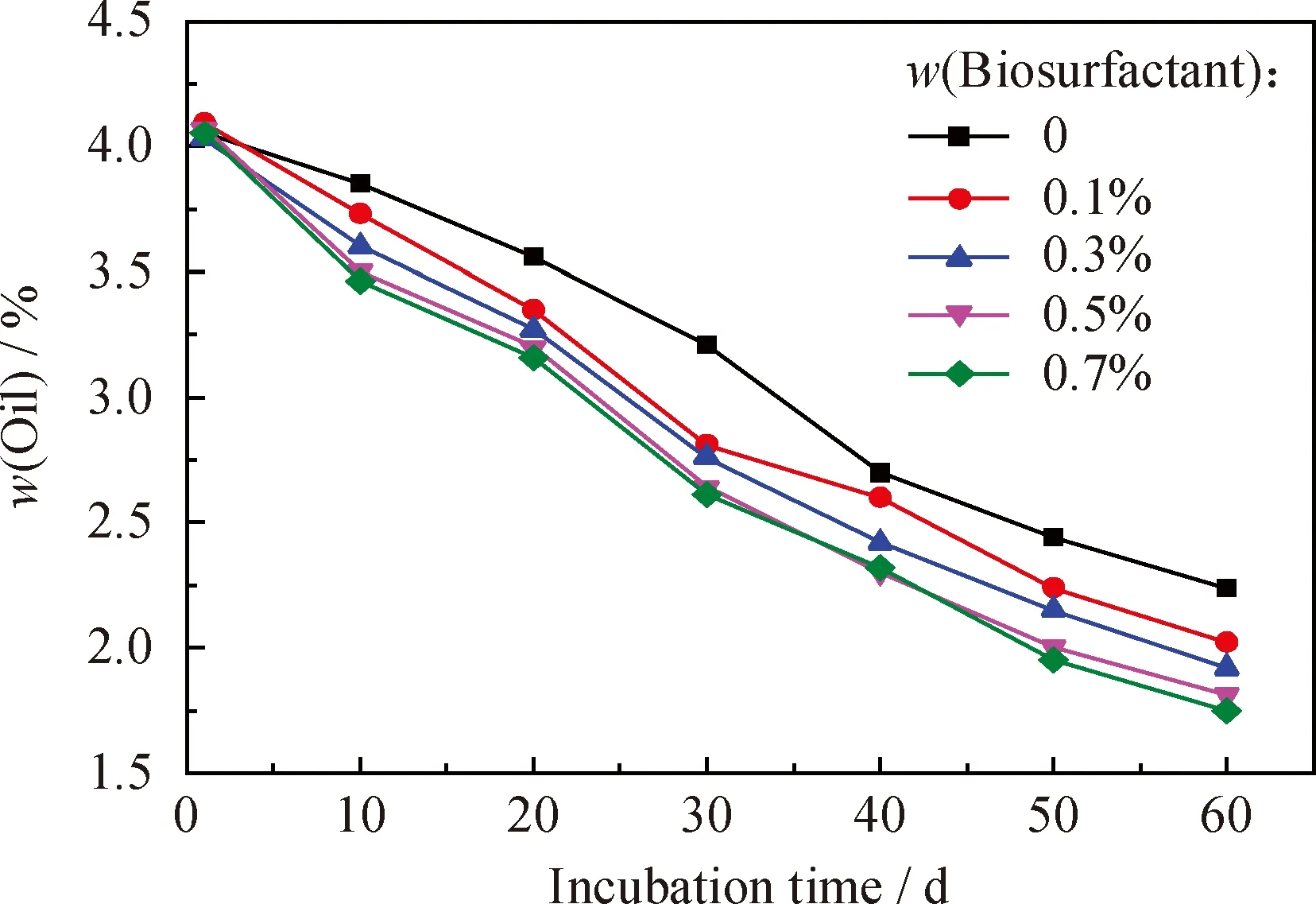
图5 不同生物表面活性剂添加量时石油污染土壤的含油率随培养时间的变化
在石油污染土壤的生物修复过程中,污染物从土壤表面到细胞内部的传递速率是生物降解的一大限制因素。表面活性物质的加入能够改善原油的疏水性,降低土壤颗粒对原油的吸附性,加快这一传质过程,从而提高其生物可利用性[30]。与化学合成的表面活性剂相比,生物表面活性剂具有无毒或者低毒的优点,并且可生物降解,对环境的影响较小,因而非常适合在环境领域应用。由图5可以看出,经过60 d的生物修复,添加生物表面活性剂的实验组土壤样品的含油率降低更加显著。由于该生物表面活性剂为混合菌群本身降解过程中产生的代谢产物,不对土壤中其它降解菌产生毒性,且同时参与了某些降解菌的共代谢过程,因此具有较好的降解效果。随着表面活性剂添加量的增加,土壤的含油率逐渐降低,当添加生物表面活性剂质量分数为0.5%时,土壤含油率由4.07%下降到1.81%,石油烃降解率为55.53%;添加表面活性剂质量分数为0.7%时,石油烃降解率为56.79%。综合考虑,选择生物表面活性剂添加量为质量分数0.5%是最适生物修复条件。
综上所述,石油污染土壤生物修复的优化条件为土壤孔隙度55%、土壤含水率25%、固体菌剂添加量5%、n(N)/n(P)=10、生物表面活性剂添加量0.5%。
2.3 石油污染土壤生物修复效果
2.3.1 土壤含油率的变化
在上述优化的生物修复条件下对石油污染土壤室内生物修复60 d,土壤含油率的变化如图6所示。
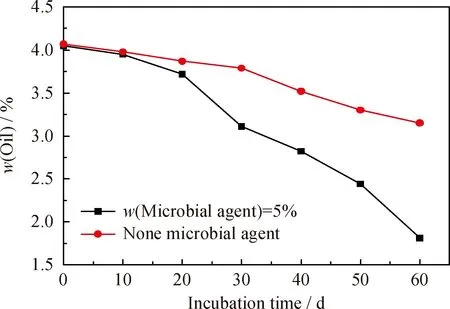
图6 优化条件下石油污染土壤修复中含油率随培养时间的变化
由图6可知,对于添加微生物菌剂的土壤,在修复最初的20 d,含油率变化不大,此时降解菌可能处在适应阶段,还没发挥降解作用;在20~50 d,含油率迅速降低,表明降解菌已经开始适应该土壤环境,在大量增殖的同时降解了污染物;而50 d之后,降解速率变缓,可能是因为此时营养物质消耗殆尽,并且原油中容易被微生物利用的组分变少,剩余的难于被降解甚至有毒的组分较多,从而导致降解速率变慢;添加菌剂的土壤修复60 d,含油率由最初的4.07%下降到1.81%,降解率为55.53%。而同等条件不添加菌剂的土壤含油率变化不大,仅由最初的4.07%下降到3.15%,石油降解率为22.6%,远低于添加菌剂的土壤。可见,对于石油烃降解菌含量(3.24×103CFU/g,见表2)较少的土壤,单纯的通过添加营养物质(氮、磷肥)、改善土壤的理化性质(增大孔隙度、增大含水率)以及改善原油的性状(添加生物表面活性剂)等措施来刺激土壤中固有降解菌达到降解石油烃的目的不可行,必须再投加具有高效降解石油烃能力的菌剂,才可以有效地强化生物修复的速率和效果。
2.3.2 石油烃组成的变化
石油污染土壤添加微生物菌剂和对照土壤样品室内生物修复60 d后石油烃组成的气相色谱示于图7。从图7可以看出,经过60 d的生物修复,与对照土壤相比,添加菌剂的石油污染土壤中小于C27的烃类得到了明显的降解。说明低碳数的烃类组分在修复过程中优先被微生物利用,而菌剂对高碳原子数石油烃的利用率低[31]。

图7 石油污染土壤修复60 d后残余石油烃组分的气相色谱
2.3.3 土壤微生物数量的变化
石油污染土壤经微生物菌剂室内生物修复60 d过程中微生物数量的变化如图8所示。由图8可知,整个修复过程中,真菌的数量变化不大,放线菌数量略有升高,细菌和石油降解菌数量变化规律基本一致,变化幅度最大。土壤中固有的石油降解菌含量较少,而添加菌剂后,石油降解菌数量由3.24×103CFU/g(见表2)增加到1.04×104CFU/g,对应的细菌的数量也有很大的增加。在修复最初的20 d,石油降解菌数量增加缓慢,这是因为此时菌群处于适应期,生长代谢较慢;之后,随着菌群逐渐适应土壤环境,石油降解菌大量生长繁殖,在修复的第50 d,石油降解菌数量增加到1.15×106CFU/g,在第60 d增加到1.6×106CFU/g,占细菌总数(2.0×106CFU/g)的80%。在土壤中内源性烃降解菌数量大于106CFU/g时,土壤中石油烃污染物降解速率会较快[32],因此,在生物修复的第50 d应该采取一定的措施,如适当的添加营养、增加土壤中的氧气含量等来改善石油降解菌的外部生长环境,促进污染物的进一步降解。

图8 石油污染土壤微生物数量随培养时间的变化
2.3.4 土壤酶活性的变化
在土壤生态系统的物质循环和能量转化中,土壤酶起着非常重要的作用,它催化土壤中的一切生物化学反应,反映土壤中各种生物化学过程的强度和方向[33]。当土壤受到石油的污染后,土壤系统中酶活性会受到一定的影响,它能够有效地促进土壤中的有机污染物进行净化。 土壤酶作为土壤的组成部分,是土壤生物活性的一个重要指标,其活性的大小反映土壤中生化反应的方向强度[34]。微生物菌剂对石油污染土壤室内生物修复60 d过程中,土壤中脱氢酶活性、过氧化氢酶活性以及多酚氧化酶活性的变化列于表3。
脱氢酶属于胞内酶,是土壤中很重要的一种酶,它能够催化有机物质脱氢,起着氢的中间转化传递作用,因此脱氢酶活性可以反映处理体系内活性微生物量及其对有机物的降解活性,进而评价降解性能[35]。过氧化氢酶广泛存在于微生物的细胞中,是参与土壤中物质和能量转化的一种重要的氧化还原酶[36]。过氧化氢酶是在生物呼吸过程中和有机物质的生物化学氧化反应过程中形成,在土壤营养物质的转化过程中起着重要的作用,它可以分解土壤中对微生物有害的过氧化氢物(微生物的呼吸作用及土壤有机物氧化分解过程中会产生一定浓度的过氧化氢物),参与土壤有机碳的转化,为土壤微生物活动提供一个良好的土壤环境,并在一定程度上反映了土壤生物化学过程的强度,而且与土壤肥力状况关系密切[37]。土壤中的多酚氧化酶是一类含铜的氧化还原酶,能将土壤腐殖质组分中芳香族化合物氧化成醌,醌与土壤中蛋白质、氨基酸、 糖类、矿物等物质反应生成大小相对分子质量不等的有机质,完成土壤芳香族化合物循环,促进土壤有机碳的累积,改善土壤物理性状[38]。多酚氧化酶与土壤中芳烃和酚类的降解密切相关[39]。
由表3可知,在生物修复的过程中,土壤中脱氢酶活性、过氧化氢酶活性和多酚氧化酶活性均发生了较大的变化,均随着修复时间的增长不断升高。
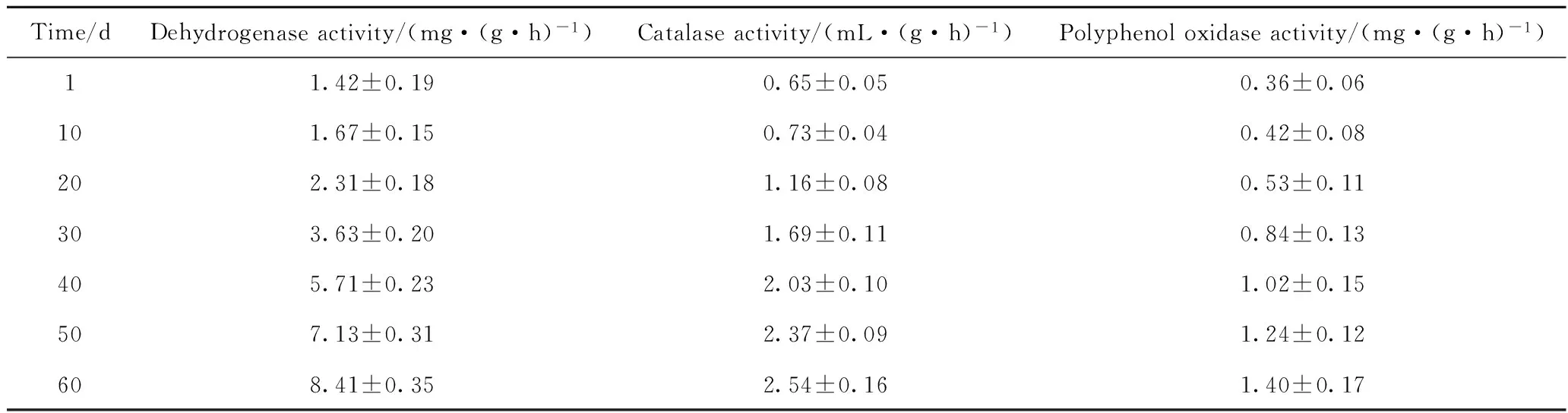
表3 石油污染土壤室内生物修复60 d过程中酶活性随培养时间的变化
经过60 d的生物修复,土壤中脱氢酶活性增加幅度较大,说明石油污染土壤中氢原子的传递速率增加,石油类有机污染物的氧化分解速率加快;过氧化氢酶活性逐渐升高,这是因为在生物修复过程中土壤微生物大量增加,尤其是石油降解菌大量繁殖,使土壤中的石油烃得到氧化分解,同时也产生大量过氧化氢,微生物为避免细胞膜等被氧化而分泌更多的过氧化氢酶,导致土壤中过氧化氢酶活性增大;多酚氧化酶活性逐渐升高,这是因为在生物修复过程中石油污染土壤中的芳烃被氧化为酚类物质,刺激微生物产生大量多酚氧化酶,使土壤的多酚氧化酶活性增大。
3 结 论
(1)从克拉玛依油田采集的石油污染土壤为灰漠土,成分以粉砂为主,土壤未遭受重金属离子的污染,含水率低,含油率6.15%高于国家标准,弱碱性,土壤中三大营养元素(N、P、K)的有效含量很低,不利于微生物的生长繁殖。
(2)使用固体微生物菌剂对该石油污染土壤进行修复的优化条件为土壤孔隙度55%、土壤含水率25%、固体菌剂添加量5%(质量分数)、n(N)/n(P)为10、生物表面活性剂添加量0.5%(质量分数)。
(3)在生物修复过程中,单靠改善外在环境条件进行生物刺激不能有效去除石油烃,添加微生物菌剂进行生物强化是去除土壤中石油烃的关键因素。在最优修复条件下,添加菌剂的土样经过60 d的生物修复,含油率由最初的4.07%下降到1.81%,降解率为55.53%,小于C27的正构烷烃得到了明显的降解,并且在生物修复过程中微生物数量、土壤的酶活性(脱氢酶活性、过氧化氢酶活性和多酚氧化酶活性)均有所提高。
[1] BANDURA L, FRANUS M, JZEFACIUK G, et al. Synthetic zeolites from fly ash as effective mineral sorbents for land-based petroleum spills cleanup[J].Fuel, 2015, 147: 100-107.
[2] WANG J, ZHENG Y, WANG A. Effect of kapok fiber treated with various solvents on oil absorbency[J].Industrial Crops and Products, 2012, 40: 178-84.
[3] 胡迪, 李川, 董倩倩, 等. 油田区土壤石油烃组分残留特性研究[J].环境科学, 2014, 35(1): 227-232.(HU Di, LI Chuan, DONG Qianqian, et al. Compositions and residual properties of petroleum hydrocarbon in contaminated soil of the oilfields[J].Environmental Science, 2014, 35(1): 227-232.)
[4] 孙铁珩, 周启星, 李培军. 污染生态学[M].北京: 科学出版社, 2001.
[5] 苏增建, 李敏, 王颖. 土壤石油污染的生物修复原理及研究进展[J].安徽农业科学, 2007, 35(6): 1742-1744.(SU Zengjian, LI Min, WANG Ying. Principle and research status of bioremediation to soil polluted by oil[J].Journal of Anhui Agricultural Sciences, 2007, 35(6): 1742-1744.)
[6] 廉景燕, 哈莹, 黄磊, 等. 石油污染土壤物化修复前后生物毒性效应[J].环境科学, 2011, 32(3): 870-874.(LIAN Jingyan, HA Ying, HUANG Lei, et al. Biological toxicity effect of petroleum contaminated soil before and after physicochemical remediation[J].Environmental Science, 2011, 32(3): 870-874.)
[7] VASUDEVAN N, RAJARAM P. Bioremediation of oil sludge-contaminated soil[J].Environment International, 2001, 26(5-6): 409-411.
[8] 卢晓霞, 李秀利, 马杰, 等. 焦化厂多环芳烃污染土壤的强化微生物修复研究[J].环境科学, 2011, 32(3): 864-869.(LU Xiaoxia, LI Xiuli, MA Jie, et al. Enhanced bioremediation of coking plant soils contaminated with polycyclic aromatic hydrocarbons[J].Environmental Science, 2011, 32(3): 864-869.)
[9] 王佳楠, 石妍云, 郑力燕, 等. 石油降解菌的分离鉴定及4株芽胞杆菌种间效应[J].环境科学, 2015, 36(6): 2245-2251.(WANG Jianan, SHI Yanyun, ZHENG Liyan, et al. Isolation and identification of petroleum degradation bacteria and interspecific interactions among fourBacillusstrains[J].Environmental Science, 2015, 36(6): 2245-2251.)
[10] ABED R M M, SAFI N M D, KÖSTER J, et al. Microbial diversity of a heavily-polluted microbial mat and its community changes following degradation of petroleum compounds[J].Applied and Environmental Microbiology, 2002, 68(4): 1674-1683.
[11] GOMEZ F, SARTAJ M. Field scale ex-situ bioremediation of petroleum contaminated soil under cold climate conditions[J].International Biodeterioration & Biodegradation, 2013, 85: 375-382.
[12] 张秀霞, 滕芝, 吴佳东, 等. 激活剂对石油污染土壤修复的强化作用及修复条件的优化[J].石油学报(石油加工), 2013, 29(2): 353-358.(ZHANG Xiuxia, TENG Zhi, WU Jiadong, et al. Strengthening bioremediation of oil contaminated soil by activation agent and optimization of bioremediation conditions[J].Acta Petrolei Sinica (Petroleum Processing Section), 2013, 29(2): 353-358.)
[13] BRZESZCZ J, STELIGA T, KAPUSTA P, et al. R-strategist versus K-strategist for the application in bioremediation of hydrocarbon-contaminated soils[J].International Biodeterioration & Biodegradation, 2016, 106: 41-52.
[14] LI Zheng, GU Guizhou, ZHAO Chaocheng, et al. Degradation characteristics and community structure of a hydrocarbon degrading bacterial consortium[J].China Petroleum Processing and Petrochemical Technology, 2015, 17(3): 15-24.
[15] LI Zheng, ZHAO Chaocheng, ZHANG Yunbo, et al. Structure and characterization of a biosurfactant produced by Pseudomonas aeruginosa strain KO9[C]//The 5th International Conference on Bioinformatics and Biomedical Engineering, 2011: 1-4.
[16] 李政, 梁昌峰, 赵朝成, 等. 应用SPSS软件分析石油污染土壤微生态环境[J].石油学报(石油加工), 2012, 28(2): 345-351.(LI Zheng, LIANG Changfeng, ZHAO Chaocheng, et al. Analysis of microbial ecosystem in petroleum polluted soils by statistic analysis software SPSS[J].Acta Petrolei Sinica (Petroleum Processing Section), 2012, 28(2): 345-351.)
[17] 沈萍, 范秀容, 李广武. 微生物学试验(第三版)[M].北京: 高等教育出版, 1999.
[19] 关松荫. 土壤酶及其研究法[M].北京: 农业出版社, 1986.
[20] 鲁如坤. 土壤农业化学分析方法[M].北京: 中国农业科技出版社, 1999: 13-165.
[21] 唐松林. 红外光度法测定土壤中的石油类[J].中国环境监测, 2004, 20(1): 36-38.(TANG Songlin. Using the method of infrared luminosity to determine the petroleum in soil[J].Environmental Monitoring in China, 2004, 20(1): 36-38.)
[22] 顾美英, 刘洪亮, 李志强, 等. 新疆连作棉田施用生物炭对土壤养分及微生物群落多样性的影响[J].中国农业科学, 2014, 47(20): 4128-4138.(GU Meiying, LIU Hongliang, LI Zhiqiang, et al. Impact of biochar application on soil nutrients and microbial diversities in continuous cultivated cotton fields in Xinjiang[J].Scientia Agricultura Sinica, 2014, 47(20): 4128-4138.)
[23] 中华人民共和国环保部. GB4284-84农用污泥中污染物控制标准[S].北京: 中国标准出版社, 1984.
[24] 吴俊松, 刘建, 刘晓菲, 等. 稻麦秸秆集中沟埋还田对麦田土壤物理性质的影响[J].生态学报, 2016, 36(7): 65-70.(WU Junsong, LIU Jian, LIU Xiaofei, et al. Effects of rice and wheat straw ditch-buried returns on the soil physical properties of wheat fields[J].Acta Ecologica Sinaca, 2016, 36(7): 65-70.)
[25] 贾建丽, 李广贺, 张旭, 等.基于PCR-DGGE技术的石油污染土壤微生物多态性[J].清华大学学报(自然科学版), 2005, 45(9): 1217-1220.(JIA Jianli, LI Guanghe, ZHANG Xu, et al. Microbial communities in petroleum polluted soils by PCR-DGGE[J].Journal of Tsinghua University (Science and Technology), 2005, 45(9): 1217-1220.)
[26] GRAHAM D W, SMITH V H, CLELAND D L, et al. Effects of nitrogen and phosphorus supply on hexadecane biodegradation in soil systems[J].Water, Air and Soil Pollution , 1999, 111(1-4): 1-18.
[27] 刘五星, 骆永明, 滕应, 等. 石油污染土壤的生态风险评价和生物修复Ⅲ石油污染土壤的植物-微生物联合修复[J].土壤学报, 2008, 45(5): 994-999.(LIU Wuxing, LUO Yongming, TENG Ying, et al. Eco-risk assessment and bioremediation of petroleum contaminated oil Ⅲ PPhyto-microbial remediation of petroleum contaminated soil[J].Acta Pedologica Sinica, 2008, 45(5): 994-999.)
[28] 邵辉煌, 李广贺, 章卫华, 等. 包气带油污土层生物修复现场控制性因素的评价[J].中国环境科学, 2001, 21(6): 519-522.(SHAO Huihuang, LI Guanghe, ZHANG Weihua, et al. Evaluation of the in-situ limiting factors of the bioremediation of the oily soil in the vadose zone[J].China Environmental Science, 2001, 21(6): 519-522.)
[29] WANG Q, ZHANG S, LI Y, et al. Potential approaches to improving biodegradation of hydrocarbons for bioremediation of crude oil pollution[J].Journal of Environmental Protection, 2011, 2: 47-55.
[30] MAKKAR R S, ROCKNE K J. Comparison of synthetic surfactants and biosurfactants in enhancing biodegradation of polycyclic aromatic hydrocarbons[J].Environmental Toxicology Chemistry, 2003, 22(10): 2280-2292.
[31] 赵东风, 吴伟林, 张云波, 等. 克拉玛依石油污染土壤生物修复的初步研究[J].石油学报(石油加工), 2012, 28(4): 696-704.(ZHAO Dongfeng, WU Weilin, ZHANG Yunbo, et al. Primary study on the bio-remediation of oil contaminated soil of Karamay oilfield[J].Acta Petrolei Sinica (Petroleum Processing Section), 2012, 28(4): 696-704.)
[32] ATLAS R M. Microbial degradation of petroleum hydrocarbons: An environmental perspective[J].Microbiology and Molecular Biology Reviews, 1981, 45(1): 180-209.
[33] 姜勇, 梁文举, 闻大中. 免耕对农田土壤生物学特性的影响[J].土壤通报, 2004, 35(3): 347-351.(JIANG Yong, LIANG Wenju, WEN Dazhong. Effects of no-tillage on soil biological properties in farmlands: A review[J].Chinese Journal of Soil Science, 2004, 35(3): 347-351.)
[34] DHRUVA K J, SHARMA G D, MISHRA R R. Soil microbial population numbers and enzyme activities in relation to altitude and forest degradation[J].Soil Biology and Biochemistry, 1992, 24(8): 761-767.
[35] 吴伟林, 张秀霞, 单宝来, 等. 不同处置方式对石油污染土壤理化性质和生物学特性的影响[J].石油学报(石油加工), 2010, 26(5): 831-834.(WU Weilin, ZHANG Xiuxia, SHAN Baolai, et al. Effect of different treatment methods on the physicochemical and biochemical properties of an oil polluted soil[J].Acta Petrolei Sinica (Petroleum Processing Section), 2010, 26(5): 831-834.)
[36] 邱莉萍. 黄土高原植被恢复生态系统土壤质量变化及调控措施[D].陕西: 西北农林大学, 2007.
[37] 蔺昕, 李培军, 孙铁珩, 等. 石油污染土壤的生物修复与土壤酶活性关系[J].生态学杂志, 2005, 24(10): 1226-1229.(LIN Xin, LI Peijun, SUN Tieheng, et al. Bioremediation of petroleum-contaminated soil and its relationship with soil enzyme activities[J].Chinese Journal of Ecology, 2005, 24(10): 1226-1229.)
[38] 严昶升. 土壤肥力研究方法[M].北京: 农业出版社, 1988: 284-285, 248.
[39] 李慧, 陈冠雄, 杨涛, 等. 沈抚灌区含油污水灌溉对稻田土壤微生物种群及土壤酶活性的影响[J].应用生态学报,2005, 16(7): 1355-1359.(LI Hui, CHEN Guanxiong, YANG Tao, et al. Impacts of petroleum-containing wastewater irrigation on microbial population and enzyme activities in paddy soil of Shenfu irrigation area[J].Chinese Journal of Applied Ecology, 2005, 16(7): 1355-1359.)
Application of Solid Microbial Agent in Bioremediation ofPetroleum Contaminated Soil in Karamay Oilfield
LI Zheng, GU Guizhou, NING Chunying, LI Fayun, YANG Lei
(InstituteofEco-environmentalSciences,LiaoningShihuaUniversity,Fushun113001,China)
In order to study solid microbial agent bioremediation for petroleum contaminated soil in Karamay oilfield, the physicochemical properties of soil were analyzed. The optimal bioremediation conditions and the changes of soil microbe quantity, enzyme activity and hydrocarbon component in the process of bioremediation were investigated. The results showed that the Karamay petroleum contaminated soil was silt-based gray desert soil with low H2O content, high oil content, weak alkaline, and the available content of three major nutrients (nitrogen, phosphorus and potassium) was low, which was not conducive to the growth of microorganisms. The optimal bioremediation conditions were soil porosity 55%, moisture mass fraction 25%, inoculation amount of microbial agent 5%, nitrogen/phosphorus molar ratio 10 and the addition amount of biosurfactant 0.5%. After 60 d bioremediation under the optimal conditions, the oil content in petroleum contaminated soil dropped from 4.07% to 1.81% with the degradation rate 55.53%, andn-alkanes less than C27were biodegraded obviously. In this process, both the microbe quantity and enzyme activities (dehydrogenase activity, catalase activity and polyphenol oxidase activity) in the soil were improved. In the bioremediation process, only the improvement of external environment conditions for biostimulation could not effectively remove petroleum hydrocarbons, while the addition of microbial agents for bioaugmentation on the basis was the key factor to remove petroleum pollutants from soil.
solid microbial agent; petroleum contaminated soil; bioremediation; bioaugmentation; biostimulation
2016-01-15
国家自然科学基金项目(41571464)和辽宁省教育厅科学研究项目(L2014148)资助
李政,女,讲师,博士,从事石油污染治理相关研究;E-mail:lizheng.zz@163.com
李法云,男,教授,博士,从事石油污染土壤修复方面的研究;E-mail:lifayun@hotmail.com
1001-8719(2016)06-1195-10
X172; TE991
A
10.3969/j.issn.1001-8719.2016.06.016
