大型海藻厌氧发酵特性研究
2016-12-14孔晓英孙永明王忠铭李连华杨立贵任守军袁振宏
张 毅,孔晓英,孙永明,王忠铭,李连华,杨立贵,任守军,袁振宏
(1.中国科学院广州能源研究所 中国科学院可再生能源重点实验室,广东 广州 510640;2.中国科学院大学,北京 100049;3.兰州理工大学 西部能源与环境研究中心,甘肃 兰州 730050)
大型海藻厌氧发酵特性研究
张 毅1,2,孔晓英1,孙永明1,王忠铭1,李连华1,杨立贵1,2,任守军3,袁振宏1
(1.中国科学院广州能源研究所 中国科学院可再生能源重点实验室,广东 广州 510640;2.中国科学院大学,北京 100049;3.兰州理工大学 西部能源与环境研究中心,甘肃 兰州 730050)
文章采用中温批式厌氧发酵工艺,研究清洗及未清洗海带在不同接种率下,盐度对厌氧发酵特性的影响。研究结果表明:相同底物浓度发酵时,未清洗海带的产气性能要优于清洗海带,无机盐对产气率提高约13%~25%。未清洗海带组在盐度为12.96 g·L-1时的产气性能最佳,产气率和产甲烷率分别为464.4±0.39和288.28±0.24 mL CH4·g-1VSadded,比相同条件下清洗海带的产甲烷率提高29.56%,此时发酵液中主要金属离子浓度K+4780 mg·L-1,Mg2+250 mg·L-1,Ca2+130 mg·L-1和Na+1600 mg·L-1,表明适宜浓度的无机盐有利于厌氧发酵的产气性能。
海带;接种率;盐度; 厌氧发酵;甲烷
生物质能因清洁低碳、可再生和原料丰富等特点受到越来越多国家的关注,但以高粱玉米等粮食作物为代表的第一代能源作物和以纤维素类为原料的第二代能源作物因其占用大量耕地肥料等限制了其发展前景,而藻类作为第三代的生物质能,具有不与“粮”争地、生长迅速、单位面积产量高和资源量丰富等优点[1],正成为未来生物能源的研究焦点。
大型海藻生物量大、碳水化合物含量高和木质素含量较低[2],适合作为厌氧发酵制备生物燃气的原料。美国较早开展了海藻产甲烷的研究,并在70年代建立了海藻制备甲烷的技术工艺[3]。此外,德国、荷兰和日本[4]等发达国家也对浒菜(Enteromorphaprolifera),江蓠(Gracilariaspp)、掌状红皮藻(Palmariapalmata)和海带(Laminariajaponica)等大型海藻发酵产甲烷进行了研究。目前,对大型海藻厌氧发酵预处理的研究比较热门,如Oliveira[5]等对江蓠(Gracilarialemaneiformis))采用清洗、浸泡和热碱处理等预处理结合的方法,发现采用清水洗净和浸泡的预处理方式能显著提高产甲烷率,达到481 mL·g-1VS,热碱处理虽能增加海藻的溶解,但对产甲烷率并无影响;Tedesco[6]等对昆布进行机械破碎成浆与污泥进行共发酵,发现预处理后的样品的产甲烷率提高了20%。另外在干燥[7]、超声[8]、紫外[9]和酸处理[10]方面也有涉及,这些预处理前的共同点是先将海藻清洗干净,并未考虑无机盐对发酵微生物的影响。未清洗的海藻表面会夹带大量的无机盐,其中钠钾等轻金属离子对发酵过程有一定的影响作用,适量的无机盐能刺激微生物的生长,而过量盐分对微生物的生长有毒害作用,抑制发酵产气[11]。
因此,为了定量研究盐度对厌氧发酵制备生物燃气过程中影响,笔者将利用清洗与未清洗的海带为原料,在不同VS接种率下进行厌氧发酵,分析不同发酵条件下发酵过程中盐度,pH值等参数的变化,研究不同无机盐度下海带的厌氧发酵特性,从而为适宜条件下大型海藻制备生物能源提供理论依据。
1 实 验
1.1 原料特性
试验原料为海带,购自广州市天河区长湴菜市场。海带的总固体含量(TS)、挥发性固体含量(VS)和灰分含量分别为61.24%,51.44%和38.15%,C,H,N和S元素质量分数分别为37.36%,5.67%,2.51%和1.20%,热值为14.56 kJ·g-1。漂洗工艺为用自来水漂洗3次,浸泡24 h,自然烘干后切割成2 cm左右,然后在粉碎机中粉碎成粉末状,装包置于-20℃冰箱中保存。清洗后海带的总固体含量(TS)、挥发性固体含量(VS)和灰分含量分别为85.68%,71.53%和16.51%。
1.2 接种污泥来源和特性
厌氧消化污泥来源于博罗一座养猪场沼气池。接种前采用1 mm筛网过滤除去接种物中大颗粒杂质。接种污泥的pH值为7.72,盐度为4.42 g·L-1,TS含量为1.15%,VS/TS为54.39%。
1.3 实验装置及操作
装置为2500 mL玻璃反应器,有效容积为2000 mL,反应装置如图1所示。反应器置于35℃±1℃的恒温水浴锅中。清洗组和未清洗组中的菌种与海带的VS比分别为2∶1,1∶1和1∶2,其发酵液的总挥发性固体浓度为1.73%,2.30%和3.45%,实验组按初始发酵液盐度编号,清洗组为4.65,4.72和5.11 g·L-1,未清洗组分别为6.46,7.99和12.96 g·L-1。每组实验设置2个平行,空白对照组仅加入菌种。加料后反应器顶部充入高纯N2以排除空气。试验期间每天早晚各手动震荡1次,整个厌氧消化过程直至无气体产出为止,共运行40 d。
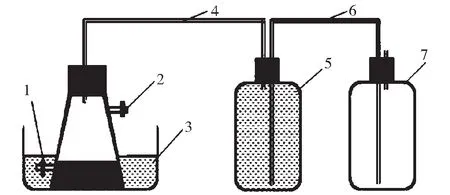
1.液样口;2.气样口;3.水浴锅;4.通气管;5.集气瓶;6.排液管;7.集液瓶图1 发酵装置示意图
1.4 测试及分析方法
TS和VS分别采用105℃干燥法和550℃干法灰化法[12]测定;C,H,N和S元素含量采用Vario EL cube 元素分析仪(德国Elementar公司)测定;金属元素Na+,Mg2+,Ca2+、和K+采用Thermo Jarrell Ash公司的IRIS 1000 ER/S全谱直读型等离子体耦合光谱发射仪分析。热值(calorific value,CV)由量热仪C2000(德国IKA@公司)测定;日产气量采用排饱和食盐水法计量,并将产气量换算成标准状态;pH值测定采用雷磁pHS-3C型pH计(上海精科科学仪器有限公司雷磁仪器厂);盐度采用便携式盐度测试仪(CLEAN CON200G1型)测定;挥发性脂肪酸(VFAs)的测定采用高效液相色谱仪waters e2695(美国waters公司),柱子为Shodex KC-811,柱温为50 ℃;流动相为0.1% H3PO4,流速为0.7 mL·min-1。分析前液体样品首先在0℃~4℃,12000 r·min-1离心15 min,离心后的样品再通过0.2 nm纤维素乙酸酯膜分离。生物燃气中CH4和CO2等气体含量采用岛津GC2014型高效气相色谱测定,TCD检测器,Porapak Q 色谱柱,载气为Ar,柱箱和检测器温度分别为50℃和120℃,测样时间5 min。
2 结果与分析
2.1 厌氧发酵过程中的盐度变化
厌氧发酵过程中盐度的变化如图2,在开始发酵时,未清洗组的初始盐度为6.46~12.96 g·L-1,显著高于清洗组的初始盐度4.65~5.11 g·L-1,并且清洗组的初始盐度差异较小,而未清洗组的初始盐度差异较大,主要原因是清洗组的原料经漂洗浸泡后,海带表面的无机盐基本被去除干净,而未清洗组的原料表面会附着大量的无机盐,发酵原料浓度越高,夹带的无机盐会越多,盐度差异也就越大。在发酵过程中,各实验组中盐度的变化趋势基本一样,主要分为3个阶段:第1阶段在发酵开始时,盐度会小幅降低约为0.3 g·L-1,这主要是因为发酵液中的Na+,Mg2+,Ca2+,Fe3+和K+等一些离子,是微生物生长繁殖所必须的营养源,如Na+对维持微生物细胞内的渗透压有着非常重要的作用,Ca和Mg是合成生物大分子重要组成部分及Mg2+作为生物酶的激活剂[13]。第2阶段在发酵第3~8 d,盐度增加较快,清洗组盐度增加0.29~1.45 g·L-1,未清洗组盐度增加1.29~2.16 g·L-1,主要是海带细胞被发酵型细菌分解的水解酶所破坏,使得海带细胞液中的无机盐大量释放,导致发酵液盐度增长较快。此外,清洗组盐度相比未清洗组增加较小,清洗组原料经浸泡24 h后,海藻细胞中部分离子渗透到水中,从而使得细胞液中的离子浓度较低。第3阶段盐度增加较小,约为0.5 g·L-1,主要原因是发酵液中的有机物逐渐被降解并释放出少量的无机盐离子。
通过盐度为5.1和12.96 g·L-1两组发酵前后主要离子浓度变化测定见表1,Mg2+和Ca2+浓度均降低,其中较为明显的是UW3中Mg2+和Ca2+浓度降幅达到50%左右,这可能与发酵液中较多的微生物数量会需要大量的Mg2+和Ca2+有关[13]。海带中金属离子含量较多的是Na+和K+,其含量分别可达到28 mg·g-1和61 mg·g-1[14],反应过程中原料中Na+和K+被释放,因而发酵液中Na+和K+浓度会有较大范围的增加:Na+为190~410 mg·L-1,K+为250~700 mg·L-1。
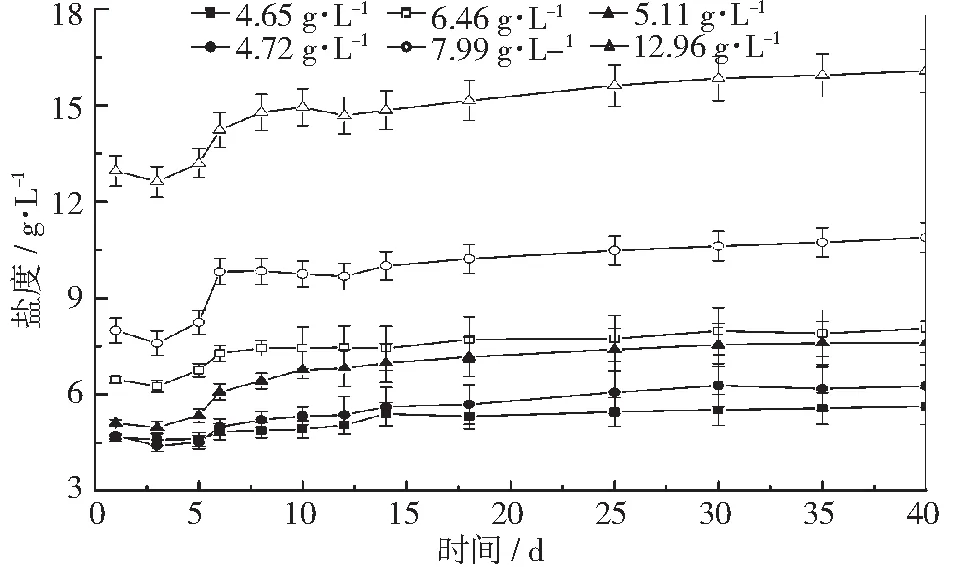
图2 发酵液中的盐度变化

表1 盐度为5.1和12.96 g·L-1的主要离子浓度变化
2.2 厌氧发酵过程中的pH值变化
清洗和未清洗海带厌氧发酵过程中pH值随时间的变化如图3和图4。发酵开始前,清洗组的pH值差异较小,约为7.85,而未清洗组中随着海带盐度浓度越高,pH值越低,约为7.64~7.98,主要原因是海藻夹带的无机盐中含有的Mg2+和Ca2+等弱酸性金属离子能产生H+,从而使得发酵液的pH值降低。发酵开始后,所有实验组的pH值变化趋势基本一致,主要呈现“下降—上升—稳定”的趋势,并且未清洗组的pH值波动要大于清洗组。首先发酵初期在发酵性细菌和产酸菌的联合作用,海藻中容易降解的成分快速水解并产生大量的挥发性脂肪酸(VFAs),VFAs大量生成使得发酵液pH值快速降低,在第5 d时均降至最低,清洗组pH值处于6.75~7.35之间,而未清洗组pH值处于6.3~7.15之间。同VS浓度的未清洗组均比清洗组的pH值低0.4,如清洗海带盐度5.11 g·L-1中发酵液pH值为6.75,未清洗盐度12.96 g·L-1中发酵液pH值为6.35。当发酵进行到6~14 d,发酵液中的pH值整体呈上升趋势,此时产甲烷菌大量繁殖和活性不断增强,VFAs不断被降解,同时系统产生了大量的氨氮[15],使得发酵液pH值不断升高,并在20 d达到稳定并维持在7.18~7.57。

图3 清洗组pH值随时间的变化

图4 未清洗组pH值随时间的变化
2.3 厌氧发酵过程中的挥发性脂肪酸(VFAs)变化
发酵液中第6 d和第11 d的挥发性脂肪酸成分见表2。发酵初期,原料迅速降解并产生大量挥发性脂肪酸,如乙酸、丙酸和丁酸等,此外还有少量的甲酸和异丁酸等,此时有机酸的产生速率远大于分解速率,导致有机酸的大量积累。发酵在第4~6 d时,发酵液中pH值最低,对应的挥发性脂肪酸含量达到最高,海带VS浓度越高,其发酵液中有机酸的含量越多,而同VS浓度的海带,未清洗比清洗海带产生挥发性脂肪酸的种类和含量均要多。在盐度为5.11 g·L-1和12.96 g·L-1时,清洗和未清洗海带在第6 d的挥发性脂肪酸酸含量分别为1824.4 mg·L-1和5042 mg·L-1,并且未清洗海带发酵液中检测到了乙酸、丙酸和戊酸,而清洗海带发酵液中主要为乙酸和丙酸,未清洗海带中无机盐有效促进了挥发性脂肪酸的产生。随后发酵过程中,有机酸逐渐被消耗,乙酸优先被产甲烷菌利用,当乙酸消耗到一定程度时,才开始利用其它代谢底物,而丙酸和丁酸必须转化成乙酸才能微生物利用,从表2可知,乙酸、丙酸、丁酸和戊酸是厌氧发酵制备生物燃气过程的重要中间代谢产物,并且挥发酸转化为乙酸优先顺序为:丁酸>戊酸>丙酸。
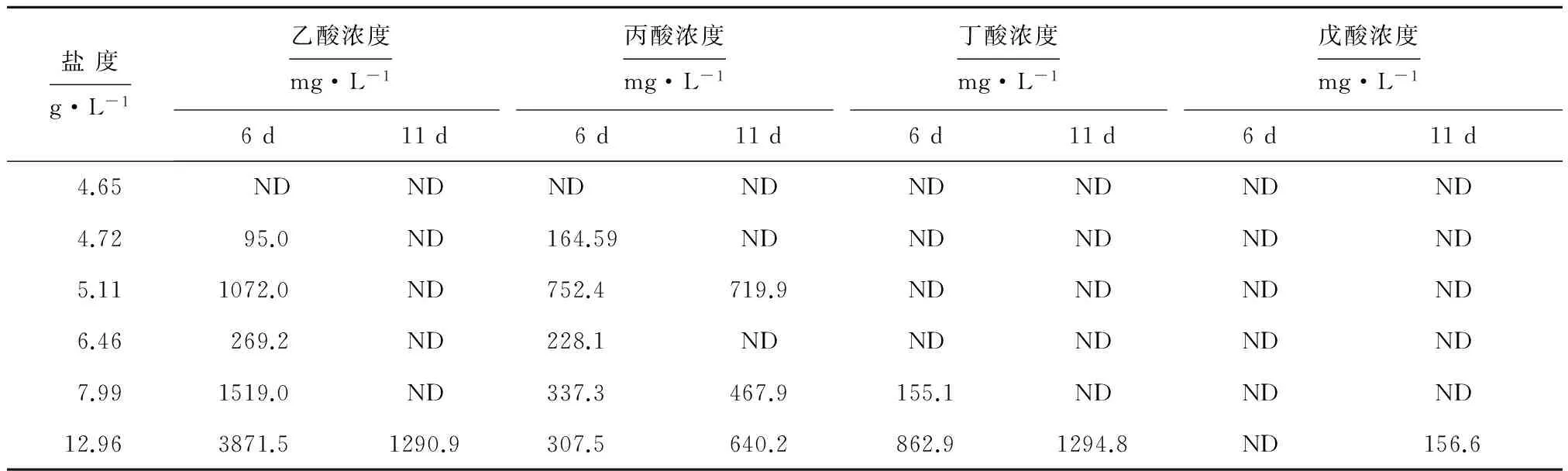
表2 发酵过程中第6天和第11天的挥发性脂肪酸产量
注:ND为未测出。
2.4 厌氧发酵过程中的日产气量变化
清洗和未清洗海带厌氧发酵日产气量随反应时间变化如图5和图6,可见不同浓度海带发酵产气的总体趋势大致分为3个阶段。发酵初期为水解阶段,发酵型细菌将原料中易被利用的有机物分解为小分子物质,各组日产气量约为800 mL,根据气相色谱测定气体中成分主要为CO2,CH4含量低于10%。发酵到第3天时基本进入产酸阶段,清洗海带组的产酸阶段持续2天,日产气量为550~1200 mL,未清洗海带的产酸时间随盐度的增加而延长,这与挥发性酸的变化规律也一致,盐度为12.96 g·L-1的产酸时间较长为4天,日产气量约为600 mL。随后发酵系统集中产甲烷,根据气相色谱测定沼气中CH4体积分数均大于50%,表明发酵系统已进入稳定的产甲烷阶段。实验组在发酵第5~8 d达到产气高峰,清洗组的最大日产气量分别为780 mL,1450 mL和2720 mL,未清洗组的最大日产气量分别为860 mL,1580 mL和2180 mL。在经过产气高峰后,随着挥发性有机酸不断被消耗,发酵液中可利用的有机物越来越少,各反应器产气量也逐渐减少直至停止。

图5 清洗组的发酵日产气量

图6 未清洗组的发酵日产气量
2.5 厌氧发酵过程中的累积产气率变化
清洗和未清洗海带累积产气率随发酵时间的变化如图7和图8。清洗组的产气速率较快,发酵进行到第13d时,系统产气量占到总产气量的90%以上;未清洗组的产气速率随着发酵液中盐度的增加而变慢,发酵系统产气量占到总产气量90%所需的时间分别为5,12和22 d。从表3可知,清洗海带在盐度4.72 g·L-1产气性能最佳,产气率、产甲烷率和甲烷含量分别为423.05±32.88 mL·g-1VS,267.46±20.8 mL CH4·g-1VS和63.25%;未清洗海带在盐度7.99 g·L-1的产气率最高,达到527.57±2.18 mL·g-1VS,而产甲烷率和甲烷含量则随着盐度的升高逐渐增加,在盐度为12.96 g·L-1的产甲烷率和甲烷含量最高,为288.28±0.24 mL CH4·g-1VS和62.09%,比同VS浓度清洗海带的产甲烷率提高29.56%。发酵液中无机盐尤其是金属离子,在一定的浓度范围内对发酵系统起着不同作用,如Na+,Mg2+和Ca2+的质量浓度在100~200 mg·L-1,75~150 mg·L-1和100~200 mg·L-1能刺激发酵过程;当浓度增加到Na+为3500~5500 mg·L-1,Mg2+为1000~1500 mg·L-1,Ca2+为2500~4500 mg·L-1时,对发酵过程产生中等强度的抑制;当浓度更大时,Na+为8000 mg·L-1,Mg2+为3000 mg·L-1,Ca2+为8000 mg·L-1时,对发酵过程产生重度抑制作用[16]。W3和UW3发酵液中Mg2+,Ca2+和Na+浓度均未达到抑制浓度,但UW3在Mg2+250 mg·L-1,Ca2+130 mg·L-1和Na+1600 mg·L-1产甲烷率更高,表明发酵液中适量无机盐有利于海带厌氧发酵的产气性能。

表3 厌氧发酵的产气率、产甲烷率和甲烷含量

图7 清洗组累积产气量随发酵时间的变化

图8 未清洗组累积产气量随发酵时间的变化
3 结论
清洗海带组中盐度为4.72 g·L-1的产气性能最佳,累积产气率、产甲烷率和甲烷含量为423.05±32.88 mL·g-1VS,267.46±20.8 mL CH4·g-1VS和63.25%。在盐度为12.96 g·L-1,主要离子浓度Mg2+250 mg·L-1,Ca2+130 mg·L-1和Na+1600 mg·L-1时,海带厌氧发酵的产气性能最佳,累积产气率、产甲烷率和CH4含量分别为464.4±0.39 mL·g-1VS,288.28±0.24 mL CH4·g-1VS和62.09%,比同VS浓度清洗海带的产甲烷率提高29.56%,适量无机盐能促进发酵系统挥发性有机酸的生成,有利于海带厌氧发酵的产气性能。
[1] P S Nigam,A Singh.Production of liquid biofuels from renewable resources[J].Progress in Energy and Combustion Science,2011,37(1): 52-68.
[2] P Morand,M Merceron.Macroalgae population and sustainability[J].Coast Res,2005,21: 1009-1020.
[3] I Paya,B Santelices.Macroalgae Survive Digestion by Fishes[J].Journal of Phycology,1989,25(1): 186-188.
[4] R Rajkumar,Z Yaakob,M S Takriff.Potential of the Micro and Macro Algae for Biofuel Production: A Brief Review[J].Bioresources,2014,9(1): 1606-1633.
[5] J V Oliveira,M M Alves,J C Costa.Design of experiments to assess pre-treatment and co-digestion strategies that optimize biogas production from macroalgae Gracilaria vermiculophylla[J].Bioresource Technology,2014,162: 323-330.
[6] S Tedesco,K Y Benyounis,A G Olabi.Mechanical pretreatment effects on macroalgae-derived biogas production in co-digestion with sludge in Ireland[J].Energy,2013,61: 27-33.
[7] J H Mussgnug,V Klassen,A Schluter,et al.Microalgae as substrates for fermentative biogas production in a combined biorefinery concept[J].J Biotechnol,2010,150(1): 51-56.
[8] M Daroch,S Geng,G Y Wang.Recent advances in liquid biofuel production from algal feedstocks[J].Applied Energy,2013,102: 1371-1381.
[9] F Passos,M Hernandez-Marine,J Garcia,et al.Long-term anaerobic digestion of microalgae grown in HRAP for wastewater treatment.Effect of microwave pretreatment[J].Water Research,2014,49: 351-359.
[10] R Harun,W S Y Jason,T Cherrington,et al.Exploring alkaline pre-treatment of microalgal biomass for bioethanol production[J].Applied Energy,2011,88(10): 3464-3467.
[11] Y Chen,J J Cheng,K S Creamer.Inhibition of anaerobic digestion process: A review[J].Bioresource Technology,2008,99(10): 4044-4064.
[12] K H Wong,P C K Cheung.Nutritional evaluation of some subtropical red and green seaweeds-Part I-proximate composition,amino acid profiles and some physico-chemical properties[J].Food Chemistry,2000,71(4): 475-482.
[13] U Deppenmeier,T Lienard,G Gottschalk.Novel reactions involved in energy conservation by methanogenic archaea[J].Febs Letters,1999,457(3): 291-297.
[14] 谢宗墉.海洋水产品营养与保健[M].青岛:青岛海洋大学出版社,1991.
[15] 李连华,孙永明,孔晓英,等.刈割时间对杂交狼尾草成分及厌氧发酵性能影响试验[J].农业机械学报,2014(01): 155-161.
[16] 袁振宏,吴创之,马隆龙.生物质能利用原理与技术[M].北京:化学工业出版社,2005: 79.
Characteristics of Anaerobic Digestion of Marine Macro-algae/
ZHANG Yi1,2,KONG Xiao-ying1,2,SUN Yong-ming1,WANG Zhong-ming1,LI Lian-hua1,YANG Li-gui1,2,REN Shou-jun3,YUAN Zhen-hong1/
(1.Guangzhou Institute of Energy Conversion Chinese Academy of Sciences,CAS,Key Laboratory of Renewable Energy,Guangzhou 510640,China; 2.University of Chinese Academy of Sciences,Beijing 100049,China; 3.China Western Energy and Environment Research Center,Lanzhou University of Technology,Lanzhou 730050,China)
The effects of salinity on anaerobic digestion performance ofLaminariaJaponicawere investigated under the different inoculation rate adopting batch mesophilic experiments.The results indicated that the biogas production performance of the non-washedLaminariaJaponicawere better than that of the washed groups,which the biogas yield was increased by 13%~25%.And the best biogas production of 464.4±0.39 mL·g-1VSaddedand best methane production of 288.28±0.24 mL CH4·g-1VSaddedwere obtained for the non-washedLaminariaJaponicaunder condition of salinity concentration of 12.96 g·L-1,and K+,Mg2+,Ca2+,Na+concentration of 4780 mg·L-1,250 mg·L-1,130 mg·L-1and 1600 mg·L-1respectively.It showed that the suitable concentration of inorganic salt was beneficial to the gas production performance.
LaminariaJaponica; inoculation rate; salinity; anaerobic digestion; methane
2016-01-27
项目来源:国家高技术研究发展计划(863计划)( 2012AA101802);中国科学院重点部署项目资助(KGZD-EW-304-1);广东省科技计划项目(2015B020215011);广州市科技计划项目(201508020098)
张 毅(1990-),男,博士生,主要从事生物质能源生化转化研究工作,E-mail:zhangyi@ms.giec.ac.cn
孔晓英,E-mail:kongxy@ms.giec.ac.cn
S216.4
A
1000-1166(2016)03-0003-06
