肝窦内皮细胞诱导T细胞免疫耐受
2016-12-14景亚青袁晶华李克秋
景亚青,刘 义,韩 菲,袁晶华,李克秋,李 光
肝窦内皮细胞诱导T细胞免疫耐受
景亚青1,刘 义1,韩 菲2,袁晶华1,李克秋1,李 光1
目的 探讨肝窦内皮细胞(LSEC)对T细胞的耐受作用。方法 CD3和CD28抗体活化的人T细胞和人LSEC混合培养,检测48 h时单独培养和混合培养T细胞的凋亡情况和细胞因子白细胞介素2(IL-2)、白细胞介素4(IL-4)和白细胞介素10(IL-10)的表达量及分泌量。结果 和LSEC混合培养的T细胞凋亡率显著高于单独培养的T细胞,混合培养的T细胞中IL-2的表达量没有发生明显变化,IL-4的表达量显著升高,IL-2/IL-4的值降低,IL-10的表达量增加。IL-2、IL-4和IL-10细胞因子分泌情况和表达量一致。结论 LSEC可通过降低T细胞数目和改变细胞因子分泌两种途径诱导T细胞产生耐受。
LSEC;T细胞耐受;混合培养;凋亡检测;细胞因子
肝脏是人体最大的有消化和排毒功能的脏器,容易受到伤害。肝脏功能失调会导致各种并发症的产生。目前,肝移植是治疗各种终末期肝病(肝癌、肝硬化)最重要的手段[1]。和其他器官移植相比,肝脏更容易产生耐受。肝是人体重要的免疫器官,人的肝脏有两个血液供应途径:门静脉和肝动脉[2],分别含有胃肠道和系统免疫的抗原,环境的复杂性要求肝脏既可以抵御外来抗原还可以防止肝脏细胞被破坏。肝脏可通过外周耐受途径,防止免疫细胞(特别是T细胞)对肝造成损伤。肝的免疫耐受作用主要由非实质细胞发挥[3],肝窦内皮细胞(liver simusoidal endothelial cell, LSEC)是肝脏内含量最多的非实质细胞,其功能与移植物的存活状态有关[4-5]。本研究通过LSEC对体外活化的T细胞凋亡情况和细胞因子分泌情况进行分析,探讨其对活化T细胞的耐受作用。
1 材料与方法
1.1 细胞株 人原代LSEC株购自上海复蒙生物科技有限公司。富含血小板的白膜购自天津市血液中心。
1.2 主要试剂 内皮细胞培养基(endothelial cell medium, ECM)购自美国Sciencell公司;淋巴细胞分离液购自天津市灏洋生物技术公司;CD3免疫磁珠购自德国Miltenyi公司;AnnexinV/7-AAD凋亡检测试剂盒购自美国eBioscience公司;IL-2、IL-4和IL-10 ELISA检测试剂盒购自北京达科为生物技术有限公司;TRIzol、MLV-cDNA合成试剂盒和Real-time PCR检测试剂盒购自美国Invitrogen公司。
1.3 方法
1.3.1 LSEC复苏 将1 ml 10 μg/ml纤连蛋白溶液加到10 cm培养皿中,轻轻晃动使液体均匀附在培养皿底,37 ℃恒温培养箱中孵育过夜。将含有105个LSEC的冻存管放置到37 ℃恒温水浴锅中,缓慢转动冻存管至完全融化,将液体移至已包被好的培养皿中,并加入ECM培养基,37 ℃、5% CO2恒温培养箱培养16 h后进行细胞换液,并继续培养。待细胞生长至覆盖90%培养皿时,进行胰酶消化传代培养。
1.3.2 T细胞分离活化 将人白膜细胞和生理盐水等体积混合并吹打均匀,轻轻加入到含等体积淋巴细胞分离液的离心管中,使分离液和细胞层界限清晰,2 000 r/min室温离心20 min,吸出中间的细胞层,PBS清洗2次,进行细胞计数。
取108个淋巴细胞悬液离心,加入800 μl预冷的磁珠缓冲液重悬细胞,4 ℃孵育15 min,加入12 ml磁珠缓冲液1 200 r/min离心10 min。用1 ml磁珠缓冲液重悬细胞,将细胞过MS分离柱,1 000 r/min离心10 min,制备细胞悬液,计数细胞数目。
吸取T细胞悬液50 μl放入1.5 ml离心管中,加入1 μl FITC标记的CD3抗体,4 ℃避光孵育30 min。将细胞悬液1 000 r/min离心5 min,PBS清洗2次,并加入1 ml 4%多聚甲醛重悬细胞,流式细胞仪(BD verse,美国BD公司)分析T细胞含量。
磁珠分选得到的T细胞加入含1 μg/ml CD3和1 μg/ml CD28抗体的1640培养基(包括15%胎牛血清和1%青霉素/链霉素抗生素溶液)中培养24 h。
1.3.3 LSEC和T细胞混合培养 生长状况良好的LSEC进行传代,计数细胞,将105个LSEC接种到纤连蛋白包被的6孔板中,37 ℃、5% CO2培养箱中培养过夜。吸去ECM培养液,调整T细胞浓度,分别将2×105个T细胞接种到含或不含LSEC的6孔板中,37 ℃、5% CO2培养48 h。
1.3.4 AnnexinV/7-AAD凋亡检测 将培养的T细胞吸出,1 100 r/min 离心4 min,吸去上清液,PBS清洗细胞。1 100 r/min 离心4 min后,吸去上清液,加入1 ml溶液悬浮细胞。单独培养的T细胞和混合培养的T细胞进行PE标记的AnnexinV和7-AAD染色30 min,PBS清洗细胞2次,加入1 ml 4%多聚甲醛溶液重悬细胞,采用BD verse细胞仪检测细胞凋亡情况,FlowJo 7.6.1软件分析T细胞凋亡情况。
1.3.5 mRNA表达水平 TRIzol法提取单独培养48 h T细胞和混合培养48 h T细胞的mRNA,采用Nanodrop仪(Nanodrop 2000,美国Thermo公司)检测mRNA的浓度和纯度,选用MLV-cDNA逆转录试剂盒将mRNA逆转录成cDNA。采用荧光定量PCR仪(7500 Fast,美国ABI公司)检测IL-2、IL-4、IL-10的mRNA水平,引物序列见表1。根据扩增的Ct值计算基因表达量,以48 h单独培养的T细胞为参照计算ΔΔCt,基因相对表达量为2-ΔΔCt。

表1 Real-time PCR检测mRNA表达情况引物序列
1.3.6 细胞因子含量测定 采用双夹心酶标法检测细胞因子IL-2、IL-4和IL-10的分泌情况,按照ELISA检测试剂盒说明书检测单独培养的LSEC、单独培养的T细胞和混合培养细胞48 h时上清液中细胞因子的分泌情况。采用ELISACal软件绘制细胞因子标准曲线,并根据标准曲线和样本吸光度值计算细胞因子的分泌量。
1.4 统计学处理 采用SPSS 17.0统计软件进行分析,两组间比较采用独立样本t检验,3组间比较采用单因素方差分析。
2 结果
2.1 LSEC和T细胞生长情况 LSEC解冻后均匀的悬浮在ECM中,经过16 h的过夜培养,LSEC呈梭形贴附在培养皿底部生长,更换新的ECM培养48 h时LSEC贴壁生长,细胞形态为鹅卵形或梭形,细胞表面光滑,折光率较强。CD3免疫磁珠分离得到1.5×107个T细胞,得率为15%,纯化的T细胞比例由62.7%增加到98.3%,见图1。培养24 h后的T细胞形态均一,大小一致,透光率较高。培养48 h的T细胞与LSEC混合培养,24 h后观察T细胞贴附在LSEC细胞表面,两者状态较好,见图2。

图1 白膜和CD3磁珠分选后T细胞比例
A:T细胞在白膜淋巴细胞的比例;B:CD3磁珠分选后T细胞的比例

图2 单独培养和混合培养下的LSEC
A:单独培养的LSEC×100;B:T细胞和LSEC混合培养×200
2.2 LSEC促进T细胞凋亡 由图3可见,单独培养的T细胞凋亡率为(9.70±0.36)%,与LSEC混合培养的T细胞早期凋亡率为(17.43±0.70)%,混合培养T细胞凋亡率明显高于单独培养的T细胞(t=9.76,df=4,P=0.000 6),说明LSEC可有效诱导T细胞凋亡。
2.3 细胞因子IL-2、IL-4及IL-10的mRNA表达水平 单独培养的T细胞和混合培养的T细胞mRNA检测结果表明:IL-2 mRNA的表达量两者没有明显变化,混合培养的T细胞IL-4和IL-10 mRNA的表达量显著高于单独培养的T细胞,混合培养的T细胞IL-2和IL-4 mRNA的比值显著低于单独培养的T细胞(IL-2t=2.10, df=4,P=0.103 2; IL-4t=7.67, df=4,P=0.001 6; IL-2/IL-4t=16.22, df=4,P<0.000 1; IL-10t=12.43, df=4,P=0.000 2),见图4。
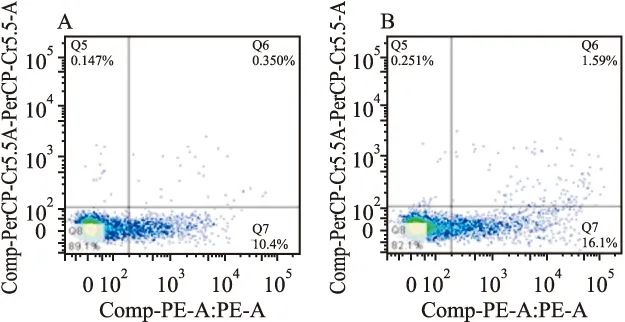
图3 AnnexinV/7-AAD检测T细胞凋亡情况
A:T细胞48 h凋亡情况;B:LSEC混合培养的T细胞凋亡情况
2.4 细胞因子IL-2、IL-4及IL-10的分泌情况 ELISA法检测细胞因子的分泌情况,统计结果显示与LSEC共培养的T细胞,上清液中IL-4和IL-10的分泌量增加,IL-2的分泌量无明显变化,表明LSEC可降低IL-2/IL-4的值并有效刺激IL-10的分泌,有利于诱导免疫偏离,与mRNA表达检测结果一致,见图5(FIL-2=157.60,P<0.000 1;FIL-4=88.54,P<0.000 1;FIL-10=30.47,P=0.007)。
3 讨论
肝脏是实体器官移植中比较容易产生耐受的器官,其它器官(皮肤、心脏、肾)连同肝脏共同移植可降低排斥的发生率,从而增加器官存活时间[6]。LSEC属于肝脏的非实质细胞的组成部分,约占非实质细胞的50%,含量最多[7]。1970年,Eddie Wisse第一次有确信的证据指出LSEC是一种新的细胞类群。LSEC在肝窦腔内将肝细胞和血液分开,内皮层不含有序的基底细胞层,在肝细胞和内皮细胞间形成一个空隙,称为Disse间隙,可以防止肝细胞和窦腔直接接触[8]。LSEC构成了肝脏与外界接触的第一道防线,可进行物质交换并参与免疫反应,与肝脏的移植耐受过程有关。耐受大鼠血清中LSEC透明质酸含量比排斥大鼠的低,大分子蛋白的摄取速度较快,表明LSEC在机体免疫耐受中可能发挥重要作用[9]。LSEC表面有清道夫受体、甘露糖受体,参与细胞的吞噬作用,表面分子MHC-Ⅰ和MHC-Ⅱ可将抗原呈递给CD8+和CD4+T细胞,表面分子L-SIGN、ICAM可以将细胞黏附到LSEC。解剖学和分子生物学特征表明LSEC在免疫调节过程中发挥了作用。
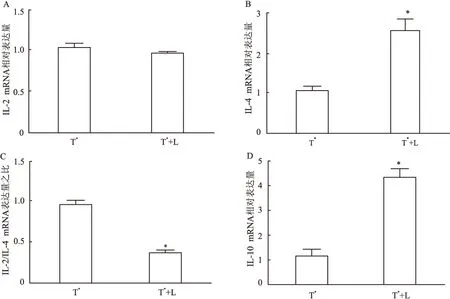
图4 IL-2、IL-4和IL-10的mRNA表达含量

图5 IL-2、IL-4和IL-10分泌情况
器官移植后免疫排斥反应的发生主要是由细胞免疫反应造成的,活化的T细胞可识别外来的移植物抗原,对移植物发生免疫反应造成移植物丧失功能[10]。移植耐受患者中,免疫反应性T细胞含量减少,而可诱导免疫耐受的调节性T细胞含量增加[11]。在本实验中LSEC可促进CD3抗体和CD28抗体联合活化的T细胞凋亡,减少T细胞数量,降低免疫反应。T细胞细胞因子的分泌发生改变是T细胞耐受的形成途径之一。在T细胞耐受中,主要通过Th1和Th2细胞因子的比例决定[12]。Th细胞是T细胞的一种重要的细胞亚群,可以通过分泌细胞因子来调节机体的免疫应答。Th1细胞主要分泌IL-2、γ-干扰素及肿瘤坏死因子,介导细胞免疫应答,在抗感染、器官移植排斥反应和自身免疫性疾病的诱导过程中起重要作用。Th2细胞产生IL-4、IL-5、IL-6、IL-9、IL-10和IL-13,介导体液免疫。有研究[13-14]表明,在器官移植中,长期存活的移植患者可检测到高表达的IL-10,而在发生急性排斥反应的移植患者中,几乎检测不到IL-10。Th1和Th2细胞所诱导的免疫反应能互相调节或产生交叉调节作用[15-16],其动态平衡对诱导和维持免疫耐受十分重要。Th2可下调Th1诱发的排斥反应,消除损伤效应,从而有助于建立移植免疫耐受。本实验中和LSEC混合培养的T细胞IL-2/IL-4的比值降低,Th1细胞功能受到抑制,Th2细胞功能增强,Th2分泌的免疫抑制因子IL-10增多[12]。T细胞因子分泌的改变也表明LSEC可促进T细胞耐受。本研究结果表明,LSEC可通过促进T细胞凋亡和调节Th1/Th2细胞因子分泌两种方式诱导T耐受。
[1] Bosch A,Dumortier J,Maucort-Boulch D,et al.Preventive administration of UDCA after liver transplantation for primary biliary cirrhosis is associated with a lower risk of disease recurrence[J]. J Hepatol, 2015, 63(6):1449-58.
[2] DeLeve L D. Liver sinusoidal endothelial cells and liver regeneration[J]. J Clin Invest,2013,123(5):1861-6.
[3] Spiering R,Margry B,Keijzer C.DEC205+ dendritic cell-targeted tolerogenic vaccination promotes immune tolerance in experimental autoimmune arthritis[J]. J Immunol,2015,194(10):4804-13.
[4] Jenne C N,Kubes P. Immune surveillance by the liver[J].Nat Immunol,2013,14(10):996-1006.
[5] Karimi M H,Geramizadeh B,Malek-Hosseini S A.Tolerance induction in liver[J]. Int J Organ Transplant Med, 2015, 6(2):45-54.
[6] Topilsky Y,Raichlin E,Hasin T,et al.Combined heart and liver transplant attenuates cardiac allograft vasculopathy compared with isolated heart transplantation[J]. Transplantation, 2013, 95(6):859-65.
[7] Igarashi Y, Onoe T, Ohdan H. The role of liver sinusoidal endothelial cells in induction of carbohydrate reactive B cells tolerance through the programmed death 1/programmed death ligand 1 pathway[J]. Transplantation, 2015, 99(11):2325-36.[8]DeLeveLD.Liversinusoidalendothelialcellsinhepaticfibrosis[J].Hepatology, 2015, 61(5):1740-6.
[9]GeX,NowakG,EriczonBG.Liversinusoidalendothelialcellfunctioninrejectedandspontaneouslyacceptedratliverallografts[J].TransplInt,2008, 21(1):49-56.
[10]MatignonM,AissatA,Canoui-PoitrineF,etal.Th-17alloimmuneresponsesinrenalallograftbiopsiesfromrecipientsofkidneytransplantsusingextendedcriteriadonorsduringacuteTcell-mediatedrejection[J].AmJTransplant,2015, 15(10):2718-25.
[11]DenneyHA,WhittleRJ,LaiJ,etal.RegulatoryTcellsinchronicGraft-Versus-Hostdiseaseafterextracorporealphotopheresis:correlationwithskinandglobalorganresponses,andabilitytotapersteroids[J].Transplantation, 2016:[Epubaheadofprint].
[12]LiB,TianL,DiaoY.ExogenousIL-10inducescornealtransplantationimmunetolerancebyamechanismassociatedwiththealteredTh1/Th2cytokineratioandtheincreasedexpressionofTGF-β[J].MolMedRep, 2014, 9(6):2245-50.
[13]IngelstenM,GustafssonK,OlaussonM,etal.Rapidincreaseofinterleukin-10plasmalevelsaftercombinedauxiliaryliver-kidneytransplantationinpresensitizedpatients[J].Transplantation, 2014, 98(2):208-15.
[14]ShouvalDS,BiswasA,GoettelJA,etal.Interleukin-10receptorsignalingininnateimmunecellsregulatesmucosalimmunetoleranceandanti-inflammatorymacrophagefunction[J].Immunity, 2014, 40(5): 706-19.
[15]ObremskiK.ChangesinTh1andTh2cytokineconcentrationsinilealPeyer′spatchesingiltsexposedtozearalenone[J].PolJVetSci, 2014, 17(1):53-9.
[16]HuA,LiQ,ShiH,etal.Donor-derivedbonemarrowtransfusionproducesmixedchimerismandpromotesaTh2shiftinTh1/Th2balanceinratheterotopicsmallboweltransplantation[J].DigLiverDis, 2012, 44(12):988-94.
T cell immune tolerance induced by LSEC
Jing Yaqing1, Liu Yi1, Han Fei2, et al
(1DeptofGenetics,SchoolofBasicMedicalSciences,TianjinMedicalUniversity,Tianjin300070;2DeptofClinicalLaboratory,TheSecondHospitalofTianjinMedicalUniversity,Tianjin300211)
ObjectiveToexploretheroleofLSEConTcelltolerance. MethodsTcellapoptosis,cytokine(IL-2,IL-4andIL-10)expressionandsecretionofhumanTcellsactivatedbyCD3/CD28aloneandmixed-culturedwithhumanLSECweredetected.ResultsTheratioofcellapoptosiswashigherinmixed-culturedTcellsthanTcellsalone.ThegeneexpressionsofIL-4andIL-10werehigherinmixed-culturedTcellsthanTcellsalone,whilegeneexpressionofIL-2hadnosignificantdifferenceinmixed-culturedTcellsthanTcellsalone.ThecytokinesecretionofIL-2,IL-4andIL-10wasconsistentwithgeneexpression.ConclusionLSECcouldinduceTcelltolerancebydecreasingTcellnumberandalteringcytokinesecretion.
LSEC;Tcelltolerance;mixedculture;apoptosisdetection;cytokine
国家高技术研究发展计划(863计划)(编号:2012AA021003)
1天津医科大学基础医学院遗传学系,天津 3000702天津医科大学第二医院检验科,天津 300211
景亚青,女,助理实验师; 李 光,女,教授,博士生导师,责任作者,E-mail: lig@tmu.edu.cn
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.004.html
R 392
A
1000-1492(2016)11-1569-05
10.19405/j.cnki.issn1000-1492.2016.11.004
2016-06-27接收
