人EBI3蛋白及其突变体的表达及定位研究
2016-12-14邢雪梅耿慧武潘林鑫刘泽宇邓欢欢刘晓颖范礼斌
邢雪梅,耿慧武,潘林鑫,刘泽宇,姚 亮,邓欢欢,刘晓颖,范礼斌
人EBI3蛋白及其突变体的表达及定位研究
邢雪梅1,耿慧武1,潘林鑫1,刘泽宇1,姚 亮2,邓欢欢2,刘晓颖1,范礼斌1
目的 研究人EB病毒诱导的基因3(EBI3)及其突变体在哺乳动物细胞中的表达及定位差异及其原因。方法 基于NCBI数据库中人EBI3氨基酸的序列分析,利用分子克隆技术构建人EBI3真核表达质粒pcDNA3.1-EBI3-FLAG、单独包含氨基端或羧基端Ⅲ型纤连蛋白(FN3)结构域的缺失突变体的表达质粒pcDNA3.1-EBI3(1~135)-FLAG和pcDNA3.1-EBI3(125~230)-FLAG以及第210位天冬氨酸(Asp)点突变体Asp210的表达质粒pcDNA3.1-EBI3-D210A-FLAG;Western blot方法检测EBI3及其突变体在HEK 293T细胞中的表达;免疫荧光实验观察人EBI3及各突变体在COS7细胞中的定位。结果 成功构建了下游携带FLAG标签的人EBI3及其突变体的真核表达质粒;Western blot结果显示重组蛋白均能在HEK 293T细胞中稳定表达;经激光共聚焦显微镜观察,EBI3及其缺失突变体在COS7细胞的表达位置发生明显变化。结论 人EBI3及其突变体真核表达质粒均能在HEK 293T、COS7细胞中成功表达;人EBI3缺失突变体在COS7细胞中的定位发生明显变化,氨基端结构域可能在EBI3蛋白的正确定位中发挥重要作用;EBI3蛋白的第210位Asp的突变影响了其在细胞内的定位。
EBI3;质粒构建;Western blot;免疫荧光
EB病毒诱导的基因3 (Epstein-Barr virus-induced gene 3,EBI3)是从EB病毒感染的B淋巴细胞中发现并命名,定位于染色体的19p13.2/3区域,全长1 161 bp,编码的成熟EBI3蛋白是一种34 ku 的可溶分泌性糖蛋白[1]。人体内,EBI3主要表达于淋巴器官如扁桃体、脾,提示EBI3是重要的免疫因子,参与免疫系统的调节。EBI3蛋白也在胎盘中大量表达,且随着妊娠时间的延续而增加。EBI3与p19、p28、p35及p40同属于IL-12家族,与p40在结构上有27%的同源性[2]。EBI3可分别与p28、p35结合,形成细胞因子IL-27(p28/EBI3)和IL-35(p35/EBI3)[3-4]。氨基酸序列分析显示,EBI3蛋白包括两个串联的经过修饰的Ⅲ型纤连蛋白结构域FN3,该结构域通常包含两对半胱氨酸残基形成的二硫键,以及一个典型的Trp-Ser-X-Trp-Ser(WSXWS)的基序[5-6]。该研究通过运用分子克隆技术,结合蛋白数据库中已知人EBI3蛋白的信息,构建了单独包含氨基端或羧基端FN3结构域的EBI3的缺失突变体,分别转染入真核细胞HEK 293T和COS7细胞,对突变体的表达及定位进行比较。针对IL-27结构的研究[6]表明,EBI3蛋白的第210位的天冬氨酸Asp参与形成带负电荷的蛋白质表面结构,是影响EBI3与IL-27p28的对应正电荷区域结合的关键残基。设想Asp210可能也参与EBI3与其他蛋白的结合,因此构建了EBI3Asp210点突变体的真核重组质粒,了解其表达和定位的改变。该研究旨在通过探讨结构域及关键氨基酸残基的改变对EBI3蛋白在真核细胞中的蛋白表达及细胞定位的影响,进一步揭示EBI3蛋白在人类免疫系统中的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 菌株、细胞株、质粒和引物 真核表达载体pcDNA3.1(+)、E.coliDH5α感受态细菌、COS7及HEK 293T细胞株、含人EBI3全长cDNA序列的质粒均为本生物实验室保存;实验使用引物由上海生工生物有限公司合成。
1.1.2 主要工具酶和试剂 Pfu PCR MasterMix(北京康为世纪生物科技有限公司);PrimeSTAR Max DNA Polymerase(日本TaKaRa公司);T4 DNA Ligase、DNA限制性内切酶(加拿大Fermentas公司);DNA胶回收试剂盒(美国Axygen公司);质粒提取试剂盒(美国OMEGA公司);DMEM高糖培养基(美国Hyclone公司);胎牛血清(美国CLARK公司); LipofectamineTM2000、Opti-MEM Reduced Serum Medium(美国Invitrogen公司);Western blot相关试剂(上海碧云天生物技术研究所); Monoclonal anti-FLAG M2(美国Sigma公司);TRITC/FITC标记山羊抗小鼠IgG(北京中杉金桥生物技术有限公司);荧光封片胶(丹麦DAKO公司);PVDF膜(加拿大BioBasic公司);SuperSignal West Pico显色试剂盒(美国Pierce公司)。
1.1.3 主要仪器 紫外-可见分光光度计(美国Nano-Drop公司);Leica TCS SP5共聚焦显微镜(德国Leica公司);超声破碎仪(VC750型,美国Sonic公司);电泳仪(BIO RAD 041BR型,美国Bio-Rad公司);垂直电泳槽和转移电泳槽(北京六一仪器厂);Bioshine ChemiQ化学发光成像系统(上海勤翔科学仪器有限公司)。
1.2 方法
1.2.1 EBI3突变体设计 分析美国国立生物技术信息中心NCBI数据库(http://www.ncbi.nlm.nih.gov/)中人EBI3序列的结构域信息,EBI3蛋白的氨基酸结构包括两个串联的保守性区域,即经过修饰的纤连蛋白Ⅲ型结构域FN3,分别包含第47~115、129~224位氨基酸。本实验设计构建了EBI3野生型以及分别包含氨基端、羧基端FN3结构域的三种突变体,同时构建了将EBI3第210位天冬氨酸突变为丙氨酸的Asp210点突变体,见图1。

图1 EBI3蛋白结构及突变体质粒构建示意图(红线为210位天冬氨酸突变为丙氨酸)
1.2.2 野生型人EBI3及缺失突变体构建 运用软件Primer Premier 5设计出下游带FLAG标签的EBI3全长及其突变体的引物(表1,下划线部分为FLAG标签序列),设计的特定基因目的片段均构建于真核表达载体pcDNA3.1(+)上,特异性引物均由上海生工生物工程有限公司合成。以含人EBI3全长cDNA序列的质粒为模板,采用25 μl PCR体系,使用厂商推荐的PCR反应程序,分别用Pfu MasterMix扩增出EBI3-FLAG、用PrimeSTAR Max 扩增出EBI3(1~135)-FLAG和EBI3(125~230)-FLAG目的片段,DNA胶回收试剂盒回收PCR产物。分别将真核表达载体pcDNA3.1(+)和回收的PCR产物双酶切后进行凝胶电泳,并用DNA胶回收试剂盒再次回收,将回收产物用T4 DNA连接酶于16 ℃连接16 h,连接产物转化入DH5α感受态细菌,37 ℃培养箱内倒置培养约16 h,挑取单克隆在含有氨苄青抗性的LB培养基中,37 ℃恒温震荡培养约12 h;碱裂解法提取质粒后做双酶切鉴定,酶切鉴定正确的质粒送上海生工生物工程有限公司测序。
1.2.3 点突变体构建 构建了点突变体Asp210的真核表达重组质粒pcDNA3.1-EBI3-D210A-FLAGEBI3,引物设计见表1。配制突变PCR反应液体系,在1.5 ml离心管中加PrimeSTAR Max Premix(2×)12.5 μl,上、下游引物(10 μmol/L)各0.5 μl,测序正确的pcDNA3.1-EBI3-FLAG质粒模板30 ng,加双蒸水至25 μl。反应条件:98 ℃ 2 min,98 ℃ 10 s,56 ℃ 30 s,72 ℃ 6 min,共32个循环,72 ℃ 10 min,PCR反应结束后产物4 ℃保存,先取5 μl PCR产物经琼脂糖凝胶电泳鉴定片段大小正确后,再将装有余下PCR产物的离心管迅速放入冰浴5 min,之后加入2 μl DpnⅠ酶,37 ℃水浴2 h消化模板,随后将离心管内溶液全部转化入DH5α感受态细菌中进行培养,提取质粒,酶切鉴定正确的克隆送至上海生工生物工程有限公司测序。
1.2.4 细胞培养 将HEK 293T细胞和COS7细胞以适当浓度分别接种于含10%胎牛血清的DMEM培养液(含青霉素和链霉素各100 U/ml)中,于37℃、5% CO2细胞培养箱培养,待细胞融合至80%~90%时进行传代。

表1 质粒名称及引物序列
1.2.5 Western blot检测EBI3野生型和突变体的蛋白表达 转染前约24 h,传代HEK 293T细胞,以1×105~2×105/cm2的密度均匀接种于35 mm的培养皿中,待细胞长至80%~90%汇合度时,进行转染实验,重组质粒与LipofectamineTM2000的比例为1 μg ∶2 μl。转染后48 h分别收集细胞,用预冷的PBS清洗2次,加入含有蛋白酶抑制剂PMSF的细胞裂解液,4 ℃混旋裂解1 h,14 000 r/min离心20 min收集上清液,经蛋白定量后制成样品进行SDS-PAGE电泳;100 V电转膜1 h;用含5%脱脂奶粉的TBST室温封闭PVDF膜2 h,FLAG-M2抗体(1 ∶500)4 ℃孵育过夜,TBST漂洗;二抗(1 ∶5 000)室温孵育2 h,TBST漂洗后显影。
1.2.6 免疫荧光实验 转染前约24 h,将灭菌过的盖玻片置于35 mm的培养皿,用多聚赖氨酸溶液包被后自然晾干。传代COS7细胞,以1×105~2×105/cm2的密度将细胞均匀接种于预置盖玻片的培养皿,37 ℃、5% CO2继续培养,待细胞长至50%~60%汇合度时,进行转染实验。分别转染EBI3野生型及其突变体质粒,重组质粒与LipofectamineTM2000的比例为1 μg ∶1 μl。培养6 h后换含有10%血清的培养液继续培养约24 h。取出盖玻片,预冷的PBS清洗后依次用预冷的甲醇(-20 ℃冷藏)和乙醇(室温)固定细胞,预冷的PBS清洗后用含1%脱脂奶粉的TBST室温封闭0.5 h,PBS清洗后Monoclonal anti-FLAG M2(1 ∶200)室温孵育2 h,TRITC/FITC标记山羊抗小鼠IgG(1 ∶200)室温孵育1 h,PBS清洗后0.5 μg/ml 的DAPI溶液染核,PBS清洗后封片,4 ℃储存。
2 结果
2.1 EBI3缺失突变体的构建与鉴定 应用碱裂解法抽提重组质粒pcDNA3.1-EBI3-FLAG、pcDNA3.1-EBI3(1~135)-FLAG、pcDNA3.1-EBI3(125~230)-FLAG,经EcoRⅠ、XhoⅠ双酶切,酶切产物经琼脂糖凝胶电泳后置紫外凝胶分析仪下观察,在相应位置出现目的条带,酶切正确的克隆送测序,结果证实目的片段正确插入到pcDNA3.1(+)载体中。见图2。
2.2 EBI3点突变体的鉴定 点突变PCR反应结束后,取5 μl经凝胶电泳鉴定,确认PCR产物片段符合pcDNA3.1-EBI3-D210A-FLAG的大小,结果见图3A。同样使用碱裂解法抽提EBI3点突变体质粒,经EcoRⅠ、XhoⅠ双酶切鉴定正确,见图3B。送重组质粒至上海生工生物工程有限公司测序,结果运用BLAST 软件比对点突变测序序列,确认点突变重组质粒序列正确,见图3C。

图2 重组质粒酶切鉴定图
M1:λDNA/EcoR Ⅰ+Hind Ⅲ Marker;M2:TaKaRa DL2000 Marker;1:pcDNA3.1-EBI3-FLAG酶切鉴定结果;2:pcDNA3.1-EBI3(1~135)-FLAG酶切鉴定结果;3:pcDNA3.1- EBI3(125~230)-FLAG酶切鉴定结果
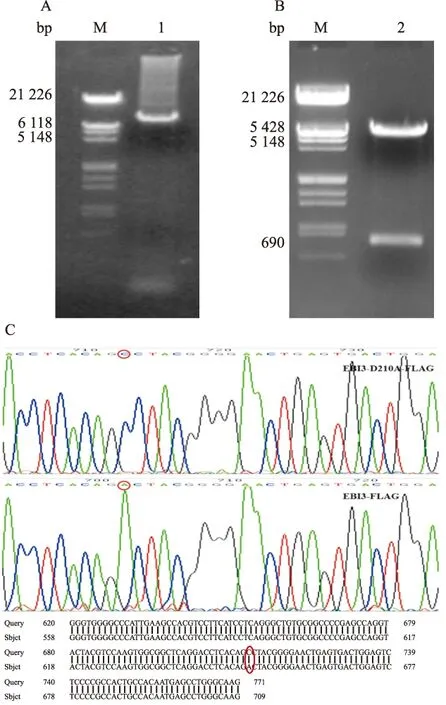
图3 pcDNA3.1-EBI3-D210A-FLAG重组质粒的鉴定
A: pcDNA3.1-EBI3-D210A-FLAG PCR产物凝胶电泳图,M:λDNA/EcoRⅠ+HindⅢ Marker;1:pcDNA3.1-EBI3-D210A-FLAG PCR产物;B:pcDNA3.1-EBI3-D210A-FLAG酶切鉴定图,M:λDNA/EcoRⅠ+HindⅢ Marker;2:pcDNA3.1-EBI3-D210A-FLAG 酶切鉴定结果;C:pcDNA3.1-EBI3-D210A-FLAG与野生型的EBI3序列比对图

图4 Western blot检测EBI3及缺失突变体在HEK 293T细胞中的表达
1:转染pcDNA3.1-EBI3-FLAG的细胞裂解液;2:转染pcDNA3.1-EBI3-D210A-FLAG的细胞裂解液;3:转染pcDNA3.1-EBI3(1~135)-FLAG的细胞裂解液;4:转染pcDNA3.1-EBI3(125~230) -FLAG的细胞裂解液
2.3 EBI3及其突变体在HEK 293T细胞中的表达 转染48 h后,收集细胞,Western blot检测到HEK 293T细胞裂解液中野生型和突变体蛋白,其分子量与预期分子量一致,即EBI3-FLAG、EBI3-D210A-FLAG的分子量均为33 ku,EBI3(1~135)-FLAG、EBI3(125~230)-FLAG的分子量分别为15 ku 和12 ku。见图4。
2.4 EBI3及其突变体在COS7细胞中的定位 转染24 h后经激光共聚焦显微镜观察:野生型EBI3在胞质中大量表达且存在斑块状分布,细胞核中有极少量表达;缺失突变体EBI3(1~135)-FLAG在胞质中表达大幅减少,在核膜处和细胞核内表达增多;EBI3(125~230) -FLAG表达主要集中于核膜和核内,细胞质中少量表达;Asp210点突变体的表达蛋白EBI3-D210A-FLAG在胞质、核膜与核内均有表达。见图5。
3 讨论
固有免疫系统是机体防止外来病原体侵袭的天然防线,EBI3蛋白通过构成不同的细胞因子,在机体免疫系统中发挥着免疫防御和免疫调节的作用。一方面可以诱导产生IFNγ,促进Th1细胞的分化和增殖;另一方面通过抑制T细胞增殖等防止过度的炎症反应的发生[7-8]。机体中的EBI3蛋白与IL-12、IL-23共同由单核细胞、巨噬细胞、树突状细胞以及B细胞等合成,通过病原体特异性抗体识别模式被激活而快速发挥非特异性抗感染等作用[9-11],另外作为IL-35的重要亚基,EBI3也可以由Foxp3+调节性T细胞分泌,亦发现在外周γδT细胞、CD8+T细胞和胎盘滋养层细胞中,EBI3可与p35共同表达[8,12]。在机体中,EBI3的分泌量远大于其参与构成IL-27、IL-35的需要量,因而Collison et al[7]认为多分泌的EBI3可能以单体或者同二聚体的形式拮抗IL-27或IL-35的作用。机体中EBI3表达的异常与多种疾病的发病机制密切相关,如炎症性肠炎克罗恩病、严重的肿瘤性疾病霍奇金病、鼻咽癌等, 在宫颈癌组织中亦发现EBI3表达量显著提高[13-14]。

图5 EBI3及其突变体在COS7细胞中的表达及定位 ×1 500
本研究成功构建了野生型EBI3及分别包含氨基端、羧基端结构域的缺失突变体的真核表达质粒,并且构建了将210位天冬氨酸突变为丙氨酸的定点突变真核表达质粒,转染至真核细胞HEK 293T、COS7细胞系中均能成功表达。免疫荧光定位显示野生型EBI3主要在COS7细胞胞质中呈斑块状分布,且位于胞核的一侧,疑似分布在内质网上,Devergne et al[1]也认为EBI3蛋白分子倾向于以非成熟的形式与分子伴侣calnexin结合积聚于内质网上,但仍需进一步通过对内质网进行荧光标记加以确认。EBI3(1~135)-FLAG融合蛋白中包含了氨基端及一个FN3结构域,与野生型相比,EBI3(1~135)-FLAG在细胞质中的分布减少,但在胞质内仍可见斑块状集中分布,EBI3(125~230)-FLAG融合蛋白中包含了另一个位于羧基端的FN3结构域,该突变体蛋白分子较集中分布在核膜,在细胞质中表达量极低。比较免疫荧光的定位差异,可以推测EBI3蛋白分子中的氨基端存在重要的结构帮助其定位于细胞质,该结构对于EBI3蛋白的分泌亦发挥重要作用;EBI3蛋白分子中的两个FN3结构域则可能参与了EBI3蛋白与其他蛋白分子的结合过程。Asp210突变体的表达蛋白EBI3-D210A-FLAG在细胞质内形成的斑块较为均匀,其在核膜处的分布也较集中,推测EBI3蛋白的第210位的Asp既是影响该蛋白分子与p28结合的关键残基,也可能影响其在细胞内定位。
本课题组在前期的酵母双杂交文库筛选工作中发现EBI3蛋白可与多个蛋白相互作用,但是作用的具体结构位置尚不明确。本实验通过研究含有EBI3不同结构域突变体及Asp210点突变体的蛋白表达和定位差异,为后续进一步揭示EBI3蛋白的功能提供重要的细胞学基础。
[1] Devergne O, Hummel M, Koeppen H,et al.A novel interleukin-12 p40 related protein induced by latent Epstein-Barr virus infection in B lymphocytes[J].J Virol,1996,70(2):1143-53.
[2] Devergne O, Coulomb-L′Hermine A,Capel F,et al. Expression of Epstein-Barr virus-induced gene 3, an interleukin-12 p40-related molecule, through-out human pregnancy:involvement of syncytiotrophoblasts and extravillous trophoblasts[J].Am J Pathol,2001,159(5):1763-76.
[3] Kastelein, R A, Hunter C A, Cua D J. Discovery and biology of IL-23 and IL-27:related but functionally distinct regulators of inflammation[J].Annu Rev Immunol,2007,25:221-42.
[4] Goriely S,Neurath M F. Goldman M. How microorganisms tip the balancebetween interleukin-12 family members[J].Nat Rev Immunol, 2008, 8(1):81-6.
[5] Bazan J F. Structural design and molecular evolution of a cytokine recep-tor superfamily[J].Proc Natl Acad Sci USA, 1990, 87(18):6934-8.
[6] Rousseau F,Basset L,Froger J,et al. IL-27 structural analysis demonstrates similarities with ciliary neurotrophic factor(CNTF) and leads to the identi-fication of antagonistic variants[J].Proc Natl Acad Sci USA, 2010,107(45):19420-5.
[7] Collison L W,Vignali D A.Interleukin-35:odd one out or part of the family?[J]. Immunol Rev, 2008, 226:248-62.
[8] Collison L W,Workman C J, Kuo T T,et al. The inhibitory cytokine IL-35 contributes to regulatory T-cell function[J]. Nature, 2007, 450(7169):566-9.
[9] Ma X, Chow J M, Gri G,et al. The interleukin 12 p40 gene promoter is primed by interferon gamma in monocytic cells[J]. J Exp Med,1996, 183(1):147-57.
[10]Pflanz S,Timans J C,Cheung J,et al. IL-27, a heterodimeric cytokine com-posed of EBI3 and p28 protein, induces proliferation of naive CD4+ T cells[J]. Immunity, 2002, 16(6):779-90.
[11]Hibbert L,Pflanz S,De Waal Malefyt R,et al. IL-27 and IFN-alpha signalviaStat1 and Stat3 and induce T-Bet and IL-12Rbeta2 in naive T cells[J]. J Interferon Cytokine Res, 2003, 23(9):513-22.
[12]Devergne O,Birkenbach M,Kieff E. Epstein-Barr virus-induced gene 3 and the p35 subunit of interleukin 12 form a novel heterodimeric hematopoietin[J].Proc Natl Acad Sci U S A, 1997, 94(22):12041-6.
[13]Hou Y M,Dong J,Liu M Y,et al. Expression of Epstein-Barr virus-induced gene 3 in cervical cancer: Association with clinicopathological parameters and prognosis[J].Oncol Lett, 2016, 11(1):330-4.
[14]Schmidt C,Giese T,Ludwig B,et al. Expression of interleukin-12-related cytokine transcripts in inflammatory bowel disease: elevated interleukin-23p19 and interleukin-27p28 in Crohn′s disease but not in ulcerative colitis[J].Inflamm Bowel Dis, 2005, 11(1):16-23.
Expression and localization of human protein EBI3 and its mutants
Xing Xuemei, Geng Huiwu, Pan Linxin, et al
(DeptofBiology,AnhuiMedicalUniversity,Hefei230032)
ObjectiveToanalyzeexpressionandthereasonofdifferentlocalizationamongwild-typeEBI3(epstein-barrvirus-inducedgene3)anditsmutantsinmammaliancelllines.MethodsBasedontheanalysisofaminoacidsequencefromNCBIdatabase,thehumanEBI3eukaryoticexpressionplasmidspcDNA3.1-EBI3-FLAGwasconstructed,itsmutantspcDNA3.1-EBI3(1-135)-FLAGandpcDNA3.1-EBI3(125-230)-FLAGwhichcontainedsingleFN3domaininaminoterminalorcarboxyterminalandEBI3Asp210pointmutantpcDNA3.1-EBI3-D210A-FLAGwerealsoconstructed;WesternblotanalysiswasappliedtodetecttheexpressionoftherecombinanteukaryoticexpressionplasmidsinmammalianHEK293TcellsandimmunofluorescencetechniquewasusedtodetectthecellularlocalizationinCOS7celllines.ResultsTherecombinanteukaryoticexpressionplasmidswithdownstreamedFLAG-tagofhumanwild-typeEBI3anditsmutantsweresuccessfullyconstructed;WesternblotshowedthattherecombinantproteinscouldstablyexpressinHEK293Tcells;confocalfluorescencemicroscopyresultsindicatedthesignificantchangesinlocalizationofthemutantsofEBI3.ConclusionTheeukaryoticexpressionplasmidsofhumanwild-typeEBI3anditsmutantscansuccessfullyexpressinHEK293TandCOS7cells.ThelocalizationofitsdeletionmutantsinCOS7cellschangesignificantly,indicatingdomainstructureinaminoterminalmayplayanimportantroleinEBI3proteincorrectlocation;theAsp210ofEBI3alsoaffectsthelocalizationofEBI3withinthecell.
EBI3;plasmidconstruction;Westernblot;immunofluorescence
国家自然科学基金青年基金(编号: 81201368)
安徽医科大学生命科学学院1生物学系、2生物科学,合肥 230032
邢雪梅,女,硕士研究生; 刘晓颖,女,副教授,责任作者,E-mail:liuxiaoying@ahmu.edu.cn; 范礼斌,男,教授,硕士生导师,责任作者,E-mail:lfan@ahmu.edu.cn
时间:2016-10-12 13:23:00
http://www.cnki.net/kcms/detail/34.1065.R.20161012.1323.005.html
Q 28;R 392.6
A
1000-1492(2016)11-1573-06
10.19405/j.cnki.issn1000-1492.2016.11.005
2016-07-07接收
