白酒黄水中纤维素降解菌的分离鉴定及产酶活性研究
2016-12-14曾林,谭霄,袁春红等
白酒黄水中纤维素降解菌的分离鉴定及产酶活性研究
曾林1,2,谭霄1,袁春红1,3,张庆1,2*,杨颖4,赵婷婷1,2,唐洁1
(1.西华大学食品与生物工程学院,四川省食品生物技术重点实验室,四川成都610039;2.西华大学古法发酵(酿造)生物技术研究所,四川成都610039;3.乐山市食品药品检验检测中心,四川乐山614000;4.山东省食品药品检验研究院,山东济南250101)
为拓展纤维素降解菌资源,以羧甲基纤维素钠(CMC-Na)为唯一碳源作初筛培养基,从浓香型白酒发酵副产物黄水中分离得到18株具有产纤维素酶能力的菌株进行纯培养。形态学、生理生化和系统发育鉴定结果显示,菌株XH01、XH04、XH05、XH18为Bacillus cereus,菌株XH34为Bacillus circulans,菌株SW01、SW05为Bacillus megaterium,菌株SW02为Bacillus endophyticus,菌株SW03、SW04为Bacillus simplex,菌株SW09、SW13为Bacillus bataviensis。菌株ZL08为Penicillium camemberti,菌株ZL13为Aspergillus fumigatus,菌株ZL04和ZL25为Penicillium chrysogenum,菌株ZL15和ZL17为Alternaria tenuissima。利用二硝基水杨酸法对菌株发酵液纤维素酶活进行研究,结果表明,菌株SW02的产酶活性较高,其羧甲基纤维素酶活为153.36 U/mL,β-葡萄糖苷酶活为126.00 U/mL,微晶纤维素酶活为17.64 U/mL,滤纸酶活为30.48 U/mL。
黄水;纤维素酶;微生物;系统发育;酶活
纤维素是地球上分布最广的碳水化合物,同时又是世界上含量最丰富的可再生资源[1]。目前,许多研究者致力于不同来源的产纤维素酶微生物的筛选,因为对自然界进行生物多样性探索,是获得适合、适用工业生产的新型生物催化剂最有效的手段[2]。
纤维素酶是一类诱导型多酶复合体,通常由内切型葡聚糖酶、外切型葡聚糖酶及β-葡萄糖苷酶3种具有不同催化反应功能的酶组成,几种酶协同作用催化纤维素水解为葡萄糖,利用微生物及其产生的纤维素酶类来分解纤维素是一种经济、有效且无污染的方法[3-4]。纤维素酶是微生物在纤维素类诱导物的诱导作用下产生的[5-6],产纤维素酶的微生物在自然界中广泛存在,但由于酶的生成量、酶稳定性及催化效率等因素的制约,使得纤维素酶的生产远远不能满足工业的需要[7-8]。因此,对产纤维素酶微生物的筛选一直是研究的热点。
黄水是白酒酿造的副产物,具有黏度大、溶氧低等特点,构成了极为复杂的微生物生长环境[9]。迄今为止,产纤维素酶微生物的筛选来源大多限于土壤、粪便、水体等,杨柳等[10]从土壤中分离的一株产滤纸酶和羧甲基纤维素酶活性较高的解淀粉芽孢杆菌;YOUNG C C等[11]从森林土壤中分离出2株能降解碱性木质素的芽孢杆菌。但从浓香型白酒黄水中筛选产纤维素酶微生物的报道不多。
本研究从浓香型白酒发酵副产物黄水中筛选产纤维素酶菌株,并对其进行鉴定及产酶活性评估,以期对窖池中黄水微生物系统的研究提供一定的理论指导,拓宽了产纤维素酶的种质资源。
1 材料与方法
1.1 材料与试剂
浓香型白酒黄水样品:四川水井坊股份有限公司。
羧甲基纤维素钠(carboxymethylcellulose sodium,CMCNa)(分析纯):天津市瑞金特化学品有限公司;微晶纤维素(化学纯)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(化学纯):成都市科龙化工试剂厂;TaKaRa聚合酶、DH5α感受态细胞:TaKaRa Biotechnology(大连);pGM-T试剂盒、MarkerⅦ:天根生化科技有限公司。
培养基:CMC-刚果红平板筛选培养基、CMC液体发酵培养基、酵母浸出粉胨葡萄糖(yeastextractpeptonedextrose,YPD)培养基、LB培养基菌均按参考文献[12]配制。
1.2 仪器与设备
720BR/01492电泳凝胶成像分析系统、BiometraT1PCR仪:BIO-RAD公司;DYY-8C电泳仪:北京六一仪器厂;Heraues Multifuge X1R冷冻高速离心机:Thermo Fisher Scientific公司;BHC-1300ⅡA2生物安全柜:苏州安泰空气技术有限公司;BiometraPCR仪:德国耶拿分析仪器有限公司。
1.3 方法
1.3.1 微生物的分离纯化
取黄水样液25 mL,加入225 mL无菌生理盐水的均质袋中,均质5 min。取适量均质液用无菌生理盐水10倍梯度稀释后涂布于LB培养基菌和YPD培养基进行分离,LB培养基于37℃培养48 h,YPD培养基于28℃、120 r/min培养48 h。分别挑取单菌落划线纯化3次。
1.3.2 纤维素酶产生菌的筛选
将纯化后的菌株接种于筛选培养基,培养2 d后向培养加入适量碘液染色2 min。观察并测量菌株及其周围透明水解圈直径大小,计算透明水解圈直径与菌落直径的比值,初步确定菌株的纤维素酶活性高低。
1.3.3 菌株的形态及生理生化特征
按照《伯杰氏系统细菌学手册》[13]和《真菌鉴定手册》[14]中的鉴定方法进行。
1.3.4 系统发育树的构建
根据XIANG W L等[15]方法提取细菌DNA。16S rRNA扩增引物为Eu27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5'-GGTTACCTTGTTACGACTT-3′)。扩增条件:95℃预变性5 min,95℃变性1 min、50℃退火1 min、72℃延伸2 min,30循环后72℃保持10 min。
根据李可[16]的方法提取真菌DNA。18S rRNA扩增引物:18S-F(5′-AACCTGGTTGATCCTGCCAGT-3′)和18S-R(5′-TGATCCTTCTGCAGGTTCACCTAC-3′)。扩增条件:94℃预变性5 min,94℃变性1 min、55℃退火1 min、72℃延伸55 s,36个循环后72℃保持10 min。
扩增产物连接到pGM-T载体后克隆入感受态细胞E.coliDH5α中,提取重组质粒对16S rRNA和18S rRNA测序。所得序列提交至NCBI进行Blast比对,利用MEGA 5.0软件构建系统发育树。
1.3.5 纤维素酶系活力测定
将产酶菌株接于种子培养基,细菌于37℃、180 r/min摇床培养6 h,真菌于28℃、180 r/min培养12 h。以2%的接种量(约1×107CFU/mL)将种子液接种于液体产酶发酵培养基中,分别于37℃和28℃恒温空气摇床上180 r/min振荡培养3 d。发酵液8 000×g离心5 min,上清液即为粗酶液。采用3,5-二硝基水杨酸测定还原糖的方法检测内切型葡聚糖苷酶(CMC酶活)、外切型葡萄糖苷酶(微晶纤维素酶)、β-葡萄糖苷酶的酶及滤纸酶活。分别以CMC-Na、微晶纤维素、D-水杨苷、滤纸为唯一作用底物,取1 mL适当稀释的待测酶液和1 mL磷酸氢二钠-柠檬酸缓冲液(pH 7.0),于50℃水浴1 h后,加入2 mL DNS试剂终止反应,沸水浴中煮沸10 min,冷水浴冷却后,于波长540 nm处比色[17]。
纤维素酶系活力定义为每1mL样液每分钟水解纤维素底物生成1μg葡萄糖所需的酶量为1个酶活力单位,U/mL。
2 结果与分析
2.1 微生物的分离纯化及形态特征分析
以CMC-Na为唯一碳源对浓香型白酒发酵黄水中微生物进行筛选培养,共筛选到18株纤维素降解菌,将18株纤维素降解菌纤维素降解菌接种于平板培养基中,30℃、120 r/min培养24 d后,菌体形态见图1,其菌落直径和透明圈直径见表1。

图1 产纤维素酶菌株的菌体形态Fig.1 Mycelial morphology of cellulase-producing strains
由图1可知,细菌菌落多数为圆形,均具有光泽,显微观察菌体均为杆状,革兰氏染色均为阳性。真菌菌落扩散生长,呈棉絮状,结构疏松,孢子黑色,边缘较整齐。

表1 筛选平板上18株微生物的菌落直径和透明圈直径Table 1 Diameters of colony and clear haloes on the screening plate formed by cellulose-decomposing strains
由表1可知,菌株XH34和SW02在筛选培养基上表现出具有较大的水解纤维素能力,比酶活力分别是6.52±0.54和9.04±0.67。
2.2 菌株的生理生化及系统发育树的构建
对筛选出的18株产纤维素酶系菌株进行生理生化试验,结果见表2。将产纤维素酶的18株菌株全部进行测序,测得序列经Mallard 1.02检测后,通过软件BioEdit 7.0检测,无异常序列发现。再利用MEGA5.0软件以Neighbor-Joining法构建系统发育树,结果见图2和图3。18株菌株中4株被鉴定为蜡样芽胞杆菌(Bacillus cereus);1株鉴定为内生芽孢杆菌(Bacillus endophyticus);1株被鉴定为环状芽孢杆菌(Bacillus circulans);2株被鉴定为简单芽孢杆菌(Bacillus simplex);2株被鉴定为巴达维亚芽孢杆菌(Bacillus bataviensis);2株被鉴定为巨大芽胞杆菌(Bacillus megaterium);2株被鉴定为细极链格孢菌(Alternariatenuissima);1株被鉴定为沙门柏干酪青霉菌(Penicillium camemberti);1株鉴定为烟曲霉(Aspergillus fumigatus);2株被鉴定为黄青霉(Penicillium chrysogenum)。这与生理生化特征试验结果相符。

表2 纤维素降解细菌理化特征比较Table 2 Comparison of physicochemical properties of cellulose-decomposing strains

图2 基于16S rRNA序列同源性的纤维素降解细菌系统发育树Fig.2 Bacteria phylogenetic tree of cellulose-decomposing bacteria based on homology of 16S rRNA gene sequences

图3 基于18S rRNA序列同源性的纤维素降解真菌系统发育树Fig.3 Fungus phylogenetic tree of cellulose-decomposing fungi based on homology of 18S rRNA gene sequences
2.3 纤维素酶系活力测定
采用3,5-二硝基水杨酸试剂测定还原糖的方法检测菌株纤维素酶系活力。分别以CMC-Na、D-水杨苷、滤纸、微晶纤维素为唯一作用底物,测定浓香型白酒黄水中纤维素降解菌发酵液中内切型葡聚糖苷酶(CMC酶活)、β-葡萄糖苷酶的酶、外切型葡萄糖苷酶(微晶纤维素酶和滤纸酶活)。结果如图4所示,总体来说,从浓香型白酒黄水中筛选的18株纤维素降解菌产生的纤维素酶对各底物的降解各不相同,表现出不同的活力,在白酒酿造过程中,各纤维素降解菌的协同作用和其产生的纤维素酶系的相互作用共对原料中的纤维素进行降解,破坏间质细胞壁的结构,使其包含的淀粉释放出来,以利于糖化酶的作用,从而起到提高原料利用率、提高发酵率和缩短发酵时间的效果。个体来说,菌株ZL25和SW02产生的纤维素酶系活力较高。其中菌株SW02对羧甲基纤维素钠和D-水杨苷表现出较高的降解活性,分别为153.36 U/mL和120.00 U/mL,也就是说,菌株SW02产生的纤维素酶系中内切型葡聚糖苷酶和β-葡萄糖苷酶活性较高。
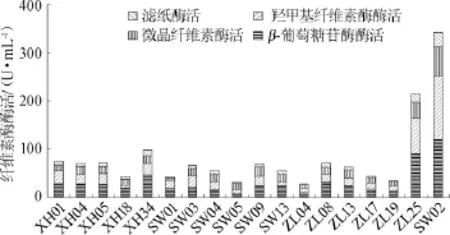
图4 产纤维素酶菌株酶活力比较Fig.4 Comparison of the cellulase activities of the cellulase-producing strains
2.4 讨论
纤维素酶由于其广泛的应用性及良好的应用前景一直受到人们的关注,产纤维素酶菌株筛选、高产菌株的诱变选育、酶系基因克隆、酶系组成及作用机制等各个方向的研究一直都在进行[18]。菌种筛选是纤维素酶生产的基础性工作,也是关键步骤,国内外许多学者已做了大量的研究工作,建立了较为完善的分离筛选方法,现如今已有很多关于纤维素酶产生菌选育的报道[19]。
本研究采用CMC-Na为唯一碳源的初筛方法从低氧、高酸度、营养匮乏的黄水环境中分离出12株产纤维素酶细菌和6株产纤维素酶的真菌,通过透明圈大小及比酶活力大小分析,菌株XH34和SW02在筛选培养基上表现出具有较大的水解纤维素能力。虽然透明圈大小及比酶活力大小可以直观地反映酶浓度的高低及酶活力大小,但不能完全代表菌株产酶能力。其原因是多方面的,固态和液态培养条件下水活度、氧含量、菌的代谢情况等的不同;不同菌株具有不同的生长、产酶速度及纤维素酶系组成;菌苔大小及在平板上堆积情况的差异等因素都会造成透明圈大小与液态发酵酶活力结果的不完全一致[20]。此外,初筛培养基所用的筛选底物为人工合成的可溶性纤维素,与天然不可溶纤维素相比更易被微生物分解利用,因此羧甲基纤维素钠平板筛选法还忽略了天然纤维素和人工纤维素之间的差异,其结果并不能准确反映出菌株对天然纤维素底物的利用能力[21]。所以,进一步对菌株进行液态发酵对产纤维素酶菌株的表达能力评估必不可少。
经形态观察、生理生化分析及分子鉴定得出12株细菌均属于芽孢杆菌属,分别为Bacilluscereus、Bacilluscirculans、Bacillusmegaterium、Bacillusendophyticus、Bacillussimplex、Bacillusbataviensis。目前,已有许多种芽孢杆菌被报道其产纤维素酶能力,如Bacillus amyoliquefaciensDL-3、Bacillus subtilisKG10、Bacillus flexus、Bacillus haloduransCAS1、BacilluslicheniformisSVD1等,而有关Bacillus megaterium、Bacillusendophyticus、Bacillussimplex及Bacillusbataviensis的产纤维素酶的报道还未曾见到[22]。在白酒酿造工业,产纤维素酶菌可对粗原料中的纤维素进行降解,破坏间质细胞壁的结构,使其包含的淀粉释放出来,以利于糖化酶的作用,从而起到提高原料利用率、提高发酵率和缩短发酵时间的效果[23]。农业上,这些产纤维素酶芽孢杆菌还具有微生物催腐剂的潜力,可加速田间农作物废弃物软化腐朽,提升土壤肥力,减少环境污染。因此,本研究对黄水中产纤维素酶细菌进行筛选、鉴定,不仅为黄水中微生物系统的研究提供一定的理论指导,扩展了纤维素酶的种质来源,还为潜质工业微生物的研究及开发提供参考。
3 结论
纤维素酶酶系表达能力分析结果表明,18株菌株都能分泌外型内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶,其中内切葡聚糖酶及β-葡萄糖苷酶酶的活力较高。与其他17株菌株相比菌株SW02的纤维素酶系活力最高,经初步发酵测得的外型内切葡聚糖酶、外切葡聚糖酶、β-葡萄糖苷酶及总酶活力大小分别为153.36 U/mL、12.00 U/mL、17.65 U/mL、30.48 U/mL,其中β-葡萄糖苷酶酶活力最高,与其他研究者筛选到的产纤维素酶菌株相比[7],菌株SW02的酶系活力较低,但不同来源纤维素酶系的组成成分不同、结构不同,其酶活力和分解能力也不相同,并且微生物的培养条件和酶活力测定条件对所测的酶活力影响较大。因此,后续的发酵条件优化以提高纤维素酶系活力的研究尤为重要,这将为酶发酵工业化开发利用、提高纤维素分解效率等研究探讨奠定基础。
[1]YU H Y,LI X.Alkali-stable cellulase from a halophilic isolate,Gracilibacillussp.SK1 and its application in lignocellulosic saccharification for ethanol production[J].Biomass Bioenerg,2015,81:19-25.
[2]JING L,ZHAO S,XUE J L,et al.Isolation and characterization of a novel Penicillium oxalicumstrain Z1-3 with enhanced cellobiohydrolase production using cellulase-hydrolyzed sugarcane bagasse as carbon source [J].Ind Crop Prod,2015,77:666-675.
[3]许志,曾柏泉,宋睿,等.高产纤维素酶菌株筛选及诱变选育[J].中国农学通报,2011,27(24):108-111.
[4]卢敏,王帅豪,狄元冉,等.纤维素酶基因克隆与表达[J].动物营养学报,2012,24(6):1013-1018.
[5]TRIVEDI N,GUPTA V,KUMAR M,et al.An alkali-halotolerant cellulase fromBacillus flexusisolated from green seaweedUlva lactuca[J]. Carbohyd Polym,2011,83(2):891-897.
[6]WEN Z Y,LIAO W,CHEN S.Production of cellulase byTrichoderma reeseifrom dairy manure[J].Bioresource Technol,2005,96(4):491-499.
[7]KETNA M,DIGANTKUMAR C,JYOTI D,et al.Production of cellulase by a newly isolated strain ofAspergillus sydowiiand its optimization under submerged fermentation[J].Int Biodeter Biodegr,2013,78:24-33.
[8]LI W Y,TECK N A,GEK C N,et al.Fungal solid-state fermentation and various methods of enhancement in cellulase production[J].Biomass Bioenerg,2014,67:319-338.
[9]彭佑信.论浓香型白酒生产中的黄水[J].酿酒,2009,36(1):37-39.
[10]杨柳,魏兆军,朱武军,等.产纤维素酶菌株的分离、鉴定及其酶学性质研究[J].微生物学杂志,2008,28(4):65-69.
[11]YOUNG C C,DUBOK C,KAZUHIRO T,et al.Isolation ofBacillussp. strains capable of decomposing alkali lignin and their application in combination with lactic acid bacteria for enhancing cellulase performance[J].Bioresource Technol,2014,152:429-436.
[12]SHIKATA S,SAEKI K,OKOSHI H,et al.Cellulases for laundry detergents:Production by alkalophilic strains ofBacillusand some properties of the crude enzymes[J].Agr Biol Chem,1990,54(1):91-96.
[13]GEORGE M G,JULIA A B,TIMOTHY G L.et al.Bergey's manual of systematic bacteriology,second edition[M].New York:Springer Verlag,2004:20-25.
[14]魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979:60-73.
[15]XIANG W L,LIANG H Z,LIU S,et al.Isolation and performance evaluation of halo tolerant phosphate solubilizing bacteria from the rhizosphericsoilsof historicDagongBrineWellinChina[J].World J Microb Biot,2011,27(11):2629-2637.
[16]李可.中国浓香型白酒发酵黄水中微生物群落结构及多样性解析[D].成都:西华大学,2014.
[17]GANESH D S,RIJUTA G S,SANG E.Production and characterization of multiple cellulolytic enzymes by isolatedStreptomycessp.MDS[J]. Biomass Bioenerg,2012,47:302-315.
[18]RAMALINGAM K,RAMASAMY G.,Isolation,screening and characterization of cellulase producingBacillus subtilisKG10 from virgin forest of Kovai Kutralam,Coimbatore,India[J].Res J Biotechnol,2013,8 (6):17-24.
[19]李琦,刘伍生,刘正初.不同地点筛选纤维素酶产生菌的研究进展[J].中国农学通报,2012,28(33):194-198..
[20]KUMAR H,AVINASH M,BHAVANATH J.Purification and characterization of cellulase from a marineBacillussp.H1666:a potential agent for single step saccharification of seaweed biomass[J].J Mol Catal B-Enzym,2013,45(5):51-56.
[21]JENNIFER L,MORRELL F,WANG Z W,et al.Determination of the cellulase activity distribution inClostridium thermocellumandCaldicellulosirupyor obsidiansiscultures using a fluorescent substrate[J].J Environ Sci,2015,34:212-218.
[22]陈丽园,夏伦志,吴东,等.油菜秸秆分解菌的筛选与产酶特性初探[J].试验研究,2007,27(5):9-12.
[23]HU D X,JU X,LI L Z,et al.Improved in situ saccharification of cellulose pretreated by dimethyl sulfoxide/ionic liquid using cellulase from a newly isolatedPaenibacillussp.LLZ1[J].Bioresource Technol,2016, 201:8-14.
Isolation and identification of cellulose-degrading strains from yellow water ofBaijiu (Chinese liquor)and its cellulase activity
ZENG Lin1,2,TAN Xiao1,YUAN Chunhong1,3,ZHANG Qing1,2*,YANG Ying4,ZHAO Tingting1,2,TANG Jie1
(1.Provincial Key Laboratory of Food Biotechnology of Sichuan,College of Food and Bioengineering,Xihua University,Chengdu 610039, China;2.Biotechnology Institute of Ancient Brewing,Xihua University,Chengdu 610039,China;3.Food and Drug Testing Center of Leshan,Leshan 614000,China;4.Food and Drug Institute of Shandong,Jinan 250101,China)
In order to broaden and evaluate the strain resources with cellulose degradation capability,using carboxymethyl cellulose-Na as sole carbon sources,a total of 18 strains with cellulose-producing abilitywere isolated from yellow water of the Luzhou-flavorBaijiu(Chinese liquor)fermentation. The results of morphological,physiological and biochemical characterization and 16S rRNA analysis showed that strain XH01,XH04,XH05 and XH18 were identified asBacillus cereus,strain XH34 was identified asBacillus circulans,strain SW01 and SW05 were identified asBacillus megaterium,strain SW02 was identified asBacillus endophyticus,strain SW03 and SW04 were identified asBacillus simplex,strain SW09 and SW13 were identified asBacillus bataviensis.Strain ZL08 was identified asPenicillium camemberti,strain ZL13 was identified asAspergillus fumigatus, strain ZL04 and ZL25 were identified asPenicillium chrysogenum,strain ZL15 and ZL17 were identified asAlternaria tenuissima.Their cellulase activity were detected by DNS method,and results showed that strain SW02 had higher cellulase activity,the CMCase,β-glucosidase,avicelase and FPase activity were 153.36 U/ml,126.00 U/ml,17.64 U/ml and 30.48 U/ml,respectively.
yellow water;cellulase;microorganism;phylogeny;enzyme activity
TQ920.6
0254-5071(2016)11-0059-05
10.11882/j.issn.0254-5071.2016.11.012
2016-08-02
教育部春晖计划项目(Z2014060);四川省应用基础项目(2016JY0253);省级大学生创新训练项目(201510623081)
曾林(1992-),男,硕士研究生,研究方向为食品微生物技术。
*通讯作者:张庆(1979-),男,副教授,博士,研究方向为食品微生物技术。
