ACE抑制肽的制备及其结构对活性的影响
2016-12-14吴楠双全
吴楠,双全
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
ACE抑制肽的制备及其结构对活性的影响
吴楠,双全*
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
血管紧张素转化酶(ACE)通过一系列的生理反应,从而起到升高血压的作用,在人体中过量ACE的产生会引起高血压,而生物活性物质ACE抑制肽能够抑制ACE的功能。文章主要综述了ACE抑制肽的主要制备方法及氨基酸序列特点与ACE抑制活性的关系,并阐述了脯氨酸对ACE抑制活性的影响,以及部分氨基酸的结构特点及功能,为今后ACE抑制肽的制备与应用提供参考依据。
血管紧张素转化酶;抑制肽;脯氨酸;半抑制浓度
随着生活水平的不断提高,由饮食带来的各种疾病层出不穷(如高血压、高血脂、肥胖症、糖尿病、癌症等)。大众的饮食理念已从吃饱向防治疾病方向转变,以追求更健康的饮食习惯。生物活性肽(bioactive peptides,BAP)的分子质量较小(一般<6 ku),与普通蛋白质相比更易吸收,同时具有抗血栓、抗癌、抑菌、抗氧化、抗病毒、降低胆固醇以及抗高血压等作用,已成为21世纪研究的新宠[1]。
血管紧张素转换酶(angiotensin converting enzyme,ACE)是一种膜结合的糖蛋白,是一种多功能酶,在细胞膜上通过锚序列结合,分子质量为13 000~15 000 u,最适pH值为7.5~8.3。正常人体内ACE的含量处于平衡状态,一旦平衡失调或ACE的含量增多就会导致高血压疾病的发生。血管紧张素转化酶抑制肽(angiotensin I-converting enzyme inhibitory peptides,ACEI)作为一种生物活性肽,具有降血压的作用。如今化学合成的ACE抑制剂有很多,如赖洛普利、卡托普利、依那普利、雷米普拉等,对治疗高血压方面有很好的效果,但也会带来很多毒副反应;而食源性ACE抑制肽(乳类、鱼类、豆类等)与化学合成的ACE抑制肽不同,食用安全且具有保健和营养等功能,近几年来成为国内外研究的热点,同时还是功能性产品的一个开发方向。根据国内外对ACE抑制肽的研究显示,其氨基酸序列的组成对其生物学功能具有一定的影响,如肽段中脯氨酸的存在位置影响ACE抑制肽的抑制活性、肽段中酪氨酸的存在可以增强肽段的抗氧化活性以及ACE抑制肽C-端和N-端上不同种类的氨基酸对ACE抑制肽活性有不同的影响。本文主要探讨具有降血压作用的血管紧张素转换酶抑制肽[2]的主要的制备方法、结构特点及应用,进而发现氨基酸序列的排列方式及单个氨基酸所处位置对ACE抑制肽活性的影响,为今后更好地开发和利用ACE抑制肽提供理论的支持。
1 ACE抑制肽来源及其作用机制
ACE抑制肽的探索和研究开始于1965年,FERREIRA S H[3]从南美蝮蛇毒液中首次分离提取出有缓激肽增强因子(bradykinin potentiating factors,BPF)的多肽类物质,而这种多肽物质对ACE的活性有抑制作用,这种多肽的发现激发了学者们对肽类降压药的研究兴趣。1971年,ONIDETTI M A等[4]提出了ACE抑制肽的初始模型,同时合成了应用于临床的ACE抑制肽—壬肽抗压素(teprotide),它是缓激肽增强因子(bradykinin-potentiating factor,BPFS)的成分之一。1977年,ONIDETTI M A等[5]提出了ACE与底物的作用模型并进行了后续的模型改善,根据这种改善后的模型合成了多种ACE抑制剂,但这些抑制剂通常会产生各种副作用。而其后,学者们将注意力转向了食品领域,以求寻找更安全、更有效、无副作用的降血压物质。1979年,OSHIMA G等[6]采用细菌性胶原酶水解明胶分离了6条ACE抑制肽,这也是人类首次利用食源性蛋白质为底物水解得到的ACE抑制肽。而其后,人们又从乳酪蛋白[7]、乳清蛋白[8]、乳酸菌发酵乳[9]、海洋生物蛋白[10-12]、大豆蛋白[13]、大麦蛋白[14]、大麻蛋白等[15]中发现了ACE抑制肽,并对其序列或结构进行研究,目前采用最多的是从牛奶中提取的ACE抑制肽。
血管紧张素转换酶(ACE)是一种膜结合的的二肽羧基酶,是一种糖蛋白,人体组织及血浆中存在广泛,在肺部的含量最多。血管紧张素转换酶2(ACE2)是近年来发现的人ACE的同系化合物,主要存在于肾脏和血管内皮细胞中。人体中的ACE具有两种亚型:分别是体细胞ACE(somatic ACE,sACE)和睾丸ACE(testicular ACE,tACE)。ACE是一种多功能酶,参与体内肾素-血管紧张素系统(renin-angiotensin system,RAS)和激肽释放酶-激肽系统(kallikrein-kininsystem,KKS)来影响机体血压。RAS系统和KKS系统有相互拮抗的作用,是否平衡关系到血压是否正常,ACE通过RAS和KKS来调节血压[16]。在ACE的催化作用下血管紧张素I(angiotensin,AngI)转化为一种有效的血管收缩剂血管紧张素II(angiotensin,AngII),AngII是目前发现的最强的血管收缩剂之一,其具体在体内的作用关系如图1所示。
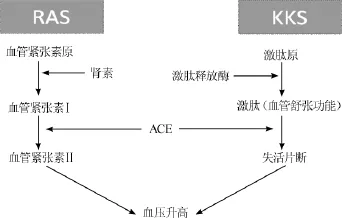
图1 ACE降压作用机制Fig.1 Antihypertensive mechanism of ACE
2 ACE抑制肽的制备方法
2.1 直接酶解法
酶解法一般通过选择合适的酶水解蛋白质或多肽的方法,把具有ACE抑制活性的片段释放出来,从而达到制备ACE抑制肽的目的。目前,酶水解法是提取ACE抑制肽普遍采用的方法,对乳蛋白采用酶水解法提取ACE抑制肽是研究最多的。酶水解法提取的ACE抑制肽无副作用,安全性高,在温和条件下水解分裂产生ACE抑制肽,水解过程易于控制,且酶法生成的ACE抑制肽片段分子质量小。
酶解法可分为两类,即单一酶的一步反应和复合酶对底物的同时一步水解或按顺序水解的多步反应。ACE抑制肽的功能与其氨基酸序列直接相关,ACE抑制肽的一级结构或氨基酸潜在的影响其抑制活性,即影响其生物学功能,所以酶对底物的不同的酶解位点也是制备ACE抑制肽的关键。研究表明,2~7个氨基酸残基组成的多肽更易被人体吸收并发挥其生物功能[17],故采用复合酶解法或分部酶解法来制备分子质量小而活性高的ACE抑制肽成为如今的研究热点。
很多食品源的蛋白质如乳蛋白、鱼蛋白、植物蛋白等中都含有ACE抑制肽,由于食源蛋白中的ACE抑制肽在进入人体后在胃中就有大部分被分解,而食源蛋白中的ACE抑制肽的活性远远低于其在体外的活性,所以在普通条件下一般不具备降血压的作用,而如果ACE抑制肽在体内有较高的抑制活性,就会很好的发挥其作用。这些潜在的具有降血压的功能的蛋白质,之所以具有ACE的抑制活性是因为其含有降血压功能的肽段。目前,制备ACE抑制肽常用的蛋白酶有两种,分别是动物来源蛋白酶和植物来源蛋白酶,动物来源的有胰蛋白酶、胰凝乳蛋白酶、胃蛋白酶等,植物来源的有小麦蛋白酶、木瓜蛋白酶[18]、生姜蛋白酶[15]、菠萝蛋白酶[18]等。除此之外也有其它的蛋白酶,如:米曲霉蛋白酶[19]、黑曲霉脯氨酰胞内蛋白酶[20]、风味酶蛋白酶、碱性蛋白酶等。经研究证明,不同蛋白酶水解产物的ACE抑制活性具有显著差异,其关键在于不同底物与不同蛋白酶的切合性。于晓庆等[21]以耗牛乳为原料,分别用4种蛋白酶(蛋白酶A、木瓜蛋白酶、胃蛋白酶、胰蛋白酶)进行水解制备ACE抑制肽,蛋白酶A是制备乳源ACE抑制肽的最佳水解酶,它的半抑制浓度(50%inhibitory concentration,IC50)值为1.206 3 mg/mL,最佳反应条件为温度52℃、pH 7、酶用量3%、底物质量分数4.5%、水解9.5 h,酶解过程中随着时间的延长,水解度略有所增加,同时游离氨基酸大幅增加。酶解法制备ACE抑制肽的过程中,通过改变酶的种类、酶的水解参数等条件,以达到制备具有较高抑制活性的降血压肽的目的。
2.2 发酵法
发酵法又称为间接酶解法,利用微生物体内酶解反应制备ACE抑制肽。据研究表明,现如今研究的最多的是乳酸菌,发现瑞士乳杆菌(Lactobacillus helveticus)有较强的蛋白水解活性。YAMAMOTO N等[22]在1993年对瑞士乳杆菌(Lactobacillus helveticus)CP790进行研究发现,其分泌的蛋白水解酶水解酪蛋白后可以产生多种降血压肽。NAKAMURA A等[23-24]用瑞士乳杆菌(Lactobacillus helveticus)和酿酒酵母(Saccharomyces cerevisiae)作为发酵剂制作的一种乳酸菌饮料“Calpis”,对自发性高血压(spontaneouslyhypertensive rats,SHR)大鼠长期饲喂后发现可抑制血压的上升,并从“Calpis”中提取出了具有ACE抑制活性的短肽缬氨酸-脯氨酸-脯氨酸(Val-Pro-Pro,VPP)和异亮氨酸-脯氨酸-脯氨酸(Ile-Pro-Pro,IPP),经国内外多个学者验证VPP和IPP具有显著的降血压效果。PAND等[25]采用Lactobacillus helveticusLB10菌种进行酸奶发酵,研究最佳发酵条件下得到的发酵产物具有最高ACE的抑制活性,所以通过实验测定,最佳发酵条件是温度39.0℃、pH 7.5、培养液4%,ACE的抑制率为75.46%。
发酵法是一种安全便捷的制备ACE抑制肽的方法,现今国内外对发酵法制备ACE抑制肽的研究也较多,发酵法可通过改变发酵条件,使底物和酶都达到最佳反应条件以求得到具有最高ACE抑制活性的ACE抑制肽。
3 ACE抑制肽结构对抑制活性的影响
3.1 ACE抑制肽活性与分子质量的关系
根据许多研究表明,通过3 ku或更低的分子质量的薄膜过滤的ACE抑制肽其抑制活性在增加。因此,不管蛋白底物的来源是什么,在一种蛋白水解产物中低分子质量的多肽普遍具有更高效的活性。降血压肽的长度一般为2~12个氨基酸残基组成,个别多肽含有27个以上的氨基酸残基,但2~7个氨基酸残基的ACE抑制肽的抑制活性较高。吴晖等[26]在首次用碱性蛋白酶(alcalase)酶解丝素蛋白制备抑制活性高的降血压肽,实验测得ACE抑制率为74.07%,并用基质辅助激光解吸电离飞行时间质谱仪(matrix-asissted laser desorption ionization-time of flight-mass spectrometry,MALDL-TOF-MS)分析表明,得到的短肽分子质量<2.4u。代永刚等[27]用碱性蛋白酶酶解制备ACE抑制肽,用超滤进行初步分离,ACE的抑制率为57.34%,经凝胶柱纯化的ACE抑制率为62.78%,相对分子质量<1500u。MARQUESC等[28]用乳清蛋白水解液饲喂自发性高血压大鼠(spontaneously hypertensive rats,SHR),采用自动测量传导技术给大鼠测量血压,结果表明,乳清水解液中分子质量在1~3 u之间组分具有降血压的作用。CHEN J等[29]建立了有效的分离体系,使大米蛋白源的ACE抑制肽分离,经过超滤等一系列步骤后的得到的ACE抑制肽的分子质量<3 u,且具有较好的抑制活性。崔楠[30]在研究木瓜蛋白酶酶解制备黄粉虫ACE抑制肽中,采用超滤和葡聚糖G-15凝胶对酶水解产物分离,得到分子质量不同的组分如下:分子质量>30 u、分子质量10~30 u、分子质量5~10 u、分子质量3~5 u、分子质量<3 u,经过对各组分进行检测,分子质量<3 u的ACE抑制率高达65.43%,再经过进一步的分离和纯化ACE抑制率提高到72.11%。
3.2 ACE抑制肽活性与氨基酸序列脯氨酸末端的关系
目前,对ACE抑制肽结构与功能的关系还没有研究透彻,但国内外的研究普遍认为,ACE抑制肽的活性与其自身的结构和氨基酸顺序有关。经研究表明体细胞ACE的C端催化部位有三个催化结合位点,这三个位点分别与血管紧张素I(ACE-I)的三个疏水性残基苯丙氨酸(Phe)、组氨酸(His)、亮氨酸(Leu)对应。研究发现ACE抑制肽的C端氨基酸为脯氨酸的抑制肽活性较高。脯氨酸(Pro)的化学名称是吡咯烷酮羧酸,是一种环装亚氨基酸。脯氨酸(Pro)是人体的非必需氨基酸,是构成蛋白质的基本单位,是组成人体蛋白质的21种氨基酸之一。
NORRIS R等[20]用黑曲霉(Aspergillus niger)产的脯氨酰胞内蛋白酶(prolyl endoproteinase,PEP)简称为An-PEP,对牛乳中αS-酪蛋白酶解得到的ACE抑制肽进行研究,通过分析确认An-PEP主要分裂蛋白质C末端并且确认An-PEP具有把C末端分裂成丙氨酸(Ala)、亮氨酸(Leu)、精氨酸(Arg)和组氨酸(His)的作用,证明有效ACE抑制肽的释放是An-PEP特异性的作用,同时末端为脯氨酸的肽端抑制活性较高。同时在实验过程中,水解物在Corolase PP蛋白酶的作用下的水解度为(11.27±0.61)%,1C50为(96.7±22.7)%,结果表明Corolase PP蛋白酶对水解物中的ACE抑制活性没有太大的作用,但Corolase PP蛋白酶作用后ACE的抑制活性的稳定性增强是由于ACE抑制肽的进一步降解使新的活性多肽释放,同时ACE抑制活性保持平衡,这证明了含有大量脯氨酸的ACE抑制肽中包含有免受于胃部体内的降解物。据报道低分子量且含有脯氨酸的多肽也许对机体内消化酶有抵抗作用。QUIROS A等[31]也对包含脯氨酸的酪蛋白多肽中的ACE抑制活性在酶解作用后的稳定性进行评估得知,含有两个脯氨酸的多肽Leu-His-Leu-Pro-Leu-Pro对胃蛋白酶和Corolase PP的水解有较好的抵抗作用,其稳定性是由于多肽序列的特异性。这可能说明脯氨酸在ACE抑制肽中起着关键作用。
黄国栋[32]对以脯氨酸为端基的ACE抑制三肽定量构效关系进行研究表明,ACE抑制三肽的第一位和第三位对抑制活性的影响较大,中间的对抑制活性的影响较小,末端为脯氨酸的ACE抑制肽更易于与ACE结合。
3.3 美拉德反应对ACE抑制肽的影响
美拉德反应是羰基化合物和氨基化合物之间发生的一系列的复杂反应,从而改善食品的口感、色泽、香气等特性。近年来作为一种改性手段,美拉德反应在食品中用来提高反应物的生物活性,如抗菌性、抗氧化活性、抗敏性、苹果多酚氧化酶抑制活性、葡萄糖苷酶抑制活性等。美拉德反应主要有干法和湿法两种,其中采用湿法来提高其生物活性的较广泛。
RUFIÁN-HENARES J A等[33]通过制备8种葡萄糖美拉德反应体系,对终产物得到的类黑精进行研究得知,类黑精具有较高的体外ACE抑制活性。洪旭[34]通过对酪蛋白进行两部酶解、分离纯化、氨基酸序列测定得到了4条ACE抑制活性较高的肽段,然后再用美拉德反应改性后其ACE抑制活性显著提高,最后对改性后的产物进行结构与性质的分析得出,湿法与干法美拉德反应相比,湿法的产物颜色深,羰氨缩合产物比例较大,反应程度高,且产物具有耐热、耐酸碱、耐胃肠道消化等特点。
美拉德反应过程中羰氮缩合反应导致体系中C=O含量减少,C-N、N-H键含量升高,美拉德反应是一个级联反应,多肽中有精氨酸、酪氨酸、赖氨酸与糖分子之间发生羰氮缩合反应,导致其结构发生改变,从而提高ACE抑制活性。因此,可以推断ACE的抑制活性与其结构有很大关系。
4 ACE抑制肽的应用
4.1 食品中的应用
ACE抑制肽具有降血压的作用,可用于生产具有降血压功能的保健品。最常用的就是发酵乳制品,利用乳酸菌发酵可以得到具有ACE的抑制活性的产物,通过优化发酵条件来获得更高ACE抑制活性的发酵乳。最为人所知的是已在日本上市的由乳酸杆菌发酵的脱脂牛奶“Calpis”,这种酸奶具有明显的降血压作用。
4.2 临床应用
从ACE抑制肽的发现到现在,大量的医学临床研究证明了ACE抑制剂用来治疗各种疾病的价值。ACE抑制剂可以改善血管内壁的功能,增加心肌的血量,降低梗死面积,减少心率衰竭的发生。ACE抑制剂能够提高患者对胰岛素的敏感性,从而改善胰岛素抵抗,还具有保护肾脏的作用。ACE抑制剂具有预防和治疗心力衰竭和维护心肌的功能。ACE抑制剂将广泛应用于高血压、冠心病、心肌梗死、心力衰竭等疾病的治疗和预防。
经GADELHA A等[35]研究表明,血管紧张素转换酶活性与精神分裂症患者的认知程度有关,在普通人与患者的测试中具有高ACE活性的患者记忆力差,通过对小鼠的动物试验得知ACE基因的负载调节与小鼠的认知能力有关。因此,ACE抑制肽的研究对疾病的治疗有一定的推动性作用。
5 结论
现如今对ACE抑制肽的研究较广泛,但是仍然对其结构与功能有疑惑。具有芳香性氨基酸和脯氨酸的ACE抑制肽,其ACE抑制活性都较高,这可能归因于它们都是疏水性氨基酸且脯氨酸与芳香性氨基酸相似都具有环装结构。这些特征可能会影响其自身的稳定性和对ACE的抑制能力。
今后的研究可致力于ACE抑制肽的氨基酸序列的结构与其功能的关系,蛋白质的结构本身会影响蛋白的生物学功能。通过对ACE抑制肽结构的研究,寻找一个在人体中可以稳定存在的抑制肽,使其进入人体后依旧保持高的ACE抑制活性。所以对ACE抑制肽结构稳定性的研究将有一个广阔的前景。
[1]王竹清,李八方.生物活性肽及其研究进展[J].中国海洋药物,2010(2):60-68.
[2]沈小璐,吴兰芳,郭善广.ACE抑制肽构效关系的研究进展及乳源性ACE抑制肽的加工利用现状[J].中国乳品工业,2015,43(3):34-37.
[3]FERREIRA S H.A bradykinin-potentiating factor(BPF)present in venom of bothrops jararaca[J].Brit J Pharmacol Chemoth,1965,24(1): 163-169.
[4]ONDETTI M A,WILLIAMS N J,SABO E F,et al.Angiotensin-converting enzyme inhibitors from the venom ofBothrops jararaca.Isolation, elucidation of structure,and synthesis[J].Biochemistry,1971,10(22): 4033-4039.
[5]ONDETTI M A,RUBIN B,CUSHMAN D W.Design of specific inhibitors of angiotensin-converting enzyme:new class of orally active antihypertensive agents[J].Science,1977,196(4288):441-4.
[6]OSHIMA G,SHIMABUKURO H,NAGASAWA K.Peptide inhibitors of angiotensin I-converting enzyme in digests of gelatin by bacterial collagenase[J].Biochi Bioph Acta,1979,566(1):128-137.
[7]MAENO M,YAMAMOTO N,TAKANO T.Identification of an antihypertensive peptide from casein hydrolysate produced by a proteinase fromLactobacillus helveticusCP790[J].J Dairy Sci,1996,79(8):1316-21.
[8]PIHLANTO-LEPPÄLÄ A,KOSKINEN P,PIILOLA K,et al.Angiotensin I-converting enzyme inhibitory properties of whey protein digests:concentration and characterization of active peptides[J].J Dairy Res,2000, 67(1):53-64.
[9]王宇.乳酸菌发酵乳抑制血管紧张素转化酶活性的研究[D].无锡:江南大学,2008.
[10]BALTI R,BOUGATEF A,SILA A,et al.Nine novel angiotensin I-converting enzyme(ACE)inhibitory peptides from cuttlefish(Sepia officinalis)muscle protein hydrolysates and antihypertensive effect of the potent active peptide in spontaneously hypertensive rats[J].Food Chem, 2015,170C:519-525.
[11]KLEEKAYAI T,HARNEDY P A,O'KEEFFE M B,et al.Extraction of antioxidant and ACE inhibitory peptides from Thai traditional fermented shrimp pastes[J].Food Chem,2015,176:441-447.
[12]WU S,FENG X,LAN X,et al.Purification and identification of angiotensin-I converting enzyme(ACE)inhibitory peptide from lizard fish (Saurida elongata)hydrolysate[J].J Funct Foods,2015,13:295-299.
[13]WU J,DING X.Hypotensive and physiological effect of angiotensin converting enzyme inhibitory peptides derived from soy protein on spontaneously hypertensive rats[J].J Agr Food Chem,2001,49(1): 501-506.
[14]GANGOPADHYAY N,WYNNE K,CONNOR P O,et al.In silico and in vitro analyses of the angiotensin-I converting enzyme inhibitory activity of hydrolysates generated from crude barley(Hordeum vulgare) protein concentrates[J].Food Chem,2016,203:367-374.
[15]TEH S S,BEKHIT E D A,CARNE A,et al.Antioxidant and ACE-inhibitory activities of hemp(Cannabis sativaL.)protein hydrolysates produced by the proteases AFP,HT,Pro-G,actinidin and zingibain[J].Food Chem,2016,203:199-206.
[16]LI G H,LE G W,SHI Y H,et al.Angiotensin I-converting enzyme inhibitory peptides derived from food proteins and their physiological and pharmacological effects[J].Nutr Res,2004,24(7):469-486.
[17]PAN D,CAO J,GUO H,et al.Studies on purification and the molecular mechanism of a novel ACE inhibitory peptide from whey protein hydrolysate[J].Food Chem,2012,130(1):121-126.
[18]BARBANA C,BOYE J I.Angiotensin I-converting enzyme inhibitory properties of lentil protein hydrolysates:Determination of the kinetics of inhibition[J].Food Chem,2011,127(1):94-101.
[19]MIZUNO S,NISHIMURA S,MATSUURA K,et al.Release of short and proline-rich antihypertensive peptides from casein hydrolysate with anAspergillus oryzaeprotease[J].J Dairy Sci,2004,87(10):3183-8.
[20]NORRIS R,O'KEEFFE M B,POYARKOV A,et al.Peptide identification and angiotensin converting enzyme(ACE)inhibitory activity in prolyl endoproteinase digests of bovine αs-casein[J].Food Chem,2015, 188:210-217.
[21]于晓庆,王雄,司佳.酶法制备乳源ACE抑制肽[J].食品研究与开发,2011,32(9):134-136
[22]YAMAMOTO N,AKINO A,TAKANO T.Purification and specificity of a cell-wall-associated proteinase fromLactobacillus helveticusCP79 [J].J Biochem,1993,114(5):740-745.
[23]NAKAMURA Y,YAMAMOTO N,SAKAI K,et al.Purification and characterization of angiotensin I-converting enzyme inhibitors from sour milk[J].J Dairy Sci,1995,78(4):777-783.
[24]NAKAMURA Y,YAMAMOTO N,SAKAI K,et al.Antihypertensive effect of sour milk and peptides isolated from it that are inhibitors to angiotensin I-converting enzyme[J].J Dairy Sci,1995,78(6):1253-1257.
[25]PAN D,GUO Y.Optimization of sour milk fermentation for the production of ACE-inhibitory peptides and purification of a novel peptide from whey protein hydrolysate[J].Int Dairy J,2010,20(7):472-479.
[26]吴晖,罗美琪,唐语谦.酶解丝素蛋白制备ACE抑制肽的研究[J].现代食品科技,2011,27(12):1461-1465.
[27]代永刚,南喜平,李铁柱.酪蛋白源ACE抑制肽的分离纯化[J].中国乳品工业,2010,38(10):21-23.
[28]MARQUES C,AMORIM M M,PEREIRA J O,et al.In vitro ACE-inhibitory peptide KGYGGVSLPEW facilitates noradrenaline release from sympathetic nerve terminals:relationship with the lack of antihypertensive effect on spontaneous hypertensive rats[J].Peptides,2015, 71:72-76.
[29]CHEN J,LIU S,YE R,et al.Angiotensin-I converting enzyme(ACE) inhibitory tripeptides from rice protein hydrolysate:Purification and characterization[J].J Func Food,2013,5(4):1684-1692.
[30]崔楠.木瓜蛋白酶酶解制备黄粉虫ACE抑制肽的研究[D].北京:北京林业大学,2015.
[31]QUIRÓS A,CONTRERAS M D M,RAMOS M,et al.Stability to gastrointestinal enzymes and structure-activity relationship of β-caseinpeptides with antihypertensive properties[J].Peptides,2009,30(10): 1848-1853.
[32]黄国栋.以脯氨酸为端基的ACE抑制三肽定量构效关系及分子作用机制研究[D].广州:广东药学院,2015.
[33]RUFIÁN-HENARES,J A,MORALES F J.Functional properties of melanoidins:In vitroantioxidant,antimicrobial and antihypertensive activities[J].Food Res Int,2013,40(8):995-1002.
[34]洪旭.酪蛋白ACE抑制肽的制备分离及改性[D].无锡:江南大学,2014.
[35]GADELHA A,VENDRAMINI A M,YONAMINE C M,et al.Convergent evidences from human and animal studies implicate angiotensin I-converting enzyme activity in cognitive performance in schizophrenia [J].Translat Psychiat,2015,5(12):e691.
Preparation of ACE inhibitory peptides and effect of their structures on ACE activity
WU Nan,SHUANG quan*
(College of Food Science and Engineering,Inner Mongolia Agricultural University,Hohhot 010018,China)
Angiotensin converting enzyme(ACE)plays an important physiologic role in the blood pressure regulation.The generation of excessive ACE in the human body could lead to high blood pressure,and the bioactive substances ACE inhibitory peptides could inhibit function of ACE.The main preparation methods of ACE inhibitory peptides and the relationship of amino acid sequence characteristics and ACE inhibitory activity were mainly summarized.The effect of proline on ACE inhibitory activity and the structure features and functions of some amino acids were elaborated, which provided reference for preparation and application of ACE inhibitory peptides.
angiotensin converting enzyme;inhibitory peptide;proline;IC50
TQ464.7
0254-5071(2016)11-0054-05
10.11882/j.issn.0254-5071.2016.11.011
2016-07-11
国家自然科学基金(31460443);内蒙古自治区自然科学基金(2016MS0338)
吴楠(1993-),女,硕士研究生,研究方向为食品生物技术。
*通讯作者:双全(1964-),男,教授,博士,研究方向为食品科学。
