棉花多胺氧化酶基因( GhPAO3)的克隆及表达分析
2016-12-13成新琪朱雪峰程文翰朱华国
成新琪,朱雪峰,程文翰,贺 雪,孙 杰,朱华国
(石河子大学 农学院,新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子 832003)
棉花多胺氧化酶基因( GhPAO3)的克隆及表达分析
成新琪,朱雪峰,程文翰,贺 雪,孙 杰,朱华国
(石河子大学 农学院,新疆生产建设兵团绿洲生态农业重点实验室,新疆石河子 832003)
根据拟南芥AtPAO5的cDNA序列在雷蒙德氏棉数据库中Blastn比对获得同源PAO基因,设计特异性引物并利用RT-PCR技术克隆获得1个陆地棉PAO基因,命名为GhPAO3。对GhPAO3的cDNA序列进行生物信息学分析,结果显示:该基因cDNA全长为1 736 bp,开放阅读框为1 530 bp,编码506个氨基酸,预测蛋白大小为56.88 ku,等电点为5.77,编码蛋白为亲水性蛋白。Real-time PCR结果表明,GhPAO3在不同组织中的表达情况不同,表达量依次是叶>茎>根>花瓣>子房>雄蕊>种子>雌蕊。不同诱导处理下GhPAO3基因表达量也存在差异,其中低温处理和ABA处理后该基因在6 h时表达量达到最大值,PEG处理后在24 h时表达量达到最大值,NaCl则在处理后3 h时表达量最高。表明GhPAO3基因受非生物胁迫诱导表达,可能以不同的角色参与棉花抗逆过程,结果为进一步研究该基因的功能奠定基础。
棉花;克隆;多胺氧化酶;非胁迫处理
多胺是一类具有生物活性的、含有2个或2个以上氨基的低分子量脂肪族含氮碱,在生物生长和适应环境变化中扮演重要的角色[1-3]。植物体的多胺主要包括腐胺(Put)、尸胺(Cad)、亚精胺(Spd)、精胺(Spm)和热精胺(Tspm)[4],通过调节合成和分解代谢保持体内多胺的动态平衡。多胺的降解主要是通过二胺氧化酶(DAO)和多胺氧化酶(PAO)催化来实现,二胺氧化酶作为铜酶氧化腐胺和尸胺,主要生成 4-氨基正丁醛、氨和H2O2。多胺氧化酶与辅酶FAD以非共价键结合,但多胺氧化酶有多个同源基因,因此代谢途径分为2类,第1类催化精胺和亚精胺生成1,3-丙二胺(Dap)、H2O2和3-氨丙基-4-氨基正丁醛或4-氨基正丁醛[5-6],如小麦PAO、玉米PAO1和水稻PAO7。第2类催化精胺生成亚精胺,再生成腐胺,同时生成3-氨基正丁醛和H2O2[7]。如拟南芥PAO(AtPAO1-AtPAO5)及水稻PAO(OsPAO1、OsPAO3、OsPAO4和OsPAO5)[8]。多胺氧化产生的H2O2作为一种信号分子参与植物体内细胞的程序性死亡、细胞的防御性反应、细胞质木质素合成和生物与非生物胁迫等过程[9-11]。
多胺氧化酶的研究在拟南芥、水稻及柑橘中较多。拟南芥的5个同源基因在不同组织中差异表达,AtPAO1主要在花的器官中表达,AtPAO2在花粉和长角果中表达,AtPAO3在保卫细胞表达相对较高,AtPAO4在根表达量最高,AtPAO5则在根和子叶中表达量较高[12]。柑橘的6个PAO基因均在根中优势表达[13]。水稻中研究7个同源PAO基因在花药中的表达情况,OsPAO1、OsPAO2、OsPAO6不表达,OsPAO3、OsPAO4、OsPAO5在花药的早期表达,并且OsPAO3在单细胞阶段表达,OsPAO4在双细胞阶段表达,OsPAO5在三细胞阶段表达,OsPAO7在花药后期表达。另外,OsPAO7可能参与木质素的合成,与花药中木质素对次生壁的增厚有关[8]。
棉花是新疆主要的经济作物,生物和非生物胁迫对棉花的产量和品质造成极大的负面影响,因为PAO受非生物胁迫时可能会提高植物的抗逆性,拟南芥PAO4对干旱胁迫产生响应[14],非生物胁迫柑橘时PAO3能够产生应答反应[13],所以对多胺氧化酶在非生物胁迫应答反应的研究具有重要意义。目前棉花多胺氧化酶基因GhPAO1和GhPAO2已被克隆,GhPAO1参与棉花的抗黄萎病过程[15-16]。本研究从陆地棉中克隆多胺氧化酶(PAO)基因,对其在不同组织和不同非生物胁迫处理条件下的表达情况进行分析,为深入研究基因功能奠定基础。
1 材料与方法
1.1 材料处理
试验材料陆地棉品种‘新陆早33号’由石河子大学棉花所提供。‘新陆早33号’种子经浓硫酸脱绒,选取籽粒健康、饱满的种子,在质量浓度为1 g/L的汞中消毒10 min,去离子水冲洗3次,然后种植于无菌蛭石中,用Hongland’s营养液培养(28 ℃,昼/夜为14 h/10 h),分别取棉花的不同组织(根、茎、叶和种子)、于盛花期在田间摘取的花(花瓣、雄蕊、雌蕊、子房)为材料。等长至3片真叶时,选取长势一致的植株除去蛭石,在Hongland’s营养液中培养1周后进行如下处理:低温处理,将棉苗浸泡于Hongland’s营养液中,4 ℃培养;干旱处理,将棉苗浸泡于含有200 g/L PEG的Hongland’s营养液中;盐胁迫处理,将棉苗浸泡于含有200 mmol/L Nacl的Hongland’s营养液中;ABA处理,用1 mmol /L ABA喷施棉花叶片。取样时间点为0、1、3、6、12、24和48 h,取样后迅速用液氮冷冻并于-80 ℃保存,备用。
1.2 基因全长的克隆
利用Primer 5.0软件设计扩增全长的特异引物GhPAO3-S 和GhPAO3-A(表1),以棉花‘新陆早33号’cDNA为模板,扩增基因全长。扩增体系:cDNA模板(20 ng/μL)1 μL,引物(10 μmol/L)1 μL,dNTP(2.5 mmol/L)1.6 μL,Taq酶(5 U/μL)0.4 μL,TaqBuffer 2 μL,加水至20 μL。PCR程序:94 ℃预变性3 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸2 min,共30个循环;72 ℃延伸10 min。用10 g/L琼脂糖凝胶回收目的片段,回收后的产物连接Peasy-Blunt载体,转化Trans10感受态,将其涂于含卡那霉素的LB固体培养基上,37 ℃倒置过夜培养,挑取单克隆,在含卡那霉素的液体培养基过夜揺菌,菌液PCR验证,提取质粒PCR并酶切验证是否插入目的片段,将阳性克隆送公司测序,引物合成和测序由上海生工生物工程技术服务有限公司完成。

表1 所用引物
1.3 生物信息学分析
采用Clustal软件对测序结果进行序列比对分析,ORF finder在线预测开放阅读框,MEGA5软件构建系统进化树,用DNAMAN软件进行多重序列比对,用ProtParam(http://web.expasy.org/protparam/)分析蛋白质理化性质,用SOPMA(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_Sopm.html)软件分析蛋白质二级结构的组成。
1.4 RNA提取与cDNA检测
‘新陆早33号’不同组织和不同处理的试验材料经液氮处理后,根据改良CTAB法提取总RNA,RNA提取后用10 g/L琼脂糖凝胶电泳检测,反转录酶Reverse Transcriptase M-MLV反转录,取1 μg总RNA为模板进行RT-PCR,体系中RNA 1 μg,Oligo dt(T18)1 μL,加DEPC水补至12 μL,70 ℃保温10 min后,于冰上迅速急冷2 min,离心5 s,然后加入RNA变性液12 μL,5×M-MLV Buffer 4 μL,dNTP(10 mmol/L)1 μL,Rnase Inhibitor 0.5 μL,Rnase M-MLV 1 μL,补水至20 μL,42 ℃保温1 h,70 ℃保温15 min后冰上冷却,-20 ℃保存。反转录获得的cDNA用内参基因检测。
1.5 表达分析
设计GhPAO3基因GhPAO3-F、GhPAO3-R和内参GhUBI-F、GhUBI-R基因实时荧光引物(表1),采用改良CTAB法提取不同组织和不同处理下棉花叶片总RNA,并反转录为cDNA,利用Real-time PCR 对GhPAO3基因进行差异表达分析。反应体系为10 μL:(2×)SYBR Primix ExTaqTM5 μL,GhPAO3-F和GhPAO3-R(10 μmol/L)各0.5 μL,模板1 μL,无菌水3 μL,每个样品设3次重复,试验结果采用2-△△CT法分析。
2 结果与分析
2.1 GhPAO3基因cDNA序列的克隆
以拟南芥(AtPAO5)基因的cDNA为序列探针,在雷蒙德氏棉数据库中进行Blastn检索,获得一个陆地棉的同源基因,命名为GhPAO3。以陆地棉‘新陆早33号’的cDNA为模板,采用PCR方法进行验证,获得序列全长为1 736 bp的DNA片段(图1),切胶后利用DNA回收试剂盒纯化目的片段,并连接至Peasy-Blunting载体,在LB固体培养基挑阳性单克隆,将质粒经KpnⅠ和XbaⅠ双酶切酶切鉴定,将质粒送公司测序。通过ORF Finder在线软件预测,GhPAO3具有一个完整的开放阅读框(图2),ORF全长1 530 bp,编码506个氨基酸。

图1 GhPAO3基因PCR扩增结果

图2 棉花 GhPAO3基因cDNA序列和推导的氨基酸序列
2.2 GhPAO3的蛋白生物信息学分析
运用ProtParam软件分析该蛋白的基本理化性质,结果表明,GhPAO3的蛋白分子式为C2549H3933N683O756S20,分子质量为56.88 ku,带正电荷的氨基酸残基数(Arg+Lys)为51,带负电荷的氨基酸残基数(Asp+Glu)为63,等电点为5.77,脂肪指数为84.11,该蛋白不稳定性参数为37.97,属于稳定蛋白,蛋白质疏水性平均值是-0.223,属于亲水性蛋白。利用SOPMA软件对该蛋白二级结构进行预测,结果表明,由α-螺旋、延伸直链、β-转角和无规则卷曲4种组成,其中α-螺旋包含188个氨基酸,约占36.94%,延伸直链包含93个氨基酸,约占18.27%,β-转角包含59个氨基酸,约占11.59%,无规则卷曲包含169个氨基酸,约占33.20%,α-螺旋和无规则卷曲是二级结构的主要组成部分。
2.3 GhPAO3蛋白系统发育树分析
在NCBI中对BlastpGhPAO3基因编码的氨基酸序列与其他同源性较高的氨基酸序列进行系统发育树分析(图3)和多重比对(图4)。结果表明,GhPAO3与可可树TcPAO5同源性最高,为72.60%,与葡萄VvPAO5的同源性达到64.83%,与模式植物拟南芥AtPAO5的同源性为61.62%。

图3 GhPAO3与同源基因氨基酸序列的系统进化树

图4 不同植物PAO氨基酸序列比对
2.4GhPAO3基因在不同组织中的表达情况
以Real-time PCR对GhPAO3基因在不同组织中的表达进行分析,结果显示,GhPAO3基因在不同组织中的表达情况存在差异,在叶中表达量最高,达到根和茎表达量的3倍以上。花瓣和子房中的表达量较低,雌蕊和种子中的表达量最低,基本不表达(图5)。
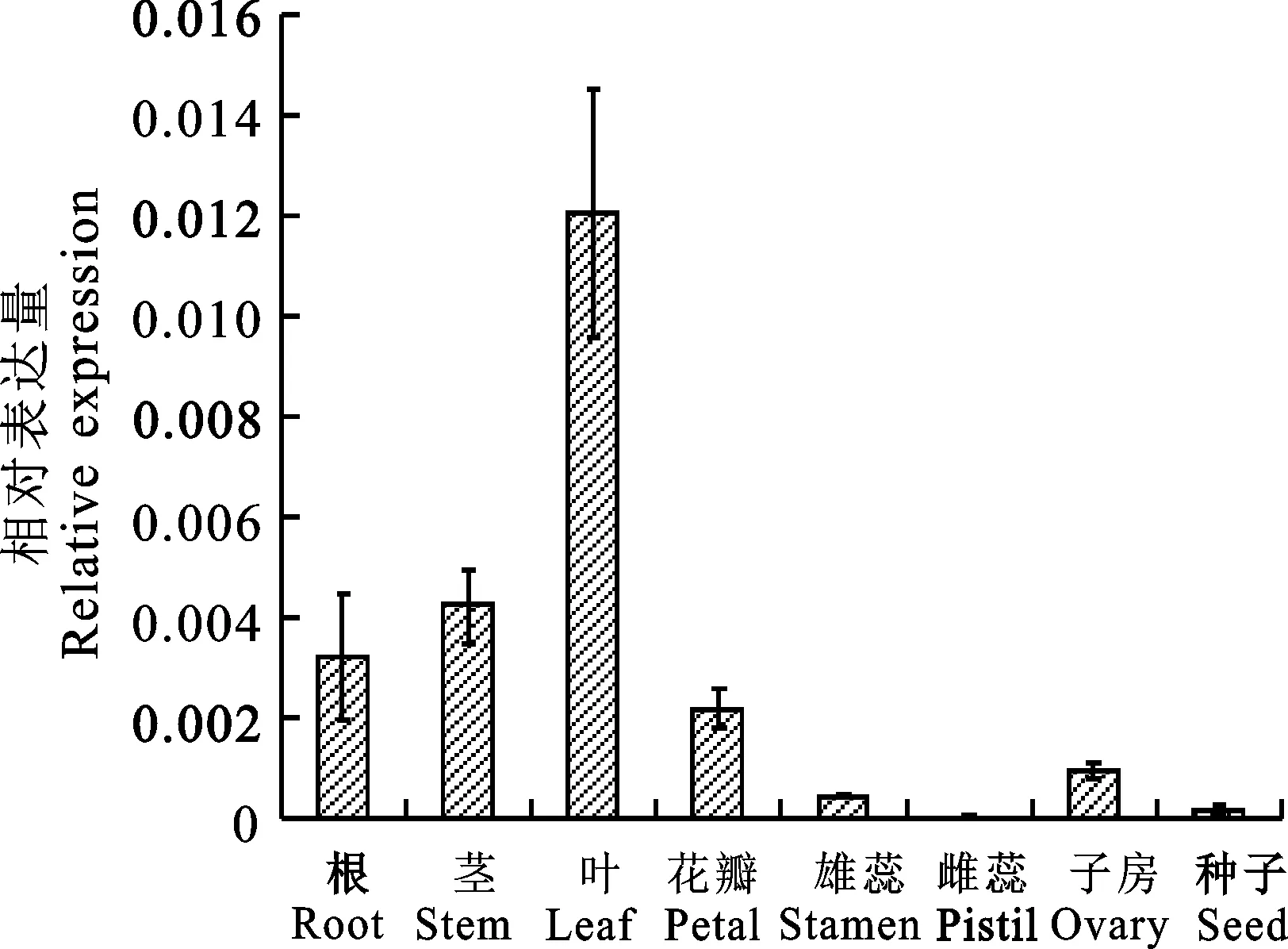
图5 GhPAO3的组织表达分析
2.5 非生物胁迫下GhPAO3基因的表达分析
利用Real-time PCR分析GhPAO3基因在不同非生物胁迫处理下的表达特性,从图6可以看出,低温处理3 h时基因表达量开始升高,处理6 h 时迅速上升并达到最大值,达到未处理前的21倍以上,此后随着时间的延长基因表达量下降(图6-A)。PEG处理后,基因的表达量迅速上升,1 h 时表达量达到0 h的3倍多,之后表达量下降,并在处理12 h时表达量再次迅速上升,达到最大值后下调(图6-B)。NaCl处理后,表达量在1 h时开始上升,处理3 h时达到最大值,是未处理前的10倍以上,此后下降,并在处理12 h时再次上升,之后随着时间延长表达量减弱(图6-C)。ABA 处理时表达量先上升后下降,并在处理6 h时急剧上升至最大值,是未处理前的6倍以上,之后下降(图6-D)。表明该基因受低温、PEG、NaCl和ABA诱导表达,但表现出不同的表达模式,GhPAO3可能以不同的角色参与抵御上述非生物胁迫过程。
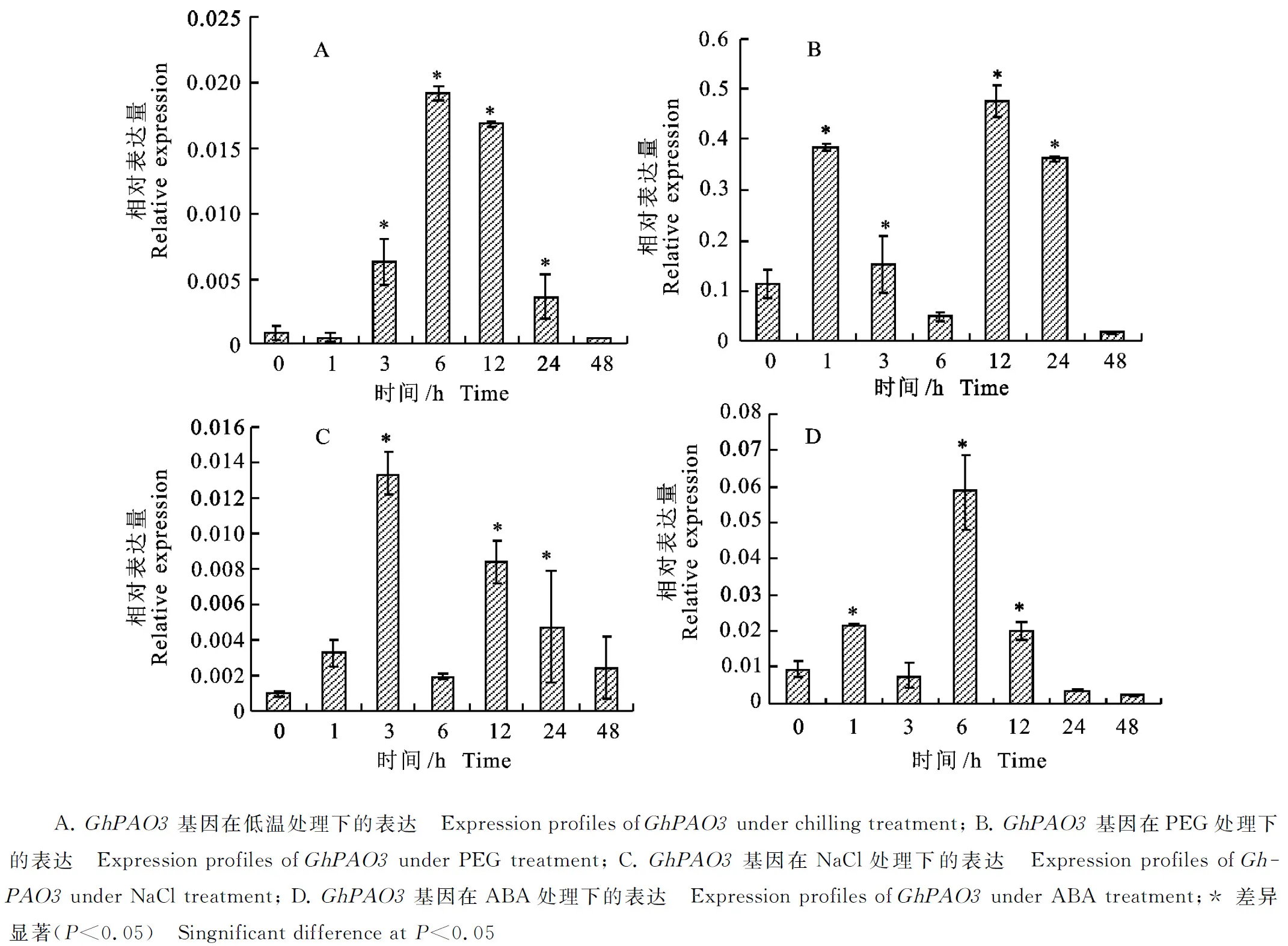
图6 不同胁迫处理条件下 GhPAO3基因的表达分析
3 讨论与结论
本研究从陆地棉中克隆获得多胺氧化酶基因GhPAO3,系统进化树和多重序列比对分析表明,GhPAO3与TcPAO5、VvPAO5及AtPAO5同源性较高,而与克隆获得的GhPAO1[15]和GhPAO2[16]同源性较低。Real-time PCR分析表明,GhPAO3基因在棉花叶片中的表达量最高,与Fincato等[12]通过GUS融合拟南芥PAO5在子叶中表达量高的结果相似,表明不同物种中同源PAO基因可能具有相似的组织表达模式。另一方面,大量研究[17-18]表明,多胺能够提高植物抵御逆境胁迫的能力。本研究中棉花幼苗经低温、PEG和NaCl处理后GhPAO3表达量短时间内均有显著地提高,表明该基因在非生物胁迫处理条件下受到诱导表达,可能通过改变植物体内多胺和H2O2含量以应对外界生长条件的变化[4,19-21]。此外,外源ABA处理棉花幼苗后GhPAO3基因在处理6 h时达到最高表达量,表明GhPAO3基因可能通过ABA信号途径响应非生物胁迫过程[22]。
Reference:
[1]ALCAZAR R,ALTABELLA T,MARCO F,etal.Polyamines:molecules with regulatory functions in plant abiotic stress tolerance[J].Planta,2010,231(6):1237-1249.
[2]胡炳义,牛明功,王启明,等.渗透胁迫与大豆幼苗叶片多胺含量的关系[J].植物营养与肥料学报,2006,12(6):881-886.
HU B Y ,NIU M G ,WANG Q M,etal.Relationship between osmotic stress and polyamine levels in leaves of soybean seedlings[J].PlantNutritionandFertilizerScience,2006,12(6):881-886(in Chinese with English abstract).
[3]TAKANO A,KAKEHI J I,TAKAHASHI T.Thermospermine is not a minor polyamine in the plant kingdom[J].PlantandCellPhysiology,2012,53(4):606-616.
[4]TIBURCIO A F,ALTABELLA T,BITRIN M,etal.The roles of polyamines during the lifespan of plants:from development to stress[J].Planta,2014,240(1):1-18.
[5]ANGELINI R,CONA A,FEDERICO R,etal.Plant amine oxidases “on the move”:an update[J].PlantPhysiologyandBiochemistry,2010,48(7):560-564.
[6]MOSCHOU P N,WU J,CONA A,etal.The polyamines and their catabolic products are significant players in the turnover of nitrogenous molecules in plants[J].JournalofExperimentalBotany,2012,63(14):5003-5015.
[7]AHOU A,MARTIGNAGO D,ALABDALLAH O,etal.A plant spermine oxidase/dehydrogenase regulated by the proteasome and polyamines[J].JournalofExperimentalBotany,2014,65(6):1585-1603.
[8]LIU T,KIM D W,NIITSU M,etal.Polyamine oxidase 7 is a terminal catabolism-type enzyme inOryzasativaand is specifically expressed in anthers[J].PlantandCellPhysiology,2014:pcu047.
[9]LAMB C,DIXON R A.The oxidative burst in plant disease resistance[J].AnnualReviewofplantBiology,1997,48(1):251-275.
[10]YODA H,YAMAGUCHI Y,SANO H.Induction of hypersensitive cell death by hydrogen peroxide produced through polyamine degradation in tobacco plants[J].PlantPhysiology,2003,132(4):1973-1981.
[11]TUN N N,SANTA-CATARINA C,BEGUM T,etal.Polyamines induce rapid biosynthesis of nitric oxide (NO) inArabidopsisthalianaseedlings[J].PlantandCellPhysiology,2006,47(3):346-354.
[12]FINCATO P,MOSCHOU P N,AHOU A,etal.The members of Arabidopsis thalianaPAOgene family exhibit distinct tissue-and organ-specific expression pattern during seedling growth and flower development[J].AminoAcids,2012,42(2/3):831-841.
[13]WANG W,LIU J H.Genome-wide identification and expression analysis of the polyamine oxidase gene family in sweet orange (Citrussinensis)[J].Gene,2015,555(2):421-429.
[14]KAMADA-NOBUSADA T,HAYASHI M,FUKAZAWA M,etal.A putative peroxisomal polyamine oxidase,AtPAO4,is involved in polyamine catabolism inArabidopsisthaliana[J].PlantandCellPhysiology,2008,49(9):1272-1282.
[15]MO H J,WANG X F,ZHANG Y,etal.Cotton polyamine oxidase is required for spermine and camalexin signalling in the defence response toVerticilliumdahliae[J].ThePlantJournal,2015,83(6):962-975.
[16]成新琪,程文翰,王凡龙,等.棉花多胺氧化酶基因 (GhPAO2) 的克隆及非生物胁迫下的表达分析[J].分子植物育种,2015(10):8.
CHENG X Q,CHENG W H,WANG F L,etal.Cloning and expression analysis ofGhPAO2gene in cotton[J].MolecularPlantBreeding,2015(10):8(in Chinese with English abstract ).
[17]BITRIN M,ZARZA X,ALTABELLA T,etal.Polyamines under abiotic stress:metabolic crossroads and hormonal crosstalks in plants[J].Metabolites,2012,2(3):516-528.
[18]MOSCHOU P N,PASCHALIDIS K A,DELIS I D,etal.Spermidine exodus and oxidation in the apoplast induced by abiotic stress is responsible for H2O2signatures that direct tolerance responses in tobacco[J].ThePlantCell,2008,20(6):1708-1724.
[19]徐盛春.烟草种子和幼苗多胺代谢的调控及与其耐寒性关系的研究[D].杭州:浙江大学,2009.
XU SH CH.Modulation of polyamines in seeds and seedlings of tobaeco and its relationship with ehilling toleranee[D].Hangzhou:Zhejiang University,2009(in Chinese with English abstract).
[20]张春梅,邹志荣,张志新,等.聚乙二醇胁迫下的番茄幼苗内 ABA,JA 和多胺含量以及多胺氧化酶活性的变化[J].植物生理学通讯,2008,44(4):689-692.
ZHANG CH M,ZOU ZH R,ZHANG ZH X.Changes in ABA,JA,polyamines contents and polyamine oxidase activity of tomato seedlings under PEG stress[J].PlantPhysiologyCommunications,2008,44(4):689-692(in Chinese with English abstract).
[21]MOSCHOU P N,PASCHALIDIS K A,DELIS I D,etal.Spermidine exodus and oxidation in the apoplast induced by abiotic stress is responsible for H2O2signatures that direct tolerance responses in tobacco[J].ThePlantCell,2008,20(6):1708-1724.
[22]TAVLADORAKI P,CONA A,FEDERICO R,etal.Polyamine catabolism:target for antiproliferative therapies in animals and stress tolerance strategies in plants[J].AminoAcids,2012,42(2/3):411-426.
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
Cloning and Expression Analysis of Polyamine Oxidase (GhPAO3) Gene in Cotton (GossypiumhirsutumL.)
CHENG Xinqi,ZHU Xuefeng,CHENG Wenhan,HE Xue,SUN Jie and ZHU Huaguo
(The Key Laboratory of Oasis Eco-agriculture of Xinjiang Production and Construction Corps,College of Agronomy,Shihezi University,Shihezi Xinjiang 832003,China)
A homologous polyamine oxidase (PAO) gene was cloned through blastingAtPAO5cDNA in Raymond’s cotton genome database.A newPAOwas identified using RT-PCR and was named asGhPAO3in upland cotton.The full length ofGhPAO3cDNA was 1 736 bp,including a 1 530 bp open reading frame,encoding 506 amino acid residues,and the molecular weight of predicted protein was 56.88 ku,isoelectric point was 5.77.Expression pattern ofGhPAO3was analyzed in different tissues and treatments using real-time PCR.The results suggested that the order of expression level ofGhPAO3was leaf> stem> root> petal> ovary> stamen> seed> pistil.Besides,expression levels ofGhPAO3were significantly changed under different treatments.Expression level ofGhPAO3reached the highest level at 6 h under low temperature and ABA treatment,whereas the highest expression level ofGhPAO3occurred at 3 h and 24 h under NaCl and PEG treatments,respectively.These results indicated thatGhPAO3is induced by abiotic stresses,and will play an important role in defending against abiotic stress in cotton.
Cotton; Cloning; Polyamine oxidase; Abiotic stress
CHENG Xinqi,male,master student.Research area:seed biology and germplasm innovation.E-mail:360028055@qq.com
ZHU Huaguo,male,associate professor.Research area:plant biotechnology.E-mail:zhgroger@sohu.com
2015-11-23
2016-01-14
国家自然科学基金 (31301363);兵团科技攻关 (2014BA004);石河子大学动植物育种专项(gxjs2013-yz02)。
成新琪,男,硕士研究生,研究方向为种子科学与技术。E-mail:360028055@qq.com
朱华国,男,副教授,研究方向为植物生物技术。E-mail:zhgroger@sohu.com
日期:2016-10-20
Q966
A
1004-1389(2016)10-1472-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161020.1653.016.html
Received 2015-11-23 Returned 2016-01-14
Foundation item The National Natural Science Foundation of China (No.31301363); Corps Technological Program(No.2014BA004); Animal and Plant Breeding Program(No.gxjs2013-yz02).
