采用溴代十六烷基吡啶从碱性氰化液中萃取和富集钯、铂
2016-12-13张金燕陈慕涵吴胜杰李金飞黄章杰
李 荣,张金燕,陈慕涵,吴胜杰,刘 燕,李金飞,黄章杰
采用溴代十六烷基吡啶从碱性氰化液中萃取和富集钯、铂
李 荣,张金燕,陈慕涵,吴胜杰,刘 燕,李金飞,黄章杰
(云南大学化学科学与工程学院,昆明 650091)
对使用溴代十六烷基吡啶(HPB) 作为萃取剂,在碱性氰化液中同时萃取富集钯、铂进行考察,对影响萃取富集效率的各种因素:稀释剂种类、溴代十六烷基吡啶浓度、改性剂用量、相比、萃取时间、水相中Pd(II)和Pt(II)浓度及溶液的pH值进行研究。结果表明:使用溴代十六烷基吡啶浓度为0.05 mol/L,正辛醇含量为30%(体积分数),相比(O/A)为1:5的有机相,在pH=10.5碱性氰化液中,5 min内能将Pd(II)(<70 mg/L)和Pt(II)(<60 mg/L)从水相转移至有机相,采用NH4SCN溶液反萃有机相中的Pd(II)和Pt(II),采用斜率法、红外和紫外光谱分析对萃取机理进行推测,该方法可运用于钯、铂浮选精矿氰化浸出液中Pd(II)和Pt(II)的萃取,富集倍数为15,回收率大于95%。
碱性氰化液;溴代十六烷基吡啶;钯;铂
铂族金属是我国极其紧缺的战略金属,云南已发现元谋、牟定、大理荒草坝等铂族金属大小矿体10多处,被地质学家认为是我国探寻铂族金属矿藏前景最好的地区,是我国迄今所查明的储量居第二位的铂族金属矿床,探获的资源量为:铂加钯约45 t,但铂加钯品位仅1.5~3.5 g/t,不及南非矿的1/3,低于工业开采的边界品位[1]。
2001年,陈景院士等[2−3]提出了将铂钯浮选精矿直接进行加压氰化的全湿法新工艺,全湿法新工艺的技术路线是:浮选精矿在首先进行氧压酸浸,使矿料中的贱金属以硫酸盐形态转入溶液,从而将铜、镍、钴等贱金属去除,氧压酸浸渣主要成分为二氧化硅,然后将得到的氧压酸浸渣进行两级加压氰化,使钯、铂以氰配阴离子形态转入氰化液,用锌粉置换得到贵金属富集物,继后进行贵金属精炼。全湿法工艺具有建设投资小、生产周期短、生产成本低、回收投资快、效益空间大等优点。不足之处是加压氰化液中,钯、铂浓度较低,在进行锌粉置换前,需进行富集处理,之前本项目组已提出采用活性炭吸附富集加压氰化后液钯、铂的方法,2014年获中国发明专利授权[4],在前期研究基础上,为了丰富加压氰化后液的处理方法,提高钯、铂富集的选择性,进一步降低处理成本,本文作者提出采用溶剂萃取的手段,通过建立适宜溶剂萃取体系,建立从加压氰化后液中富集钯、铂新工艺。
目前,钯、铂的溶剂萃取提取大都是在酸性介质中进行的,文献[5−17]已报道了硫醚和亚砜类、肟类、膦类、胺类萃取剂在酸性介质中对金属钯、铂的萃取提取,例如国内最大的铂族金属生产企业金川公司,在酸性介质中采用二异戊基硫醚(S201)萃取剂钯、三烷基混合叔胺(N235)萃取铂和三烷基氧化膦(TRPO)萃取铱,萃余液精制铑工艺,建立铂族金属钯、铂、铱、铑全萃取分离流程[18]。
碱性氰化液介质中贵金属溶剂萃取研究主要集中于金的提取分离,从20世纪80年代起,文献[19−22]中已报道了大量这方面的研究工作,陈景院士课题 组[23−25]针对季铵盐萃金体系普遍存在的萃取率低,且易乳化,提出了首先将季铵盐按摩尔比1:1加入Au(CN)2−溶液,再用磷酸三丁酯(TBP)萃取Au(CN)2−的萃取新工艺。不仅萃取率高,且不易发生乳化现象。从碱性氰化液中溶剂萃取铂族金属,相关文献报道仅局限于单一金属元素钯的萃取研究[26],不涉及复杂基体干扰,离实际运用存在较大的差距,而从铂族金属浮选精矿浸出液复杂成分中直接萃取铂族金属,目前尚未有这方面的文献报道。本文作者采用季铵盐溴代十六烷基吡啶(HPB)为萃取剂,磺化煤油为稀释剂,正辛醇为改性剂,对碱性氰化液溶剂中钯、铂进行共萃富集,对影响萃取富集的主要工艺参数进行了系统研究,并将其运用于钯、铂浮选精矿加压氰化后液的钯、铂富集处理,取得了满意的钯、铂共萃富集效果,富集溶液中铂、钯的含量能达到150~750 mg/L,便于衔接后续精炼工艺。
1 实验
1.1 实验试剂及设备
实验试剂如下:磺化煤油(上海莱雅仕化工有限公司生产),溴代十六烷基吡啶(HPB)、苯、二甲苯、氯仿、NH4SCN (分析纯,北京伊诺凯科技有限公司生产), Pd(CN)42−储备液(1120 mg/L),Pt(CN)42−储备液(940 mg/L),两批次浮选精矿加压氰化实际料液(简称样品X1和样品X2),均由云南黄金矿业集团股份有限公司提供。浮选精矿加压氰化液成分如表1所列。
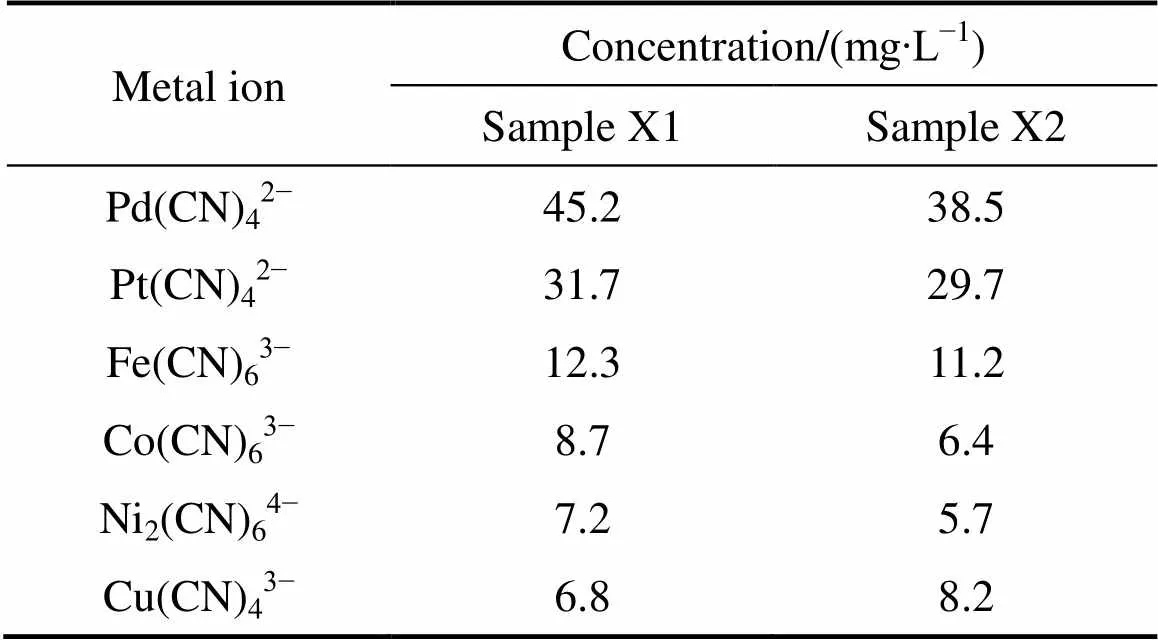
表1 浮选精矿加压氰化液成分
从表1可以看出,实验所用该浮选精矿加压氰化液主要由贵金属钯、铂及少量贱金属铁、钴、镍和铜构成。
实验所需设备如下:日本HITACHI公司生产的Z-2000型原子吸收光度计, 日本SHIMADZU公司生产的UV-2550型紫外可见分光光度计,美国Thermo公司生产的FT-IR NICOLET 8700型红外光谱仪(Thermo), 常州国华电器有限公司生产的CHA-S型恒温振荡器。
1.2 实验方法
有机相配制:有机相由萃取剂(HPB)、改性剂(长链脂肪醇)和稀试剂构成,其中改性剂占有机相总体积的30%(体积分数),萃取前有机相需用预定pH值的蒸馏水进行预平衡。
水相配制:分别准确量取一定体积Pd(CN)42−,Pt(CN)42−储备液于容器中,混合后用蒸馏水稀释至所需浓度,萃取前水相先用稀酸或碱调节pH值至预定值。
萃取实验步骤:将配制好的有机相和水相用移液管各移所需体积于梨形分液漏斗中,在振荡器中震荡规定的时间,静置待完全分相后将水溶液层放出,用原子吸收法测定萃余液和原萃液的金属离子量。再通过差减法即可算出萃取率()。
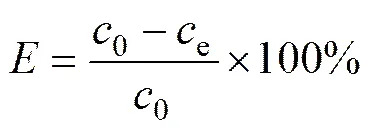
式中:0为原萃液中金属离子的原始浓度;e为萃余液中的金属离子的浓度。
反萃实验步骤:待萃取完成,放出水相后,载有金属离子的有机溶液仍在分液漏斗里,按适当相比加入一定浓度的NH4SCN反萃溶液,在振荡器中震荡规定的时间,静置待完全分相后将水溶液放出,用原子吸收测定水相中待测金属离子的浓度,有机相中剩余金属离子的浓度由差减法求出,计算反萃率。
反萃后的有机相经过饱和KBr溶液洗涤后得到再生有机相,用再生有机相对Pd(CN)42−和Pt(CN)42−混合氰化液进行萃取完成一次循环实验。进行多次循环实验并记录实验结果。
2 结果与讨论
2.1 稀释剂种类对萃取性能的影响
萃取剂中添加稀释剂,可减小有机相的黏度,改善萃取剂的传质性能,有利于两相流动和分离,稀释剂对萃取平衡有较显著的影响,对同一种萃取剂,当使用不同的稀释剂时,萃取性能会发生明显改变[27]。室温下,固定Pd(CN)42−和Pt(CN)42−混合氰化液中, Pd(CN)42−和Pt(CN)42−的浓度分别为56.0 mg/L和47.0 mg/L,HPB的浓度为0.05 mol/L,相比O/A=1/5,在pH=10.5的碱性条件下,萃取时间=5 min,分别以苯、磺化煤油、二甲苯、氯仿作稀释剂,比较稀释剂种类对HPB萃取Pd(CN)42−和Pt(CN)42−性能的影响,结果见表2。
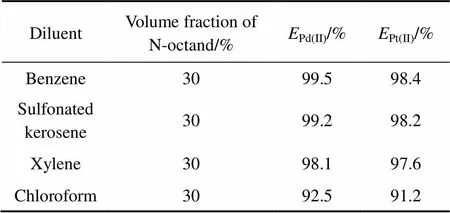
表2 不同稀释剂对Pd(CN)42−和Pt(CN)42−萃取性能的影响
实验结果表明:当直接用以上4种稀释剂时出现分层困难以及严重的乳化现象,HPB也难溶解于以上4种稀释剂。当有机相中正辛醇含量为30%(体积分数),可以有效消除第三相。其中,以苯和磺化煤油作为稀释剂时,HPB对Pd(CN)42−和Pt(CN)42−混合氰化液中的萃取率均较高,因磺化煤油对环境污染小,因此,选择磺化煤油作为萃取体系的稀释剂。
所用稀释剂苯、磺化煤油、二甲苯和氯仿,极性均较小,而萃取剂HPB属季铵盐具有一定极性,根据相似相溶原理,HPB难溶解于以上4种稀释剂。另一方面,HPB与Pd(CN)42−或Pt(CN)42−形成的萃合物是与离子缔合体形式被萃入有机相,离子缔合体的阴-阳离子之间的相互作用主要是静电作用,萃合物易溶于有一定极性的有机相。所以当直接用以上4种稀释剂时萃取体系出现分层困难以及出现严重的乳化现象。表3所列为所用稀释剂及改性剂的介电常数() 值[28],从表3数据可以看出,磺化煤油和苯的介电常数值小于二甲苯和氯仿的,在稀释剂与萃取剂的协同作用[27]的影响下,萃取所形成的萃合物憎水基R更易插入介电常数小的有机相,有机相中加入改性剂正辛醇后,增加了有机相的极性,这时萃合物中带正电荷的亲水端、带负电荷的抗衡离子(Pt(CN)42−和Pd(CN)22−)随即也进入有机相,由于苯和磺化煤油介电常数较二甲苯和氯仿小,以苯和磺化煤油作为稀释剂的萃取体系更利于萃合物憎水端的进入,因此,以苯和磺化煤油作为稀释剂的萃取体系对Pd(CN)42−和Pt(CN)42−的萃取率较另外两种稀释剂萃取体系高。
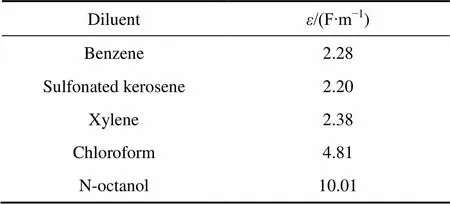
表3 各稀释剂的介电常数
2.2 萃取剂的浓度对Pd(CN)42−萃取性能的影响
萃取剂的浓度如果偏低,萃取体系萃取容量小,致使萃取不完全,过高不仅会造成萃取剂的浪费,而且易导致萃取分相困难,因此,萃取剂的浓度应随待萃金属离子浓度的变化而作调整[25]。室温下,固定Pd(CN)42−和Pt(CN)42−混合氰化液中,Pd(CN)42−和Pt(CN)42−的浓度分别为56.0 mg/L和47.0 mg/L,相比O/A=1/5,在 pH=10.5的碱性条件下,萃取时间=5 min,有机相中含有30%正辛醇,不同浓度的HPB对Pd(CN)42−和Pt(CN)42−萃取性能的影响如图1所示。
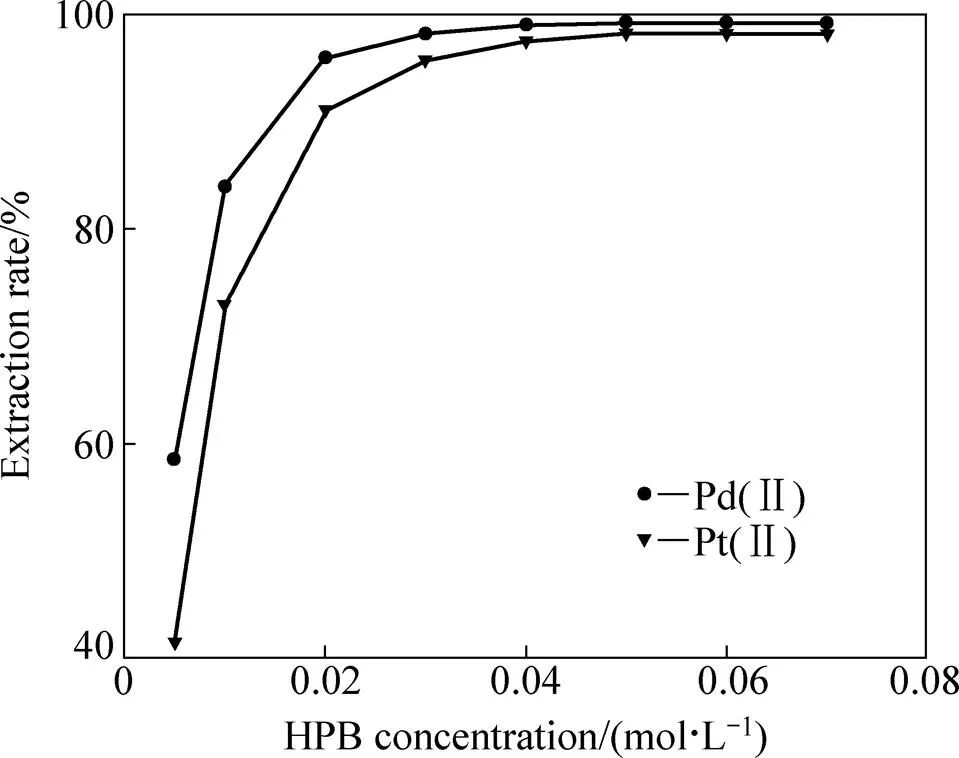
图1 HPB 浓度对萃取Pd(II) and Pt(II)的影响
结果表明:随着HPB的浓度从0.005增大到0.04 mol/L时,Pd(CN)42−的萃取率从58.6% 增大到99.1%,Pt(CN)42−的萃取率从41.5 % 增大到97.5%,继续增大HPB的浓度至0.05 mol/L,Pd(CN)42−萃取率不再增加,而Pt(CN)42−的萃取率增大到98.2%,此后,再继续增大HPB的浓度,Pd(CN)42−和Pt(CN)42−的萃取率均保持稳定,因此,综合各方面的因素最后选用萃取剂HPB浓度为0.05 mol/L。
2.3 改性剂种类和浓度对萃取的影响
溶剂萃取中第三相的消除往往借助于在萃取体系中加入改性剂,在实际操作时,常加入长链脂肪醇作改性剂[19]。本实验分别采用正戊醇、正己醇、正庚醇、正辛醇和正癸醇用作HPB萃取Pd(CN)42−和Pt(CN)42−的改性剂,室温下,固定Pd(CN)42−和Pt(CN)42−混合氰化液中,Pd(CN)42−和Pt(CN)42−的浓度分别为56.0 mg/L和47.0 mg/L,相比O/A=1/5,在 pH 10.5的碱性条件下,萃取时间=5 min,有机相中长链醇含量为30%,不同种类改性剂对实验结果的影响见表4。
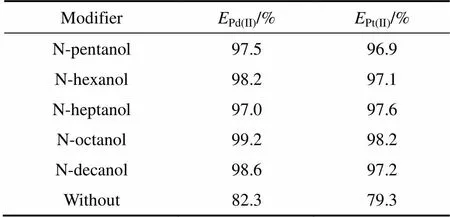
表4 长链醇种类对Pd(II)、Pt(II)萃取率的影响
从表4可以明显看出: 长链醇能明显增加HPB萃取Pd(CN)42−和Pt(CN)42−的萃取率,此外,在不添加长链醇时,HPB萃取Pd(CN)42−和Pt(CN)42−的萃取体系有明显第三相产生,本实验在萃取有机相中添加了30%正辛醇后,不仅完全避免了乳化的形成和第三相的产生,而且使萃取体系萃取Pd(CN)42−和Pt(CN)42−均取得较佳萃取效果。可能的原因是在不添加长链醇时,虽然萃合物的疏水端很容易插入有机相,但它带正电荷的亲水端及带负电荷的抗衡离子(Pd(CN)42−和Pt(CN)42−)却很难进入以稀释剂为主体的弱极性的有机相,第三相随即产生。随着长链脂肪醇的加入,有机相的极性加大,不仅使HPB在有机相的溶解度加大,HPB在有机相中能彻底溶解,同时随着有机相的极性增加,有机相与萃合物中带正电荷的亲水端及带负电荷的抗衡离子(Pd(CN)42−和Pt(CN)42−)的亲和力增大,萃取所形成的离子缔合物容易进入有机相[29]。从表4数据可以发现,长碳链的正辛醇和正癸醇较短碳链的脂肪醇萃取率高,这与文献[30]所报道的实验结果相吻合,具体原因还有待于对萃取机理的深入研究。研究还发现,有机相中长链脂肪醇的含量超过30%, Pd(CN)42−和Pt(CN)42−的萃取率不但不会升高反而会有所下降。造成这一现象的可能原因是有机相过高的极性会有碍于萃合物疏水端插入有机相,从而影响了萃合物整体萃入有机相。
2.4 相比对萃取性能的影响
铂族金属浮选精矿浸出液中Pd(CN)42−和Pt(CN)42−的浓度较低,一般在几十个10−6数量级,溶剂萃取技术本身也是一种富集手段,使用低相比(O/A)萃取,在降低化学有机试剂消耗的同时也改善了操作环境。但过低的相比(O/A),要完成萃取则需借助特殊的设备[23]。因此,选择合适的相比,在溶剂萃取操作中显得十分重要。室温下,固定Pd(CN)42−和Pt(CN)42−混合氰化液中, Pd(CN)42−和Pt(CN)42−的浓度分别为56.0 mg/L和47.0 mg/L,有机相中HPB的浓度为0.05 mol/L,有机相中正辛醇的含量为30%,在pH 10.5碱性条件下,萃取时间=5 min。实验中将相比(O/A)从1:1减少为1:5,Pd(CN)42−的萃取率均大于99.0%,而Pt(CN)42−的萃取率均大于98.0%,如继续减少相比(O/A),则萃取体系不稳定,易出现乳化现象,为保证萃取体系稳定性和萃取高富集倍数,将相比(O/A)控制为1/5。萃取完成后,在有机相中,Pd(CN)42−和Pt(CN)42−的浓度被富集了5倍。相比对Pd(CN)42−和Pt(CN)42−萃取的影响如图2所示。
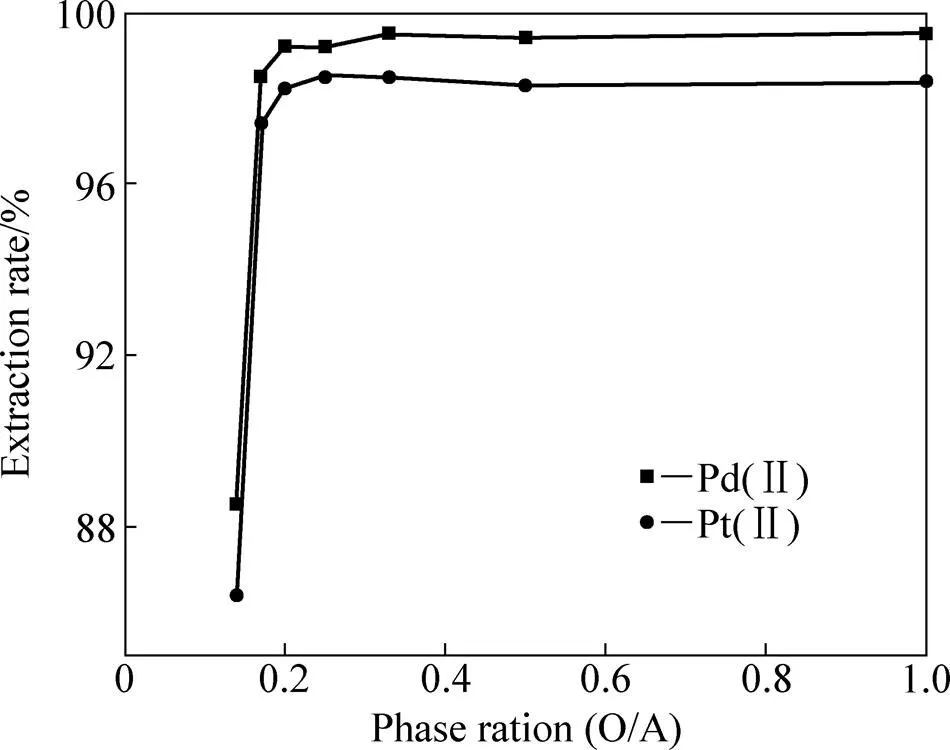
图2 相比(O/A)对Pd(II) −和Pt(II)萃取影响
2.5 时间对萃取性能的影响
两相的充分接触,是高萃取率的保证,但对萃取时间的无效拖延,会直接导致萃取成本的增加。因此,萃取时间是影响萃取性能的另一个关键参数[8],选定适宜的萃取时间,对提高萃取效率意义重大。室温下((25±1) ℃),固定实验参数:Pd(CN)42−和Pt(CN)42−的浓度分别为56.0 mg/L和47.0 mg/L,有机相中HPB的浓度为0.05 mol/L,有机相中正辛醇的含量为30%,在pH 10.5碱性条件下, 萃取时间1~3 min间隔,Pd(CN)42−和Pt(CN)42−混合氰化液中Pd(CN)42−萃取率从76.8%增大到98.5%,Pt(CN)42−萃取率从69.8%增大到97.2%,萃取时间继续增加到4 min,Pd(CN)42−萃取率为99.2%,Pt(CN)42−萃取率可达到98.2%。如再继续增加萃取时间,Pd(CN)42−和Pt(CN)42−萃取率保持不变,因此,选择5 min作为最佳萃取时间。萃取时间对Pd(CN)42−和Pt(CN)42−萃取的影响如图3所示。
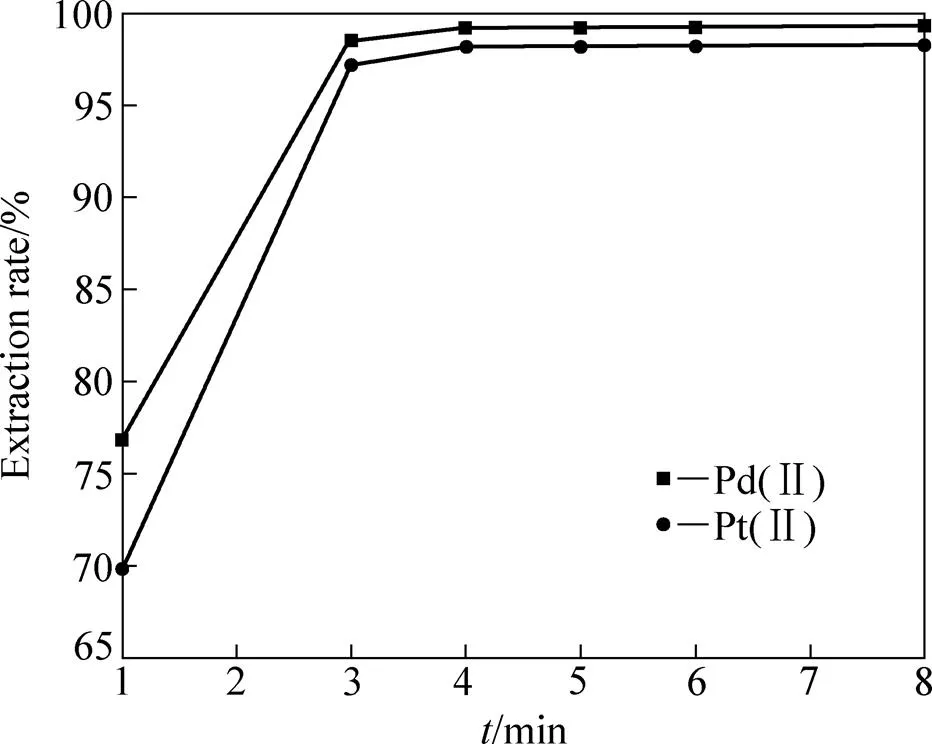
图3 时间对Pd(II)−和Pt(II)萃取影响
2.6 pH对萃取性能的影响
为保证萃取在稳定的pH值下进行,萃取前,首先分别对水相和有机相进行预处理,水相先用稀酸或碱调节pH值至预定值,而有机相则用相应pH值的蒸馏水多次进行萃取平衡操作,每次3 min,至平衡后水相pH值恒定在预定值。
室温下,固定Pd(CN)42−和Pt(CN)42−混合氰化液中,Pd(CN)42−和Pt(CN)42−的浓度分别为56.0 mg/L和47.0 mg/L,有机相中HPB的浓度为0.05 mol/L,有机相中正辛醇的含量为30%,相比O/A=1/5,萃取时间=5 min,研究了不同pH条件下HPB对Pd(CN)42−和Pt(CN)42−混合氰化液萃取性能的影响。实验结果表明:在pH为9.0~12.0的范围内,HPB对Pd(CN)42−萃取率大于99.0%;Pt(CN)42−萃取率大于98.0%,在pH为12~14的范围,Pd(CN)42−萃取率从99.0%,下降到82.5%,Pt(CN)42−萃取率从98.1%,下降到78.1%。这主要原因是过高pH值导致OH−浓度较大,OH−对Pd(CN)42−和Pt(CN)42−的反萃效应增大[31],对萃取产生不利影响,而pH < 9.4混合氰化液不能稳定存在[22],因此,实验控制萃取体系的pH =10.5。pH对Pd(CN)42−和Pt(CN)42−萃取的影响如图4所示。
2.7 水相中Pd(CN)42−和Pt(CN)42−浓度大小对萃取性能的影响
在萃取体系各参数固定的前提下,为保证高的萃取率,水相中金属离子浓度必须控制在一定范围,过高的金属离子浓度会导致萃取率的下降[32],室温下((25±1) ℃),固定有机相中HPB的浓度为0.05 mol/L,有机相中正辛醇的含量为30%,相比O/A=1/5,萃取时间=5 min,pH=10.5,实验钯、铂混合氰化液中Pd(CN)42−和Pt(CN)42−浓度的变化对萃取率的影响,实验数据见表5。

图4 pH对Pd(II)和Pt(II)萃取影响
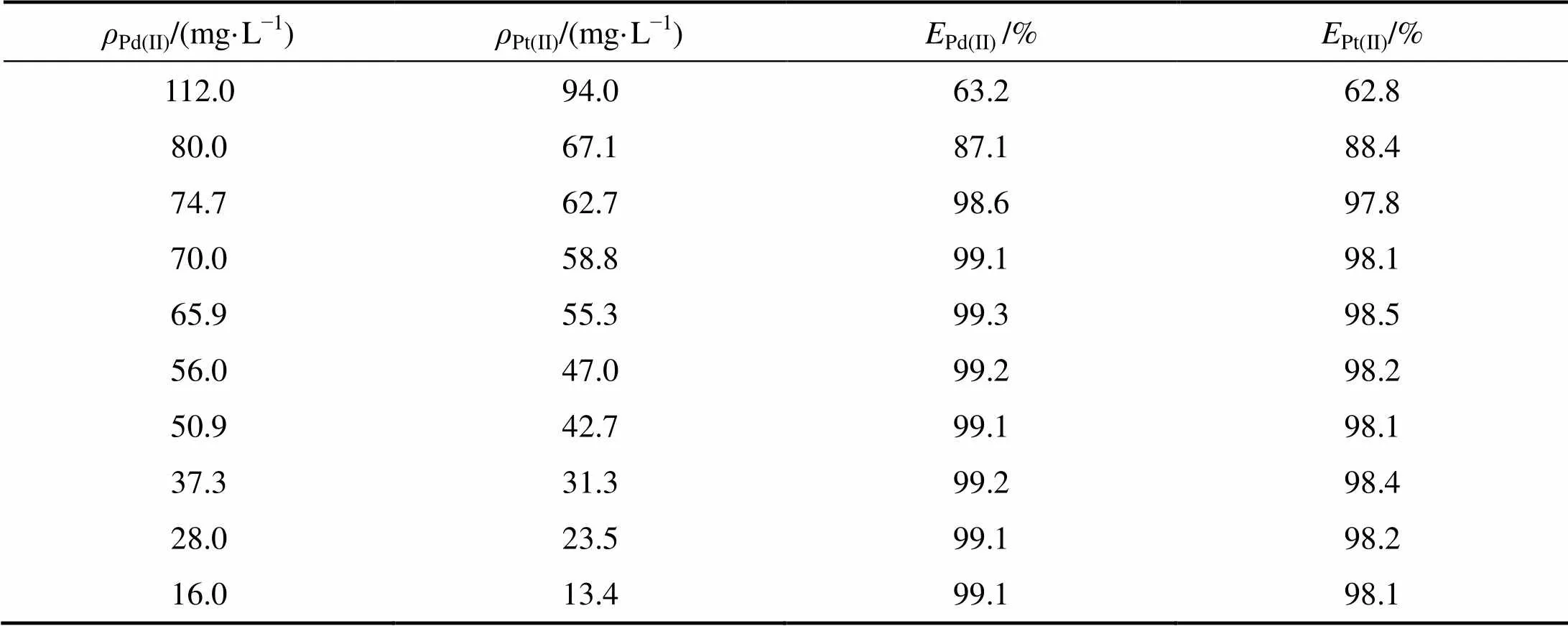
表5 水相中Pd(CN)42−和Pt(CN)42−浓度对萃取率的影响
由表5中可看出:当钯、铂混合氰化液中Pd(CN)42−浓度小于70 mg/L,Pt(CN)42−浓度小于60 mg/L时,混合氰化液中Pd(CN)42−萃取率大于99.0 %,Pt(CN)42−萃取率大于98.0%。由于铂钯浮选精矿加压氰化浸出液Pd(CN)42−和Pt(CN)42−浓度较低(均小于50 mg/L),故该方法能实现铂、钯浮选精矿加压氰化浸出液Pd(CN)42−和Pt(CN)42−的完全共萃。
2.8 有机相中Pd(CN)42−和Pt(CN)42−的反萃
按前面所述萃取步骤,使用0.05 mol/L HPB有机相30 mL,萃取56.0 mg/L Pd(CN)42−和47.0 mg/L Pt(CN)42−混合溶液150 mL,然后将负载Pd(CN)42−和Pt(CN)42−有机相,采用 NH4SCN溶液对Pd(II),Pt (II)进行反萃,研究发现:相比(O/A)对反萃结果产生较大影响,O/A>4易出现乳化现象,为了获得高富集倍数和避免出现第三相,控制反萃相比O/A=3.0,反萃时间=5 min,在此相比条件下,随着NH4SCN的浓度从0.5 mol/L增大到1.0 mol/L,Pd(CN)42−反萃率从40.7%,增大到99.0%,此时Pt(CN)42−反萃率为94.5%,继续加大NH4SCN溶液浓度,Pd(CN)42−反萃率保持不变,当NH4SCN的浓度大于1.5mol/L时,Pt(CN)42−反萃率为98.0%,此后再继续增加NH4SCN溶液浓度,Pd(CN)42−和Pt(CN)42−反萃率均保持常数,实验最终选择2.0 mol/L NH4SCN溶液作为反萃剂,相比O/A=3,反萃时间=5 min。
2.9 HPB萃取Pd(CN)42−和Pt(CN)42−的重复性
室温下((25±1) ℃),固定Pd(CN)42−和Pt(CN)42−混合氰化液中,Pd(CN)42−和Pt(CN)42−的浓度分别为56.0 mg/L和47.0 mg/L,有机相中HPB的浓度为0.05 mol/L,有机相中正辛醇的含量为30%,相比O/A=1/5,控制pH=10.5碱性条件,萃取时间=5 min。反萃液为2.0 mol/L的NH4SCN溶液,反萃时间5 min,相比O/A=3.0,计算反萃率,再用饱和KBr溶液再生有机相,5次循环实验结果见表6。
5次循环HPB体系对Pd(CN)42−和Pt(CN)42−萃取率及NH4SCN反萃 Pd(II)、Pt(II)的反萃率均无明显下降,回收率均大于95%。重复性使用实验表明,使用HPB作为萃取剂,NH4SCN作为反萃剂在碱性氰化液介质中溶剂萃取富集Pd(II)、Pt(II),方法稳定可靠,回收指标高。
2.10 萃取体系在浮选精矿氰化料液中的运用
室温下,取两批次浮选精矿加压氰化实际料液(简称X1和X2号)各450mL为水相(成分见表1),有机相中HPB的浓度为0.05 mol/L,有机相中正辛醇含量为30%,按相比O/A=1/5取有机相总体积90 mL,在碱性条件下(pH=10.5)萃取5 min后,分离,有机相按相比O/A=3再用浓度为2.0 mol/L的NH4SCN溶液30 mL反萃5 min,测定数据,实验结果见表7。
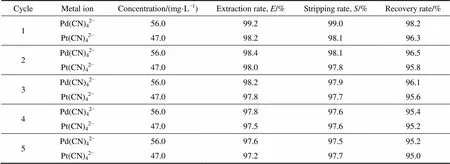
表6 HPB的重复性使用实验
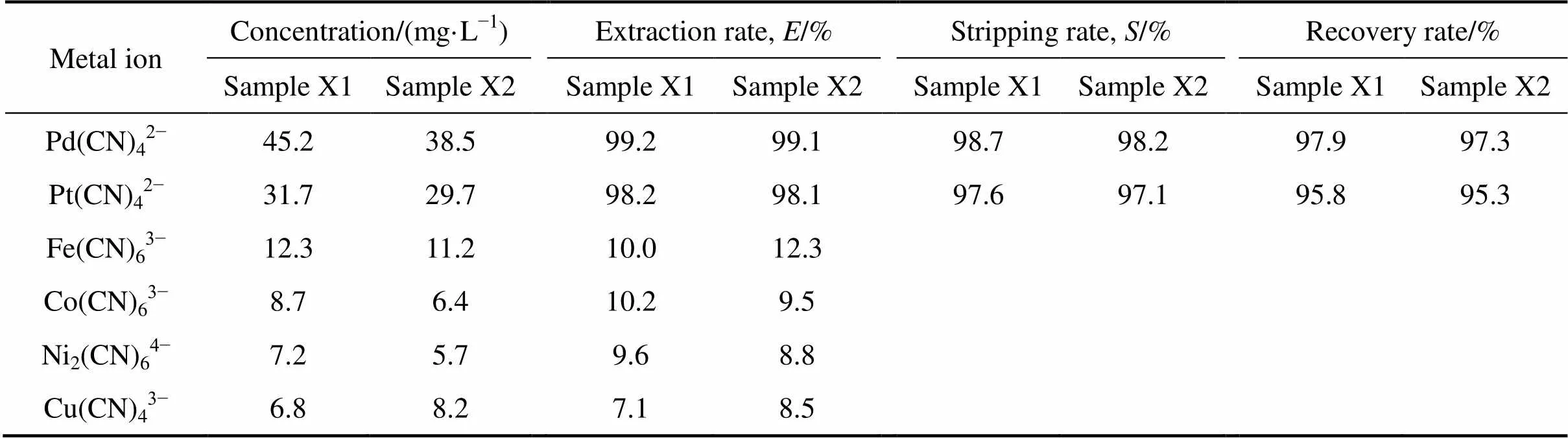
表7 浮选精矿氰化液萃取Pd(II)和Pt(II) 回收率
表7所列浮选精矿主要金属离子中Fe(CN)63−、Co(CN)63−、Ni2(CN)64−、Cu(CN)43−离子比电荷参数由小到大依次为Pd(CN)42−、Pt(CN)42−、Fe(CN)63−、Co(CN)63−、Ni2(CN)64−、Cu(CN)43−,根据最小电荷密度原理[33],HPB体系对表7中金属离子的萃取顺序由大到小依次为为Pd(CN)42−、Pt(CN)42−、Fe(CN)63−、Co(CN)63−、Ni2(CN)64−、Cu(CN)43−,由于HPB体系对浮选精矿加压氰化液介质中的Fe(III)、Ni(I)、Co(III)和Cu(I)萃取能力较低,全湿法新工艺对贱金属处理又较为彻底[2−3],致使浮选精矿加压氰化液中主要贱金属离子Fe(III)、 Ni(I)、Co(III)和Cu(I)对Pd(II)、Pt(II)的富集影响较小。实验结果表明:在实验所选定的最佳条件下,HPB体系能直接运用于浮选精矿氰化料液中Pd(II)、Pt(II)的富集,浮选精矿加压氰化实际料液中主要贱金属离子Fe(III)、Ni(I)、Co(III)和Cu(I)对Pd(II)和Pt(II)萃取富集干扰小,在实验选定条件下,HPB体系对Pd(II)、Pt(II)富集倍数达到了15倍,Pd(II) 和Pt(II) 萃取富集回收率均大于95%。该方法可衔接低品位铂钯浮选精矿加压氰化全湿法新工艺,可直接用于浮选精矿加压氰化实际料液的处理,为该工艺提供一种加压氰化后液Pd(II)和Pt(II) 富集处理新方法,具有良好产业化运用前景。
3 萃取机理的初步探讨
3.1 斜率法确定萃合物组成
由于Pd(CN)42−的面电荷密度低于Br−的面电荷密度,Pd(CN)42−与Br−的交换可降低体系的自由能,故可假定HPB萃取Pd(CN)42−反应为式(2):
[Pd(CN)42−](aq)+[R4N+Br−](org)
[(R4N)·Pd(CN)4](n−2)+(org)+Br−(2)
式中R4N+Br−为HPB;为萃合物中HPB的配位数[34](下标aq代表水相,org代表有机相,下同)
萃取平衡常数
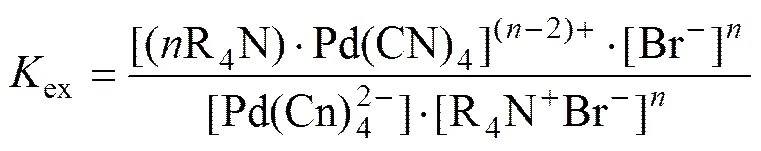
分配比
(4)
整理得
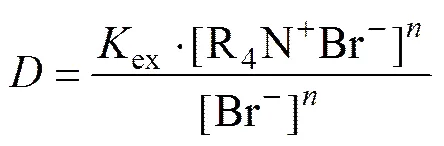
取对数lg=lgex+lg[R4N+Br−]−lg[Br−],即
lg=lgex+lg[HPB]−lg[Br−] (6)
利用实验数据作lg−lg[HPB] 图,得到图5(a)直线:
lg=2.106lg[HPB]+5.670 (7)
=0.9985,直线斜率=2.106,取整数得2,表明Pd(II)萃和物中HPB的配位数为2。
HPB季铵盐阳离子(R4N+)与Pd(CN)42−结合比为2:1。推测HPB萃取Pd(CN)42−反应式为
[Pd(CN)42−](aq)+2[R4N+Br−](org)
[2R4N+][Pd(CN)42−](org)+2Br−(8)
Pd(CN)42−与HPB季铵盐阳离子(R4N+)形成1:2离子缔合物。
采用斜率法假定HPB萃取Pt(CN)42−,反应式 如下:
[Pt(CN)42−](aq)+[R4N+Br−](org)
[(R4N)·Pd(CN)4](n−2)+(org)+Br−(9)
利用实验数据作lg−lg[HPB]图,得到图5(b)直线:
lg=1.926lg[HPB]+4.981 (10)
=0.9990,直线斜率=1.926,取整数得2,表明Pt(II)萃和物中HPB的配位数为2。
HPB季铵盐阳离子(R4N+)与Pt(CN)42−结合比为2:1。推测HPB萃取Pt(CN)42−反应式为
[Pt(CN)42−](aq)+2[R4N+Br−](org)
[2R4N+][Pt(CN)42−](org)+2Br−(aq)(11)
Pt(CN)42−与HPB季铵盐阳离子(R4N+)形成1:2离子缔合物。
斜率法研究表明:HPB季铵盐阳离子与Pd(CN)42−和 Pt(CN)42−阴离子通过静电吸引作用形成离子对,结合比均为2:1,符合离子缔合机理。
采用斜率法研究表明:HPB季铵盐阳离子与Fe(CN)63−,Co(CN)63−,Ni2(CN)64−,和Cu(CN)43−阴离子通过静电吸引作用形成离子对,结合比实验测定分别为3:1、3:1、4:1和3:1,符合离子缔合机理。推测的离子缔合反应式分别为
[Fe(CN)63−](aq)+3[R4N+Br−](org)
[3R4N+][Fe(CN)63−](org)+3Br−(12)
[Co(CN)63−](aq)+3[R4N+Br−](org)
[3R4N+][Co(CN)63−](org)+3Br−(13)
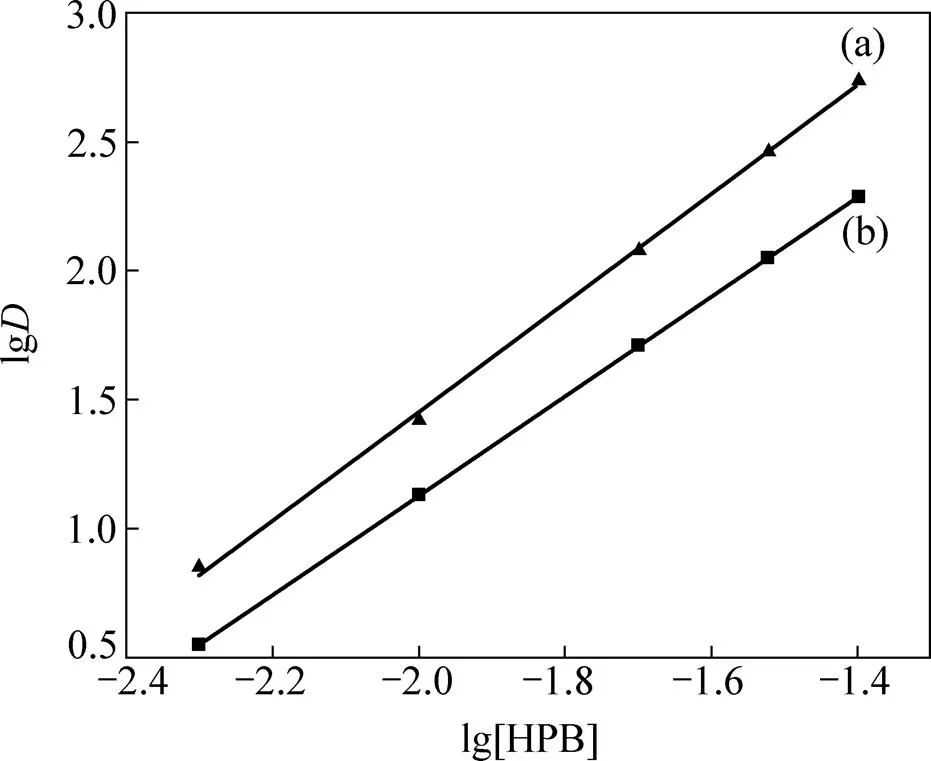
图5 lgD−lg[HPB]曲线
[Ni2(CN)64−](aq)+4[R4N+Br−](org)
[4R4N+][Ni2(CN)64−](org)+4Br−(14)
[Cu(CN)43−](aq)+3[R4N+Br−](org)
[3R4N+][Cu(CN)43−](org)+3Br−(15)
3.2 红外光谱分析
图6所示为HPB及其萃取钯、铂的红外吸收光谱,其中图6(a)所示为3401 cm−1为HPB表面所吸收水分子的O—H伸缩振动吸收峰,2920 cm−1、2850 cm−1处为—CH2—碳氢伸缩振动吸收峰,1631 cm−1、1584 cm−1、1482 cm−1处为吡啶环C=C和C=N伸缩振动吸收峰[35],图6(b)中的萃钯和图6(c)中萃铂后上述吡啶环特征吸收峰未发生明显位移且强度变化不大,表明吡啶环上N原子没有直接参与配位,配位取代反应没有发生,萃取反应机理应是离子缔合机理。此外,图6(b)采用HPB萃取Pd(CN)42−,图6(c)采用HPB萃取Pt(CN)42−后,分别在2109 cm−1和2111 cm−1处出现氰根C≡N伸缩振动吸收峰[36−39]。
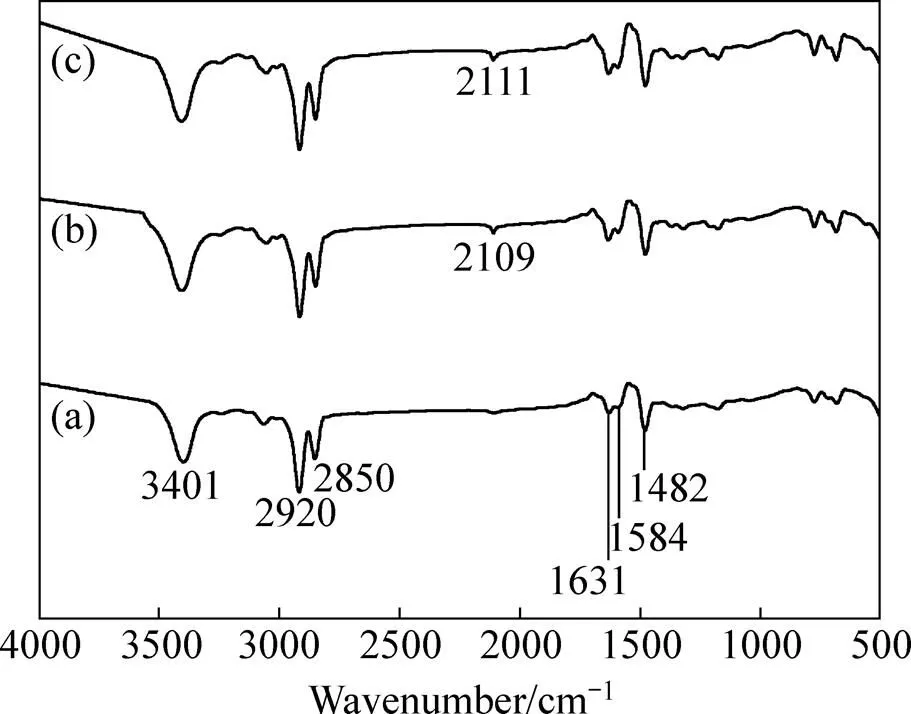
图6 HPB、HPB-Pd(II)萃合物、HPB-Pt(II) 萃合物红外光谱
3.3 紫外光谱分析
图7所示为HPB、HPB-Pd(CN)42−萃合物和Pd(CN)42−的紫外光谱。由图7(a)可看出,在碱性氰化液介质中,HPB在200~300 nm紫外区有两个明显的吸收峰,分别位于205和261 nm处[40],HPB与Pd(CN)42−所形成的萃合物吸收峰出现的在212和260 nm处(见图7(b));萃合物最大吸收峰位置与HPB吸收峰位置相近,Pd(CN)42−在此区域没有明显的吸收峰(见图7(c));与文献[41]报道结果一致,紫外光谱表明Pd(CN)42−被HPB萃取时,Pd(CN)42−和HPB其结构均未出现明显变化。

图7 HPB、HPB-Pd(CN)42−萃合物和Pd(CN)42−紫外光谱
铂离子在200~300 nm紫外区有两个明显的吸收峰,分别位于215和255 nm处(见图8中的曲线a),这与文献[41]报道的Pt(CN)42−紫外光谱完全一致,证明铂离子以Pt(CN)42−络合物形式存在于碱性氰化液中。HPB吸收峰出现在205 nm和261 nm处(见图8中的曲线b),HPB与Pt(CN)42−所形成的萃合物吸收峰出现的在205、217和260 nm处(见图8中的曲线c),萃合物在205 nm吸收峰与萃取剂HPB在205 nm出峰位置一致,萃合物在217 nm吸收峰与Pt(CN)42−在215nm出峰位置相近,萃合物在260 nm吸收峰与HPB在261 nm及Pt(CN)42−在255 nm出峰位置变化不大。因此,萃合物最大吸收峰位置与HPB和水相Pt(CN)42−吸收峰位置没有明显差别,说明Pt(CN)42−被HPB萃取时,Pt(CN)42−和HPB结构均未发生改变。紫外光谱分析进一步证实:在碱性氰化液介质中,HPB 与Pd(CN)42−和Pt(CN)42−以离子缔合形式结合,HPB萃取Pd(CN)42−和Pt(CN)42−过程均遵循离子缔合机理。
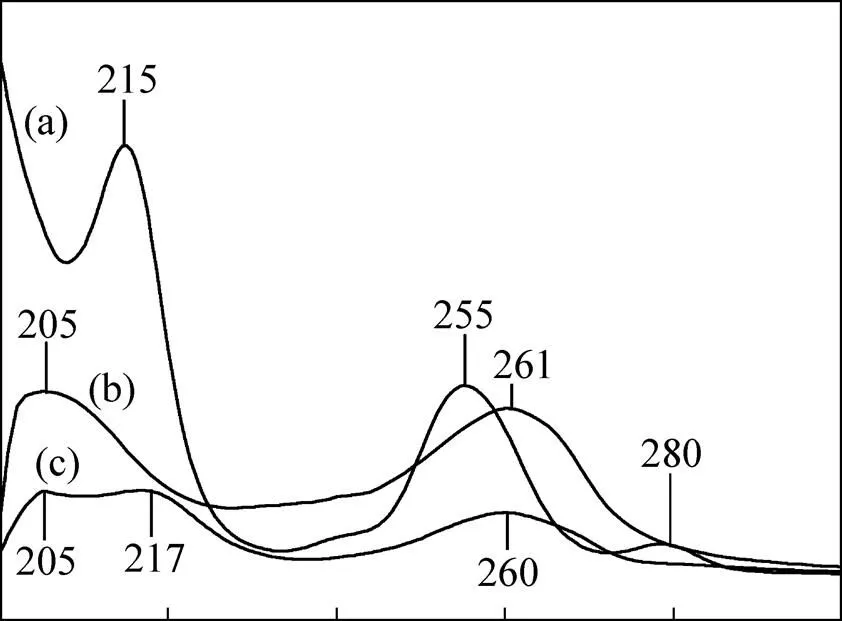
图8 Pt(CN)42−、HPB和HPB-Pt(CN)42−萃合物紫外光谱
3.4 反萃机理推测
使用NH4SCN溶液反萃有机相中的Pd(CN)42−和Pt(CN)42−时,其反萃过程可表述如下:充当反萃剂的SCN−阴离子与离子缔合物[2R4N+][Pd(CN)42−]和[2R4N+][Pt(CN)42−]中R4N+阳离子结合,将Pd(CN)42−和Pt(CN)42−阴离子挤入水相,从而实现NH4SCN溶液对Pd(II)−和Pt(II)离子反萃。反萃规律符合最小电荷密度原理[33],充当反萃剂的阴离子半径越大,越易实现与季铵盐阳离子结合,Pd(CN)42−和 Pt(CN)42−反萃越易进行。结合反萃容易、萃取动力学速度快等特点,推测反萃过程遵循离子交换机理,反萃剂NH4SCN对载钯、铂有机相中Pd(Ⅱ)和Pt(II)的反萃机理可用下式表示:
[2R4N+][Pd(CN)42−](org)+2SCN−(aq)
2[R4N+][SCN−](org)+[Pd(CN)42−](aq)(16)
[2R4N+][Pt(CN)42−](org)+2SCN−(aq)
2[R4N+][SCN−](org)+[Pt(CN)42−](aq)(17)
同理,推测NH4SCN对载铁、钴、镍和铜有机相中Fe(III)、Co(III)、Ni(I)和Cu(I)的反萃机理可用式(18)~(21)表示:
[3R4N+][Fe(CN)63−](org)+3SCN−(aq)
3[R4N+][SCN−](org)+[Fe(CN)63−](aq)(18)
[3R4N+][Co(CN)63−](org)+3SCN−(aq)
3[R4N+][SCN−](org)+[Co(CN)63−](aq)(19)
[4R4N+][Ni2(CN)64−](org)+4SCN−(aq)
4[R4N+][SCN−](org)+[Ni2(CN)64−](aq)(20)
[3R4N+][Cu(CN)43−](org)+3SCN−(aq)
3[R4N+][SCN−](org)+[Cu(CN)43−](aq)(21)
4 结论
1) 十六烷基吡啶可用于混合氰化料液中Pd(II)和Pt(II)的共同萃取,有机相组成为十六烷基吡啶的浓度为0.05 mol/L,有机相中正辛醇的含量为30%(体积分数),磺化煤油为稀释剂,按相比O/A=1/5,在pH=10.5碱性条件下,萃取时间5 min。对Pd(CN)42−为56.0 mg/L和Pt(CN)42−的浓度为47.0 mg/L的混合氰化液的萃取率可分别达到99.1%和98.2%。采用2.0 mol/L NH4SCN作为反萃剂,在相比O/A=3,反萃时间=5 min,Pd(CN)42−和Pt(CN)42−的反萃率分别大于 98.0%和97.0%。萃取pH范围广,反应动力学速度快,几分钟即达平衡,富集倍数可达15倍。
2) 该方法可衔接低品位铂钯浮选精矿加压氰化全湿法新工艺,直接用于浮选精矿加压氰化实际料液中Pd(II)和Pt(II)萃取富集,为该工艺提供一种全新后液处理方法,Pd(II)和Pt(II) 萃取富集回收率均大于95%,具有良好产业化运用前景。
3) 结合斜率法、红外光谱分析,紫外光谱分析, HPB萃取Pd(Ⅱ)和Pt(II)符合离子缔合机理,可推测溴代十六烷基吡啶季铵盐阳离子与Pd(CN)42−和Pt(CN)42−阴离子形成离子缔合物而进入有机相。
REFERENCES
[1] 陈 景. 铂族金属冶金化学[M]. 北京: 科学出版社, 2008: 157−164. CHEN Jing. Metallurgical chemistry for platinum group metals[M]. Beijing: Science Press, 2008: 157−164.
[2] 陈 景, 黄 昆, 陈奕然. 铂族金属硫化矿或其浮选精矿提取铂族金属及铜镍钴: 中国, CN1234889 C[P]. 2006−01−04. CHEN Jing, HUANG Kun, CHEN Yi-ran. Extraction of platinum group metals and copper, nickel and cobalt from platinum group metal sulfide ore or its flotation concentrate: China, CN1234889 C[P]. 2006−01−04.
[3] CHEN Jing, HUANG Kun. A new technique for extraction of platinum group metals by pressure cyanidation[J]. Hydrometallurgy, 2006, 82(3/4): 164−171.
[4] 陈 景, 黄章杰. 一种从加压氰化后液中富集铂、钯的方法: 中国, CN102808084 B[P]. 2014−04−02. CHEN Jing, HUANG Zhang-jie. An method for enrichment of platinum and palladium from leaching solution of pressure cyanide: China, CN102808084 B[P]. 2014−04−02.
[5] ZHANG Chao, HUANG Kun, YU Pin-hua, LIU Hui-zhou. Salting-out induced three-liquid-phase separation of Pt(IV), Pd(II) and Rh(III) in system of S201-acetonitrile-NaCI- water[J]. Separation and Purification Technology, 2011, 80(1): 81−89.
[6] ZHANG Chao, HUANG, Kun, YU Pin-hua, LIU Hui-zhou. Sugaring-out three-liquid-phase extraction and one-step separation of Pt(IV), Pd(II) and Rh(III)[J]. Separation and Purification Technology, 2012, 87: 127−134.
[7] ZHANG Chao, HUANG, Kun, YU Pin-hua, LIU Hui-zhou. Ionic liquid based three-liquid-phase partitioning and one-step separation of Pt(IV), Pd(II) and Rh(III)[J]. Separation and Purification Technology, 2013, 108: 166−173.
[8] PAN Lu, ZHANG Zu-de. Solvent extraction and separation of palladium(II) and platinum(IV) from hydrochloric acid medium with dibutyl sulfoxide[J]. Minerals Engineering, 2009, 22(15): 1271−1276.
[9] PAN L, BAO X, GU G. Solvent extraction of palladium(II) and effective separation of palladium(II) and platinum(IV) with synthetic sulfoxide mso[J]. Journal of Mining and Metallurgy Section B: Metallurgy, 2013, 49(1): 57−63.
[10] SHEN Y F, XUE W Y. Recovery palladium, gold and platinum from hydrochloric acid solution using 2-hydroxy-4-sec-octanoyl diphenyl-ketoxime[J]. Separation and Purification Technology, 2007, 56(3): 278−283.
[11] CIESZYNSKA A, WISNIEWSKI M.Selective extraction of palladium(II) from hydrochloric acid solutions with phosphonium extractants[J]. Separation and Purification Technology, 2011, 80(2): 385−389.
[12] BELOVA V V, KHOLKIN A I, ZHIDKOVA T I. Extraction of platinum-group metals from chloride solutions by salts of quaternary ammonium bases and binary extractants[J]. Theoretical Foundations of Chemical Engineering, 2007, 41(5): 743−751.
[13] GIRIDHAR P, VENKATESAN K A, SRINIVASAN T G, VASUDEVA R P R. Extraction of fission palladium by aliquat 336 and electrochemical studies on direct recovery from ionic liquid phase[J]. Hydrometallurgy, 2006, 81(1): 30−39.
[14] ORTET O, PAIVA A P. Development of tertiary thioamide derivatives to recover palladium(II)from simulated complex chloride solutions[J]. Hydrometallurgy, 2015, 151: 33−41.
[15] HUANG Huang, HUANG Chao, WU Yu-xuan, DING Song-dong, LIU Ning, SU Dong-ping, LÜ Tian-hao.Extraction of palladium(II) from nitric acid solutions with diglycolthioamide[J]. Hydrometallurgy, 2015, 156: 6−11.
[16] NGUYEN T H, SONU C H, LEE M S. Separation of platinum(IV) and palladium(II) from concentrated hydrochloric acid solutions by mixtures of amines with neutral extractants[J]. Journal of Industrial and Engineering Chemistry, 2015, 32: 238−245.
[17] ORTET O, PAIVA A P. Liquid-liquid extraction of palladium(II) from chloride media by N,N'-dimethyl-N,N'- dicyclohexylthiodiglycolamide[J]. Separation and Purification Technology, 2015, 156: 363−368.
[18] 余建民. 贵金属萃取化学[M]. 北京: 化学工业出版社, 2005: 269−271. YU Jian-min. Extraction chemistry for precious metal[M]. Beijing: Chemical Industry Press, 2005: 269−271.
[19] JIANG Jian-zhun, ZHOU Wei-jin, GAO Hong-cheng, WU Jing-guang, XU Guang-xian. Solvent extraction and stripping of gold(I) cyanide in the tetradecyldimethylbenzylammonium chloride system[J]. Hydrometallurgy, 2003, 70(1/3): 73−81.
[20] 黄 昆, 陈 景, 崔 宁, 吴瑾光, 周维金, 闫文飞. CTMAB 萃取Au(CN)2−体系中盐析剂反常效应[J]. 中国有色金属学报, 2001, 11(3): 518−521. HUANG Kun, CHEN Jing, CUI Ning, WU Jing-guang, ZHOU Wei-jing, YAN Wen-fei. Abnormal influence of salting-out agent on Au(CN)2−solvent extraction by CTMAB[J]. The Chinese Journal of Nonferrous Metals, 2001, 11(3): 518−521.
[21] 杨项军, 陈 景, 吴瑾光, 张 欣, 黄 昆, 赵家春, 李奇伟, 陈奕然. 水相添加表面活性剂CTAB对TBP萃取低浓度金的影响[J]. 中国有色金属学报, 2002, 12(6): 1309−1313. YANG Xiang-jun, CHEN Jing, WU Jing-guang, ZHANG Xin, HUANG Kun, ZHAO Jia-chun, LI Qi-wei, CHEN Yi-ran. Effects of addition of CTAB in aqueous phase on extraction with TBP from low gold concentration cyanide solutions[J]. The Chinese Journal of Nonferrous Metals, 2002, 12(6): 1309−1313.
[22] 周 杨, 李学玲, 顾烁玥, 杨项军. 用N503/TBP从碱性氰化液中萃取低浓度金[J]. 中国有色金属学报, 2009, 19(7): 1345−1349. ZHOU Yang, LI Xue-ling, GU Shuo-yue, YANG Xiang-jun. Solvent extraction of trace Au(I) from alkaline cyanide solution by N503/TBP system[J]. The Chinese Journal of Nonferrous Metals, 2009, 19(7): 1345−1349.
[23] YANG Xiang-jun, HUANG Kun, HUANG Zhang-jie, WEI Qun-yan, CHEN Jing, WU Jin-guang. Solvent extraction of Au(I) from aurocyanide solution with cetyltrimethylammonium bromide/tri-n-butyl phosphate system using column-shaped extraction equipment[J]. Solvent Extraction and Ion Exchange, 2007, 25(2): 299−312.
[24] YANG Xiang-jun, HUANG Kun, WEI Qun-yan, HUANG Zhang-jie. CHEN Jing, WU Jin-guang. Stripping of Au(I) from a loaded cetyltrimethylammonium bromide/tributyl phosphate organic solution: Conversion and reduction[J]. Solvent Extraction and Ion Exchange, 2008, 26(5): 556−569.
[25] YANG Xiang-jun, LI Xue-ling, HUANG Kun, WEI Qun-yan, HUANG Zhang-jie, CHEN Jing, XIE Qi-ying. Solvent extraction of gold(I) from alkaline cyanide solutions by the cetylpyridinium bromide/tributylphosphate system[J]. Minerals Engineering, 2009, 22(12): 1068−1072.
[26] CHEN Lei, HUANG Zhang-jie, CHEN Jing. Solvent extraction and stripping of Pd(II) cyanide in cetyltrimethylammonium bromide system[J]. Asian Journal of Chemistry, 2013, 25(18): 10169−10171.
[27] 李吕辉,赵国良. 惰性稀释剂的性质对萃取的影响[J]. 原子能科学技术, 1964(6): 616−626. LI Lü-hui, ZHAO Guo-liang. Influence of properties of inert diluents on the extraction[J]. Atomic Energy Science and technology, 1964(6): 616−626.
[28] 杨得岭, 宁朋歌, 曹宏斌, 张 懿. 伯胺N1923络合萃取苯酚[J]. 过程工程学报, 2012, 12(4): 569−575. YANG De-ling, NING Peng-ge, CAO Hong-bin, ZHANG Yi. Extraction of phenol with primary amine N1923[J]. The Chinese Journal of Process Engineering, 2012, 12(4): 569−575.
[29] 黄 昆, 陈 景, 吴瑾光, 高宏成, 崔 宁, 余建民. CTMAB萃取Au(CN)2−体系中几种改性剂的对比[J].中国有色金属学报, 2001,11(2): 307−311. HUANG Kun, CHEN Jing, WU Jing-guang, GAO Hong-cheng, CUI Ning, YU Jian-min. Effects of modifiers on Au(CN)2−solvent extraction by CTMAB[J]. The Chinese Journal of Nonferrous Metals, 2001, 11(2): 307−311.
[30] 沈兴海, 李改玲, 高宏成. 醇对萃取有机相中形成微乳液的影响[J]. 北京大学学报(自然科学版), 1997, 33(2): 153−157. SHEN Xing-hai, LI Gai-ling, GAO Hong-cheng. The effects of alcohols on the stability of the formed microemulsion in extraction organic phase[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 1997, 33(2): 153−157.
[31] 潘 路, 王凤武, 张祖德. 盐酸胍与溴化十六烷基吡啶从碱性氰化液中萃取Au(I)[J]. 过程工程学报, 2008, 8(4): 741−745. PAN Lu, WANG Feng-wu, ZHANG Zu-de. Extraction of Au(I) from alkaline cyanide solution with guanidine hydrochloride−hexadecylpyridine bromide[J]. The Chinese Journal of Process Engineering, 2008, 8(4): 741−745.
[32] ZHANG Tian-xi, HUANG Bao-gui, ZHOU Wei-jin, GAO Hong-cheng, CHEN Jing, WU Ha-shen, WU Jin-guang. Extraction and recovery of gold from KAu(CN)2using cetyltrimethylammonium bromide microemulsions[J]. Journal of Chemical Technology and Biotechnology, 2001, 76(11): 1107−1111.
[33] 陈 景. 铂族金属难溶配合物的分类及溶解度规律[C]//中国工程院. 陈景文集. 北京: 冶金工业出版社, 2014: 86−94. CHEN Jing. Classification and solubility of platinum group metal insoluble complexes[C]//The Chinese Academy of Engineering. A collection From Cheng Jing. Beijing: Metallurgical Industry Press, 2014: 86−94.
[34] 徐光宪, 王文清, 吴瑾光. 萃取化学原理[M]. 上海: 上海科学技术出版社, 1984: 144−176. XU Guang-xiang, WANG Wen-qing, WU Jin-guang. Principle of extraction chemistry[M]. Shanghai: Shanghai Science and Technology Press, 1984: 144−176.
[35] 宁永成. 有机化合物结构鉴定与有机波谱学[M]. 北京:科学出版社, 2003: 332−337. NIN Yong-cheng. Structural identification of organic compounds and organic spectroscopy[M]. Beijing: Science Press, 2003: 332−337.
[36] YANG Xiang-jun, YANG Rui-si, SHI De-qiang, WANG Shi-xiong, CHEN Jing, GUO Hong. Hydrophobic ionic liquids as novel extractantsfor gold(I) recovery from alkaline cyanidesolutions[J].Journal of Chemical Technology and Biotechnology, 2015, 90: 1102−1109.
[37] 杨项军, 王世雄, 邹安琴, 陈 景, 郭 洪. TRPO萃淋树脂从碱性氰化液中固相萃取Au(1)机理研究[J]. 光谱学与光谱分析, 2014, 34(2): 483−488. YANG Xiang-jun, WANG Shi-xiong, ZOU An-qin, CHEN Jing, GUO Hong. Mechanism of gold solid extraction from aurocyanide solution using D3520 resin impregnated with TRPO[J]. Spectroscopy and Spectral Analysis, 2014, 34(2): 483−488.
[38] ADAMS M D. Fourier-transform infrared spectrophotometric study of adsorbed aurocyanide species on activated carbon[J]. Hydrometallurgy, 1992, 31(1/2): 111−120.
[39] 姜健准, 周维金, 高宏成, 陈 景, 吴瑾光. 萃金体系第三相的产生及其谱学研究[J]. 光谱学与光谱分析, 2002, 22(3): 396−398. JIANG Jian-zhun, ZHOU Wei-jin, GAO Hong-cheng, CHEN Jing, WU Jin-guang. Formation of the third phase and spectroscopic research of the loading organic phases in the gold extraction[J]. Spectroscopy and Spectral Analysis, 2002, 22(3): 396−398.
[40] 李小静, 完颜辉, 牟维运, 杨汝栋. 1,5-双(1’-苯基-3’-甲基-5’-吡唑啉酮-4’)-戊二酮-[1,5]和十六烷基吡啶盐的稀土配合物的合成及表征[J]. 高等学校化学学报, 1991, 12(5): 580−584. LI Xiao-jing, WAN Yan-hui, MU Wei-yun, YANG Ru-dong. Preparation and characterization of the solid complexes of rare earth with 1,5-bis-(1’-phenyl-3’-methyl-5’- pyrazolone-4’)- pentanedione-[1,5](BPMPPD) and cetyl pyridinium bromide (CPB)[J]. Chemical Journal of Chinese Universities, 1991, 12(5): 580−584.
[41] 黄 昆. 加压氰化法提取铂族金属新工艺研究[D]. 昆明: 昆明理工大学, 2004: 196−198. HUANG Kun. Study on the new process of extracting platinum group metals by pressure cyanidation[D]. Kunming: Kunming University of Science and Technology, 2004: 196−198.
(编辑 李艳红)
Simultaneous extraction and preconcentration of palladium and platinum from alkaline cyanide solution by hexadecylpyridinium bromide
LI rong, ZHANG Jin-yang, CHEN Mu-hang, WU Sheng-jie,LIU Yang, LI Jin-fei, HUANG Zhang-jie
(School of Chemical Science and Technology, Yunnan University, Kunming 650091, China)
Simultaneous extraction and preconcentration of Pd(II) and Pt(II) from alkaline cyanide solution using hexadecylpyridinium bromide(HPB) as extractant were investigated. The factors affecting extraction and preconcentration efficiency, including diluent type, concentration of hexadecylpyridinium bromide,content of modifier, phase ratio (O/A), contact time of aqueous and organic phase, concentrations of Pd(II) and Pt(II) and pH value of solution, were studied. The results indicate that, at concentration of hexadecylpyridinium bromide (HPB) 0.05 mol/L, content of n-octyl alcohol 30% (volume fraction), phase ratio(O/A)=1:5, pH values 10.5 contact time of 5 min, Pd(II)(<70 mg/L) and Pt(II)(<60 mg/L) in alkaline cyanide solution can be transferred from the aqueous phase into the organic phase. Ammonium thiocyanate solution can be used as stripping agent. The extraction mechanism can be deduced based on slope analysis,FTIR spectrum and UV spectrum. The proposed method was applied to extract of Pd(II) and Pt(II) from leaching cyanide liquor of Pt-Pd flotation concentrate. The enrichment factor of 15 is achieved. The recovery rate is high than 95%.
alkaline cyanide solution; hexadecylpyridinium bromide; palladium; platinum
Project(51264038) supported by the National Natural Science Foundation of China; Project(2014CB643406) supported by the Major State Basic Research Development Program of China; Project(2013HA010, 2014HA010)supported by Academician Free Exploration Project of Yunnan Province, China; Project supported by Engineering Research Center of Photocatalytic Treatment of Industrial Wastewater of Yunnan Province, China
2015-09-28; Accepted date: 2016-02-29
HUANG Zhang-jie; Tel: +86-871-65032180; E-mail: Zhjhuang@ynu.edu.cn
1004-0609(2016)-11-2449-12
TF 111.31
A
国家自然科学基金资助项目(51264038);国家基础研究计划资助项目(2014CB643406);云南省院士自由探索项目(2013HA010,2014HA010);云南省工业废水光催化处理工程研究中心计划项目
2015-09-28;
2016-02-29
黄章杰,教授,博士;电话:0871-65032180;E-mail:Zhjhuang@ynu.edu.cn
