双膜三室电解槽中电沉积钴的离子传输
2016-12-13王三反宋小三张学敏
周 键,王三反,宋小三,张学敏
双膜三室电解槽中电沉积钴的离子传输
周 键1, 2,王三反1, 2,宋小三1, 2,张学敏1, 2
(1. 兰州交通大学环境与市政工程学院,兰州 730070;2. 兰州交通大学寒旱地区水资源综合利用教育部工程研究中心,兰州 730070)
针对传统氯化钴电沉积工艺阳极产氯的缺陷,采用双膜三室电解槽进行电沉积钴。通过测定各隔室中的电解液成分变化深入研究电沉积过程的离子传输行为。结果表明:在电场与浓度梯度作用下,阴极液的氯离子与阳极液的氢离子可经电迁移与扩散进入中隔室形成盐酸,盐酸浓度可达1 mol/L;并同时阻止阳极析氯,实现产酸抑氯同步化。
钴;电沉积;离子交换膜电解槽;离子传输
金属钴因具有熔点高、稳定性良好的特点,通常作为制造耐热合金、防腐合金、磁性合金、硬质合金和钴盐等的重要原料[1−4],广泛用于机械制造、航空航天、化学、军事、陶瓷等工业。因此,钴是一种战略性金属。
制备金属钴的常用方法是不溶阳极法[5],即电化学阴极还原法,也是钴湿法冶炼的最后一步。具体地说是采用高浓度的含钴溶液作为电解液,惰性电极作为阳极,钴种板作为阴极;在通电过程中,阳极不发生溶解反应;钴离子向阴极迁移,发生电化学还原反应,沉积于阴极表面,从而得到高纯金属钴。依据电解液类型不同,可分为硫酸体系[6−8]和氯化体系[9−11]。相比于硫酸体系,氯化体系的导电性更高;钴沉积过电位、阳极过电位更低;以及有机萃取时,镍钴更易于分离[9, 12]。所以,氯化钴体系的阴极电流效率和能耗均优于硫酸体系。国内外采用氯化电积法的钴冶炼企业较多,例如中国金川公司、加拿大鹰桥钴冶炼厂、日本住友公司等[13]。虽然氯化电积法的优点较多,但也存在严重的缺点,就是阳极产生氯气,污染和腐蚀较为严重。
由于氯气具有强烈的毒性,必须经过无害化处理。处理氯气的一般方法是碱液吸收法[14],或是将氯气与氢气点燃生成盐酸回用于其他生产阶段[15]。上述方法均需要复杂且安全可靠的气体收集、输送、处理系统。此系统使电解槽的设计更为复杂,设备操作更为繁琐,且进一步增加钴电积成本。另外,利用阳极隔膜袋收集氯气时,尤其是在阳极袋使用一段时间后,氯气发生泄漏是不可避免的。为此,如何从根源上解决氯化钴电沉积过程的产氯问题引起了相关科研人员的极大关注。目前,有关此方面研究甚少。
本文作者提出采用双膜三室电解槽从氯化钴体系中电沉积钴[16],在阴极沉积钴时,同时将氯直接电化学再生为盐酸并回用于酸浸出阶段。通过测定双膜三室电解槽中的阴极液、中间液、阳极液成分变化研究离子传输行为,同时探讨了双膜电解槽产酸抑氯的可行性,并对电解槽中的3种阳离子交换膜的抑氯性能进行了对比研究。
1 实验
1.1 材料与试剂
实验所用的3种阳离子交换膜与1种阴离子交换膜如表1所列。阴极液为某钴冶炼厂酸浸出液−高浓度氯化钴电解液(75~80 g/L Co2+),初始中间液为自配的0.5%稀盐酸溶液,阳极液为自配的1%稀硫酸溶液(质量分数)。所有化学试剂均为分析纯,溶剂为三重蒸馏水。

表1 实验用膜的性能指标
1.2 实验装置
所有电沉积钴实验均在自制的离子交换膜反应器中进行[17]。该反应器采用双膜三室阳极密闭式结构,利用一张阴离子交换膜与一张阳离子交换膜将单元电解槽依次分隔成阴极室、中隔室、阳极室。各个隔室配有相应的电解液循环系统,通过数字计量泵控制电解液流量。中隔室中的溶液定义为中间液。每个隔室的几何尺寸相同,有效容积均为300 mL。阴极与阴膜、阳极与阳膜均呈对应平行设置。阴极为不锈钢板,阳极为Dimensionally stable anode(DSA)电极。阴极和阳极的尺寸均为9 cm×15 cm。有效膜尺寸为8 cm×13 cm。将膜反应器置于恒温水浴槽中,温度控制在(50±1) ℃。恒电位仪用于提供恒定的直流电流。将精密伏特计并联接入电路,连接阴极与阳极用于测定槽电压,计算电耗;将精密电流计串联接入电路,用于计算电流效率。
1.3 数据处理
实验前后分别称量阴极板质量,计算金属钴增量。基于电积钴质量及纯度进行阴极电流效率计算。电流效率等于用于电沉积钴的电流与实际消耗的总电流的比值,电沉积钴消耗的电流根据阴极钴的增量并按法拉第电解第一定律进行计算。具体的电流效率计算公式如式(1)所示:

式中:为电流效率,%;为电积钴纯度,%;/为时间内沉积钴的增量,g;为电子数,=2;为法拉第常数(96485.33 C/mol);Co为钴摩尔质量(58.93 mol/g);tot为总表观电流密度(A/m2);为电极的有效面积(m2)。
1.4 测试方法
阴极液的钴离子浓度及阴极钴板纯度采用电感耦合等离子体原子发射光谱法(ICP-AES)进行测定。阳极液中的氯离子采用电位滴定法测定,以氯离子选择性电极作为指示电极。中间液和阴极液中的氯离子浓度采用硝酸银滴定法测定,二苯碳酰二肼作为指示剂。中间液和阳极液酸度采用氢氧化钠滴定法。
1.5 实验操作
实验开始前,阴极室注入高浓度氯化钴电解液,并调节pH至2~2.5;中隔室初始注入0.5%稀盐酸溶液;阳极液注入1%稀硫酸溶液。阴极背面涂有一层环氧树脂胶用于绝缘;阴极正面采用金刚砂纸进行打磨抛光,打磨后先用丙酮溶液清洗,再用蒸馏水洗净。阴极与阳极的间距为50 mm。开启数显恒流泵进行电解液循环,控制流量为60~65 mL/min。打开恒流电源和恒温水浴器,在所需电流密度(200 A/m2)和温度(50 ℃)下进行电沉积钴实验。实验期间,定时取样,用于检测分析;实验结束后,用电子天平称量沉积钴板,然后小心地剥离沉积的钴片,用于纯度分析。
2 结果与讨论
2.1 不同阳膜电解槽中电沉积钴的实验结果
双膜三室电解槽中电沉积钴的运行参数及结果如表2所列。
从表2可以看出,3种阳膜的电流效率均大于95%,Nafion-117的电流效率最高,能耗最低,其原因是:Nafion-117对氢离子的选择透过性最好(>98),相应地,阳极液中氢离子迁移到中间液最多。基于溶液电中性原则,中间液所需的负电荷离子就最多,而带负电荷粒子来源只能是阴极液中的氯离子,因此,Nafion-117的阴极液中的氯离子减少量最多,为维持电荷平衡,相应的钴离子减少量也最多,钴的减少主要用于发生钴电化学还原反应。
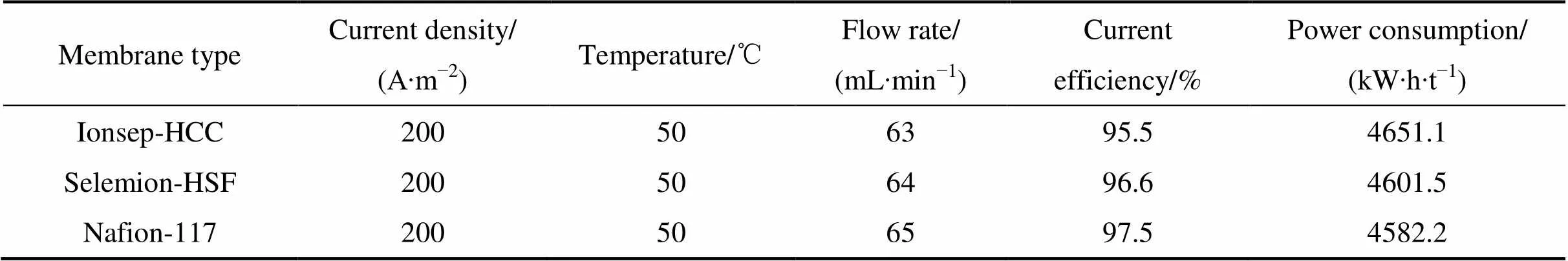
表2 钴电积实验条件及结果
由图1可知,3种阳膜的槽电压均随着电解时间增加而升高,增加幅度为0.25 V左右,这是因为钴浓度减少,导致电解液导电性下降。由于Ionsep-HCC的电阻比其他两种膜的大,所以它的槽电压最高。虽然双膜三室电解槽的槽电压比常规无隔膜电解槽的高出0.8~1 V,即膜电压降,这主要是增加阴离子交换膜和阳离子交换膜所造成的;但从综合成本考虑,这是可接受的。
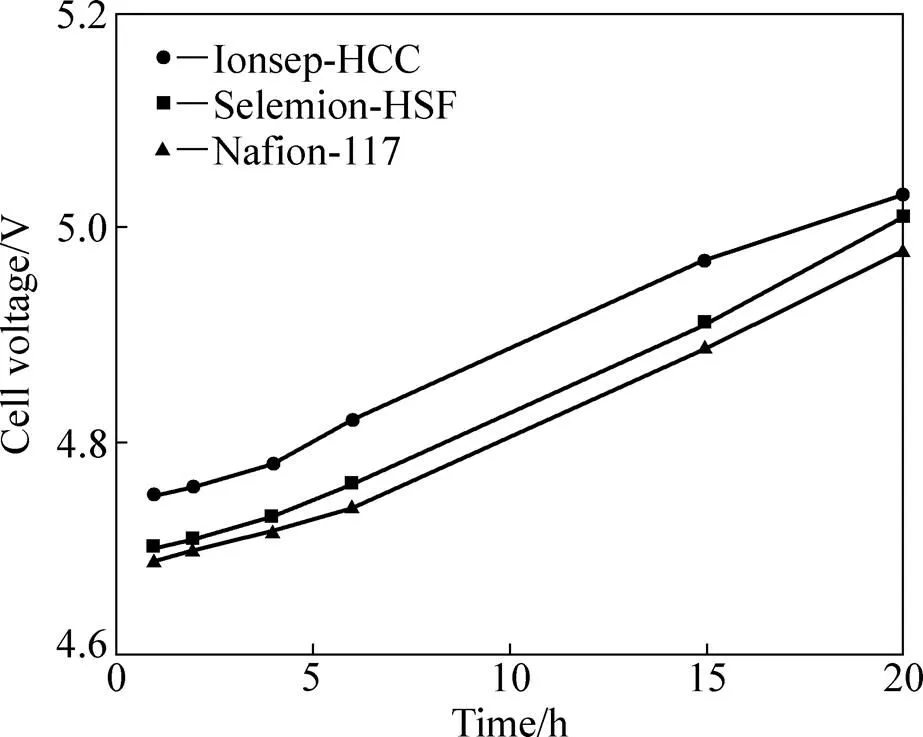
图1 槽电压随时间的变化
2.2 钴电沉积过程的离子传输行为
离子膜电沉积导电过程的实现主要依赖于穿过阴/阳离子交换膜的阴离子与阳离子的定向运动。离子膜电沉积技术是以直流电场梯度为主要推动力的膜应用过程,但除了电场梯度外,在实际应用过程中还有可能存在浓度梯度、温度梯度等的交叉或耦合作 用[18−19]。在这些梯度的作用下,离子膜电沉积钴的离子传输行为主要有离子迁移、水分子电渗透、离子扩散等。双膜三室电解槽的三个隔室电解液的可能的离子传输过程如图2所示。

图2 双膜三室电解槽的离子传输示意图
从图2中可以看出,在直流电场的牵引下,阴极室中的Co2+受到阴极吸引,向阴极做定向迁移,并在阴极上发生电还原反应,以金属单质形态析出;而Cl−迁出阴极室穿过阴离子交换膜进入中隔室,并受到阳离子交换膜的阻挡被固定于中隔室;实现阴极液与中间液之间的导电主要依靠氯离子迁移。阳极室发生水电解反应,生成H+和O2;H+受到阳极吸引,迁出阳极室穿过阳离子交换膜进入中隔室,由于阴离子交换膜的阻挡作用也被固定于中隔室;实现阳极液与中间液之间的导电主要依靠氢离子迁移。因此,随着电沉积过程进行,H+和Cl−不断地从阳极液和阴极液中迁移至中隔室,从而形成浓度不断升高的HCl。具体的电化学反应式如式(2)~(5)所示。
阴极:
Co2++2e→Co↓ (2)
2H++2e→H2↑ (3)
中隔室:
H++Cl−→HCl (4)
阳极:
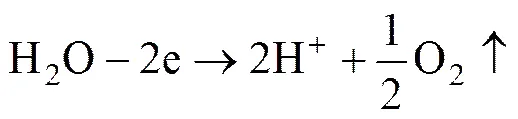
以上各离子的传输行为能否发生可通过测定阴极液、中间液、阳极液的离子浓度变化来进行验证。
2.2.1 阴极液成分变化
阴极液的各离子浓度变化如图3~5所示。由图3可得,3种阳膜的钴离子浓度均随着时间的延长而呈线性下降。钴离子的减少主要是因为阴极发生析钴反应,钴沉积于阴极表面,此外,还有少量的钴离子进入中间液。在钴发生沉积的同时,为了维持阴极液的电荷平衡,氯离子作为载流子发生扩散和迁移进入中间液。氯离子浓度随时间的变化见图4,其变化趋势与钴离子浓度的相似。从图3和图4可看出,氯离子浓度大约为钴离子浓度的2倍。阴极液的pH变化如图5所示。由图5可得,随着时间延长,pH逐渐地下降,即阴极液酸性呈逐渐上升的趋势。此现象可由氢离子扩散解释。设置在阴极液与中间液之间的阴离子交换膜特性是允许阴离子透过(Cl−),而阻止阳离子透过(H+)。但由于中间液与阴极液的氢离子浓差扩散方向与电场方向相同,即使有阴膜的阻挡作用,H+仍可穿过阴膜进入阴极液,尤其是在电解后期,氢离子浓度梯度较大时,氢离子的扩散速率较快。

图3 阴极液的钴浓度随时间的变化

图4 阴极液的氯浓度随时间的变化

图5 阴极液的pH随时间的变化
2.2.2 中间液成分变化
将中间液与阴极液、阳极液相互隔离的媒介分别为阴离子交换膜和阳离子交换膜。氢离子和氯离子被认为是实现阳极液、中间液、阴极液相互之间导电的最重要的载流子。这可由中间液的酸度变化和氯离子浓度变化证明,分别如图6与图7所示。
由图6可得,中间液的酸度随时间的增加不断地升高,且3种阳膜的酸度变化趋势相似。中间液酸度提高的原因包括两个:一是氢离子扩散,二是氢离子电迁移,两者推动力分别是氢离子浓度梯度和电场梯度,且方向相同。氢离子的供给源是阳极析氧反应生成的H+。由图7可得,随着时间延长,中间液的氯离子浓度呈线性地提高。同样地,中间液氯离子浓度的提高也是因为氯离子扩散和氯离子电迁移。中间液增加的氯离子来自于阴极液。从图6和图7中可以看出,中间液的酸度和氯离子浓度均随时间升高,因此,盐酸可在中隔室形成,且盐酸浓度达1 mol/L左右,此浓度的盐酸正适合钴湿法冶炼的酸浸出工艺。
由于阴极液与中间液之间存在钴离子浓度梯度,虽然钴离子扩散方向与电场方向相反,钴离子会受到阳极的排斥力,同时钴离子还受到阴离子交换膜的阻挡作用,但是阴极液中的钴离子仍能穿过阴离子交换膜扩散到中间液。中间液的钴离子浓度变化如图8所示。由图8可得,3种阳膜的中间液钴离子浓度均随时间的增加而缓慢地升高。所以说,中间液会有少量的钴存在,但这并不影响中间液作为酸浸出剂的循环使用。

图6 中间液的酸度随时间的变化
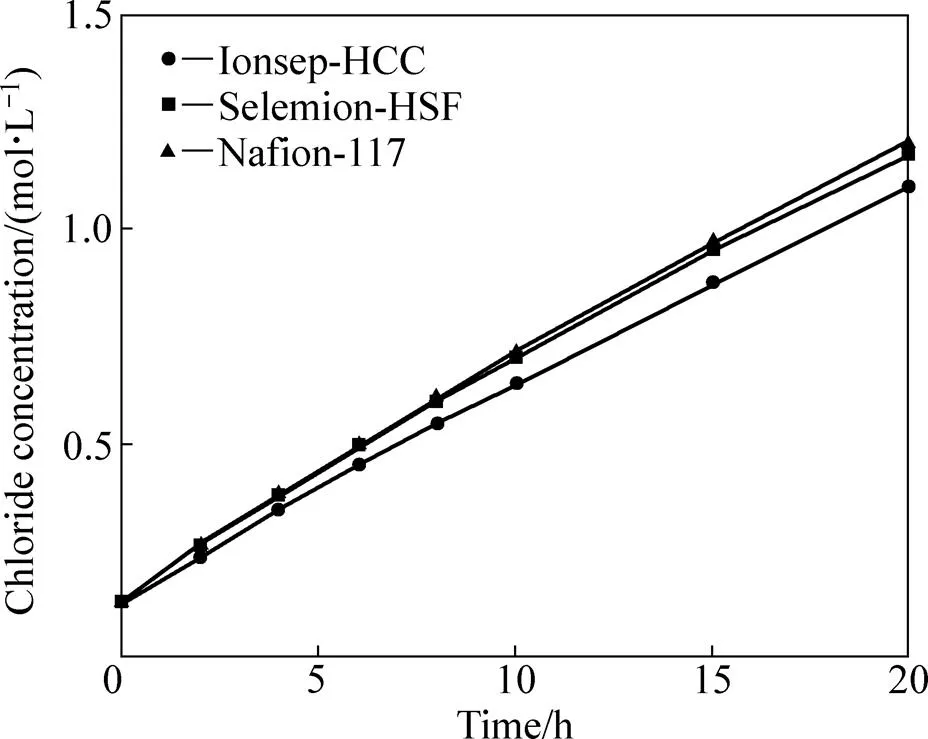
图7 中间液的氯离子浓度随时间的变化

图8 中间液的钴离子浓度随时间的变化
2.2.3 阳极液成分变化
利用双膜电解槽进行氯化钴电积的目的是阻止阳极产氯气,并将氯再生为盐酸。为了达到这样的目的,阳极发生的电化学反应就是析氧反应而不是析氯反应,并要求阳极液中无氯离子或氯离子浓度很低。设置在阳极液与中间液之间的阳离子交换膜就是为了阻挡中间液的氯离子进入阳极液,但由于阳离子交换膜的选择透过系数不能达到100%,仍有少量的氯离子存在于阳极液中。导致氯离子泄漏到阳极液的主要原因是氯离子浓差扩散。由于氯离子泄漏方向与电场方向相一致,在电场作用下,氯离子穿过阳膜进入阳极液是极有可能的。泄漏到阳极液中的氯离子浓度变化如图9所示。从图9可以看出,3种阳膜的氯离子泄漏行为迥异,Nafion-117的氯离子泄漏率最低,分别约为Ionsep-HCC的1/2和Selemion-HSF的1/4,这与膜结构及本性有关。Nafion-117为全氟磺酸均相膜,Selemion-HSF为苯烯类均相膜,Ionsep-HCC为非均相膜。对3种阳膜的表面固定电荷密度进行测试[21],分别为0.9、0.8、1.7。依据“空穴传导−双电层”理论[20]可知,阳膜表面固定电荷密度越大,所构成的负电场强度越大,且相应的空穴数量越多,由于静电作用,就对反离子的选择透过性越高,显然对同离子(Cl−)阻挡性越好。所以,与Selemion-HSF相比,Nafion-117对氯离子阻挡性更好。
从理论上说,Ionsep-HCC对氯离子阻挡性应最好,但实验现象表明,其结果恰好相反。这是因为,异相膜在制造过程中避免不了存在局部结构不均匀及个别微孔,这样膜孔径远大于水合氯离子半径,在外加电场作用下,氯离子较易从中隔室迁移至阳极室,所以氯离子泄漏量最高。

图9 阳极液的氯离子浓度随时间的变化
3 结论
1) 对双膜三室电解槽的离子传输研究表明:在中隔室中可形成盐酸,盐酸浓度高达1 mol/L,同时阻止阳极产氯,实现产酸抑氯同步化。双膜三室电解槽电沉积钴的槽电压与电流效率是在可接受的范围内。
2) 3种阳离子交换膜对氯离子的阻挡性能由高到低顺序依次为:Nafion-117、Selemion-HSF、Ionsep-HCC。为了使阳极发生析氧反应而取代析氯反应,阳极液维持低浓度的氯离子是关键所在。因此,选用阳离子交换膜的基本原则是对氯离子阻挡性要好。
REFERENCES
[1] 蔡传算, 刘荣义, 陈进中, 夏忠让. 含钴高温合金废料的综合利用学[J]. 中国有色金属学报, 1996, 6(1): 49−52.CAI Chuan-suan, LIU Rong-yi, CHEN Jin-zhong, XIA Zhong-rang. Comprehensive utilization of waste cobalt alloy[J]. The Chinese Journal of Nonferrous Metals, 1996, 6(1): 49−52.
[2] 郭海霞, 梁成浩, 穆 琦. TiNi及Co合金生物医用材料的腐蚀行为及血液相容性[J]. 中国有色金属学报, 2001, 11(S2): s272−s276.GUO Hai-xia, LIANG Cheng-hao, MU Qi. Corrosion behavior and haemocompatibility of TiNi shape memory alloy and cobalt-based alloys[J]. The Chinese Journal of Nonferrous Metals, 2001, 11(S2): s272−s276.
[3] 高禄梅, 宋晓平, 王胖胖, 杨 森. 铁钴合金纳米线有序阵列的制备及其磁性表征[J]. 西安交通大学学报, 2006, 40(10): 1139−1143.GAO Lu-mei, SONG Xiao-ping, WANG Pang-pang, YANG Sen. Synthesis and magnetic properties of FeCo alloy nanowire arrays in porous alumina template[J]. Journal of Xian Jiaotong University, 2006, 40(10): 1139−1143.
[4] 谭兴龙, 易茂中, 罗崇玲. 球形钴粉的制备及其在超细晶粒硬质合金中的应用[J]. 中国有色金属学报, 2008, 18(2): 119−124.TAN Xing-long, YI Mao-zhong, LUO Chong-ling. Preparation of spherical cobalt powder and its application in ultra-fine cemented carbides[J]. The Chinese Journal of Nonferrous Metals, 2008, 18(2): 119−124.
[5] LAKSHMINARAYANAN G R, CHEN E S, SADAK J C, SAUTTER F K. Electrodeposition of cobalt using an insoluble anode[J]. Journal of the Electrochemical Society, 1996, 123(11): 1612−1616.
[6] DAS S C, SUBBAIAH T. Electrowinning of cobalt: I. Winning from pure cobalt sulphate bath[J]. Hydrometallurgy, 1984, 12: 317−333.
[7] SHARMA I G, ALEX P, BIDAYE A C, SURI A K. Electrowinning of cobalt from sulphate solutions[J]. Hydrometallurgy, 2005, 80(1/2): 132−138.
[8] MISHRA K G, SINGH P, MUIR D M. Electrowinning of cobalt from sulphate solutions contaminated with organic impurities[J]. Hydrometallurgy, 2002, 65(2): 97−102.
[9] KONGSTEIN O E, HAARBERG G M, THONSTAD J. Current efficiency and kinetics of cobalt electrodeposition in acid chloride solutions. Part I: The influence of current density, pH and temperature[J]. Journal of Applied Electrochemistry, 2007, 37: 669−674.
[10] LI Min, WANG Zhao-wen, REDDY R G. Cobalt electrodeposition using urea and choline chloride[J]. Electrochimica Acta, 2014, 123: 325−331.
[11] KONGSTEIN O E, HAARBERG G M, THONSTAD J. Mass transfer of protons during electrodeposition of cobalt in chloride electrolytes[J]. Journal of the Electrochemical Society, 2010, 157(6): 335−340.
[12] 孟 龙, 曲景奎, 谢克强, 张培育, 韩林芯, 郭 强, 齐 涛, 张国之. 采用阴离子膜电解法从红土镍矿常压浸出液中制备金属镍[J]. 中国有色金属学报, 2015, 25(4): 1093−1102.MENG Long, QU Jing-kui, XIE Ke-qiang, ZHANG Pei-yu, HAN Lin-xin, GUO Qiang, QI Tao, ZHANG Guo-zhi. Preparation of Ni from nickel laterite leaching solution by anion membrane electrolysis method[J]. The Chinese Journal of Nonferrous Metals, 2015, 25(4): 1093−1102.
[13] FUJIMORI M, ONO N, TAMURA N, KOHGA T. Chloride electrometallurgy[M]. PARKER P D. Warrendale: The Metallurgical Society, 1982: 155−166.
[14] 王振文, 江培海, 尹 飞, 姚志超, 阮书锋. 密闭电解槽电积氯化钴生产电钴的工艺研究[J]. 有色金属(冶炼部分), 2013, 4: 8−11. WANG Zhen-wen, JIAG Pei-hai, YIN Fei, YAO Zhi-chao, RUAN Shu-feng. Study on cobalt preparation with cobalt chloride electrowining process in closed electrolytic cells[J]. Nonferrous Metals (Extractive metallurgy), 2013, 4: 8−11.
[15] 武彦斌, 王三反, 周 键, 陈 霞. 治理钴电积中氯气污染的研究进展[J]. 有色金属(冶炼部分), 2014, 9: 8−11.WU Yan-bin, WANG San-fan, ZHOU Jian, CHEN Xia. Research progress to treat chlorine pollution in cobalt electrowinning[J]. Nonferrous Metals (Extractive metallurgy), 2014, 9: 8−11.
[16] 王三反, 周 键, 王 挺, 赵红晶, 张学敏, 李乐卓. 一种膜法金属氯化物电积精炼生产方法: 中国, CN 102839389[P]. 2015−06−03.WANG San-fan, ZHOU Jian, WANG Ting, ZHAO Hong-jin, ZHANG Xue-min, LI Le-zhuo. Electrowinning of metal chlorides by the membrane electrolysis method: China, CN 102839389[P]. 2015−06−03.
[17] 王三反, 周 键, 王 挺, 赵红晶, 张学敏, 李乐卓. 一种用于金属氯化物精炼的膜电积槽: 中国, CN 202925116[P]. 2013−05−08.WANG San-fan, ZHOU Jian, WANG Ting, ZHAO Hong-jin, ZHANG Xue-min, LI Le-zhuo. Electrowinning of metal chlorides in the membrane electrolytic cell: China, CN 202925116[P]. 2013−05−08.
[18] SATA T. Studies on anion exchange membranes having permselectivity for specificanions in electrodialysis−effect of hydrophilicity of anion exchange membranes on permselectivity of anions[J]. Journal of Membrane Science, 2000, 167(1): 1−31.
[19] TANAKA Y. Mass transport and energy consumption in ion-exchange membrane electrodialysis of seawater[J]. Journal of Membrane Science, 2003, 215(1): 265−279.
[20] SHAHI V K, MAKWANA B S, THAMPY S K. Electrochemical characterization of cation exchange membrane with immobilized anionic and cationic surfactants[J]. Indian Journal of Chemistry, 1999, 38: 124−125.
[21] 孟 洪, 彭昌盛, 卢寿慈. 离子交换膜的选择透过性机理[J]. 北京科技大学学报, 2002, 24(6): 656−659.MENG Hong, PENG Chang-sheng, LU Shou-ci. Permselectivity mechanism of ion exchange membranes[J]. Journal of University of Science and Technology Beijing, 2002, 24(6): 656−659.
(编辑 王 超)
Ion transport for electrodeposition of cobalt in double-membrane three-compartment electrolytic cell
ZHOU Jian1, 2, WANG San-fan1, 2, SONG Xiao-san1, 2, ZHANG Xue-ming1, 2
(1. School of Environmental and Municipal Engineering, Lanzhou Jiaotong University, Lanzhou 730070, China;2. Engineering Research Center of Water Resource Comprehensive Utilization in Cold and Arid Regions,Ministry of Education, Lanzhou Jiaotong University, Lanzhou 730070, China)
Based on the evolution of chlorine gas at the anode in the traditional electrowinning process of cobalt chloride, the electrodeposition of cobalt was carried out in the double-membrane three-compartment electrolytic cell. The composition changes of electrolyte in three compartments were tested as function of time to study ion transport in the electrodeposition process deeply. The results show that chloride ions are able to migrate and diffuse from the catholyte to the middle solution by the electric field and concentration gradient; similarly, protons are also able to migrate and diffuse from the anolyte to the middle solution. Hence hydrochloric acid forms electrochemically up to 1mol/L, simultaneously obtaining oxygen evolution reaction instead of chlorine evolution at the anode. The production of acid is synchronized with the inhibition of chlorine evolution.
cobalt; electrodeposition; ion-exchange membrane electrolytic cell; ion transport
Project(2015BAE04B01) supported by National Science Technology Supported Program during the Twelfth Five-year Plan Period; Project(21466019) supported by the National Natural Science Foundation; Project(2015016) supported by Young Scholars Science Foundation of Lanzhou Jiaotong University, China
2015-08-24; Accepted date:2016-04-16
ZHOU Jian; Tel: +86-931-4956083; E-mail: zjwater123@sina.com
1004-0609(2016)-11-2426-07
TF803.27
A
国家“十二五”科技支撑计划课题(2015BAE04B01);国家自然科学基金资助项目(21466019);兰州交通大学青年科学基金资助项目(2015016)
2015-08-24;
2016-04-16
周 键,讲师;电话:0931-4956083;E-mail:zjwater123@sina.com
