金黄色葡萄球菌α-溶血素的克隆及可溶性融合表达①
2016-12-13徐文峰年四季叶迎春
吴 桐 徐文峰 年四季 叶迎春 袁 青
(四川医科大学基础医学院,泸州646000)
金黄色葡萄球菌α-溶血素的克隆及可溶性融合表达①
吴 桐 徐文峰 年四季 叶迎春 袁 青
(四川医科大学基础医学院,泸州646000)
目的:表达纯化可溶性金黄色葡萄球菌α-溶血素(α-HL)作为抗原,用以后期制备全人源抗α-HL抗体,为金黄色葡萄球菌感染提供新的治疗手段。方法:提取金黄色葡萄球菌总RNA,经反转录聚合酶链反应(RT-PCR)技术,扩增α-HL cDNA,将cDNA双酶切后与载体pCold-TF连接,转化E.coli TOPO 10,菌落PCR及测序验证插入基因的正确性。将测序正确的α-HL/pCold-TF重组质粒转化E.coli BL21进行低温诱导表达,SDS-PAGE和Western blot验证表达产物的正确性。结果:PCR扩增得到的α-HL基因大小为900 bp左右;将重组质粒α-HL/pCold-TF转化E.coli BL21,经15℃低温诱导表达24 h ,诱导得到可溶性的α-HL融合蛋白,融合蛋白大小为90 kD左右(载体上的TF 分子伴侣大小为45 kD左右);经Western blot 验证表达纯化的蛋白为α-HL融合蛋白。将纯化的α-HL蛋白注射BABL/c小鼠制备抗血清,结果显示抗血清与金黄色葡萄球菌结合良好,效价大于10 000倍。结论:成功对α-HL进行了基因克隆,并成功表达纯化到可溶性的α-HL融合蛋白。
金黄色葡萄球菌;α-HL;可溶性表达
金黄色葡萄球菌(Staphylococcus aureus)是人类感染性疾病的重要病原体,特别容易引发肺炎、皮肤脓肿和菌血症,感染后具有很高的死亡率。抗生素是治疗金黄色葡萄球菌感染的主要手段,长期以来是有效的。随着近年世界范围内的抗生素滥用越来越严重,金黄色葡萄球菌出现了对几乎所有抗生素耐药的菌株--耐甲氧西林金葡菌MRSA。MRSA几乎对所有β-内酰胺类抗菌药物耐药,甚至累及到红霉素、环丙沙星和庆大霉素。如果葡萄球菌属一旦对万古霉素耐药,临床将无药可用。而抗生素研究在近年发展缓慢,几乎没有新的更有效的抗生素产品问世。金黄色葡萄球菌感染特别是耐甲氧西林金葡菌MRSA的感染,已经成为世界上三大感染治疗难题之一。MRSA的感染治疗难度越来越大,甚至已经成为医源性感染的主要死因。
金黄色葡萄球菌α-溶血素(α-HL)是一种外毒素,具有良好的抗原性,已经被证明是金黄色葡萄球菌导致多种动物感染性疾病的关键毒力因子,在金黄色葡萄球菌感染特别是医源性感染中,起主要作用。针对金黄色葡萄球菌α-HL,近来的研究表明,免疫治疗的方法是有效的。但人类自身的抗体对抗α-HL的效果很微弱,而动物源性的抗体在临床上证明是很有局限性的,容易产生人抗鼠抗体反应(HAMA)[1-3]。因此,我们研究通过制备抗α-HL 的全人源单克隆抗体,以获得更好的治疗效果[1,4]。本研究首先需要表达纯化出可溶性的金黄色葡萄球菌α-HL作为抗原[5-7],为后期制备抗α-HL的全人源抗体奠定基础。
1 材料与方法
1.1 材料 金黄色葡萄球菌标准菌株购自中国科学院微生物研究所,DNA回收试剂盒购自天根生物,质粒提取试剂盒购自omega 公司,p-Cold-TF载体,Ni-NTA 亲和纯化系统、蛋白预染Marker(BenchMarkTMpre-stained protein ladder),MMLV反转录酶、Ex Taq 酶、DNA标准分子量(1 000 bp DNA ladder)、低分子量蛋白Marker 购自TaKaRa 公司。
1.2 方法
1.2.1 金黄色葡萄球菌总RNA提取和基因扩增 利用煮沸法提取金黄色葡萄球菌总RNA。液体培养基培养金黄色葡萄球菌,离心收集细菌沉淀,加入溶葡萄球菌酶,37℃温育10 min,再加入蛋白酶K,并继续于37℃温育10 min,然后煮沸10 min。迅速转移至冰浴放置1 min,离心收集上清加入等体积的氯仿,离心收集水相加入等体积的异丙醇,大力振荡后离心。沉淀用70%乙醇洗涤两次,离心后在空气中干燥,并溶解于25 μl RNase-free水中。
RT-PCR扩增金黄色葡萄球菌α-HL cDNA。从NCBI 基因数据库中下载金黄色葡萄球菌α-HL基因序列,根据基因序列设计引物,采用巢氏PCR扩增α-HL(表1)。取 α-HL cDNA 2 μl 作为模板,采用引物对α-HL F1-Forword/α-HL R1-Reverse进行第一次PCR扩增。取第一次PCR产物为模板,进行第二次PCR扩增,引物对为α-HL F2-XhoⅠ/α-HL R2-EcoRⅠ。PCR程序为:94℃ 30 s,50℃ 30 s,72℃ 1 min,30个循环,然后72℃ 10 min。
1.2.2 金黄色葡萄球菌α-HL的克隆 将金黄色葡萄球菌α-HL PCR扩增产物进行DNA回收,用限制性内切酶XhoⅠ和 EcoRⅠ双酶切α-HL,回收DNA和载体质粒pCold TF DNA。将酶切产物用T4连接酶连接转化E.coli TOPO 10,将转化菌涂于含氨苄青霉素的LB(LBA)平板,37℃培养过夜,次日挑取单菌落进行菌落PCR鉴定。鉴定的阳性克隆子提取质粒,送公司测序验证。将测序正确的α-HL/p-Cold TF阳性重组质粒转化E.coli BL21,涂LBA平板过夜培养,次日挑取单菌落,PCR及测序验证质粒插入序列的正确性。
1.2.3 金黄色葡萄球菌α-HL的表达纯化 接种转化有α-HL/p-Cold TF阳性重组质粒的E.coli BL21于LBA培养基中,37℃振荡培养至OD600=0.4~0.5,立即将培养液移至15℃放置30 min,加入终浓度1 mmol/L 的IPTG,15℃振荡培养24 h。离心取细菌沉淀,通过4种不同的裂解方法使得细菌裂解,再将裂解的沉淀和上清分别上样进行SDS-PAGE电泳,鉴定融合蛋白的可溶性。4种不同的裂解方法分别为:① 取5 ml 表达细菌沉淀,加入500 μl天然蛋白Lysis buffer(配方参见Ni-NTA 亲和纯化系统说明书)重悬,反复冻融3~5次,离心分别取上清和沉淀备用;② 取5 ml 表达细菌沉淀,加入500 μl天然蛋白Lysis buffer重悬,加入溶菌酶,冰上摇动30 min,再反复冻融3~5次,离心分别取上清和沉淀备用;③ 取5 ml 表达细菌沉淀,加入500 μl 1×PBS重悬,反复冻融3~5次,离心分别取上清和沉淀备用;④ 取5 ml 表达细菌沉淀,加入500 μl 1×PBS重悬,加入溶菌酶,冰上摇动30 min,再反复冻融3~5次,离心分别取上清和沉淀备用。
按Invitrogen公司的Ni-NTA 亲和纯化系统说明书对表达的可溶性蛋白进行天然纯化,并进行SDS-PAGE和Western blot鉴定。鉴定表达、纯化的蛋白采用抗His-tag单克隆抗体(GE Healthcare,来源于小鼠)和羊抗小鼠(IgG)辣根过氧化物酶标记抗体(Promega,USA)进行检测,最后加入化学发光剂(Lu minata Crescendo Western HRP substrate,USA)显色。
1.2.4 α-HL多克隆抗体的制备及效价测定 将纯化的α-HL蛋白100 μg与弗氏完全佐剂混合,皮下注射BABL/c小鼠,间隔2周后,用50 μg α-HL蛋白与弗氏不完全佐剂混合后皮下注射BABL/c小鼠2次,每次中间间隔2周。末次注射后,心脏采血,离心取血清于4℃保存。
用包被液(0.1 mol/L NaHCO3/Na2CO3溶液)稀释金黄色葡萄球菌为1×107CFU/ml,包被酶联板4℃过夜,次日加入封闭液(1×PBST含5%脱脂奶粉),37℃保湿温育1 h。加入封闭液×100、×1 000、×10 000稀释的α-HL抗血清,每孔100 μl,37℃封闭1 h;洗涤酶联板后,加入羊抗鼠HRP(1∶5 000)抗体,37℃保湿温育1 h;洗涤后加入TMB底物溶液避光显色,30 min后加入2 mol/L H2SO4终止反应,酶标仪OD450读数。
表1 用于扩增金黄色葡萄球菌α-HL cDNA的引物对
Tab.1 Primer used for amplification of S.aureus α-HL cDNA
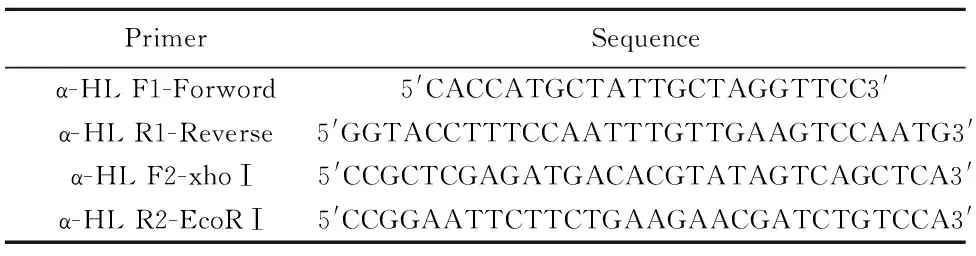
PrimerSequenceα-HLF1-Forword5'CACCATGCTATTGCTAGGTTCC3'α-HLR1-Reverse5'GGTACCTTTCCAATTTGTTGAAGTCCAATG3'α-HLF2-xhoⅠ5'CCGCTCGAGATGACACGTATAGTCAGCTCA3'α-HLR2-EcoRⅠ5'CCGGAATTCTTCTGAAGAACGATCTGTCCA3'
2 结果
2.1 金黄色葡萄球菌总RNA的提取与α-HL基因的扩增 提取金黄色葡萄球菌总RNA时,采用了传统的酚/氯仿抽提法、天根生物的总RNA提取试剂盒及本研究方法中使用的煮沸法。结果发现前两种方法提取的总RNA浓度和质量都较低,不能满足后续RT-PCR的要求,可能由于金黄色葡萄球菌细胞壁厚而坚固,导致破壁不完全。而煮沸法采用溶葡萄球菌酶使金黄色葡萄球菌破壁完全,释放总RNA,从而得到质量较高且完整的RNA,浓度为912.05 ng/μl ,采用0.8% 琼脂糖电泳结果发现,总RNA的3条带(28S、18S、5S)条带清晰,说明总RNA提取率高,并且降解少。
以总RNA为模板,Oliga dT15 为引物反转录得到cDNA。在进行PCR扩增α-HL基因片段时,采用了巢氏PCR,分两次扩增,其中第二次扩增时在引物上加入了xhoⅠ和 EcoRⅠ限制性内切酶位点,最终得到了大小为900 bp 左右的金黄色葡萄球菌α-HL基因片段(图1)。

图1 PCR扩增α-HL cDNA Fig.1 Identification of amplified α-HL cDNA by PCRNote: M.DNA marker 1 000 bp;Line 3.α-HL cDNA.
2.2 金黄色葡萄球菌α-HL基因的克隆与表达 由于表达菌株E.coli BL21转化效率低,所以将金黄色葡萄球菌α-HL和pCold-TF重组质粒双酶切并连接后,首先转化E.coli TOPO 10菌株,PCR及测序验证插入序列正确后,将重组质粒α-HL/p-Cold TF转化E.coli BL21并进行表达。pCold TF是插入蛋白可溶性标签的融合型冷休克表达载体,采用低温诱导的方法,使大肠杆菌自身的蛋白质合成受到抑制、目的蛋白质获得高效表达。pCold TF载体在His tag序列和多克隆位点之间插入了Trigger Factor(TF)基因,可与目的蛋白质进行融合表达,提高目的蛋白的可溶性。
在进行金黄色葡萄球菌α-HL表达时,在15℃诱导表达了24 h,为了验证目的蛋白的可溶性,收集表达的细菌沉淀,分别用方法中所述4种方法对细菌沉淀进行裂解,再离心分别取上清和沉淀进行SDS-PAGE电泳。结果显示:4种方法中采用的Lysis buffer 和PBS中都不含有蛋白变性剂,为天然蛋白缓冲液,将表达的细菌沉淀用反复冻融或加入溶菌酶后反复冻融的方式使细菌裂解,离心后SDS-PAGE电泳结果显示4种方法都能够有效的裂解表达细菌,从而使目的可溶性蛋白有效的释放出来,所以细菌裂解上清中都有目的融合蛋白出现,大小为90 kD 左右(载体上的TF 分子伴侣大小为45 kD左右),而裂解离心后的细菌碎片沉淀中并没有出现目的蛋白。说明表达的蛋白为可溶性蛋白,并且表达量高,达到了2 mg/100 ml 左右(图2)。
2.3 金黄色葡萄球菌α-HL 的纯化及鉴定 由于pCold-TF载体上带有His-tag标签,对表达的可溶性蛋白Ni-NTA亲和纯化系统中天然蛋白纯化条件进行纯化。纯化后的蛋白用SDS-PAGE进行了鉴定(图3),结果显示在90 kD处出现了目的蛋白条带。由于是将表达细菌进行裂解,细菌的蛋白也同时释放到缓冲液中。Ni-NTA亲和纯化系统在进行纯化时,对细菌蛋白也有一些非特异性的吸附,所以导致纯化时出现了微弱的非特性条带。为了验证在90 kD出现的条带为α-HL,对表达的蛋白进行了Western blot验证,结果显示在90 kD处出现了单一条带,说明表达纯化的可溶性蛋白为α-HL融合蛋白(图4)。
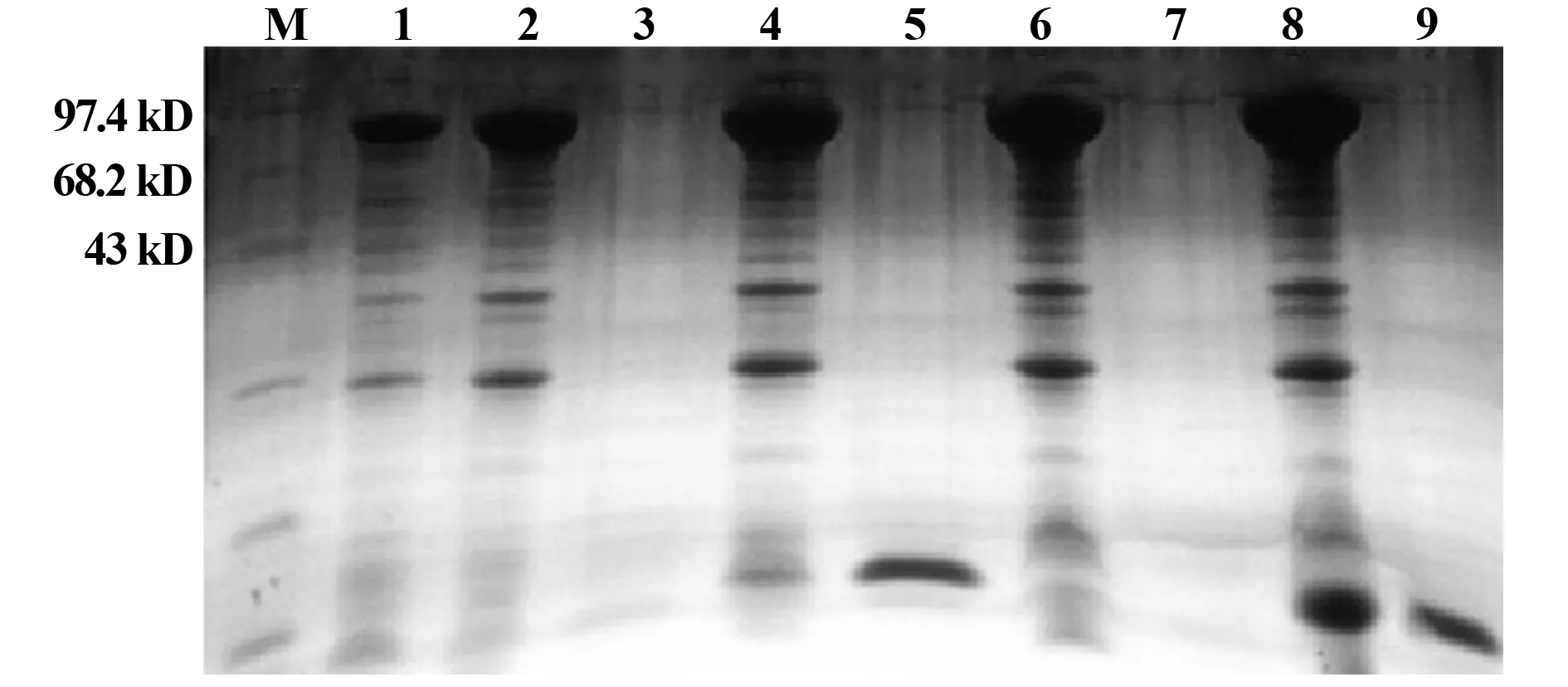
图2 SDS-PAGE电泳α-HL融合蛋白可溶性验证Fig.2 Analysis solubility of α-HL recombinant protein by SDS-PAGENote: M.Protein molecular weight marker;Line 1.Positive control;Line 2,4,6,8.Supernatant of lysised sample by method ①,②,③,④;Line 3,5,7,9.Precipitation of lysised sample from method ①,②,③,④.

图3 SDS-PAGE分析纯化的α-HL融合蛋白Fig.3 Analysis of purified α-HL protein by SDS PAGENote: M.Protein molecular weight marker;Line 1-3.Expressed protein of α-HL.

图4 α-HL 纯化蛋白Western blot 验证印迹Fig.4 Analysis of expressed α-HL protein by Wes-tern blot

图5 α-HL多克隆抗体ELISA效价测定Fig.5 α-HL polyclonal antibody ELISA titer determination
2.4 抗金黄色葡萄球菌α-HL抗血清制备及效价测定 为了验证表达纯化的α-HL融合蛋白具有生物学活性,将纯化的金黄色葡萄球菌α-HL分3次皮下注射BABL/c小鼠,取血清进行ELISA检测其抗血清效价。为了验证所制备的抗血清是针对金黄色葡萄球菌α-HL,在进行ELISA检测时,将金黄色葡萄球菌包被酶标板,结果显示制备的抗血清能与金黄色葡萄球菌良好结合,其抗血清效价>10 000倍(图5),说明表达纯化的α-HL融合蛋白是具有生物学活性的。
3 讨论
金黄色葡萄球菌是一种人类的主要病原菌,可造成危及生命的侵袭性感染,如肺炎、皮肤脓肿及菌血症、心内膜炎等。随着全球范围内的抗生素滥用,出现了几乎对所有抗生素(除万古霉素)耐药的金葡菌MRSA。近年抗生素的研究滞后,使得金黄色葡萄球菌感染的治疗越来越困难。研究发现,在健康人、金黄色葡萄球菌携带者和感染者的血清中,都检测到有金葡菌的抗体,但此抗体的抗感染保护作用还存有很大争议。
金黄色葡萄球菌α-HL是金黄色葡萄球菌的主要毒力因子,在感染中发挥主要作用。近来的研究发现,通过免疫治疗的方法,以α-HL作为抗原,制备全人源的抗α-HL抗体,在小鼠肺炎模型中,可以显著提高小鼠的存活率;在小鼠皮肤脓肿模型中,可以有效减小脓肿病灶并且使单位感染面积的细菌量显著降低;在小鼠菌血症模型中,小鼠的存活率也几乎增大一倍[1]。因此,抗金黄色葡萄球菌α-HL全人源抗体药物的开发,具有极大临床应用潜力。本研究提取金黄色葡萄球菌总RNA,扩增克隆α-HL cDNA,从而表达可溶性的α-HL。金黄色葡萄球菌细胞壁厚而坚固,裂解困难,RNA降解速度快,提取完整的总RNA不容易。通过查阅国内外相关文献,对各种提取方法进行实验比较,发现基于溶葡萄球菌酶的煮沸法是最好的提取方法,此法成功提取到高质量的完整金葡菌总RNA。采用pCold-TF载体在E.coli BL21中对α-HL进行可溶性表达。大肠杆菌表达系统是目前研究最为深入,发展最迅速的原核表达系统。大肠杆菌不仅在遗传学背景、基因表达调控机理方面的研究非常清晰,而且拥有多种适应不同表达的载体和宿主菌,但其缺点是表达的蛋白大部分为没有生物学活性的包涵体。本研究采用pCold-TF表达载体在低温条件下诱导表达的α-HL可溶性融合蛋白,将α-HL可溶性融合蛋白注射BABL/c小鼠,得到的抗血清可与金黄色葡萄球菌良好结合,说明诱导表达的α-HL具有生物学活性[8]。采用pCold-TF表达系统表达的α-HL产量高,可达到2 mg/100 ml,可满足后续全人源抗α-HL抗体的筛选。由于表达的α-HL为融合蛋白,带有TF标签,在后续作为抗原进行抗α-HL抗体的筛选时,为避免非特异性筛选,需用Factor Xa 将TF标签切除后再使用。
[1] Foletti D,Strop P,Shaughnessy L,etal.Mechanism of action and in vivo efficacy of a human-derived antibody against Staphylococcus aureus α-hemolysin[J].J Mol Biol,2013,425(10):1641-1654.[2] Stulik L,Malafa S,Hudcova J,etal:α-Hemolysin activity of methicillin-susceptible Staphylococcus aureus predicts ventilator-associated pneumonia[J].Am J Respir Crit Care Med,2014 Nov 15;190(10):1139-1148.
[3] Mocca CP,Brady RA,Burns DL.Role of antibodies in protection elicited by active vaccination with genetically inactivated alpha hemolysin in a mouse model of staphylococcus aureus skin and soft tissue infections[J].Clin Vaccine Immunol,2014,21(5):622-627.
[4] Rouha H,Badarau A,Visram ZC,etal.Five birds,one stone:neutralization of α-hemolysin and 4 bi-component leukocidins of Staphylococcus aureus with a single human monoclonal antibody[J].MAbs,2015,7(1):243-254.
[5] 张善瑞,赵宏坤,杨宏军,等.金黄色葡萄球菌α溶血素的原核表达及其生物活性分析[J].农业生物技术学报,2007,4(4):727-728.
[6] 袁 萍,王 晓,吴根鹏,等.金黄色葡萄球菌α-溶血素及其突变体的原核表达和免疫学活性[J].中国生物制品学杂志,2014,27(11):1400-1403,1411.
[7] 李闰婷,朱战波,崔玉东.金黄色葡萄球菌α-溶血素基因表达及溶血活性检测[J].中国人兽共患病学报,2009,25(3):229-233.
[8] 胡卓杰.儿童金黄色葡萄球菌感染的免疫-血清学研究[J].免疫学杂志,2014,6(6):532-535.
[收稿2015-09-15 修回2015-11-24]
(编辑 倪 鹏)
Clone and soluble fusion expression of α-HL of Staphylococcus aureus
WU Tong,XU Wen-Feng,NIAN Si-Ji,YE Ying-Chun,YUAN Qing.The School of Basic Medical Sciences,Sichuan Medical University,Luzhou 646000,China
Objective:Expression and purification of the α-HL of Staphylococcus aureus as antigen for making full human anti-α-HL antibody later,providing of new treatment for Staphylococcus aureus infection.Methods: The total RNA of Staphylococcus aureus was extracted and the cDNA of α-HL was amplified by RT-PCR.The DNA of α-HL and pCold-TF plasmid was digested and ligated by T4 ligase and then transformed into E.coli TOPO 10.The recombinant plasmid α-HL/pCold-TF which verified by sequencing was transformed into E.coli BL21 for expression.The expression products was identified by SDS-PAGE and Western blot.Results: The size of amplified cDNA of α-HL was about 900 bp and the expressed soluble fusion protein of α-HL was about 90 kD(including the molecular chaperone in the vector) after inducing expression for 24 h at 15℃.The Western blot results showed that the expressed protein was the fusion protein of α-HL.The purified α-HL was injected into BABL/c mice for making antiserum.The results showed that the antiserum had good binding activity with Staphylococcus aureus and the titer was greater than 10 000 times.Conclusion: The α-HL of Staphylococcus aureus was successfully cloned and the soluble fusion protein of α-HL was successfully expressed.
Staphylococcus aureus;α-HL;Soluble expression
10.3969/j.issn.1000-484X.2016.04.018
吴 桐(1982年-),男,助理实验师,主要从事感染免疫学研究。
及指导教师:袁 青(1978年-),女,博士,教授,主要从事重组抗体方面研究,E-mail:yuanqing_ok@hotmail.com。
R392.11
A
1000-484X(2016)04-0532-05
①本文为四川省科技厅项目(LY-96,013SZZ005)和泸州市科技局项目(2013LZLY-K77)。