碳质材料和溶解性有机质对沉积物中全氟化合物在摇蚊幼虫体内富集的影响
2016-12-12文武夏星辉陈曦翟亚威林慧
文武,夏星辉,陈曦,翟亚威,林慧
北京师范大学 环境学院水环境模拟国家重点实验室, 北京 100875
碳质材料和溶解性有机质对沉积物中全氟化合物在摇蚊幼虫体内富集的影响
文武,夏星辉*,陈曦,翟亚威,林慧
北京师范大学 环境学院水环境模拟国家重点实验室, 北京 100875
全氟化合物(PFASs)是一类具有疏水基团和亲水基团的新型污染物.目前,在环境条件对PFASs生物富集影响方面已开展了诸多研究,但有关碳质材料(CMs)和溶解性有机质(DOM)共存对PFASs在生物体内富集的影响还未见报道。为探讨这一问题,研究了沉积物-水体系中2种碳质材料木炭(W400)、多壁碳纳米管(MWCNT10)和4种DOM(丹宁酸、富里酸、蛋白胨和腐殖酸)对6种典型PFASs在摇蚊幼虫体内生物富集的影响。结果表明,暴露10 d后(已达到富集平衡状态),无论体系中是否存在CMs,添加1~50 mg C·L-1不同类型的DOM对PFASs在摇蚊幼虫体内生物富集的影响不显著。无论体系中是否存在DOM,添加CMs均能降低摇蚊幼虫体内PFASs的含量,且MWCNT10对PFASs生物富集的降低比例显著高于W400。与对照相比,添加0.4%的MWCNT10对摇蚊幼虫体内PFASs含量的降低比例为21%~56%,而同等添加量的W400对其降低比例均低于20%。这表明,在沉积物-水体系中,当CMs和DOM共存时,CMs是影响PFASs在摇蚊幼虫体内富集的主要因素,而少量DOM的引入对其影响不大。
全氟化合物;碳质材料;溶解性有机质;摇蚊幼虫;生物富集;多壁碳纳米管
全氟化合物(PFASs)是一类含有疏水性碳氟链和亲水性官能团(如羧基和磺酸基)的阴离子表面活性剂。由于其特殊的理化性质,被广泛应用于生产和生活的各个领域,如纺织、皮革、地毯等[1-2]。但是对PFASs的毒理效应研究表明,部分PFASs对生物具有肝脏毒性、免疫毒性、生殖和发育毒性、内分泌干扰效应以及致畸性等[3-6]。由于碳氟键具有很高的键能,PFASs在环境中具有良好的稳定性,很难被生物降解,因此能长期存在于环境中[7]。通过对环境样品的分析发现,以PFOS为代表的PFASs广泛存在于各种环境介质,如地表水、沉积物、水生生物、哺乳动物[8-9],甚至在人体血清中也有检出[10]。实验室生物活体暴露和野外样品调查认为,PFASs能够被多种生物富集[2, 11-12],并在食物链(网)上放大[13-15],使其生物富集系数随着营养级升高而增大[16]。PFASs在水生生物体内的富集受多种因素的影响,包括PFASs的性质、生物种类、以及水体的理化性质(如溶解性有机质(DOM)、盐度等)[13, 17-18]。
土壤和沉积物被认为是疏水性有机污染物(HOCs)的主要蓄积库。以多环芳烃(PAHs)和有机氯农药为代表的HOCs易于与水体中的悬浮颗粒物和沉积物结合[19]。与此类似,具有疏水性碳氟链的PFASs也同样容易被水体中的沉积物吸附[20];PFASs在沉积物和水之间的分配系数与沉积物中的总有机碳含量有关[21]。研究发现,碳质材料(CMs)对水体中的PFASs具有较强吸附作用,且不同来源的CMs对PFASs的吸附能力不同[22]。由于CMs的吸附作用,导致水中PFASs溶解态浓度降低,从而影响其在生物体内的富集[23]。
DOM是一种天然水体中普遍存在的、结构和组成复杂的、不均匀的有机混合物,它由不同分子量的芳香族和脂肪族有机物组成,既含有蛋白质、腐殖酸、多酚等大分子成分,也含有游离的氨基酸等小分子成分[24-25]。天然水体中DOM的含量有时高达50 mg C·L-1[26]。已有研究表明,DOM对HOCs在生物体内的富集有重要影响,HOCs能与DOM结合而难以被生物利用,并使水体中HOCs的自由溶解态浓度降低,从而降低生物体对HOCs的富集[27-28]。也有一部分研究者认为,在浓度低于10 mg C·L-1时,DOM能促进水生生物对HOCs的富集[29]。对于既具有疏水性官能团又具有亲水性官能团的PFASs,DOM对其在生物体富集的影响与HOCs相似[26, 30]。Xia等[26]研究了不同浓度腐殖酸(HA)、富里酸(FA)、蛋白胨(PEP)、鸡蛋清蛋白对大型蚤体内PFASs富集的影响,发现当DOM含量为1 mg C·L-1时,大型蚤体内的PFASs含量有所提高;但当DOM浓度为20 mg C·L-1时,大型蚤体内的PFASs含量降低了1%~77%。
可见,目前已有关于CMs或DOM对PFASs在生物体内富集影响的报道,但这些研究都是考察单独CMs或DOM的影响,而有关两者共同存在对PFASs在生物体内富集影响的研究还未见报道。因此,本文研究了2种CMs和4种不同类型不同浓度的DOM单独存在和共存时对沉积物中6种典型PFASs在摇蚊幼虫体内富集的影响及其机制,以期为评价PFASs在水环境中的生物有效性提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
用于生物富集的6种全氟化合物:全氟辛酸(PFOA,96%)、全氟壬酸(PFNA,97%)、全氟癸酸(PFDA,98%)、全氟十一酸(PFUnA,95%)和全氟十二酸(PFDoA,95%)购自美国Acros Organics公司;全氟辛烷磺酸钾(PFOS,98%)购自日本东京化工。每种PFAS储备液的浓度为1 000 mg·L-1(甲醇溶液)。使用前用甲醇将其配制成每种PFAS浓度为20 mg·L-1的混合使用液。回收率指示物[1,2,3,4-13C4]全氟辛烷磺酸钾(MPFOS) (99%)和[1,2,3,4-13C4]全氟辛酸(MPFOA)(99%)购自加拿大Wellington公司。用于摇蚊组织中PFASs萃取的甲基叔丁基醚(MTBE,99.5%)和四丁基硫酸氢铵(TBA)(99%)购自美国Sigma-Aldrich公司;色谱纯甲醇购自美国J.T. Baker公司。
丹宁酸(TA)(分析纯)、FA(95%)、PEP(分析纯)和HA(98%)分别购自美国Acros Organics公司、河南昌盛公司、北京奥博星公司和德国Aldrich公司。TA、FA、PEP和HA储备液浓度为200 mg C·L-1,其中HA储备液的配制方法如下:将购买的HA溶于pH=12的氢氧化钠水溶液中[32],充分震荡后放置过夜,用0.45 μm尼龙滤膜过滤去除不溶解的颗粒。然后用总有机碳(TOC)测定仪TOC-L CPH/CPN(日本岛津公司)测定其TOC含量。根据测定结果,用去离子水将HA溶解至200 mg C·L-1,同时用稀盐酸调节HA储备液pH至7.0。所有DOM储备液避光保存于4 ℃冰箱中。使用前从冰箱中取出,恢复至室温后,将每种DOM溶液用去离子水稀释为1、5、50 mg C·L-1的使用液。
沉积物采集于永定河上游。采集的沉积物风干、磨碎后过2 mm尼龙筛,去除大颗粒的碎石和动植物残体。沉积物中的TOC和炭黑(BC)含量用元素分析仪(德国Elementar Analysensyteme 公司)测定[33],其中TOC含量为2.18%,BC含量为0.23%。沉积物中PFASs含量低于检出限。碳质材料(CMs)包括木炭(W400)和多壁碳纳米管(MWCNT10)。MWCNT10购自北京纳辰公司,W400通过柳树(Salix babylonica)木屑热解获得[34-35]。其热解过程为,将柳树木屑置于陶瓷坩埚中,加盖后置于预热至400 ℃的马弗炉中,在400 ℃下保持2 h。W400和MWCNT10的基本性质见表1。
1.2 实验设计
称量经过预处理的沉积物200 g置于一系列500 mL的聚丙烯(PP)烧杯中,然后向烧杯中加入配制好的PFASs甲醇溶液,使每种PFAS的含量为0.1 mg·kg-1。将烧杯置于通风橱中,待甲醇溶液完全挥发后将每个烧杯中的沉积物充分混匀。将烧杯分成3组,向A组烧杯中加入W400,B组烧杯中加入MWCNT10,使每种CMs含量为0.4%,C组中不加入任何的CMs。将所有烧杯用搅拌器在60 r·min-1转速下搅拌24 h,以使添加的材料与沉积物充分混匀。然后,将TA、FA、PEP以及HA使用液溶液各300 mL分别加入到每个烧杯,使每种DOM的添加浓度为0、1、5和50 mg C·L-1(每个烧杯中只加入1种DOM),每个浓度水平有3重复。以未加入PFASs的的烧杯作为空白,所有操作与其他烧杯完全相同。将所有烧杯密封,于25 ℃下避光老化60 d。老化结束后,向每个烧杯中加入20条(300~350 mg)在实验室驯化2 d的雄性摇蚊幼虫。经10 d的生物富集实验[23]后,将摇蚊幼虫从暴露体系中取出,用去离子水小心冲洗干净后用滤纸吸干表面水分,称量湿重。然后置于PP离心管中冷冻干燥48 h后称量干重,充分磨细后用于摇蚊幼虫体内的PFAS含量分析。生物富集实验条件为:光照周期16:8(白:夜);温度(25±1) ℃;溶解氧5.5~5.7 mg·L-1;pH 7.6~7.7;实验全程不喂食摇蚊幼虫。
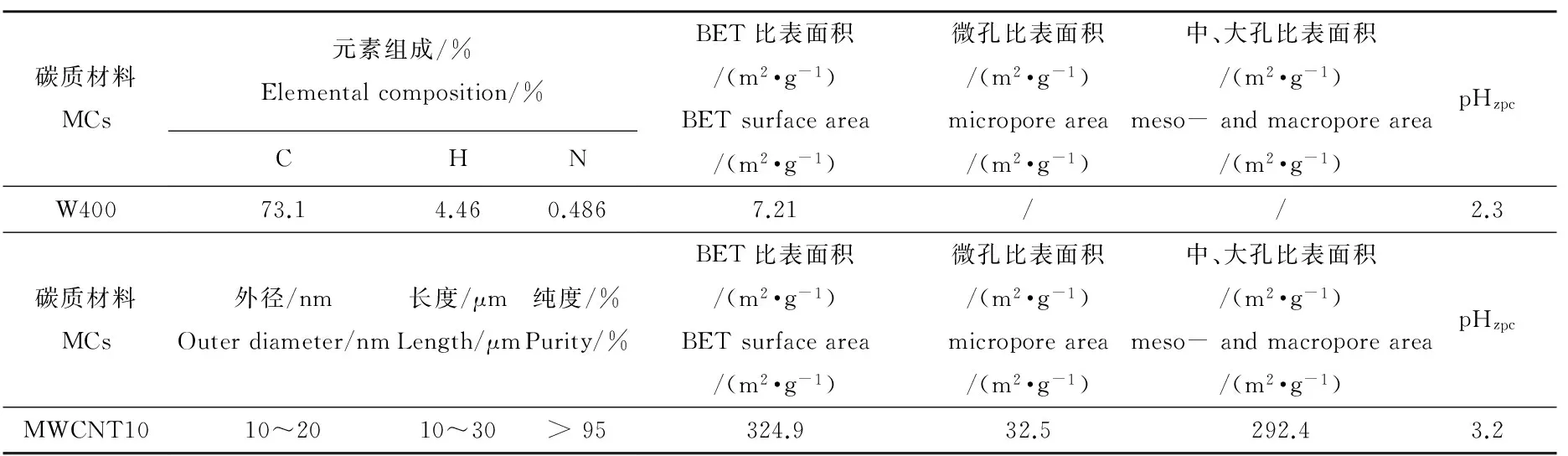
表1 W400和MWCNT10的基本性质
1.3 摇蚊幼虫组织中PFASs的萃取
采用离子对法[2, 36]萃取摇蚊幼虫体内PFASs:将磨细的摇蚊幼虫样品置于10 mL PP离心管中,加入回收率指示剂MPFOA和 MPFOS各10 ng;再加入0.25 mL 0.5 mol·L-1的TBA溶液(pH=10)、1 mL 0.25 mol·L-1的碳酸钠溶液(pH=10)和2.5 mL MTBE,充分摇匀后于25 ℃、250 r·min-1震荡30 min;然后于4 000 r·min-1离心15 min,将有机层转移至另一干净的15 mL PP离心管。然后再加入2.5 mL MTBE,重复上述操作2次,将收集到的有机萃取液收集至同一支15 mL PP离心管,涡旋混匀。用氮气慢速将有机溶剂吹至近干,用甲醇定容至1 mL,用0.2 μm 尼龙滤膜过滤至2 mL PP材质的自动进样瓶,然后上机测定PFAS含量。
1.4 仪器分析方法
样品中PFASs的含量用液相色谱-电喷雾负电离子源串联质谱(LC-MS/MS,Dionex Ultimate 3000-API 3200)测定。C18色谱柱(美国Waters公司)参数为4.6 mm×150 mm×5 μm。流动相A为5 mmol·L-1乙酸铵溶液,B为甲醇;流动相流速1 mL·min-1;梯度淋洗程序:70%流动相B保持1 min,然后在4 min内从70%上升至95%,保持3 min,在3 min内从95%降低至70%。检测方式为多反应监测(MRM),PFASs的质谱参数与之前报道相同[23]。进样体积10 μL。
1.5 质量保证及数据处理
为避免玻璃材质器皿对PFASs的吸附以及其他含氟材料对实验的干扰,实验所用到的烧杯、离心管、样品瓶等器皿均为PP材质,使用前用甲醇润洗3次。每种PFAS的检出限按3倍信噪比(S/N=3)计算、定量限按10倍信噪比(S/N=10)计算,水样中PFASs 的定量限为0.01~0.058 μg·L-1,摇蚊幼虫组织中PFAS的定量限为0.25~0.75 ng·g-1。空白水样、沉积物和摇蚊幼虫组织中PFASs含量均低于检出限。每个样品中的PFASs含量用外标法定量。每种PFAS的标准曲线相关系数均高于0.99。为了保证目标化合物的萃取效率,对所有PFASs和回收率指示物进行加标回收率实验,PFOA、PFOS、PFNA、PFDA、PFUnA和PFDoA的回收率依次为96%、96%、91%、90%、87%和91%,回收率指示物MPFOA和MPFOS的回收率分别为95%和96%。在样品检测过程中,每10个样品后加入1个溶剂空白和1个标准液。使用溶剂空白以检测仪器的背景值,使用标准液以监视标准曲线的有效性。当标准液测定值与理论值的偏差超过±20%时,重新绘制标准曲线。所有有关PFASs在摇蚊幼虫体内含量的数据均基于摇蚊幼虫干重计算得到,表示方式为平均值±标准偏差。所有数据用SPSS 18.0和微软Excel 2013进行统计分析。用单因素方差分析比较两组数据间差异的显著性。
2 结果(Results)
2.1 未添加CMs时DOM对PFASs在摇蚊幼虫体内富集的影响
当摇蚊幼虫暴露于不添加CMs的沉积物-水体系中时,不同类型、不同浓度的DOM对PFASs在摇蚊幼虫体内富集的影响如图1所示。在沉积物-水体系中,DOM的类型和添加浓度对摇蚊幼虫体内PFASs的含量都无显著影响。例如,在PEP、HA的添加浓度为1、5和50 mg C·L-1时,与未添加PEP和HA的对照相比,摇蚊幼虫体内的PFOS含量降低比例均低于4%。在所有处理中,含有8个氟代碳原子的PFOS在摇蚊幼虫体内的含量最高,为(1 614±137) ng·g-1,含有7个氟代碳原子的PFOA含量最低,为(487±67) ng·g-1;虽然PFNA与PFOS都有8个氟代碳原子,但PFNA含量(979±75) ng·g-1显著低于PFOS含量。
2.2 未添加DOM时CMs对PFASs在摇蚊幼虫体内富集的影响
在未添加DOM的条件下,沉积物中添加0.4%W400和0.4%MWCNT10对PFASs在摇蚊幼虫的影响如图2所示。与对照(未添加CMs)相比,添加CMs时,摇蚊幼虫体内的6种PFASs含量均有不同程度的降低。与对照相比,添加量为0.4%的MWCNT10对摇蚊幼虫体内PFASs含量的降低比例为28%~51%,而同等添加量的W400对其降低比例均低于16%。与对照相比,添加0.4%的MWCNT10时,随PFASs(PFOS除外)氟代碳原子数增加,摇蚊幼虫体内的PFASs含量降低比例随PFASs(PFOS除外)氟代碳原子数增加而增加。如氟代碳原子数为7和10的PFOA和PFUnA在摇蚊幼虫体内的含量分别降低了28%和37%。与前面2.1的结果相似,PFOS在摇蚊幼虫体内的富集量最高,而碳氟链最短的PFOA生物富集量最低。例如,经0.4%MWCNT10处理的暴露体系中,摇蚊幼虫体内的PFOS含量为(1 161±21) ng·g-1,而氟代碳原子数为11的PFDoA的含量仅为(350±14) ng·g-1。
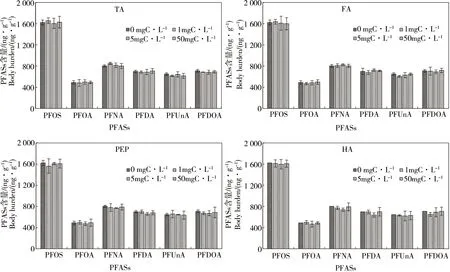
图1 未添加CMs时DOM对PFASs在摇蚊幼虫体内富集的影响Fig. 1 Effects of DOM on body burden of PFASs in the absence of CMs in Chironomus plumosus larvae
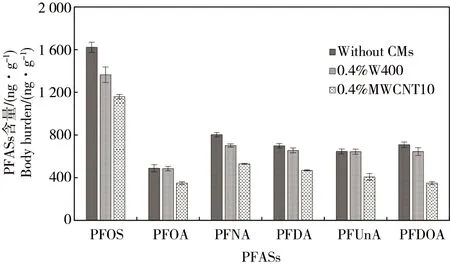
图2 未添加DOM时2种CMs对PFASs在摇蚊幼虫体内富集的影响Fig. 2 Effects of CMs on body burden of PFASs in the absence of DOM in Chironomus plumosus larvae
2.3 DOM和CMs共存对PFASs在摇蚊体幼虫内富集的影响
不同类型和浓度的DOM与0.4%的CMs共存时对PFASs在摇蚊体内富集的影响如图3所示。与对照(未添加CMs和DOM)相比,DOM和CMs共存时,PFASs在摇蚊幼虫体内的含量均有所降低。与对照相比,添加量为0.4%的MWCNT10对摇蚊幼虫体内PFASs含量的降低比例为21%~56%,而同等添加量的W400对其降低比例均低于20%。但是随着DOM浓度的增加,PFASs在摇蚊幼虫体内的含量并无明显变化。例如,当HA的浓度为1和50 mg·L-1时,与对照相比,摇蚊幼虫体内PFDoA含量的降低比例分别为51%和50%,即CMs的加入是导致PFASs在摇蚊幼虫体内含量变化的主要因素,DOM的类型和浓度对其影响不明显。在暴露体系中,无论是否加添加DOM和CMs,摇蚊幼虫体内的PFOS含量最高,PFOA含量最低。
3 讨论(Discussion)
DOM对有机污染物在生物体内富集的影响受4个方面的制约,包括有机污染物的性质、DOM的浓度、DOM的性质以及水体的理化性质。在地表水体中,前3个方面是关键因子[37]。对于传统的HOCs(如PAHs),DOM的浓度越高、分子量或芳香度越高,其对有机物的吸附能力越强,从而使有机污染物的生物有效性越低、在生物体内的富集能力越低[37-39]。与传统的HOCs相似,PFASs也具有疏水性的碳氟链。因此,DOM的浓度和类型对PFASs在生物体内的富集也有重要影响。Xia等[26]研究发现,在水体系中,当HA和鸡蛋清蛋白的添加量为1 mg C·L-1时,大型蚤体内的PFASs(C8~C12)含量都有所提高;当FA、HA、PEP和鸡蛋清蛋白添加量为20 mg C·L-1时,大型蚤体内的PFASs含量都有所降低,且PEP对大型蚤体内PFASs含量的降低比例显著高于其他DOM。而图1和图3表明,在沉积物-水体系中,无论是否添加CMs,添加的DOM类型和浓度对摇蚊幼虫体内PFASs的含量均无显著影响。这是因为DOM加入到沉积物-水体系后:一方面,DOM会与PFASs在沉积物(和CMs)上发生竞争吸附作用,使水相中的PFASs浓度升高[23];另一方面,水相中的DOM与PFASs结合,降低PFASs的自由溶解态浓度[26]。由于这两个方面的相反作用,可能导致DOM对摇蚊幼虫体内PFASs生物富集的影响不显著。计算暴露体系中的碳(C)含量发现,DOM的加入量最大为50 mg C·L-1,相当于每个烧杯中通过DOM加入的C最多为15 mg;通过W400和MWCNT10(分别0.4%)添加的C分别为0.59和0.76 g。可见,在暴露体系中DOM的加入量远小于CMs的添加量,这也可能是DOM对摇蚊幼虫体内PFASs生物富集影响不显著的因素之一。
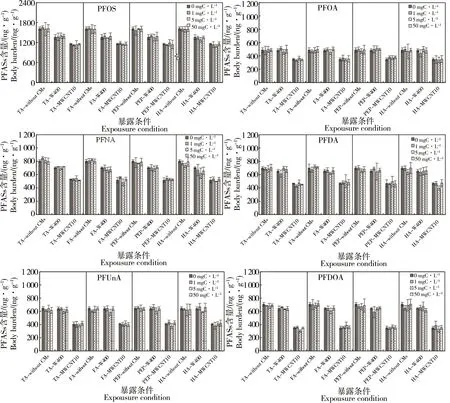
图3 不同类型和浓度的DOM与0.4%的CMs共存对PFASs在摇蚊体内富集的影响Fig. 3 Co-effects of different types and concentrations of DOM and 0.4% CMs on body burden of PFASs in Chironomus plumosus larvae
图2和图3表明,在沉积物-水体系中,无论是否添加DOM,添加的CMs对摇蚊幼虫体内PFASs的含量与对照相比都有不同程度的降低。Chen等[22]研究发现,W400和MWCNT10对PFASs具有吸附作用。由于CMs的吸附作用,水相中PFASs的自由溶解态浓度将降低[23],而污染物在生物体内的富集量与污染物自由溶解的浓度呈正相关[28],因此,W400和MWCNT10的存在导致摇蚊幼虫体内PFASs的含量降低。Xia等[23]的研究表明,PFASs在W400与水之间的配系数为75 L·kg-1~1.8×103L·kg-1,在MWCNT10与水之间的分配系数为6.6×102L·kg-1~1.5×104L·kg-1,可见,PFASs在MWCNT10与水之间的分配系数明显高于W400与水之间的分配系数。因此,在添加MWCNT10的沉积物-水体系中,摇蚊幼虫体内PFASs的含量显著低于添加W400的沉积物-水体系中的含量。综上分析,在本研究中,CMs是导致PFASs在摇蚊幼虫体内富集量减少的主要因素,而DOM对其影响不显著。由此说明,沉积物-水体系中少量DOM的引入对PFASs在摇蚊幼虫体内的富集影响不大。
由于PFASs同时具有疏水性的碳氟链和亲水性的羧酸或磺酸基团,因此PFASs在环境中的行为具有自身的独特性。它们在水生生物体内的富集同时受氟代碳原子数和亲水官能团类型影响。氟代碳原子越多,其在生物体内的富集量越大[2, 11]。而本研究中摇蚊幼虫体内PFASs的含量与氟代碳原子数并没有明显的相关性。这是因为在沉积物存在的情况下,氟代碳原子数较多的PFASs在CMs与水之间有较大的分配系数,如具有11个氟代碳原子的PFDoA在MWCNT10与水之间的分配系数高达1.5×104L·kg-1,而具有9个氟代碳原子数的PFDA的分配系数只有2.6×103L·kg-1,因此,当暴露体系中PFASs的总浓度和CMs的含量一定时,分配系数较高的PFASs的自由溶解态浓度必然低于分配系数较低的PFASs。虽然氟代碳原子多的PFASs更易于被生物富集,但在相对较低的自由溶解态浓度下其在摇蚊体内的富集量也可能比氟代碳原子少的PFASs低。对比图1、图2和图3发现,在相同暴露条件下,PFOS在摇蚊幼虫体内的含量明显高于其他PFASs。在沉积物-水体系中,由于磺酸基团与羧酸基团的静电差异[40],PFOS在沉积物(或CMs)与水之间的分配系数大于具有8个氟代碳原子的PFNA和具有7个氟代碳原子的PFOA[23],因此PFOS更易被沉积物(CMs)吸附,导致其在水相的自由溶解态浓度比PFNA和PFOA低。但是,由于磺酸基团的疏水性比羧酸基团更强[40],因此具有磺酸基的PFOS比具有羧基的PFNA和PFOA更易在生物体内富集。已有研究表明,PFOS在生物体内的基于水相浓度的生物富集系数高于PFNA和PFOA[12]。因此,在沉积物-水体系中,虽然自由溶解态的PFOS比PFNA和PFOA低,但由于PFOS在摇蚊幼虫体内的生物富集作用显著高于PFNA和PFOA,最终导致PFOS在摇蚊幼虫体内的生物富集量大于PFNA和PFOA。与氟代碳原子数大于8的PFASs相比,虽然PFOS在生物体内的基于水相浓度的生物富集系数较低[12],但在沉积物-水体系中,由于氟代碳原子数大于8的PFASs比PFOS更易于被沉积物(和CMs)吸附,导致其自由溶解态浓度比PFOS低。且后者起主要作用,最终导致PFOS在摇蚊幼虫体内的富集量高于氟代碳原子大于8的PFASs。
[1] Renner R. Growing concern over perfluorinated chemicals [J]. Environmental Science & Technology, 2001, 35(7): 154A-60A
[2] Liu C H, Gin K Y, Chang V W, et al. Novel perspectives on the bioaccumulation of PFCs--The concentration dependency [J]. Environmental Science & Technology, 2011, 45(22): 9758-9764
[3] Giesy J P, Naile J E, Khim J S, et al. Aquatic toxicology of perfluorinated chemicals [J]. Reviews of Environmental Contamination and Toxicology, 2010: 1-52
[4] Kim M, Son J, Park M S, et al. In vivo evaluation and comparison of developmental toxicity and teratogenicity of perfluoroalkyl compounds using Xenopus embryos [J]. Chemosphere, 2013, 93(6): 1153-1160
[5] Qazi M R, Abedi M R, Nelson B D, et al. Dietary exposure to perfluorooctanoate or perfluorooctane sulfonate induces hypertrophy in centrilobular hepatocytes and alters the hepatic immune status in mice [J]. International Immunopharmacology, 2010, 10(11): 1420-1427
[6] Wang F Q, Liu W, Jin Y H, et al. Interaction of PFOS and BDE-47 co-exposure on thyroid hormone levels and TH-related gene and protein expression in developing rat brains [J]. Toxicological Sciences, 2011, 121(2): 279-291
[7] Conder J M, Hoke R A, De Wolf W, et al. Are PFCAs bioaccumulative? A critical review and comparison with regulatory criteria and persistent lipophilic compounds [J]. Environmental Science & Technology, 2008, 42(4): 995-1003
[8] Zhou Z, Liang Y, Shi Y L, et al. Occurrence and transport of perfluoroalkyl acids (PFAAs), including short-chain PFAAs in Tangxun Lake, China [J]. Environmental Science & Technology, 2013, 47(16): 9249-9257
[9] Lam N H, Cho C R, Lee J S, et al. Perfluorinated alkyl substances in water, sediment, plankton and fish from Korean rivers and lakes: A nationwide survey [J]. Science of the Total Environment, 2014, 491-492(1): 54-62
[10] Zhou Z, Shi Y L, Vestergren R, et al. Highly elevated serum concentrations of perfluoroalkyl substances in fishery employees from Tangxun Lake, China [J]. Environmental Science & Technology, 2014, 48(7): 3864-3874
[11] Martin J W, Mabury S A, Solomon K R, et al. Bioconcentration and tissue distribution of perfluorinated acids in rainbow trout (Oncorhynchus mykiss) [J]. Environmental Toxicology and Chemistry, 2003, 22(1): 196-204
[12] Dai Z N, Xia X H, Guo J, et al. Bioaccumulation and uptake routes of perfluoroalkyl acids in Daphnia magna [J]. Chemosphere, 2013, 90(5): 1589-1596
[13] Loi E I, Yeung L W, Taniyasu S, et al. Trophic magnification of poly- and perfluorinated compounds in a subtropical food web [J]. Environmental Science & Technology, 2011, 45(13): 5506-5513
[14] Xu J, Guo C S, Zhang Y, et al. Bioaccumulation and trophic transfer of perfluorinated compounds in a eutrophic freshwater food web [J]. Environmental Pollution, 2014, 184(2): 54-61
[15] Fang S H, Chen X W, Zhao S Y, et al. Trophic magnification and isomer fractionation of perfluoroalkyl substances in the food web of Taihu Lake, China [J]. Environmental Science & Technology, 2014, 48(4): 2173-2182
[16] 吴江平, 管运涛, 李明远, 等. 全氟化合物的生物富集效应研究进展[J]. 生态环境学报, 2010, 19(5): 1246-1252
Wu J P, Guan Y T, Li M Y, et al. Recent research advances on the bioaccumulation potentials of perfluorinated compounds [J]. Ecology and Environmental Science, 2010, 19(5): 1246-1252 (in Chinese)
[17] Naile J E, Khim J S, Hong S, et al. Distributions and bioconcentration characteristics of perfluorinated compounds in environmental samples collected from the west coast of Korea [J]. Chemosphere, 2013, 90(2): 387-394
[18] Xia X H, Rabearisoa A H, Dai Z N, et al. Inhibition effect of Na(+) and Ca(2)(+) on the bioaccumulation of perfluoroalkyl substances by Daphnia magna in the presence of protein [J]. Environmental Toxicology and Chemistry, 2015, 34(2): 429-436
[19] Nakata H, Kannan K, Nasu T, et al. Perfluorinated contaminants in sediments and aquatic organisms collected from shallow water and tidal flat areas of the Ariake Sea, Japan: Environmental fate of perfluorooctane sulfonate in aquatic ecosystems [J]. Environmental Science & Technology, 2006, 40(16): 4916-4921
[20] Hong S, Khim J S, Park J, et al. In situ fate and partitioning of waterborne perfluoroalkyl acids (PFAAs) in the Youngsan and Nakdong River Estuaries of South Korea [J]. Science of the Total Environmen, 2013, 445(1): 36-45
[21] Wang S L, Wang H, Deng W J. Perfluorooctane sulfonate (PFOS) distribution and effect factors in the water and sediment of the Yellow River Estuary, China [J]. Environmental Monitoring and Assessment, 2013, 185(10): 8517-8524
[22] Chen X, Xia X H, Wang X L, et al. A comparative study on sorption of perfluorooctane sulfonate (PFOS) by chars, ash and carbon nanotubes [J]. Chemosphere, 2011, 83(10): 1313-1319
[23] Xia X H, Chen X, Zhao X L, et al. Effects of carbon nanotubes, chars, and ash on bioaccumulation of perfluorochemicals by Chironomus plumosus larvae in sediment [J]. Environmental Science & Technology, 2012, 46(22): 12467-12475
[24] Lam B, Baer A, Alaee M, et al. Major structural components in freshwater dissolved organic matter [J]. Environmental Science & Technology, 2007, 41(24): 8240-8247
[25] Leenheer J A, Croue J P. Characterizing aquatic dissolved organic matter [J]. Environmental Science & Technology, 2003, 37(1): 18A-26A
[26] Xia X H, Dai Z N, Rabearisoa A H, et al. Comparing humic substance and protein compound effects on the bioaccumulation of perfluoroalkyl substances by Daphnia magna in water [J]. Chemosphere, 2015, 119(9): 78-86
[27] Chen S, Xu Y P, Wang Z J. Assessing desorption resistance of PAHs in dissolved humic substances by membrane-based passive samplers [J]. Journal of Colloid and Interface Science, 2010, 350(1): 348-354
[28] Gouliarmou V, Smith K E, de Jonge L W, et al. Measuring binding and speciation of hydrophobic organic chemicals at controlled freely dissolved concentrations and without phase separation [J]. Analytical Chemistry, 2012, 84(3): 1601-1608
[29] Haitzer M, Hoss S, Traunspurger W, et al. Effects of dissolved organic matter (DOM) on the bioconcentration of organic chemicals in aquatic organisms--A review [J]. Chemosphere, 1998, 37(7): 1335-1362
[30] Xia X H, Rabearisoa A H, Jiang X M, et al. Bioaccumulation of perfluoroalkyl substances by Daphnia magna in water with different types and concentrations of protein [J]. Environmental Science & Technology, 2013, 47(19): 10955-10963
[31] Akkanen J, Kukkonen J V K. Measuring the bioavailability of two hydrophobic organic compounds in the presence of dissolved organic matter [J]. Environmental Toxicology and Chemistry, 2003, 22(3): 518-524
[32] Laor Y, Strom P F, Farmer W J. Bioavailability of phenanthrene sorbed to mineral-associated humic acid [J]. Water Research, 1999, 33(7): 1719-1729
[33] Liu S D, Xia X H, Zhai Y W, et al. Black carbon (BC) in urban and surrounding rural soils of Beijing, China: Spatial distribution and relationship with polycyclic aromatic hydrocarbons (PAHs) [J]. Chemosphere, 2011, 82(2): 223-228
[34] Braida W J, Pignatello J J, Lu Y F, et al. Sorption hysteresis of benzene in charcoal particles [J]. Environmental Science & Technology, 2003, 37(2): 409-417
[35] Glaser B, Haumaier L, Guggenberger G, et al. Black carbon in soils: The use of benzenecarboxylic acids as specific markers [J]. Organic Geochemistry, 1998, 29(4): 811-819
[36] Kannan K, Perrotta E, Thomas N J. Association between perfluorinated compounds and pathological conditions in southern sea otters [J]. Environmental Science & Technology, 2006, 40(16): 4943-4948
[37] Akkanen J, Slootweg T, Mäenpää K, et al. Bioavailability of Organic Contaminants in Freshwater Environments. Emerging and Priority Pollutants in Rivers [M]. Germany: Springer Berlin Heidelberg, 2012: 25-53
[38] Akkanen J, Penttinen S, Haitzer M, et al. Bioavailability of atrazine, pyrene and benzo[a]pyrene in European river waters [J]. Chemosphere, 2001, 45(4-5): 453-462
[39] Chen S, Ke R H, Zha J M, et al. Influence of humic acid on bioavailability and toxicity of benzo[k]fluoranthene to Japanese medaka [J]. Environmental Science & Technology, 2008, 42(24): 9431-9436
[40] Xiao F, Zhang X R, Penn L, et al. Effects of monovalent cations on the competitive adsorption of perfluoroalkyl acids by kaolinite: Experimental studies and modeling [J]. Environmental Science & Technology, 2011, 45(23): 10028-10035
◆
Co-effects of Carbonaceous Material and Dissolved Organic Matter onBioconcentration of Perfluoroalkyl Substances byChironomusplumosusin Sediments
Wen Wu, Xia Xinghui*, Chen Xi, Zhai Yawei, Lin Hui
School of Environment, State Key Laboratory of Water Environment Simulation, Beijing Normal University, Beijing 100875, China
Received 17 December 2015 accepted 13 January 2016
Perfluoroalkyl substances (PFASs) are a class of organic anionic fluorinated surfactants with a hydrophobic perfluoroalkyl chain and a hydrophilic functional group. There are some studies on the effects of environmental conditions on PFAS bioconcentration in aquatic organisms. However, co-effects of carbonaceous material (CMs) and dissolved organic matter (DOM) on bioconcentration of perfluoroalkyl substances in aquatic organisms have not been studied. In this study, the co-effects of two types of CMs and four types of DOM on PFAS bioconcentration in Chironomus plumosus larvae were investigated. The CMs included willow-derived chars (W400) and multiwalled carbon nanotubes (MWCNT10) of which the contents were 0.4% dry weight in sediment. The DOM included tannic acid (TA), fulvic acid (FA), peptone (PEP), and humic acid (HA), and their concentrations were 0, 1, 5 and 50 mg C·L-1. The PFASs included perfluorooctane sulfonate (PFOS), perfluorooctanoic acid (PFOA), perfluorononanoic acid (PFNA), perfluorodecanoic acid (PFDA), perfluoroundecanoic acid (PFUnA), and perfluorododecanoic acid (PFDoA). The concentration of each PFAS in sediment was 0.1 mg·kg-1dry weight. The results showed that, upon bioconcentration equilibrium, regardless of DOM addition or not, the body burden of the six PFASs in larvae decreased in all treatments amended with CMs. Body burden of PFASs decreased more remarkably in the MWCNT10 amended sediment than in the W400 amended sediment. Compared to the control without CM amendment, the body burden of PFASs in larvae decreased by 21%-56% in the sediment amended with MWCNT10 regardless of DOM types and concentrations, while the body burden of PFASs decreased less than 20% in the W400 amended sediment. However, irrespective of the presence and absence of CMs, when DOM types changed or their concentrations increased, the body burden of PFASs in larvae did not change significantly in the sediment amended with 0.4% CMs. Therefore, the CMs played a major role in decreasing the PFAS body burden in larvae, and the small quantity of DOM addition had no significant effects on the body burden of PFASs when the CMs and DOM were co-existent. The results suggest that CMs in sediment should be considered in the bioavailability assessment of PFASs.
perfluoroalkyl substances; carbonaceous materials; dissolved organic matters; Chironomus plumosus larvae; bioconcentration; multiwalled carbon nanotubes
10.7524/AJE.1673-5897.20151217002
国家杰出青年科学基金(51325902);国家自然科学基金(51279010)
文武(1985-),男,博士研究生,研究方向为有机污染物的环境行为,Email: wenwuliwen@163.com
*通讯作者(Corresponding author), E-mail: xiaxh@bnu.edu.cn
2015-12-17 录用日期:2016-01-13
1673-5897(2016)2-283-09
X171.5
A
简介:夏星辉(1971—),女,教授,主要研究方向为环境化学和流域水环境,发表SCI论文80余篇。
文武, 夏星辉, 陈曦, 等. 碳质材料和溶解性有机质对沉积物中全氟化合物在摇蚊幼虫体内富集的影响[J]. 生态毒理学报,2016, 11(2): 283-291
Wen W, Xia X H, Chen X, et al. Co-effects of carbonaceous material and dissolved organic matter on bioconcentration of perfluoroalkyl substances by Chironomus plumosus in sediments [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 283-291 (in Chinese)
