云南山区野生牛肝菌中重金属汞和镉来源分析及食用安全评估
2016-12-12杨天伟张霁刘鸿高王元忠
杨天伟,张霁,刘鸿高,王元忠,*
1. 云南省农业科学院药用植物研究所,昆明650200;2. 云南农业大学农学与生物技术学院,昆明650201;3. 云南省省级中药原料质量监测技术服务中心,昆明65200
云南山区野生牛肝菌中重金属汞和镉来源分析及食用安全评估
杨天伟1,2,张霁1,3,刘鸿高2,王元忠1,3,*
1. 云南省农业科学院药用植物研究所,昆明650200;2. 云南农业大学农学与生物技术学院,昆明650201;3. 云南省省级中药原料质量监测技术服务中心,昆明65200
分析重金属在“环境-牛肝菌-人体”系统中的迁移、富集规律,为牛肝菌重金属污染防治及食用安全评价提供依据。采用ICP-AES法测定云南野生牛肝菌及其生长土壤中Cd和Hg含量,分析牛肝菌对重金属的富集特征及牛肝菌的重金属含量与土壤的联系,推测云南野生牛肝菌中重金属Cd和Hg的来源;根据FAO/WHO规定的每周Cd或Hg的允许摄入量(provisional tolerable weekly intake, PTWI)评估牛肝菌的重金属暴露风险。结果显示,(1)不同种类、产地牛肝菌中Hg和Cd含量具有差异,菌盖中Hg、Cd的含量分别在0.92~16.00 mg·kg-1dw,4.97~24.07 mg·kg-1dw之间,菌柄的Hg、Cd含量分别介于0.46~8.2 mg·kg-1dw和2.11~22.08 mg·kg-1dw之间。同一种牛肝菌菌盖中Hg或Cd的含量均高于菌柄(Q(C/S)>1),表明牛肝菌菌盖对Hg和Cd的富集能力强于菌柄。(2)牛肝菌菌盖和菌柄对Hg的富集系数(bioaccumulation factor, BCF)分别在1.72~19.12和1.30~6.40之间,菌盖、菌柄的Hg含量均高于相应生长土壤的含量,其中采自楚雄永仁县的铜色牛肝菌菌盖的Hg含量是土壤的19.12倍,表明牛肝菌中的Hg不仅来自土壤,根据山地“Hg诱捕效应”及云南大气Hg升高的相关报道,可以推测云南野生牛肝菌中的Hg主要来源于大气沉降。(3)牛肝菌菌盖、菌柄对Cd的富集系数分别在0.16~1.82和0.07~1.67之间,多数牛肝菌的Cd含量低于土壤含量,表明牛肝菌中的Cd主要来自生长土壤。(4)假设成年人(60 kg)毎周食用300 g新鲜牛肝菌则多数牛肝菌菌盖、菌柄的Hg摄入量低于PTWI(Hg)标准,Hg的暴露风险较低(假设未通过其他途径摄入Hg);食用300 g黑粉孢牛肝菌菌盖或菌柄摄入的Cd达到0.722 mg和0.662 mg,超过PTWI(Cd)标准,食用有Cd暴露风险。
重金属;汞;镉;野生牛肝菌;食用菌;富集系数;健康风险;云南
Received 30 November 2015 accepted 13 January 2016
土壤、水、大气等环境因子是重金属污染物的主要载体,近年来随着工业化、城市化的快速发展,环境中镉(Cd)、汞(Hg)、铅(Pb)、砷(As)等有毒重金属污染日益严重[1-3]。土壤、大气中的重金属能被植物(农作物)吸收、富集,再通过食物链进入人体,蓄积于人体的脑组织、肝脏、肾脏等多个组织和器官,当人体长期暴露于重金属污染的环境时会发生重金属毒害作用,引发癌症、突变等疾病[4-7];因此,有毒重金属可以通过“环境-植物-人体”过程在环境和生物体中迁移、转化和富集,对生态环境及人体健康产生严重威胁。
农产品中重金属污染物超标是人们关注的食品安全问题之一,农产品的重金属污染程度与农田土壤、大气、灌溉用水等因素有关[8-9]。分析农产品中重金属的来源是保障农产品质量安全及采取有效防治措施的前提基础;研究显示植物中的重金属主要来源于生长土壤,同时也因植物类型、重金属种类不同而存在差异[10-11]。
野生食用牛肝菌是云南高原特色农产品之一,也是世界著名的美味食用菌。云南牛肝菌种类多、产量大,味道鲜美、营养丰富兼具食药用价值而举世闻名[12-15];牛肝菌受到了广大消费者青睐,其不仅在国内市场上畅销,而且已经出口到英国、法国、日本、中国台湾、中国香港等40多个国家和地区,成为云南出口农产品中换汇率较高的商品。然而研究显示野生食用菌对重金属具有很强的富集能力,如蜡蘑属真菌能够超富集砷元素[16],多数牛肝菌中Cd、Hg、Pb、As等重金属含量超标[17-18],这不仅影响云南野生食用菌出口贸易,还制约着我国食用菌产业发展。
食用菌的重金属含量主要与生长土壤、空气、水等环境因子及食用菌种类有关,当土壤、水、空气等受到重金属污染时,食用菌的重金属含量一般会升高[19-20]。采自丹麦受砷污染地区的紫蜡蘑(Laccaria amethystina)中As元素含量远高于云南未污染地区的紫蜡蘑、红蜡蘑(Laccaria laccata),红榛色蜡蘑(Laccaria vinaceoave)等蜡蘑属真菌的As含量[21-22]。测定不同地区绒盖牛肝菌(Xerocomus subtomentosus)中Hg含量,发现不同产地绒盖牛肝菌中Hg含量差异明显,其中采自矿产周围食用菌Hg含量最高[23]。因此,分析重金属在“环境-牛肝菌-人体”体系中的迁移、富集规律,探讨牛肝菌中重金属的来源,能为牛肝菌的重金属污染防治提供重要依据。
本文测定了云南不同地区野生牛肝菌及其生长土壤中重金属Cd和Hg的含量,分析重金属在“环境-牛肝菌”体系中的富集规律,推测云南野生牛肝菌中Hg、Cd的来源,为防治牛肝菌Hg、Cd污染提供依据。此外,根据FAO/WHO规定的每周Hg、Cd允许摄入量(provisional tolerable weekly intake, PTWI)评价野生牛肝菌的食用安全性,为野生牛肝菌资源开发利用和食用安全评估提供基础数据。
1 材料与方法 (Materials and methods)
1.1 实验材料
牛肝菌及土壤样品均于2012年7—8月采自云南山区,并由云南农业大学刘鸿高教授鉴定,详细信息见表1。样品采集后用塑料刀刮去泥土、杂草、枯枝等异物,用自来水和超纯水清洗干净,50 ℃烘干至恒重,将菌盖、菌柄分开粉碎过80目筛,保存于自封袋中,备用。
1.2 仪器及试剂
仪器:MA-2000型直接测汞仪-冷原子吸收光谱(日本NIC公司);ICPE-9000电感耦合等离子体原子发射光谱仪(日本岛津公司);MARS6型微波消解仪(美国CEM公司)。
试剂:超纯水,65%硝酸(优级纯),2%高氯酸(优级纯),38%盐酸(优级纯),30%过氧化氢(分析纯),40%氢氟酸(分析纯);Hg、Cd元素标准溶液(济南众标科技有限公司);生物成分分析标准物质:波兰香草混合物INCT-MPH-2(购于波兰核化学技术研究所),茶叶GBW07605(购于地矿部物化探研究所)。
1.3 Hg含量测定
采用MA-2000型直接测汞仪-冷原子吸收光谱法测定牛肝菌及其生长土壤中Hg元素含量,其原理是样品中的Hg在高温加热和催化剂的作用下转化为Hg蒸气,由金丝捕汞管吸附Hg,并在吸收池内测定样品的Hg含量。
1.3.1 建立Hg元素标准曲线
将10 mg·mL-1Hg元素标准储备稀释成1.0 mg·mL-1Hg标准溶液,精确量取0.00、50.00、100.00、200.00、500.00 μL Hg标准溶液,按从低到高的顺序置于样品舟中,测定Hg含量,建立标准曲线。
1.3.2 样品测定
牛肝菌及土壤样品置于样品舟中,在850 ℃条件下热解样品,使不同形态的Hg以气态的形式释放出来,通过金汞齐化反应吸附样品中的Hg,快速加热金丝捕汞管,使吸附的Hg瞬间释放,并随载气进入吸收池,测定样品的Hg含量。Hg元素的测定波长为253.7 nm,一个样品测定时间为7 min;每测定6个牛肝菌或土壤样品设置1个空白试样以减小或消除样品之间的干扰。按上述方法测定标准物质波兰香草混合物INCT-MPH-2,考察方法的准确性和可行性。
1.4 Cd含量测定
1.4.1 建立Cd元素标准曲线
将1000 μg·mL-1的Cd元素标准溶液用10% HNO3稀释成10 μg·mL-1的Cd元素标准储备液;精确量取0.00、0.20、0.50、1.00、5.00、10.00 mL标准储备液于100 mL容量瓶中,用10% HNO3定容,配制成0.0、0.02、0.05、0.1、0.5、1.0 μg·mL-1的标准溶液,建立Cd元素的标准曲线。
1.4.2 牛肝菌及土壤样品消解
牛肝菌消解:精确称取0.3000 g样品于消解罐中,加入6 mL浓硝酸,3 mL 30%双氧水和1 mL超纯水,加盖密封,采用MARS6型微波消解仪将牛肝菌样品消解完全,冷却后取出消解罐,将消解液转移到25 mL比色管,用超纯水定容到25 mL刻度线,摇匀,静置,待测。用同样的方法消解标准物质茶叶(GBW07605),制备空白样品。
土壤消解:准确称取0.1000 g土壤于聚四氟乙烯烧杯中,加入6 mL浓硝酸,1 mL高氯酸。置于电热板上加热到170 ℃,当硝酸消耗完全,样品成糊状时,取下冷却。加入0.5 mL高氯酸和10 mL氢氟酸,在电热板上加热到210 ℃使硅酸盐等矿物质分解,待酸消耗完全(无白烟),取下冷却。加10 mL盐酸,低温加热使残渣溶解,冷却后转移到25 mL比色管,用超纯水定容,摇匀,待测。
1.4.3 样品中Cd含量测定
采用ICP-AES法测定牛肝菌、土壤及茶叶标准物质中Cd元素含量。Cd的测定波长为214.438 nm。ICP-AES的工作参数设为:输出功率为1.2 kW,等离子体气流速为10 L·min-1,辅助气流速为0.6 L·min-1,载气流速为0.7 L·min-1。
1.4.4 实验方法学考察
采用冷原子吸收光谱-直接测汞仪测定标准物质波兰香草混合物(INCT-MPH-2)中Hg元素含量,其测定值为0.0183 mg·kg-1与标准值0.018 mg·kg-1比较接近,表明该方法可行。ICP-AES法测定茶叶标准物质(GBW07605)中的Cd元素含量,结果显示茶叶中Cd含量测定值0.056 mg·kg-1与标准值0.057 mg·kg-1相近,Cd元素的加标回收率为95.7%,表明测定方法准确、可靠。
1.5 食用安全评估方法
根据FAO/WHO规定的每周Cd、Hg允许摄入量评价云南野生牛肝菌的食用安全性。

表2 牛肝菌及生长土壤中Hg元素含量,菌盖与菌柄的含量比,富集系数及Hg摄入量估算
注:“*”指食用300g新鲜牛肝菌所摄入的Hg;同一列中不同小写字母表示Hg含量差异显著(P<0.05)。
Note:“*”is Hg intake estimates when consumption of 300 g fresh boletes. Different lowercase letters in the same column denote significant difference of Hg contents in boletes (P<0.05).
2 结果与讨论(Results and discussion)
2.1 牛肝菌中重金属含量分析
2.1.1 牛肝菌中Hg元素含量
表2为牛肝菌及生长土壤中Hg含量测定结果,由表可知,不同产地、种类牛肝菌中Hg含量具有差异,其中采自迪庆普达措的砖红绒盖牛肝菌菌盖、菌柄的Hg含量最低,分别为0.92 mg·kg-1dw和0.46 mg·kg-1dw;采自迪庆维西的美味牛肝菌Hg含量较高,菌盖、菌柄的Hg含量分别达到16.00 mg·kg-1dw和6.10 mg·kg-1dw,以上2种牛肝菌的汞含量差异显著(P<0.05)。采自不同地区的皱盖疣柄牛肝菌(样品5-9)菌盖的Hg含量相对较低且不同地区间该物种的Hg含量差异较小(P>0.05);表明不同种类、不同产地牛肝菌对重金属Hg的富集量具有差异。研究云南及波兰地区14种疣柄牛肝菌属(Leccinum)中Hg元素含量,结果显示疣柄牛肝菌属真菌的Hg含量差异明显,而且采自云南的样品Hg含量远高于波兰地区的样品[24]。Ostos等[25]分析10种野生食用菌中Hg元素含量,发现不同种类食用菌的Hg含量在(0.09±0.08)~(10.28±2.92) mg·kg-1dw之间,表明不同种类野生菌对Hg的富集量具有差异。
由牛肝菌菌盖与菌柄的Hg含量比(Q(C/S))可知,采自玉溪易门的皱盖疣柄牛肝菌菌盖与菌柄的Hg含量差异最明显,菌盖的Hg含量是菌柄的5倍(Q(C/S)=5);差异最小的是采自大理云龙县的美网柄牛肝菌。实验所测定的牛肝菌菌盖的Hg含量均高于菌柄(Q(C/S)>1),与文献报道的食用菌菌盖中重金属含量一般高于菌柄的结果相符[26-27]。
2.1.2 牛肝菌中Cd元素含量
牛肝菌及其生长土壤中Cd元素含量见表3,由表可知不同种类牛肝菌的Cd元素含量普遍较高,其中采自迪庆普达措的黑粉孢牛肝菌菌盖、菌柄中Cd含量分别达到24.07 mg·kg-1dw、22.08 mg·kg-1dw,采自玉溪大营街的云绒盖牛肝菌菌盖、菌柄的Cd含量为17.21 mg·kg-1dw和13.27 mg·kg-1dw。而采自玉溪易门的皱盖疣柄牛肝菌Cd含量比其他样品低,菌盖、菌柄的含量分别是4.97 mg·kg-1dw和2.11 mg·kg-1dw;采自文山东山乡的铜色牛肝菌菌盖、菌柄的Cd含量为5.37 mg·kg-1dw和2.47 mg·kg-1dw与上述牛肝菌的Cd含量接近。产于意大利的牛肝菌属真菌Cd含量在5.4~43.9 mg·kg-1dw之间,美味牛肝菌、褐红牛肝菌(Boletus pinophilus)中的Cd含量超过当地的相关标准[28];黄晨阳等[29]测定了云南12种野生食用菌的重金属含量,显示食用菌中Cd含量在0.39~12.8 mg·kg-1dw之间,与本研究的测定结果相近。

表3 牛肝菌及生长土壤中Cd含量,菌盖与菌柄的含量比,富集系数及Cd摄入量估算
注:“*”指食用300g新鲜牛肝菌所摄入的Cd;同一列中不同小写字母表示Cd含量差异显著(P<0.05)。
Note:“*”is Cd intake estimates when consumption of 300 g fresh boletes. Different lowercase letters in the same column denote significant difference of Cd contents in boletes (P<0.05).
牛肝菌不同部位的Cd含量具有差异,菌盖与菌柄的Cd含量比(Q(C/S))在1.09~4.40之间,表明野生牛肝菌菌盖对Cd的富集程度大于菌柄;采自迪庆普达措的黑粉孢牛肝菌的Q(C/S)值较小,为1.09,表明该牛肝菌菌盖与菌柄的Cd含量相近。采自楚雄永仁县的铜色牛肝菌的Q(C/S)值最大,即该牛肝菌菌盖和菌柄对Cd的富集能力差异最大。
2.2 牛肝菌的富集系数
富集系数(bioaccumulation factor, BCF)为牛肝菌菌盖或菌柄中重金属含量与生长土壤的含量之比,主要反应牛肝菌对土壤中重金属的富集能力及元素的迁移难易程度。由表2可知,不同种类、产地牛肝菌菌盖、菌柄对Hg的富集系数介于1.72~19.12和1.30~6.40之间,其中采自楚雄永仁县的铜色牛肝菌菌盖的Hg富集系数最大,而采自大理云龙的美网柄牛肝菌菌盖、菌柄的Hg富集系数均最小,分别为1.72和1.30。总体上看,牛肝菌菌盖、菌柄的Hg富集系数均大于1,表明牛肝菌对Hg的富集能力较强,同时牛肝菌对Hg的富集能力还与牛肝菌种类有关。Falandysz等[30]测定了15种食用菌及其生长土壤中Hg元素含量,分析不同种类食用菌的Hg富集系数,结果显示菌盖的富集系数在73~220之间,菌柄的富集系数在37~170之间,作者认为美味牛肝菌和褐绒盖牛肝菌(Xerocomus badius)可作为评价Hg污染的生物指标。Kuldo等[31]测定了高大环柄菇(Macrolepiota procera)及土壤中的矿质元素含量,结果显示菌盖、菌柄对Hg的平均富集系数分别为140±14和52±20,与上述结果相比本研究中牛肝菌样品的Hg富集系数相对较小。
牛肝菌菌盖、菌柄对Cd元素的富集系数分别在0.16~1.82和0.07~1.67之间,与Hg元素相比Cd的富集程度较低。除采自迪庆普达措的黑粉孢牛肝菌外其余样品的富集系数均小于1,表明牛肝菌对Cd的富集能力较小。Liu等[17]分析了云南不同地区、种类野生食用菌对重金属的富集能力,发现松茸(Tricholoma matsutake)的Cd富集系数达到57.6,而其余多数食用菌的富集系数小于1。
2.3 牛肝菌重金属含量与生长土壤的关系
2.3.1 Hg元素
图1为牛肝菌样品及其生长土壤中重金属Hg含量的折线图。结合表2、图1可知牛肝菌菌盖、菌柄的Hg含量与土壤Hg含量具有紧密联系,当土壤中Hg含量升高时,牛肝菌的Hg含量也随之升高,但升高趋势还与牛肝菌种类有关,比如美网柄牛肝菌(14号样品)的生长土壤中Hg含量最高为4.30 mg·kg-1,但美网柄牛肝菌菌盖、菌柄的Hg含量并非最高。所测定的牛肝菌菌盖、菌柄的Hg含量均高于生长土壤的Hg含量,其中铜色牛肝菌(10号样品)菌盖、菌柄的Hg含量分别是土壤的19.12倍和6.15倍(BCF分别为19.12和6.15),美味牛肝菌(3号样品)菌盖的Hg含量是土壤含量的12.31倍(BCF=12.31),表明野生牛肝菌所富集的Hg不仅来自土壤。
Zhang等[32]以山地“Hg诱捕效应”解释了云南环境未受污染的高海拔山区Hg含量较高的原因:高海拔山区空气湿度大,降水多,大气中的Hg容易沉降,成为Hg易于聚集的地带;而中南半岛生物质燃烧所排放的Hg是导致云南地区大气Hg浓度升高的重要原因[33]。本研究中野生牛肝菌的Hg含量均高于土壤的含量,这可能与云南山区大气Hg沉降有关,即云南野生牛肝菌富集的Hg主要来源于大气沉降;Falandysz等[34]研究发现环境未受污染的高海拔(2 946 m)地区野生菌的Hg含量远高于背景土壤和森林凋落物,主要因Hg的远程大气运输和沉降是该地区食用菌Hg含量升高的原因,与本研究结果相似。
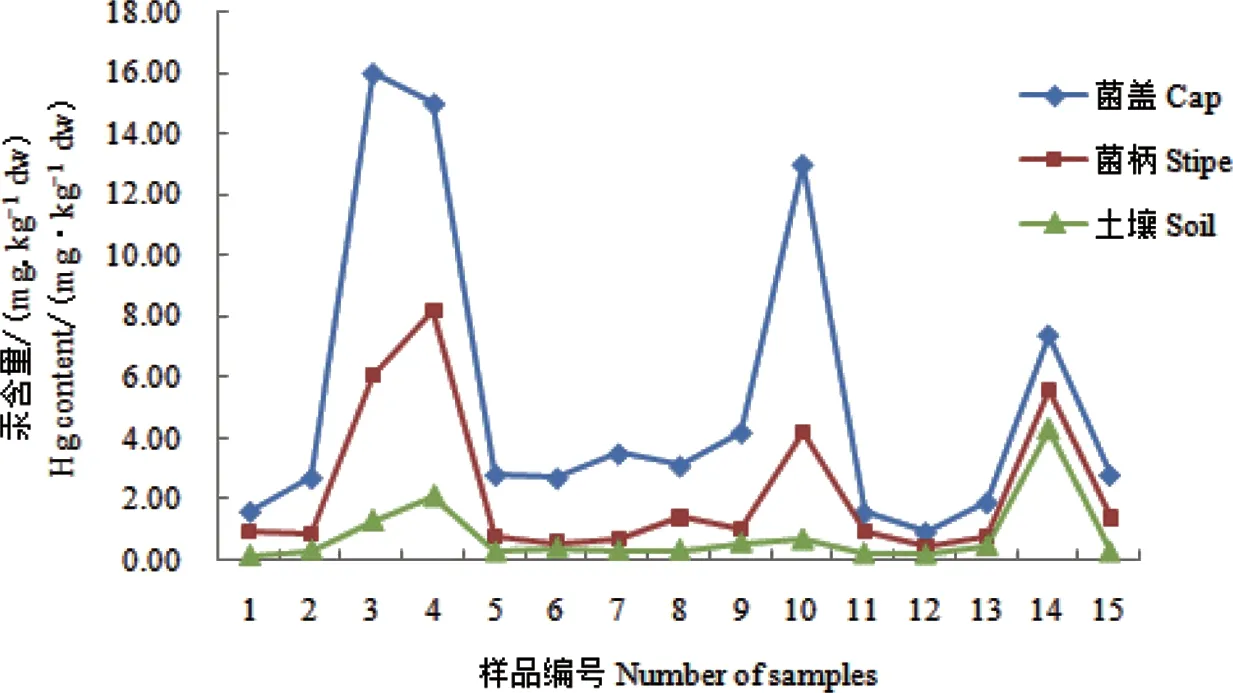
图1 牛肝菌及生长土壤中Hg含量折线图Fig. 1 The Hg contents in boletes and the topsoil
2.3.2 Cd元素
牛肝菌及其生长土壤中Cd元素含量的折线图见图2。由表3、图2可看出牛肝菌菌盖、菌柄的Cd含量与生长土壤的Cd含量没有明显规律;多数牛肝菌菌盖、菌柄对Cd的富集系数较小,其中采自玉溪易门的皱盖疣柄牛肝菌菌盖和菌柄对Cd的富集程度最低,富集系数仅为0.16和0.07。除黑粉孢牛肝菌(15号样品)外其余牛肝菌菌盖、菌柄的Cd含量均低于生长土壤的含量,由此可以推测野生牛肝菌中重金属Cd主要来自生长土壤。研究显示环境污染地区的食用菌中重金属Cd含量高于未污染地区的食用菌,甚至超过食用菌重金属限量标准[35-36],采自冶炼厂附近的美味牛肝菌中Cd含量升高[37];不同生长环境下野生菌中重金属Cd含量差异较大[38];表明食用菌中重金属Cd的含量与生长土壤环境等有关。

图2 牛肝菌及生长土壤中Cd含量折线图Fig. 2 The Cd contents in boletes and the topsoil
2.4 牛肝菌食用安全评估
为了避免和减少重金属对人体健康造成危害,FAO/WHO根据临床毒理实验,规定人体每周Hg允许摄入量(provisional tolerable weekly intake, PTWI)应小于0.004 mg·kg-1body weight (bw),每周Cd允许摄入量应小于0.007 mg·kg-1bw[39]。按成人平均体重60 kg计算,则每人一周允许摄入的Hg为60 kg bw×0.004 mg·kg-1bw=0.24 mg;每人一周Cd允许摄入量为:60 kg bw×0.007 mg·kg-1bw=0.42 mg。假设成年人每周食用300 g新鲜野生牛肝菌,则通过牛肝菌摄入的Hg或者Cd为:牛肝菌重金属含量(Hg或Cd)×300 g×10%(10%为牛肝菌干重约占其总质量的比例)。
由表2可知食用300 g新鲜牛肝菌菌盖或者菌柄摄入的Hg分别在0.028~0.48 mg及0.014~0.246 mg之间;与上述PTWI(Hg)标准相比,食用300 g牛肝菌菌盖时,多数牛肝菌的Hg摄入量低于PTWI(Hg)标准,而采自迪庆维西县,保山隆阳区的美味牛肝菌及采自楚雄永仁县的铜色牛肝菌菌盖的Hg摄入量高于该标准;由于食用菌菌柄对Hg的富集能力比菌盖弱,除保山隆阳区的美味牛肝菌菌柄的Hg摄入量略高于PTWI(Hg)标准外,其余样品的Hg摄入量均低于该标准,因此,Hg的暴露风险较低(假设未通过其他途径摄入Hg)。根据食用300 g新鲜牛肝菌摄入的Cd(表3)及成年人每周Cd允许摄入量可知,采自玉溪易门的皱盖疣柄牛肝菌菌盖或菌柄摄入的Cd最低,仅为0.149 mg和0.063 mg;而黑粉孢牛肝菌(15号样品)菌盖、菌柄的Cd摄入量最高分别达到0.722 mg和0.662 mg,超过PTWI(Cd)标准,长期或过量食用有Cd暴露风险。
采用ICP-AES法测定野生牛肝菌及其生长土壤中Hg、Cd两种重金属元素,结果显示不同种类、产地牛肝菌中重金属含量具有差异,其中菌盖的Hg含量在0.92~16.00 mg·kg-1dw之间,菌柄的含量在0.46~8.2 mg·kg-1dw之间;菌盖、菌柄的Cd含量分别在4.97~24.07 mg·kg-1dw及2.11~22.08 mg·kg-1dw之间;表明牛肝菌对重金属的富集程度与牛肝菌种类、产地及重金属类型有关。同一种牛肝菌的菌盖中Hg和Cd的含量均高于菌柄(Q(C/S)>1),表明牛肝菌菌盖对重金属的富集能力强于菌柄。
分析牛肝菌及其生长土壤的Cd、Hg元素含量可知,牛肝菌菌盖、菌柄的Hg含量均高于相应生长土壤的Hg含量(BCF>1),表明牛肝菌中的Hg不仅来自土壤;根据“Hg诱捕效应”[32]及云南大气Hg升高的原因[33]可以推测云南野生食用菌中的Hg主要来源于大气沉降。本研究中多数牛肝菌菌盖、菌柄对Cd元素的富集系数较小,除采自迪庆普达措的黑粉孢牛肝菌外其余牛肝菌的Cd含量均低于土壤的含量,表明牛肝菌中的Cd主要来源于生长土壤。
根据FAO/WHO规定的每周Cd或Hg允许摄入量标准,假设成年人(60 kg)毎周食用300 g新鲜牛肝菌则多数牛肝菌菌盖、菌柄的Hg摄入量低于PTWI(Hg)标准,Hg的暴露风险较低(假设未通过其他途径摄入Hg)。而食用300 g黑粉孢牛肝菌菌盖或菌柄摄入的Cd分别达到0.722 mg和0.662 mg,均超过PTWI(Cd)标准,长期或过量食用有Cd暴露风险。
[1] Li Z, Ma Z, van der Kuijp T J, et al. A review of soil heavy metal pollution from mines in China: Pollution and health risk assessment[J]. Science of the Total Environment, 2014, 468: 843-853
[2] He Z, Shentu J, Yang X, et al. Heavy metal contamination of soils: Sources, indicators and assessment [J]. Journal of Environmental Indicators, 2015, 9: 17-18
[3] 布吉红, 陈辉辉, 许宜平, 等. 辽河表层沉积物重金属生态风险与综合毒性表征[J]. 生态毒理学报, 2014, 9(1): 24-34
Bu J H, Chen H H, Xu Y P, et al. Ecological risk of interstitial water heavy metals and toxicity characterization of surface sediments in branches of Liaohe River [J]. Asian Journal of Ecotoxicology, 2014, 9(1): 24-34 (in Chinese)
[4] Duruibe J O, Ogwuegbu M O C, Egwurugwu J N. Heavy metal pollution and human biotoxic effects [J]. International Journal of Physical Sciences, 2007, 2(5): 112-118
[5] Järup L. Hazards of heavy metal contamination[J]. British Medical Bulletin, 2003, 68(1): 167-182
[6] 莫小荣, 吴烈善, 邓书庭, 等. 某冶炼厂拆迁场地土壤重金属污染健康风险评价[J]. 生态毒理学报, 2015, 10(4): 235-243
Mo X R, Wu L S, Deng S T, et al. Health risk assessment of heavy metal in soil of demolished smelting site [J]. Asian Journal of Ecotoxicology, 2015, 10(4): 235-243 (in Chinese)
[7] Guan X, Sun L N. Current situation and the harm of soil heavy metal pollution and food safety [J]. Applied Mechanics and Materials, 2014, 675: 612-614
[8] Lei M, Tie B, Song Z, et al. Heavy metal pollution and potential health risk assessment of white rice around mine areas in Hunan Province, China [J]. Food Security, 2015, 7(1): 45-54
[9] Kumar U. Agricultural products and by-products as a low cost adsorbent for heavy metal removal from water and wastewater: A review[J]. Scientific Research and Essays, 2006, 1(2): 33-37
[10] 赵多勇, 王成, 杨莲. “环境-植物-人体” 体系中重金属来源及迁移途径[J]. 农业工程, 2013, 3(3): 55-58
Zhao D Y, Wang C, Yang L, et al. Source identification and transfer route of heavy metal pollution in Environment-Plant-Human system (A Review)[J]. Agricultural Engineering, 2013, 3(3): 55-58 (in Chinese)
[11] Wenzel W W. Rhizosphere processes and management in plant-assisted bioremediation (phytoremediation) of soils[J]. Plant and Soil, 2009, 321(1-2): 385-408
[12] Wang X M, Zhang J, Wu L H, et al. A mini-review of chemical composition and nutritional value of edible wild-grown mushroom from China[J]. Food Chemistry, 2014, 151: 279-285
[15] 李杰庆, 杨天伟, 王元忠, 等. 不同产地皱盖疣柄牛肝菌中矿质元素含量测定及特征分析[J]. 食品科学, 2014, 35(24): 119-122
Li J Q, Yang T W, Wang Y Z, et al. Determination andcharacteristic analysis of mineral elements in Leccinum rugosiceps from different geographic origins [J]. Food Science, 2014, 35(24): 119-122 (in Chinese)
[16] Stijve T, Vellinga E C, Herrmann A. Arsenic accumulation in some higher fungi [J]. Persoonia-Molecular Phylogeny and Evolution of Fungi, 1990, 14(2): 161-166
[17] Liu B, Huang Q, Cai H, et al. Study of heavy metal concentrations in wild edible mushrooms in Yunnan Province, China [J]. Food Chemistry, 2015, 188: 294-300
[18] Falandysz J, Zhang J, Wang Y Z, et al. Evaluation of mercury contamination in fungi Boletus species from latosols, lateritic red earths, and red and yellow earths in the Circum-Pacific Mercuriferous Belt of southwestern China [J]. PloS one, 2015, doi:10.1371/journal.pone.0143608
[20] Benbrahim M, Denaix L, Thomas A L, et al. Metal concentrations in edible mushrooms following municipal sludge application on forest land [J]. Environmental Pollution, 2006, 144(3): 847-854
[21] Larsen E H, Hansen M, Gössler W. Speciation and health risk considerations of arsenic in the edible mushroom Laccaria amethystina collected from contaminated and uncontaminated locations[J]. Applied Organometallic Chemistry, 1998, 12(4): 285-291
[22] Zhang J, Li T, Yang Y L, et al. Arsenic concentrations and associated health risks in Laccaria mushrooms from Yunnan (SW China)[J]. Biological Trace Element Research, 2015, 164(2): 261-266
[23] Chojnacka A, Drewnowska M, Jarzyska G, et al. Mercury in Yellow-cracking boletes Xerocomus subtomentosus mushrooms and soils from spatially diverse sites: Assessment of bioconcentration potential by species and human intake [J]. Journal of Environmental Science and Health, Part A, 2012, 47(13): 2094-2100
[24] Falandysz J, Zhang J, Wang Y, et al. Evaluation of the mercury contamination in mushrooms of genus Leccinum from two different regions of the world: Accumulation, distribution and probable dietary intake [J]. Science of The Total Environment, 2015, 537: 470-478
[25] Ostos C, Pérez-Rodríguez F, Arroyo B M, et al. Study of mercury content in wild edible mushrooms and its contribution to the provisional tolerable weekly intake in Spain[J]. Journal of Food Composition and Analysis, 2015, 37: 136-142
[26] Falandysz J, Kunito T, Kubota R. et al. Multivariate characterization of elements accumulated in King Bolete Boletus edulis mushroom at lowland and high mountain regions [J]. Journal of Environmental Sciences and Health Part A, 2008, 43: 1692-1699
[27] Drewnowska M, Sapór A, Jarzyńska G, et al. Mercury in Russula mushrooms: Bioconcentration by Yellow-ocher Brittle Gills Russula ochroleuca [J]. Journal of Environmental Science and Health, Part A, 2012, 47(11): 1577-1591
[28] Cocchi L, Vescovi L, Petrini L E, et al. Heavy metals in edible mushrooms in Italy[J]. Food Chemistry, 2006, 98(2): 277-284
[29] 黄晨阳, 陈强, 赵永昌, 等. 云南省主要野生食用菌中重金属调查[J]. 中国农业科学, 2010, 43(6): 1198-1203
Huang C Y, Chen Q, Zhao Y C, et al.Investigation on heavy metals of main wild edible mushrooms in Yunnan Province [J]. Scientia Agricultura Sinica, 2010, 43(6): 1198-1203 (in Chinese)
[30] Falandysz J. Mercury in mushrooms and soil of the Tarnobrzeska Plain, south-eastern Poland [J]. Journal of Environmental Science and Health, Part A, 2002, 37(3): 343-352
[32] Zhang H, Yin R, Feng X, et al. Atmospheric mercury inputs in montane soils increase with elevation: Evidence from mercury isotope signatures[J]. Scientific Reports, 2013, 3(11): 3322-3322
[33] Wang X, Zhang H, Lin C J, et al. Transboundary transport and deposition of Hg emission from springtime biomass burning in the Indo-China Peninsula[J]. Journal of Geophysical Research: Atmospheres, 2015, 120(18): 9758-9771
[35] Petkovšek S A S, Pokorny B. Lead and cadmium in mushrooms from the vicinity of two large emission sources in Slovenia [J]. Science of the Total Environment, 2013, 443: 944-954
[37] Collin-Hansen C, Andersen R A, Steinnes E. Damage to DNA and lipids in Boletus edulis exposed to heavy metals[J]. Mycological Research, 2005, 109(12): 1386-1396
[38] Schlecht M T, Säumel I. Wild growing mushrooms for the Edible City? Cadmium and lead content in edible mushrooms harvested within the urban agglomeration of Berlin, Germany[J]. Environmental Pollution, 2015, 204: 298-305
[39] JECFA. Joint FAO/WHO Expert committee on food additives. Summary and conclusions [C]. Proceedings of the Seventy-Second Meeting, Rome,Food and Agriculture Organization of the United Nations World Health Organization, 16-25 February 2010
◆
Origin and Food Safety Assessment of Mercury and Cadmium in Wild Bolete Mushrooms from Yunnan Mountainous Area
Yang Tianwei1,2, Zhang Ji1,3, Liu Honggao2, Wang Yuanzhong1,3,*
1. Institute of Medicinal Plants, Yunnan Academy of Agricultural Sciences, Kunming 650200, China 2. College of Agronomy and Biotechnology, Yunnan Agricultural University, Kunming 650201, China 3. Yunnan Technical Center for Quality of Chinese Materia Medica, Kunming 650200, China
This study investigated the transfer and accumulation of heavy metal in the environment-boletes-humansystem. The content of mercury (Hg) and cadmium (Cd) in boletes and the topsoil was determined by ICP-AES. The accumulation characteristics of heavy metal in bolete mushrooms were observed and the relationship of heavy metal contents in boletes with that in the topsoil are studied. Then the source of heavy metal Hg and Cd in boletes were analyzed. The heavy metal exposure risk via the bolete mushrooms was assessed according to the Hg or Cd Provisionally Tolerable Weekly Intake (PTWI) recommended by the United Nations Food and Agriculture Organization and the World Health Organization (FAO/WHO). The results showed that (1) There were differences in Hg and Cd contents in different species of mushroom from different origins, and the Hg and Cd content in caps were in the range of 0.92-16.00 and 4.97-24.07 mg·kg-1dw, and 0.46-8.2, 2.11-22.08 mg·kg-1dw in stipes. The Hg and Cd contents in caps were higher than that in stipes in the same bolete species and the Q(C/S)values were greater than 1. It is demonstrated that the accumulation ability of Hg and Cd in caps was stronger than that in stipes in bolete mushrooms. (2) The Hg bioaccumulation factor in caps and stipes of different boletes were in the range of 1.72-19.12 and 1.30-6.40, respectively. The Hg contents in caps and stipes were higher than the topsoil. The Hg content in caps of Boletus aereus which collected from Yongren, Chuxiong was 19.12 times higher than the topsoil, indicating that the soil was not the only source of mercury in boletes. According to the reports of “Mountain Trapping Effect of Mercury” and the reasons for the rise of the Hg content in Yunnan, it can be speculated that the Hg in Yunnan wild boletes mainly comes from atmospheric deposition. (3) The Cd bioaccumulation factor in caps and stipes of different boletes were in the range of 0.16-1.82 and 0.07-1.67, respectively.The Cd contents in most of boletes were below the topsoil, indicating that boletes Cd mainly from the soil. (4) If the adults (60 kg) take 300 g fresh bolete mushrooms a week, Hg intakes of most samples were below the acceptable intake without health risk (assuming no Hg intake by other ways). However, under the same condition, the Cd intakes from caps and stipes of Tylopinus nigerrimus were 0.722 mg and 0.662 mg, which are higher than the the acceptable intake without health risk.
heavy metal; Hg; Cd; wild bolete; edible mushroom; bioaccumulation factor; health risk; Yunnan
10.7524/AJE.1673-5897.20151130001
国家自然科学基金项目(31260496, 31460538)
杨天伟(1989-),男,硕士研究生,研究方向为野生食用菌资源评价与应用,E-mail: yangtianweizj@126.com
*通讯作者(Corresponding author), E-mail: yzwang1981@126.com
2015-11-30 录用日期:2016-01-13
1673-5897(2016)2-762-09
X171.5
A
简介:王元忠(1981-),男,硕士,助理研究员,主要从事药用植物和药用真菌资源评价和利用研究,发表学术论文190余篇。
杨天伟, 张霁, 刘鸿高, 等. 云南山区野生牛肝菌中重金属汞和镉来源分析及食用安全评估[J]. 生态毒理学报,2016, 11(2): 762-770
Yang T W, Zhang J, Liu H G, et al. Origin and food safety assessment of mercury and cadmium in wild bolete mushrooms from Yunnan mountainous area [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 762-770 (in Chinese)
