广东清远电子垃圾处理地沉积物对伸展摇蚊的慢性毒性效应
2016-12-12杜娟庞俊晓游静
杜娟,庞俊晓,游静
中国科学院广州地球化学研究所 有机地球化学国家重点实验室,广州 510640
广东清远电子垃圾处理地沉积物对伸展摇蚊的慢性毒性效应
杜娟,庞俊晓,游静
中国科学院广州地球化学研究所 有机地球化学国家重点实验室,广州 510640
电子垃圾拆解引起的环境污染和生态风险已成为全球关注的热点问题,不适当的电子垃圾拆解过程造成处理区水体沉积物受到多类有机化合物和重金属污染,直接威胁生活在沉积物中的底栖动物。在典型电子垃圾处理地广东清远采集沉积物,测定样品中以烃类为主的色谱难分离混合物(unresolved complex mixture,UCM)的含量,开展伸展摇蚊全生命周期慢性毒性测试。结果表明,清远沉积物中的UCM浓度(0.08±0.01)%接近于这类污染物对伸展摇蚊的慢性半致死性效应浓度(0.073±0.022)%。同时发现清远沉积物对以摇蚊为代表的底栖无脊椎动物具有显著慢性毒性效应,且可通过测定UCM含量初步估算。这为开展以电子垃圾处理地沉积物为代表的,受到以麻醉作用为主要致毒机制的混合物污染的沉积物的毒性评价提供了一种有效方法。
电子垃圾;色谱难分离混合物;沉积物;伸展摇蚊;慢性毒性
据统计,全世界每年超过4千万吨废旧电子产品被废弃处理,其中约有70%电子垃圾在中国处理,目前在广东、浙江两省已形成了多个较大规模的电子垃圾处理地,如广东汕头贵屿、清远龙塘石角和浙江台州[1-4]。不适当的电子垃圾处理方式,对当地气、土、水等环境介质造成了严重污染。例如,清远龙塘电子垃圾拆解区每年处理电子垃圾近百万吨,主要采用手工拆解、焚烧、填埋等粗放式的处理方式。这种处置方式导致多类污染物被释放到处理地及其周边地区环境中[5]。电子垃圾拆解造成的区域环境污染问题已引起广泛关注,目前主要集中在电子垃圾拆解区持久性有机污染物和重金属在不同环境介质中浓度水平、迁移分布、生物积累和人体暴露[6-13]。
释放到环境中的疏水性污染物易于在沉积物中蓄积,前期研究在电子垃圾处理地附近水体沉积物中频繁检测到相对高浓度的重金属和多种有机污染物,如多环芳烃、多氯联苯和溴代阻燃剂等[6-7,11,13]。这些沉积物中的污染物,一方面可在生物体中富集,并沿食物链传递,另一方面,也直接影响生活在其中的底栖生物。以底栖无脊椎动物为模式生物的沉积物毒性测试常被用作沉积物风险评价的一项重要指标[14]。Mehler等[15]运用伸展摇蚊幼虫开展10 d急性毒性测试,以此评价了珠三角城市水体沉积物毒性,他们发现71%城市河道沉积物对摇蚊幼虫具有急性致死性毒性,而其中农药残留是急性毒性的主要贡献者。与此相反,虽然在清远龙塘电子垃圾处理地河道采集的沉积物中检测到较高浓度的重金属、多环芳烃和多溴联苯醚等污染物,但是这些沉积物对摇蚊幼虫无明显急性毒性效应,因此在该研究中被选做参考沉积物[15]。进一步的研究中,Pang等[16]发现电子垃圾处理地采集的沉积物对底栖动物虽然未表现急性毒性,但在底栖环节动物夹杂带丝蚓产生的生物扰动作用下,沉积物中释放出的多环芳烃等污染物却可导致在沉积物中暴露了28 d的钩虾的生存率显著降低。这说明在这些沉积物中长时间暴露对底栖生物存在潜在危害,因此针对该区域沉积物中污染物种类繁多,但对底栖动物急性毒性相对较弱的情况,有必要发展针对表现麻醉作用机制的混合污染物的慢性毒性测试方法,更有效地评价典型电子垃圾处理地的沉积物毒性效应。
色谱难分离混合物(UCM)主要成分为石油烃,其中又以烷烃、环烷烃等饱和烃类为主。低沸点的饱和烃类,浓低度时能引起动物的麻醉和昏迷,高浓度时能造成细胞的损伤死亡,而高沸点的饱和烃类则能使生物的营养与输导系统产生紊乱,整体而言UCM是表现麻醉作用机制的烃类混合污染物[17]。本研究以UCM代表急性毒性较弱的混合污染物,以伸展摇蚊为模式生物,优化全生命周期沉积物毒性测试方法,并在清远龙塘河道采集沉积物,开展摇蚊全生命周期毒性测试,以确定所优化的慢性毒性测试方法用于评价典型电子垃圾处理地沉积物毒性的适用性。
1 材料与方法 (Materials and methods)
1.1 沉积物样品的采集与加标
清远沉积物样品取自广东省清远市龙塘镇,靠近电子垃圾拆解地的一条小溪(N23°33′28.42''和E113°01′58.04'')。慢性毒性实验的对照组沉积物采自于广东省从化市流溪河水库(N23°41'58.14"和E113°42'30.06"),前期研究结果表明该沉积物对模式动物不产生慢性毒性[18-19]。在选定河道,用不锈钢铲采集表层5 cm内沉积物,过35目不锈钢筛去除碎石和枝条后,再经4 h搅拌使其充分混合均匀后,4 ℃避光保存备用。
矿物油中含有与UCM相似的较高比例的烷烃、环烷烃等饱和烃类,在美国环保局建立毒性评价鉴定程序时被作为UCM的替代物使用[20],因此本实验用矿物油作为UCM的替代物。矿物油购自荷兰赫尔市Acros Organics公司。清远沉积物搅匀后直接用于开展摇蚊慢性毒性实验。从化沉积物除了作为空白对照之外,另取部分加入不同量的矿物油用作UCM加标沉积物,共设置3个浓度梯度(理论加标浓度分别为0.06%、0.1% 和0.5% g 矿物油·g-1沉积物干重,下同),UCM加标沉积物老化1个月后进行实验。
1.2 生物测试
1.2.1 受试生物
摇蚊幼虫,又称为红虫,是许多经济鱼类的饵料生物,其生物量约占底栖生物总量的70%~80%,几乎遍及世界所有的淡水环境,在水生食物链中占据重要环节[21]。因此,摇蚊幼虫作为重要指示动物,在水体污染和生物监测中广泛运用[14,21-24]。如图1所示,摇蚊是一种完全变态发育的昆虫,其个体发育过程包括卵、幼虫、蛹和成虫4个阶段,而健康的摇蚊卵串整体长约10~25 mm,宽度大约5~10 mm,呈“C”型,裹有透明胶状物质。

图1 摇蚊全生命周期的4个阶段Fig. 1 Four stages during a whole life cycle of Chironomid midge
1.2.2 沉积物中伸展摇蚊毒性实验
本研究采用伸展摇蚊(Chironomus dilutus),其隶属昆虫纲(Insecta)、双翅目(Diptera)、摇蚊科(Chironomidae)。慢性毒性实验所用的伸展摇蚊在本实验室长期驯化培养,培养条件的各项指标均符合美国环保局标准方法[14]。沉积物全生命周期慢性毒性测试按照Du等[18]描述的方法进行。简言之,测试用烧杯中放入60 g湿沉积物,添加250 mL中等硬水作为上覆水。实验开始,加入20只刚孵化的伸展摇蚊幼虫(< 24 h),在流动换水系统中进行毒性测试。基本测试条件包括:水温保持在(23±1) ℃,光照:黑暗时间比为16:8,1 d更换2次上覆水,每次100 mL,并每日监测温度(实测值为(23.3±0.2) ℃)、pH(实测值为(7.39±0.14))、溶解氧浓度(实测值为(5.8±1.4) mg·L-1)和电导率(实测值为(342±16) μs·cm-1)等水质参数,每隔2天测定一次上覆水中氨氮含量(实测值为(0.35±0.17) mg·L-1)。摇蚊每天投喂1次磨碎的鱼食(主要成分为鱼肉、虾肉、豆粕、维生素、矿物质和酵母等),每次1 mL,但考虑到其不同生命期的生理差异及对食物需求量和敏感性的差异等因素,食物浓度在实验过程中按照下面浓度变化:(1)实验开始后2 d内不喂食;(2)(3~7) d,0.6 g·L-1;(3)(8~12) d,3 g·L-1;(4)第13 天至实验结束,6 g·L-1。
毒性测试以A、B、C 3组同时进行,每组3个平行样。A组的摇蚊在沉积物中暴露20 d后(羽化前),筛出计算其存活率,并通过测定摇蚊幼虫的去灰分干重(ash-free dry weight,AFDW)来表征生长情况[25]。B组沉积物用于研究摇蚊幼虫全生命周期的慢性毒性效应,即沉积物暴露对摇蚊羽化和繁殖情况的影响。具体操作如下:摇蚊幼虫自毒理实验开展的第23 天起开始羽化,自此,一直到实验结束,每天记录不同阶段摇蚊的羽化时间、羽化数量、成虫死亡时间、死亡数量、卵串数量及卵数,并计算累积羽化率、羽化速率、性别比例和产卵率等非致死毒性效应参数。当B组沉积物中摇蚊幼虫全部羽化完毕后,再等待7 d之后结束全生命周期毒性测试。C组沉积物用于向B组沉积物中补充雄性摇蚊成虫。表1总结了实验过程中所测定的致死性和半致死性效应。
根据美国环保局标准方法[14]的要求,慢性毒性实验中的上覆水水质参数需满足:溶解氧浓度不低于2.5 mg·L-1,pH值不低于7.8,温度23 ℃左右,氨氮含量小于1 mg·L-1。此外,各毒性效应终点参数的数值需满足以下条件时才能保证实验数据有效可靠:对照空白样中摇蚊平均存活率在第20 天时不低于70%,实验结束时不低于65%;摇蚊羽化率不低于50%;平均每串卵所含总卵数应不小于800,且孵化率不低于80%。

表1 伸展摇蚊全生命周期毒性测试中所选致死性和亚致死性效应的毒性终点
1.3 沉积物中UCM含量分析
为测定沉积物中UCM含量,冷冻干燥的沉积物用丙酮和正己烷混合溶剂萃取,再用中性硅胶-氧化铝柱层析法净化,而净化后的沉积物萃取物中UCM含量通过正构烷烃n-C10~C38总浓度来表示。其浓度用岛津QP2010 Plus系列气相色谱-质谱联用仪(GC-MS)进行分析,采用电子轰击离子源(EI)模式,全扫描(Scan)方式。GC-MS条件:初始炉温80 ℃,保留1 min后,先以8 ℃·min-1升至250 ℃,然后再以20 ℃·min-1升至300 ℃保留38 min。载气为氦气,流量1.3 mL·min-1,不分流进样;进样量为1 μL。毛细管柱:DB-5 MS (60 m长 × 0.25 mm内径 × 0.25 μm涂层厚度)。离子源温度230 ℃;传输线温度260 ℃。通过检索NIST质谱库和标准物质色谱峰保留时间对比进行定性分析,并采用外标峰面积和多点校正曲线法定量。
1.4 数据处理
毒性测试数据(半数效应浓度)用Probit分析进行处理,而数据差异性分析使用方差分析(ANOVA)和Dunnett多重比较,显著水平设置在α = 0.05,当P < 0.05时认为数据存在显著性差异。所有的数据处理均采用SPSS13.0 软件进行。
2 结果与讨论(Results and discussion)
伸展摇蚊具有筑巢习性,幼虫发育至1龄末期时开始在沉积物中筑巢,并且一般不更换巢穴,随着幼虫体长的增加巢也越来越长,幼虫以各种藻类、细菌及含有机物的泥土、动植物遗骸、排泄物为食[26-27]。随着在污染沉积物中暴露时间的延长,摇蚊幼虫由于进食沉积物颗粒量增多和体表接触沉积物时间增长,受毒害污染物的抑制和胁迫随之增强。本实验中发现暴露在UCM加标的沉积物和电子垃圾处理地采集的野外沉积物中的摇蚊均表现出慢性毒性效应。
2.1 UCM加标沉积物对伸展摇蚊的慢性毒性效应
空白从化沉积物中未检出UCM,而加标沉积物中UCM的实测浓度分别为(0.06±0.03)%、(0.11±0.04)%和(0.34±0.17)%。如图2和3所示,沉积物中不同浓度下的UCM对伸展摇蚊的存活、生长和羽化均产生了不同程度的抑制作用。
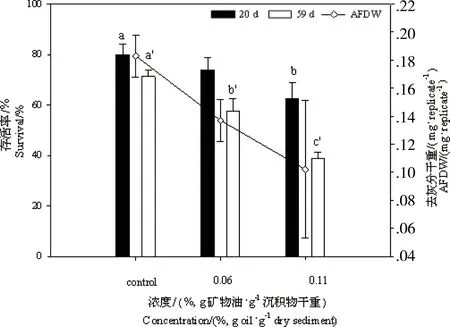
图2 在色谱难分离混合物(UCM)加标沉积物中长期暴露后伸展摇蚊的存活率与生长情况(以去灰分干重AFDW表示) 注:不同字母(a, b和a’, b’, c’)分别表示摇蚊在不同浓度下暴露20 d和59 d后的显著性差异(P < 0. 05)。Fig. 2 Percent survival and ash free dry weight (AFDW/(mg·replicate-1)) of Chironomus dilutus after chronic exposure to sediments spiked with unresolved complex mixture (UCM)Note: Significant differences (P < 0. 05) among the treatments after 20 d and 59 d exposure were indicated by different letters (a, b and a’, b’, c’), respectively.
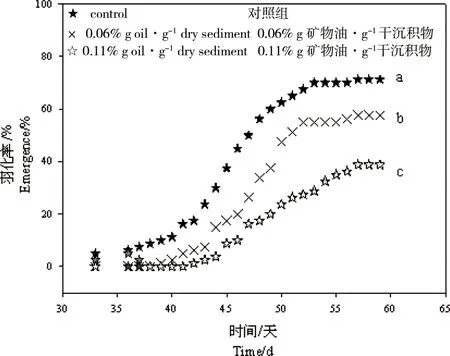
图3 在色谱难分离混合物(UCM)加标沉积物中长期暴露后伸展摇蚊羽化率与时间的关系 注:不同字母(a, b和c)表示不同暴露组的显著性差异(P < 0. 05)。Fig. 3 Cumulative emergences of Chironomus dilutus versus exposure time after chronic exposure to sediments spiked with unresolved complex mixture (UCM) Note: Significant differences (P < 0.05) among the treatments were indicated by different letters (a, b, c).
在空白对照沉积物中,摇蚊幼虫存活率在第20天和第59天毒理实验结束时分别为(80.0±4.1)%和(71.3±2.5)%,均满足实验要求[14]。随着沉积物中UCM浓度增加,摇蚊幼虫的存活率呈现明显下降趋势,在最高UCM浓度(0.34%)加标的沉积物中,摇蚊幼虫全部死亡,而UCM浓度为(0.11±0.04)%沉积物中摇蚊存活率从第20天的(62.5±6.5)%降至第59天的(38.8±2.5)%。Probit分析获得在20 d和59 d沉积物中UCM的半致死性浓度(LC50)分别为(0.100±0.075)%和(0.073±0.022)%。Sibley等[28]也曾观察到随暴露时间的延长,摇蚊存活率呈现下降趋势,他们认为2个时间点死亡率的差异是由于部分摇蚊幼虫在第20天至其成蛹前死亡[29]。同样,随着沉积物中UCM浓度增加,摇蚊幼虫的AFDW明显下降。暴露20 d后UCM对摇蚊成长所产生的5%和50%的毒性效应浓度(EC5和EC50)分别为(0.028±0.001)%和(0.010±0.075)%。因为沉积物中UCM浓度升高时,摇蚊幼虫需花费更多的能量来应对逐渐加强的毒性胁迫,所以分配到生长发育的能量相应减少,AFDW降低[30]。
当摇蚊幼虫生长受抑制时,对其羽化情况也会产生影响。图3显示UCM显著降低了摇蚊羽化率,并延缓羽化速度。沉积物中UCM对摇蚊羽化率的EC5和EC50分别为(0.008±0.000)%和(0.045±0.025)%。此外,UCM暴露对羽化后的摇蚊成虫的性别比和雌蚊产卵率都产生了影响。与对照组相比,暴露在UCM污染的沉积物中的雌性和雄性摇蚊的比例降低,且雌蚊产卵率也显著降低。以摇蚊平均产卵总数表征UCM的繁殖毒性效应,对应的EC5和EC50分别为(0.007±0.004)%和(0.039±0.020)%。整体而言,沉积物中UCM对伸展摇蚊有慢性毒性效应,对其存活率、生长情况、羽化率、产卵率和孵化率等产生不同程度的抑制作用。
2.2 清远沉积物对伸展摇蚊的慢性毒性效应
由于不适当的电子垃圾拆解过程,早期研究在清远龙塘沉积物样品中频繁检出多类重金属及持久性有机污染物[6-7,11,13,15-16]。除此之外,本实验还分析了清远沉积物中的UCM含量(0.08±0.01)%,该结果接近于全生命周期暴露实验结束时(第59天)UCM对摇蚊的LC50值(0.073 ±0.022)%。
与UCM污染的沉积物一样,电子垃圾处理地沉积物对摇蚊表现出慢性毒性效应,图4显示了清远沉积物的慢性暴露对摇蚊的存活与生长情况的影响。从图4中可见,空白对照组中,第20天和59 天毒性实验结束时摇蚊幼虫存活率分别为(80.0±4.1)%和(71.3±2.5)%,而暴露在清远电子垃圾拆解地附近河道采集的沉积物中摇蚊的存活率分别为(65.0±4.1)%和(41.0±5.7)%(分别在第20天和第59天测定)。另外,图4也显示了浓度为0.11%的UCM加标沉积物中摇蚊存活率,在第20天和第59天分别为(62.5±6.5)%和(38.8±2.5)%。
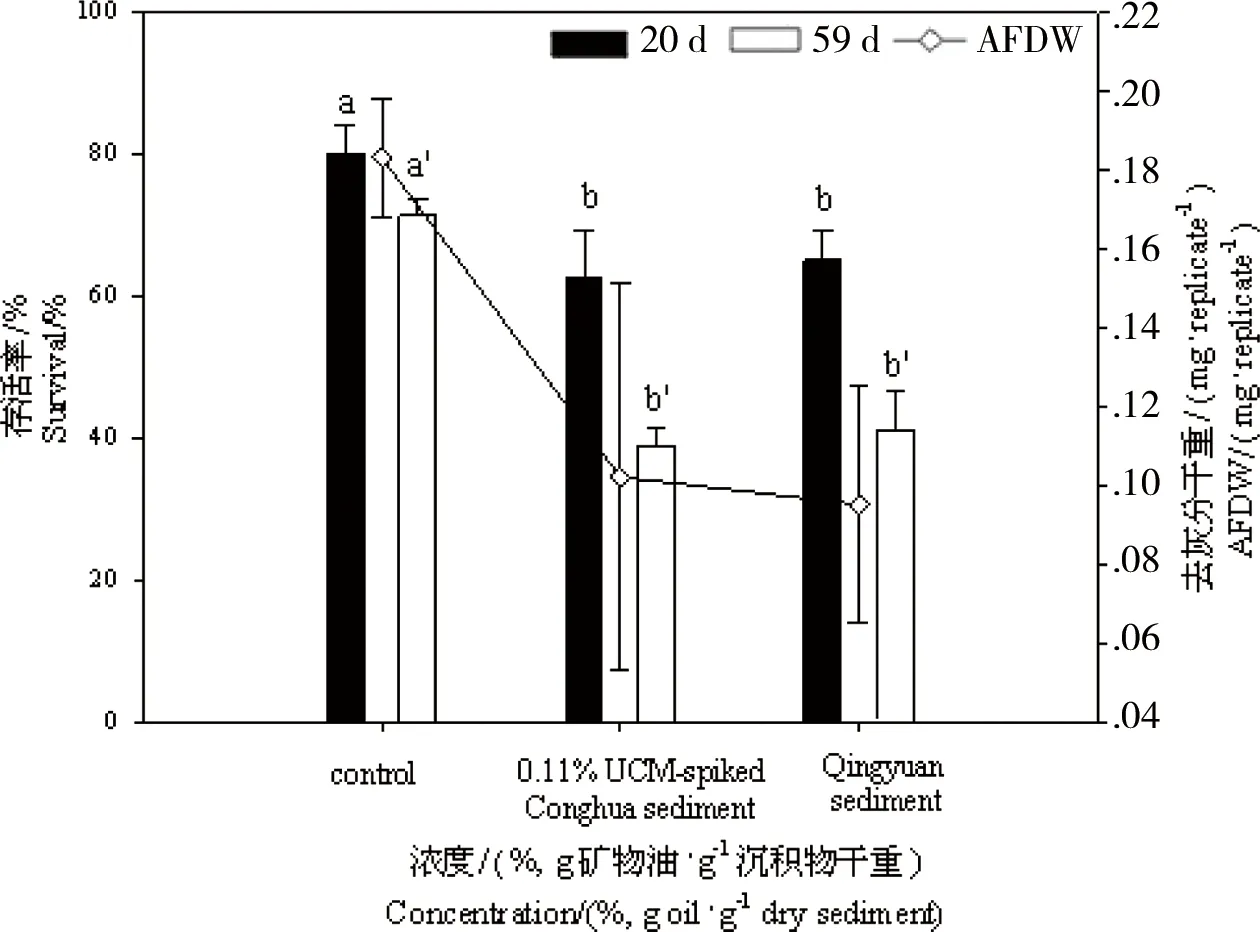
图4 在不同沉积物(从化对照组沉积物、0.11%UCM加标沉积物和清远沉积物)中长期暴露后伸展摇蚊的存活率与生长情况(以去灰分干重AFDW表示) 注:不同字母(a, b和a’, b’)分别表示摇蚊在不同浓度下暴露20 d和59 d后的显著性差异(P < 0. 05)。Fig. 4 Percent survival and ash free dry weight (AFDW/(mg·replicate-1)) of Chironomus dilutus after chronic exposure to different sediments (Conghua control, 0.11% UCM-spiked and Qingyuan sediments) Note: Significant differences (P < 0. 05) among the treatments after 20 d and 59 d exposure were indicated by different letters (a, b and a’, b’), respectively.
此外,与空白对照组相比,清远沉积物中暴露的摇蚊幼虫生长情况也明显受到了抑制,暴露20 d后摇蚊幼虫的平均AFDW显著低于对照组(降低了约40%),该结果却和0.11% 的UCM加标沉积物中摇蚊的生长情况相当。当摇蚊幼虫生长受到抑制时,其羽化和繁殖等也均会受到影响[31]。由此可见,虽然清远沉积物在10 d急性毒性测试中未对摇蚊幼虫产生毒性效应,但是在该沉积物中长时间暴露的摇蚊的生存、生长、羽化和繁殖却都受到了抑制。
2.3 以UCM为混合污染物代表的电子垃圾处理地沉积物慢性毒性评价
如图4所示,尽管UCM含量为(0.08±0.01)%的清远电子垃圾处理地沉积物中还同时存在其他多种类型的污染物,其对伸展摇蚊的致死和生长的影响与(0.11±0.01)%的UCM加标沉积物相当(20 d, P = 0.88; 59 d, P = 0.74)。除此之外,其他毒性终点也表现出相似性,如累积羽化率(清远沉积物(13.8±7.5)%,加标沉积物(35±13.5)%)、性别比(清远沉积物0.78 ± 0.38,加标沉积物0.80 ± 0.58)。这说明通过简单测定电子垃圾处理地沉积物中UCM含量,可初步评估沉积物的慢性毒性效应。可能原因是尽管电子垃圾处理所释放的污染物种类繁多,但是大多数都是以麻醉作用为主要致毒机制,在这些区域的沉积物中如农残等具有特殊作用机制的污染物含量较低。在这种情况下,电子垃圾相关混合污染物对底栖无脊椎动物的慢性毒性可用同样以麻醉作用为主要致毒机制的UCM进行初步估算。
综上所述,本实验以伸展摇蚊为模式生物,利用UCM加标沉积物建立了一套有效的摇蚊全生命周期慢性毒性测试方法,并以此评价了清远龙塘采集的典型电子垃圾处理区沉积物的慢性毒性。结果显示尽管电子垃圾处理地沉积物对底栖无脊椎动物未表现急性毒性,但是在长时间暴露后,却会对伸展摇蚊的存活、生长、羽化和繁殖等产生不同程度的抑制作用。对于主要组成以麻醉致毒机理为主的复合污染型沉积物,如电子垃圾处理地采集的沉积物样品,测定其中UCM含量可为沉积物对底栖动物的慢性毒性提供简单有效的初步评估,为受电子垃圾污染的水体沉积物中混存污染物风险评价提供一定手段。
[1] 彭平安, 盛国英, 傅家谟. 电子垃圾的污染问题[J]. 化学进展, 2009, 21(2/3): 550-557
Peng P A, Sheng G Y, Fu J M. The pollution by electronic and electric wastes [J]. Progress in Chemistry, 2009, 21(2/3): 550-557 (in Chinese)
[2] Ni H G, Zeng E Y. Law enforcement and global collaboration are the keys to containing E-waste Tsunami in China [J]. Environmental Science & Technology, 2009, 43: 3991-3994
[3] Ni H G, Zeng H, Tao S, et al. Environmental and human exposure to persistent halogenated compounds derived from e-waste in China [J]. Environmental Toxicology and Chemistry, 2010, 29: 1237-1247
[4] 袁剑刚, 郑晶, 陈森林, 等. 中国电子废物处理处置典型地区污染调查及环境、生态和健康风险研究进展[J]. 生态毒理学报, 2013, 8(4): 473-486
Yuan J G, Zheng J, Chen S L, et al. Advances in the research on pollution investigations and environmental, ecological, and health risks from e-waste recycling activities in China [J]. Asian Journal of Ecotoxicology, 2013, 8(4): 473-486 (in Chinese)
[5] Zhang K, Schnoor J L, Zeng E Y. E-waste recycling:Where does it go from here? [J]. Environmental Science & Technology, 2012, 46(20): 10861-10867
[6] Wu J P, Luo X J, Zhang Y, et al. Bioaccumulation of polybrominated diphenyl ethers (PBDEs) and polychlorinated biphenyls (PCBs) in wild aquatic species from an electronic waste (e-waste) recycling site in South China [J]. Environment International, 2008, 34(8): 1109-1113
[7] 罗勇, 罗孝俊, 杨中艺, 等. 电子废物不当处置的重金属污染及其环境风险评价Ⅳ. 电子废物不当回收地区流域水体沉积物的重金属污染[J]. 生态毒理学报, 2008, 3(4): 343-349
Luo Y, Luo X J, Yang Z Y, et al. Studies on heavy metal contamination by improper handling of E-waste and its environmental risk evaluation IV. Heavy metal contamination of sediments in a small scale valley impacted by E-waste treating activities [J]. Asian Journal of Ecotoxicology, 2008, 3(4): 343-349 (in Chinese)
[8] 张荧, 吴江平, 罗孝俊, 等. 多溴联苯醚在典型电子垃圾污染区域水生食物链上的生物富集特征[J]. 生态毒理学报, 2009, 4(3): 338-344
Zhang Y, Wu J P, Luo X J, et al. Bioaccumulation of polybrominated diphenyl ethers in a contaminated freshwater food web from an e-waste recycling site, South China [J]. Asian Journal of Ecotoxicology, 2009, 4(3): 338-344 (in Chinese)
[9] He M J, Luo X J, Yu L H, et al. Tetrabromobisphenol-A and hexabromocyclododecane in birds from an e-waste region in South China: Influence of diet on diastereoisomer- and enantiomer-specific distribution and trophodynamics [J]. Environmental Science & Technology, 2010, 44: 5748-5754
[10] Li H Z, Bai J M, Li Y T, et al. Short-range transport of contaminants released from e-waste recycling site in South China [J]. Journal of Environmental Monitoring, 2011, 13(4): 836-843
[11] Zhang B Z, Li H Z, Wei Y L, et al. Bioaccumulation kinetics of polybrominated diphenyl ethers and decabromodiphenyl ethane from field-collected sediment to the oligochaete, Lumbriculus variegatus [J]. Environmental Toxicology and Chemistry, 2013, 32(12): 2711-2718
[12] 杨彦, 王宗庆, 王琼, 等. 电子垃圾拆解场多环境介质多氯联苯(PCBs)污染特征及风险评估[J]. 生态毒理学报, 2014, 9(1): 133-144
Yang Y, Wang Z Q, Wang Q, et al. Characteristics and environment risk assessment of PCBs in multimedia environment of the electronic waste dismantling venues [J]. Asian Journal of Ecotoxicology, 2014, 9(1): 133-144 (in Chinese)
[13] Li H Z, Zhang B Z, Wei Y L, et al. Bioaccumulation of highly hydrophobic organohalogen flame retardants from sediment: Application of toxicokinetics and passive sampling techniques [J]. Environmental Science & Technology, 2014, 48(12): 6957-6964
[14] U.S. Environment Protection Agency (USEPA). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates [S]. Washington DC: USEPA, 2000
[15] Mehler W T, Li H Z, Lydy M J, et al. Identifying the causes of sediment-associated toxicity in urban waterways of the Pearl River Delta, China [J]. Environmental Science & Technology, 2011, 45(5): 1812-1819
[16] Pang J X, Sun B Q, Li H Z, et al. Influence of bioturbation on bioavailability and toxicity of PAHs in sediment from an electronic waste recycling site in South China [J]. Ecotoxicology and Environmental Safety, 2012, 84: 227-233
[17] 岳战林, 蒋平安. 石油类污染物的特性及环境行为[J]. 石化技术与应用, 2006, 24(4): 307-309
Yue Z L, Jiang P A. Characteristics and environmental behavior of petroleum pollutants [J]. Petrochemical Technology & Application, 2006, 24(4): 307-309 (in Chinese)
[18] Du J, Pang J X, You J. Bioavailability-based chronic toxicity measurements of permethrin to Chironomus dilutus [J]. Environmental Toxicology and Chemistry, 2013, 32: 1403-1410
[19] Du J, Li Y L, Huang C, et al. Chronic toxicity thresholds for sediment-associated benzo[a]pyrene in the midge (Chironomus dilutus) [J]. Archives of Environmental Contamination and Toxicology, 2014, 66: 370-378
[20] U.S. Environment Protection Agency (USEPA). Sediment Toxicity Identification Evaluation (TIE) Phases I, II, and III Guidance Document [S]. Washington DC: USEPA, 2007
[21] 张彤, 金洪钧. 摇蚊幼虫的水生生态毒理学研究进展[J]. 环境保护科学, 1995, 21: 17-21
Zhang T, Jin H J. Advance in the ecotoxicology study about Chironomid larva [J]. Environmental Protection Science, 1995, 21: 17-21 (in Chinese)
[22] Benoit D A, Sibley P K, Juenemann J L, et al. Chironomus tentans life-cycle test: Design and evaluation for use in assessing toxicity of contaminated sediments [J]. Environmental Toxicology and Chemistry, 1997, 16: 1165-1176
[23] Du J, Mehler W T, Lydy M J, et al. Toxicity of sediment-associated unresolved complex mixture and its impact on bioavailability of polycyclic aromatic hydrocarbons [J]. Journal of Hazardous Materials, 2012, 203-204: 169-175
[24] 张彤, 金洪钧. 丙烯腈、乙腈和硫氰酸钠对摇蚊幼虫的急性毒性[J]. 污染防治技术, 1996, 9: 12-14
Zhang T, Jin H J. Acute toxicity of acrylonitrile, acetonitrile and sodium rhodanide to Chironomus sp [J]. Pollution Control Technology, 1996, 9: 12-14 (in Chinese)
[25] Maul J D, Brennan A A, Harwood A D, et al. Effect of sediment-associated pyrethroids, fipronil, and metabolites on Chironomus tentans growth rate, body mass, condition index, immobilization, and survival [J]. Environmental Toxicology and Chemistry, 2008, 27: 2582-2590
[26] Armitage P D, Cranston P S, Pinder L C V. The Chironomidae: The Biology and Ecology of Non-biting Midges [M]. Schaumburg: Springer Science Business Media Dordrecht, 1995: 611-738
[27] 刘洪霞, 高希武, 冷培恩. 花翅摇蚊乙酰胆碱酯酶的底物专一性及对胆碱酯酶抑制剂敏感度的比较[J]. 应用与环境生物学报, 2008, 14: 211-214
Liu H X, Gao X W, Leng P E. Substrate specificity of acetylcholinesterase and its sensitivity to cholinesterase inhibitor in Chironomus kiinensis [J]. Chinese Journal of Applied and Environmental Biology, 2008, 14: 211-214 (in Chinese)
[28] Sibley P K, Monson P D, Ankley G T. The effect of gut contents on dry weight estimates of Chironomus tentans larvae: Implications for interpreting toxicity in freshwater sediment toxicity tests [J]. Environmental Toxicology and Chemistry, 1997, 16(8): 1721-1726
[29] Benoit D A, Sibley P K, Juenemann J L, et al. Chironomus tentans life-cycle test: Design and evaluation for use in assessing toxicity of contaminated sediments [J]. Environmental Toxicology and Chemistry, 1997, 16: 1165-1176
[30] Jager T, Crommentuijn T, van Gestel C A M, et al. Simultaneous modeling of multiple endpoints in life-cycle toxicity tests [J]. Environmental Science & Technology, 2004, 38: 2894-2900
[31] Taylor E J, Blockwell S J, Maund S J, et al. Effects of lindane on the life-cycle of a freshwater macroinvertebrate Chironomus riparius Meigen (Insecta, Diptera) [J]. Archives Environmental Contamination and Toxicology, 1993, 24: 145-150
◆
Chronic Toxicity of Sediment Collected from an E-waste Recycling Site in Qingyuan, Guangdong toChironomusdilutus
Du Juan, Pang Junxiao, You Jing*
State Key Laboratory of Organic Geochemistry, Guangzhou Institute of Geochemistry, Chinese Academy of Sciences, Guangzhou 510640, China
Received 3 December 2015 accepted 23 December 2015
Environmental pollution and ecological risk caused by e-waste recycling have become a great concern. Improper e-waste recycling activities may cause sediment contamination by organic pollutants and heavy metals, posing a potential threat to benthic organisms. Sediment samples which were collected from Qingyuan, a representative e-waste recycling site, were analyzed for unresolved complex mixture (UCM) and evaluated for the toxicity using a life-cycle toxicity testing with a benthic invertebrate, Chironomus dilutus. The concentration of UCM in Qingyuan sediment was (0.08±0.01)% (g oil·g-1dry sediment) and it was close to the chronic median lethal concentration of UCM to C. dilutus (0.073±0.022)%. In addition, the sediments from Qingyuan e-waste recycling site exhibited significant chronic toxicity to C. dilutus, and the toxicity could be estimated by measuring UCM contents in sediment. This study provided a valuable method for assessing chronic toxicity of sediments which were contaminated by a mixture of chemicals with narcotic mode of action, such as sediments in e-waste recycling sites.
E-waste; unresolved complex mixture; sediment; Chironomus dilutus; chronic toxicity
10.7524/AJE.1673-5897.20151129008
国家自然科学基金(41222024, 41273120)
杜娟(1984-),女,博士,研究方向为生态风险评价,E-mail: zixia0716@163.com
*通讯作者(Corresponding author), E-mail: youjing@gig.ac.cn
2015-12-03 录用日期:2015-12-23
1673-5897(2016)2-209-07
X171.5
A
简介:游静(1974-),女,博士,研究员,主要研究方向为沉积物生态风险评价,发表学术论文80余篇。
杜娟, 庞俊晓, 游静. 广东清远电子垃圾处理地沉积物对伸展摇蚊的慢性毒性效应[J]. 生态毒理学报,2016, 11(2): 209-215
Du J, Pang J X, You J. Chronic toxicity of sediment collected from an e-waste recycling site in Qingyuan, Guangdong to Chironomus dilutus [J]. Asian Journal of Ecotoxicology, 2016, 11(2): 209-215 (in Chinese)
