截短侧耳素产生菌原生质体的制备条件优化及再生*
2016-12-12都雯玥王鸣刚梁剑平陆锡宏李雪虎
都雯玥,王鸣刚,梁剑平,陆锡宏,李雪虎
(1兰州理工大学生命科学与工程学院,兰州730000;2中国科学院近代物理研究所,兰州 730000)
截短侧耳素产生菌原生质体的制备条件优化及再生*
都雯玥1,2,王鸣刚1,梁剑平2,陆锡宏2,李雪虎2
(1兰州理工大学生命科学与工程学院,兰州730000;2中国科学院近代物理研究所,兰州 730000)
以截短侧耳素产生菌Clitopilus pinsitus为材料,通过单因素和正交实验,研究菌龄、酶系、酶浓度、酶解时间、温度及稳渗剂对C.pinsitus原生质体制备和再生的影响。实验结果表明,制备原生质体的最佳条件为:5d菌龄,0.4mol/L甘露醇稳渗剂,2.0%蜗牛酶和2.0%纤维素酶混合酶,25℃酶解1.5h,原生质体产量5.9×107个/mL,其再生率为1.2‰。实验为截短侧耳素高产菌株原生质体诱变育种奠定基础。
微生物;斜盖菇属;原生质体;单因素实验;正交实验;优化
自1951年Kavanagh发现斜盖菇属中个别菌株能够生产抗生素截短侧耳素以来,研究者进一步发现还有大约8种斜盖菇属的菌种具有产生截短侧耳素的能力,如Clitopiluspinsitus[1,2]。截短侧耳素是二萜类抗生素,研究表明它对青霉素及链霉素抗性葡萄球菌具有较高的抗菌作用,而且截短侧耳素经过化学基团修饰后,其衍生物具有更强的抗菌性[3,4]。由于截短侧耳素产生菌发酵生长较慢,截短侧耳素产量偏低,越来越难以满足日渐提高的市场需求[5],所以要求通过工业诱变育种的方法获得截短侧耳素高产菌株。
原生质体对诱变剂敏感,原生质体诱变技术与常规诱变相比有较高的突变率并在抗生素、维生素、氨基酸等高产菌株选育中均取得较好的进展[6]。李艳丽对刺芹侧耳原生质体进行紫外诱变,选育出多糖和漆酶高产菌株[7]。Stewart使用5%诺瓦酶234在25℃水解2h获得C.pinsitus原生质体并进行常规诱变处理,选育出截短侧耳素高产菌株[8]。因此,原生质体诱变育种是一种工业育种的重要手段。原生质体制备则是原生质体诱变育种的基础,提高原生质体产量是该育种技术成功应用的重要前提[9]。
原生质体产量受酶系、菌龄、稳渗剂等多个条件的影响。张萍使用纤维素酶、蜗牛酶、溶菌酶对黑曲霉、冬菇、平菇等多种丝状真菌进行酶解法制备原生质体[10]。李江研究菌龄、酶解时间对毛栓菌原生质体制备的影响,其制备率为5.0×106个/mL[11]。李春丽优化蛹虫草原生质制备温度、稳渗剂等条件,原生质体产量为9.2×106个/mL[12]。实验以C.pinsitus为材料,通过设计单因素实验和正交实验,优化影响制备C.pinsitus原生质体的条件,如破壁酶系、稳渗剂、酶解温度等,为截短侧耳素高产菌原生质体诱变育种奠定基础。
1 材料与方法
1.1 材料
1)供试菌株。截短侧耳素生产菌Clitopiluspinsitus由山东东药药业股份有限公司提供。
2)培养基及试剂。斜面培养基:麦芽提取物1.9%、葡萄糖0.4%、酵母浸粉0.4%、棉籽粉0.3%、琼脂2.0%、pH自然。
液体培养基:麦芽提取物1.9%、葡萄糖0.4%、酵母浸粉0.4%、棉籽粉0.3%、硝酸钙0.05%、碳酸钙0.05%、pH6.2。
甘露醇稳渗剂:按实验设计浓度,称取甘露醇溶于去离子水中,高压灭菌备用。
蔗糖稳渗剂:按实验设计浓度,称取蔗糖溶于去离子水中,高压灭菌备用。
硫酸镁稳渗剂:按实验设计浓度,称取MgSO4? 7H2O溶于去离子水中,0.22μm滤膜过滤除菌备用
氯化钾稳渗剂:按实验设计浓度,称取氯化钾
溶于去离子水中,高压灭菌备用。
酶解液:按实验设计的浓度要求精确称取溶壁酶(上海索宝生物科技有限公司)、蜗牛酶(上海索宝生物科技有限公司)、纤维素酶溶解于相应稳渗剂中,0.22μm滤膜过滤除菌备用。
1.2 方法
1)菌丝培养及收集从斜面培养基铲取约5mm2大小菌块,加5mL0.9%NaCl并用研磨器研磨后,菌液接入250mL锥形瓶中,温度25℃,湿度40%~50%,静置培养至实验设计要求的时间[9]。
培养至时间要求的菌丝移入离心管,在15mL离心管中加入5mL0.9%NaCl,振荡混匀,2000r/min离心10min,弃上清液,重复两次。加入实验设计要求的稳渗液,2000r/min离心10min,弃上清液,获得菌丝。称量记录菌丝湿重。
2)原生质体制备及计数按照每克菌丝加入5mL酶解液的比例,15mL离心管中加入酶解液,振荡混匀后放入水浴锅,按实验设计要求的温度、时间酶解,每隔30min振荡一次。酶解终止后,四层灭菌擦镜纸过滤酶解混合液[13]。收集滤液,2000r/min离心10min,弃上清液,除去酶解液。沉淀中加入5mL稳渗剂,轻微振荡混匀,2000r/min离心10min,弃上清液,洗去残余酶解液,重复两次。最后加入1mL稳渗剂,得到原生质体悬浮液。血球计数板计数。
1.2.3 单因素试验
1)酶系种类优化实验 选取溶壁酶、蜗牛酶、纤维素酶、溶壁酶蜗牛酶复合酶、溶壁酶纤维素酶复合酶、蜗牛酶纤维素酶复合酶总计6种酶系进行酶解破壁。酶解液浓度2%,0.6mol/L甘露醇稳渗剂,25℃酶解2h制备的原生质体悬浮液用血球计数板计数,以原生质体产量最高为指标,筛选最佳制备酶。
2)稳渗剂种类优化实验选取甘露醇、蔗糖、硫酸镁、氯化钾4中稳渗剂制备原生质体。确定稳渗剂浓度为0.6mol/L,2%溶壁酶,25℃酶解2h制备的原生质体悬浮液用血球计数板计数,以原生质体产量最高为指标,筛选最佳制备稳渗剂。
3)酶解时间优化实验 设定0.5h,1.0h,1.5h,2.0h,2.5h,3.0h6个酶解时长。2%溶壁酶,0.6mol/L甘露醇稳渗剂,25℃酶解制备的原生质体悬浮液用血球计数板计数,以原生质体产量最高为指标,筛选最佳制备时间。
4)正交实验设计L(45)正交实验优化菌龄、酶浓度、稳渗剂浓度、和酶解温度条件(见表1)。制备的原生质体悬浮液用血球计数板计数,以原生质体产量最高为指标,筛选最佳制备条件。

表1 原生质体制备及再生条件因素水平表
2 结果与分析
2.1 原生质体制备酶系种类优化
如图1所示,使用2%蜗牛酶+2%纤维素酶复合酶制备出的原生质体产量较高,为1.6×107个/mL。2%纤维素酶,2%溶壁酶+2%纤维素酶复合酶,以及2%溶壁酶+2%蜗牛酶复合酶较低,为106个/mL。纤维素酶单酶原生质体产量最低。实验确定使用2%蜗牛酶+2%纤维素酶复合酶为最优酶系。
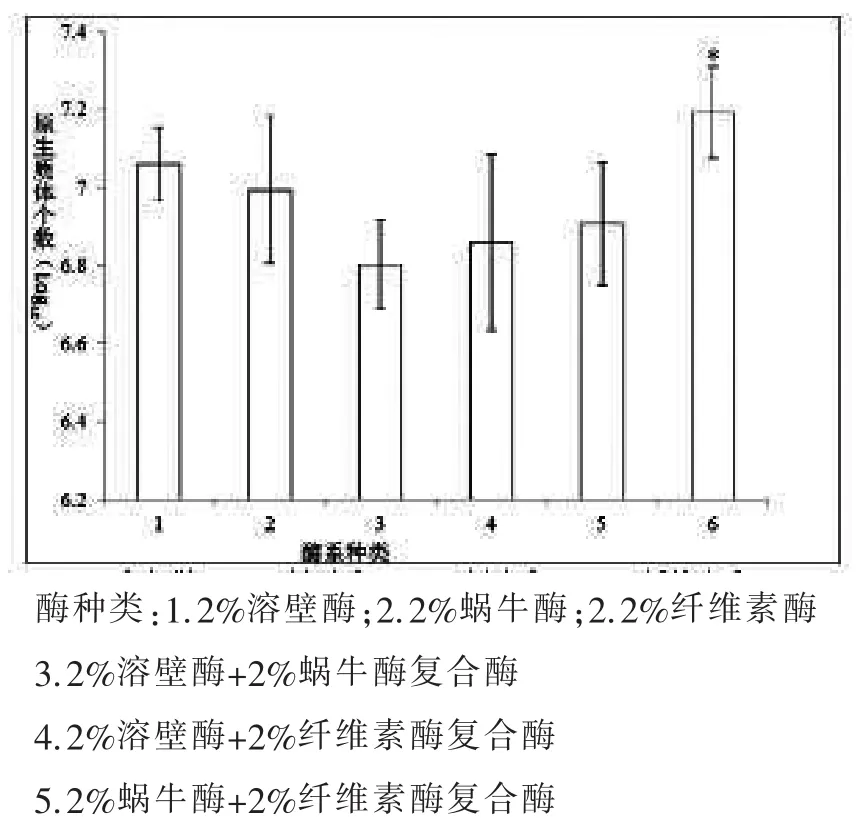
图1 不同酶系对原生质体制备的影响
2.2 原生质体制备稳渗剂种类优化
有机稳渗剂更有利于制备原生质体。甘露醇是制备原生质体的最优稳渗剂(如图2所示)。使用甘露醇稳渗剂,原生质体产量达到3.9×107个/mL,而使用无机稳渗剂,如硫酸镁稳渗剂,其原生质体产量仅为5.0×106个/mL。
2.3 原生质体制备酶解时间优化
根据图3所示,随时间的增加,破壁酶分解细胞壁,使原生质体不断释放,在酶解1.5h后原生质体产
量为9.8×107个/mL。之后原生质体产量成平缓下降的趋势。实验确定1.5h为最优酶解时长。

图2 不同稳渗剂对原生质体制备的影响

图3 酶解时间对原生质体制备的影响
2.4 原生质体制备其他条件优化及再生
正交实验结果直观分析表明(见表2),菌龄对原生质体制备有显著影响(见表3),也是影响原生质体再生的主要因素。5d菌龄的菌丝体其原生质体产量最高,3d菌龄或9d菌龄的产量偏低,而且5d菌龄的原生质体再生率也高于其他的菌龄。温度对原生质体制备影响最低,但是对原生质体的再生有较大影响,故为保证原生质体再生率较高,实验选取25℃作为酶解温度。稳渗剂浓度对原生质体制备的影响次之,确保原生质体生物活性,最有利于原生质体产量的稳渗剂浓度为0.2mol/L,但实验表明最适合原生质体再生的稳渗剂浓度为0.4mol/L,为确保原生质体不会胀破,实验选定0.4mol/L甘露醇为最优稳渗剂。酶浓度对原生质体的制备与再生没有显著影响(见表3,表4)。实验表明2.5%蜗牛酶+2.5%纤维素酶混合酶使原生质体质量最高,是最佳制备酶浓度,但1.5%蜗牛酶+1.5%纤维素酶混合酶更有利于原生质体的再生。
最终确定最佳制备及再生条件为5d菌龄,2.0%蜗牛酶+2.0%纤维素酶复合酶,0.4mol/L甘露醇,酶解1.5h。该条件重复试验3次,原生质体制备量为5.9×107个/mL,其再生率为1.20‰。

表2 正交试验结果直观分析表

表3 原生质体制备正交实验方差分析

表4 原生质体再生正交实验方差分析
3 讨论
酶解法制备原生质体是一种酶促反应,受酶种类、酶浓度、时间等条件的影响。酶的选取是依据细胞壁成分和菌种的不同决定的。曹文芩等使用蜗牛酶和溶壁酶的复合酶制备灵芝原生质体,陈敏等使用溶壁酶制备杏鲍菇原生质体,均获得满足实验需求数量的原生质体[15,16]。实验考察6种不同酶系,结果表明适用于C.pinsitus原生质体制备的酶系为蜗牛酶和纤维素酶复合酶。真菌细胞壁由几丁质和β-葡聚糖构成,蜗牛酶和纤维素酶分别以几丁质和β-葡聚糖为底物分解细胞壁,促使原生质体释放。溶壁酶是分解几丁质和β-葡聚糖的复合酶[17]。实验溶壁酶中加入蜗牛酶或纤维素酶,原生质体产量反而降低,这是由于作用于细胞壁的酶浓度过高导致原生质体破裂,结果降低了产量[18]。实验酶解时间也是影响原生质体制备的重要因素。实验表明酶解时间不应过长,过长则降低原生质体的产量。细胞壁酶解残余物有助于原生质体再生,过长时间的酶解破坏原生质体细胞壁,降低其再生率,二是破壁酶降低原生质体活性,也会影响再生率[15]。
菌龄对原生质体制备有显著影响。实验发现培养5d的菌丝处于对数生长期,菌丝量足,细胞壁较薄,最有利于原生质体制备[16]。3d菌龄偏小,菌丝娇嫩,原生质体不稳定,产量也较低,而9d菌龄偏老,细胞壁较厚,色素沉积,破壁困难[13]。
曹文芩研究发现有机稳渗剂更有利于原生质体的稳定释放[15],与实验结果相一致。稳渗剂使细胞皱缩,一是形成质壁分离的状态利于细胞壁分解,二是保证原生质体不会胀破,维持其生理活性[16]。稳渗剂为破壁酶提供作用环境,也提供原生质体的存在环境,对原生质体制备十分重要。实验表明甘露醇是最优的有机稳渗剂,何小慧等研究结论相符,而稳渗剂浓度对原生质体产量没有显著影响,为避免原生质体胀破选择较高的浓度[14-16]。
实验静置培养菌丝进行原生质体制备,研究比较摇床培养和静置培养发现后者是最佳菌丝培养方式。摇床培养形成致密的菌丝球,不利于内部菌丝与破壁酶接触,而静置培养形成絮状菌丝,增加了菌丝和酶的接触,提高了原生质体产量[9、19]。
影响原生再生关键因素是制备的细胞是否含有细胞核。张萍等[10]观察制得的原生质体,发现有空泡或不完整的原生质体,这些细胞最终都不能再生,所以从丝状真菌制备原生质体的再生率一般都很低。
原生质体诱变技术是对原生质体进行物理或化学诱变处理,经过再生培养,选育突变菌株。丁晓兵用N+辐照钝齿棒杆菌原生质体,选育再生菌株,获得遗传稳定性较好的L-异亮氨酸高产菌,其产率比原始菌株提高43.66%。针对实验使用的C.pinsitus这类丝状多核体的担子菌,特别是其在实验室环境培养下不产生孢子这一特点[8],采用原生质体诱变技术既能获得单个细胞进行诱变选育,也能拓宽突变株的变异幅度。因此,优化截短侧耳素产生菌原生质体制备条件为高产菌株诱变选育奠定了基础,为微生物诱变育种提供了一种新方法。
[1]Kavanagh F,Hervby A,Robbins W.J Antibiotic Substances From Basidiomycetes.VIII.Pleurotus mutilus(FR.)SACC. AndPleurotusPasseckerianusPilat[J].PNAS,1951,37∶570-574.
[2]Hartley A.J,de Mattos-Shipley K,Collins C.M,et al.Investigating pleuromutilin-producing Clitopilus species and related basidiomycetes[J].FEMSMicrobiolLetter,2009,297∶24-30.
[3]Davidovich C,Bashan A,Auerbach-Nevo T,et al.Induced-fit tightens pleuromutilins binding to ribosomes and remote in teractions enable their selectivity[J].PNAS,2007,104(11)∶4291-4296.
[4]Tsukagoshi T,Tokiwano T,Oikawa H.Studies on the later stage of the biosynthesis of pleuromutilin[J].Biosci.Biotech nol.Biochem,2007,71(12),3116-3121.
[5]Mattos-Shipley K,Hayes R.Collins C,et al,Biobased antibiotics from basidios∶a case study on the identification and manipulation of a gene cluster involved in pleuromutilin biosyn thesis from Clitopilus passeckerianus[R].Proceedings of the 7th International Conference on Mushroom Biology and Mushroom Products,2011,section mycosourced molecules and nutritional quality∶224-231.
[6]丁晓兵,李宗伟,刘晓波等.原生质体诱变在工业微生物育种中的应用进展[J].食品工业科技.2008,29(7)∶260-262.
[7]李艳丽.原生质体技术筛选刺芹侧耳高产多糖和漆酶菌株的研究[D].吉林∶吉林农业大学,2012.
[8]Stewart K R.Amethod for preparation of protoplasts from Clitopilus pinsitus[J].Journal of Antibiotics,1986,39(10)1486-1487.
[9]朱坚,张鹏.白灵菇原生质体制备条件的优化[J].中国农学通报,2011,27(25)∶153-157.
[10]张萍,马宗孚.几种丝状真菌原生质体的形成与再生[J].云南大学学报(自然科学版),1990, 12(3)∶255-261.
[11]李江,袁月祥,闫志英,刘晓风,廖银章,李娜.毛栓菌原生质体制备和再生及单核菌株产漆酶特性[J].菌物学报, 2012,31(1)∶102~109.
[12]李春丽,刘晓兰,郑喜群,等.蛹虫草原生质体紫外诱变选育胞外多糖高产菌株.工业微生物,2011,41(2)∶51-56.
[13]刘玉霞.侧耳属真菌原生质体技术选育高产菌株研究[D].河北∶河北大学,2006.
[14]何小慧,杨民和.杏鲍菇原生质体制备条件的研究[J].安徽农学通报,2014,20(06)∶15-17.
[15]张鹏,龚玲凤,庄卫东等.杏鲍菇原生质体制备条件初探[J].中国农学通报,2013,29(31)∶91-95.
Q93-33
甘肃省陇药产业发展专项(Y361010SJ0)项目;甘肃省国际科技合作专项(1504WKCA098)。
