磁固相萃取与纳米金比色法联合检测蛋清中的溶菌酶
2016-12-12马向东
贾 丽, 马向东, 姚 欣, 王 宇
(华南师范大学生物光子学研究院,激光生命科学教育部重点实验室,广州 510631)
磁固相萃取与纳米金比色法联合检测蛋清中的溶菌酶
贾 丽*, 马向东, 姚 欣, 王 宇
(华南师范大学生物光子学研究院,激光生命科学教育部重点实验室,广州 510631)
基于柠檬酸根包覆的纳米金(AuNPs)比色法对溶菌酶(LZ)进行快速测定. 当有LZ存在时,由于LZ与AuNPs的相互作用导致分散性良好的AuNPs发生聚集,从而使AuNPs溶液的颜色由红色变为蓝色. AuNPs溶液在625 nm和525 nm的吸光度比率(A625/A525)与LZ浓度在10~100 nmol/L范围内有很好的线性相关关系,因此LZ的含量可以通过裸眼观测AuNPs溶液的颜色变化或用紫外可见分光光度计进行快速测定,LZ的最低检测限为10 nmol/L. 将所建立的AuNPs比色法与磁固相萃取技术相结合对蛋清中LZ的含量进行了测定.
比色检测; 纳米金; 溶菌酶; 磁固相萃取
溶菌酶(LZ)作为一种碱性水解酶,广泛分布于哺乳动物的组织和分泌物、蛋清以及牛奶中[1-3]. LZ除了具有水解活性,还表现出其它如抗菌、抗肿瘤以及免疫调节等功能[4-6]. 据研究报道,LZ已经应用于伤口治疗[7]、抑制肿瘤生长[5]等方面. LZ作为抗菌剂和食品防腐剂,能够有效抑制有害微生物的生长,因此也被广泛应用于食品工业领域[4,8-9]. 由于LZ在食品工业和医疗行业具有非常广泛的应用,因此LZ检测技术获得了越来越多的关注.
目前,LZ检测方法包括微生物学测定法[10]、液相色谱法[11-12]、免疫分析法[11,13]、毛细管电泳法[14]、毛细管电色谱法[15]和电化学方法[16]等. 尽管这些检测方法能够有效检测LZ,但是,这些方法需要相应的大型仪器设备或者比较麻烦的操作过程. 因此,建立一种简单、快速又不需要大型仪器设备的LZ检测方法非常必要.
通过观察颜色的变化对物质进行检测的比色法是一种理想的快速检测方法. 近些年来,纳米金(AuNPs)由于其与距离相关的光学特性而受到广泛关注,当溶液中AuNPs粒子之间的距离大于自身的平均粒径时,溶液呈现红色;当粒子间距离接近或者小于自身平均粒径时,溶液呈现蓝色[17]. AuNPs比色法就是通过待测物质直接或者间接与AuNPs相互作用而发生颜色的改变来达到检测目标物的方法,这种方法不需要复杂的仪器设备. 此外,由于AuNPs具有较高的吸光系数,因此能够检测出较低含量的待测物. AuNPs比色法已经被应用于检测环境污染物[18-19]、抗生素残留[20]、三聚氰胺[21]、蛋白[22-23]等.
已有文献报道AuNPs比色法被应用于LZ的检测.HUANG等[24]报道了一种五肽(Cys-Ala-Leu-Asn-Asn)包覆的AuNPs作为比色探针,在LZ存在的条件下会发生聚集,进而达到检测LZ的目的;CHEN等[25]制备了人血红白蛋白(HSA)修饰AuNPs,带正电的LZ通过静电作用诱导带负电的HSA修饰的AuNPs发生聚集,从而达到检测LZ的目的. 这两种方法虽然能够检测LZ,但是制备修饰AuNPs的过程非常耗时. SU等[26]报道了带负电的适配体通过静电作用诱导带正电的AuNPs发生聚集,溶液由红色变为蓝色,加入LZ之后,由于LZ与适配体结合,使得带正电的AuNPs解聚,溶液恢复至红色,基于该现象对LZ进行检测. WANG等[27]报道了适配体能够使AuNPs稳定分散在高离子强度的盐溶液中,但加入LZ之后,由于适配体与LZ的结合,使得AuNPs在高盐溶液中发生聚集,溶液由红色转变为蓝色,进而达到检测LZ的目的,这两种方法需要合成LZ的特异性适配体. 本文将柠檬酸根包覆的AuNPs作为比色探针对LZ进行快速检测,该方法不需要对AuNPs进行进一步的修饰,同时,测定时无需加入其他的诱导剂.
1 实验部分
1.1 材料与试剂
氯金酸(HAuCl44H2O)购于上海国药;柠檬酸钠(Na3C6H5O72H2O)购于广东光华科技股份有限公司;硝酸(HNO3)购于洛阳化学试剂厂;十二水合磷酸氢二钠(Na2HPO412H2O)和二水合磷酸二氢钠(NaH2PO42H2O)购于广州化学试剂厂;磷酸(H3PO4)购于天津大茂化学试剂厂;α-酪蛋白(α-Cas,Mw2.5×104,pI 4.2~4.7)、β-酪蛋白(β-cas,Mw2.4×104,pI 4.8~5.1)、κ-酪蛋白(κ-Cas,Mw1.9×104,pI 4.6~5.1)、α-乳白蛋白(α-Lac,Mw1.4×104,pI 4.4)、β-乳球蛋白(β-Lg,Mw1.8×104,pI 5.2)、细胞色素c(Cyc,Mw1.3×104,pI 10.2)、核糖核酸酶A(Rnase A,Mw1.37×104,pI 9.3)购于Sigma-Aldrich公司(Saint Louis, MO, USA);LZ(Mw1.44×104,pI 11.1)、卵清蛋白(OVA,Mw4.43×104,pI 4.5)、伴清蛋白(Con A,Mw7.72×104,pI 6.0)购于广州捷倍斯生物科技有限公司;牛血清白蛋白(BSA,Mw6.7×104,pI 4.8)、牛血红蛋白(BHb,Mw6.45×104,pI 6.8)购于上海伯奥生物科技有限公司. 鸡蛋从超市购买. 实验用水来自英国Elga公司(ELGA, London, UK)超纯水系统.
1.2 主要仪器
微量分光光度计K5600(北京凯奥科技发展有限公司);透射电子显微镜(JEM-2100HR,日本JEOL公司);粒径分布测定仪(Zetasizer Nano ZS,英国Malvern公司).
1.3 AuNPs制备
AuNPs采用柠檬酸还原法制备[28]. 步骤:首先将100 mL HAuCl44H2O溶液(1 mmol/L)油浴加热至沸腾,然后向其中加入5 mL Na3C6H5O7溶液(38.8 mmol/L),溶液由无色转变至酒红色后,继续加热搅拌20 min,保持搅拌使溶液冷却至室温,最后将制备好的AuNPs在4 ℃条件下保存待用.
1.4 比色法检测LZ
1 mL AuNPs溶液在4 ℃离心(10 000 r/min)15 min去除无色的上清液,然后以1 mL磷酸缓冲液(PBS, 10 mmol/L,pH 10.0)进行重悬. 依据HAISS等[29]报道的纳米金浓度的测定方法,用紫外可见光谱法测得AuNPs的浓度为0.48 nmol/L. 100 nmol/L LZ的储存液在20 mmol/L PBS溶液(pH 10.0)中制得. 将20 μL重悬的AuNPs溶液加入到80 μL LZ溶液中,在室温条件下震荡30 s,用紫外可见分光光度计测定其吸光度. 探究影响LZ检测的条件,包括PBS溶液的浓度和pH,LZ同AuNPs孵育的时间以及AuNPs的量.
选择α-Cas、β-Cas、κ-Cas、α-Lac、β-Lg、BSA、OVA、BHb、Con A、Rnase A、Cyc作为对比蛋白. 20 μL重悬的AuNPs溶液分别加入到80 μL的各种蛋白溶液中来研究AuNPs对LZ的选择性,整个检测过程如图1所示.

图1 AuNPs比色法检测蛋白示意图
Figure 1 Schematic illustration of colorimetric detection of proteins by AuNPs
1.5 鸡蛋清的预处理
通过测定蛋清中的LZ含量来评价所建立的AuNPs比色法对真实样品测定的可行性. 为了避免蛋清中其他组分的干扰,样品用CHEN等[30]报道的方法进行预处理. 步骤如下:首先用20 mmol/L PBS(pH 10.0)将鸡蛋清进行体积比1∶1的稀释,并将稀释的鸡蛋清通过冰水浴搅拌6 h,之后在4 ℃离心(10 000 r/min)30 min,取上清液;其次用20 mmol/L PBS(pH 10.0)将上清液稀释2倍,再向稀释后含有LZ的上清液0.2 mL中加入0.4 mg的聚苯乙烯磺酸钠修饰的磁粒(PSS-MNPs)进行吸附实验;然后用含有1.0 mol/L NaCl的PBS(20 mmol/L,pH 7.0)溶液将吸附到PSS-MNPs上的LZ洗脱下来,并用PBS(20 mmol/L,pH 10.0)溶液将洗脱下来的溶液稀释1 000倍;最后,将20 μL重悬的AuNPs溶液加入到80 μL稀释后的洗脱液中,孵育30 s之后进行紫外可见检测.
2 结果与讨论
2.1 AuNPs和AuNPs-LZ复合物的表征
AuNPs和AuNPs-LZ复合物用紫外可见吸收光谱、动态光散射以及透射电子显微镜(TEM)分析进行表征(图2). 从TEM(图2A)可以看出AuNPs是粒径大约30 nm的球形颗粒;动态光散射分析得到AuNPs的平均粒径是30.4 nm,同TEM分析的结果吻合,由此表明AuNPs具有良好的分散性;由紫外可见吸收光谱图(图2B)可知,AuNPs的最大吸收峰在525nm,AuNPs-LZ复合物的最大吸收峰在625 nm,向长波方向发生移动,该结果表明LZ可诱导AuNPs发生聚集,聚集后的AuNPs的吸收波长向长波方向移动,溶液颜色由红色变为蓝色(图2C),同TEM图中AuNPs-LZ复合物的聚集状态一致(图2D). 动态光散射分析聚集的AuNPs的平均尺寸为615.1 nm,进一步表明LZ诱导了AuNPs的聚集.
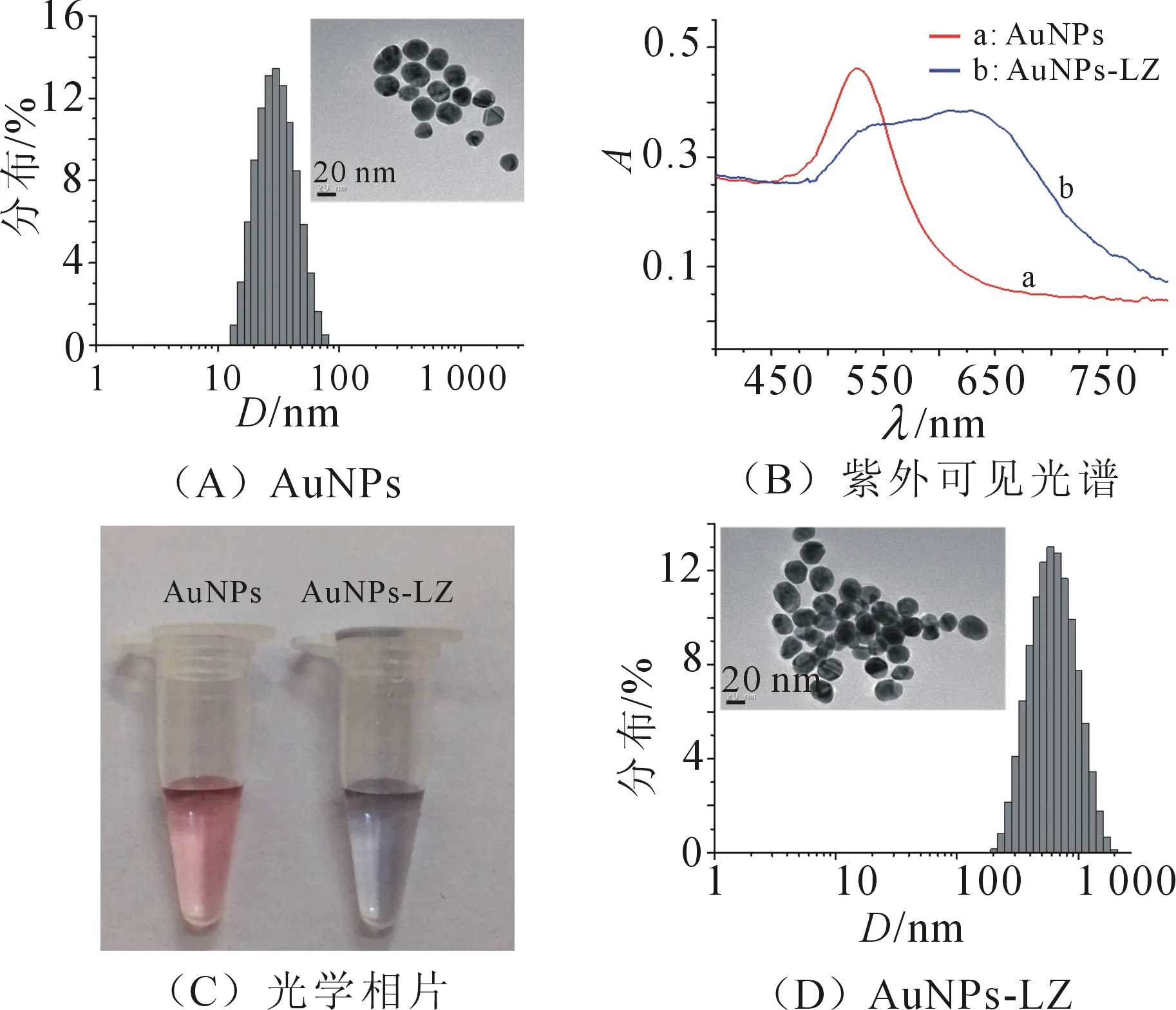
图2 AuNPs和AuNPs-LZ复合物的粒径分布、TEM、紫外可见光谱及相片
Figure 2 Size distribution, TEM images, UV-vis spectra, corresponding photographs of well-dispersed AuNPs and AuNPs-LZ conjugates
2.2 LZ诱导AuNPs发生聚集的机制
将重悬的AuNPs(0.48 nmol/L,20 μL)溶液分别加入到不同浓度的LZ溶液(10~100 nmol/L,80 μL)中,其紫外可见图谱及相对应的照片如图3所示,检测溶液为20 mmol/L PBS(pH 10.0),孵育时间为30 s,从c到h,LZ分别为0、10、30、50、70、100 nmol/L,LZ溶液体积为80 μL,AuNPs溶液体积为20 μL. 随着LZ浓度的增加,AuNPs在525 nm处的吸收减小,在625 nm处增大,而且相对应的照片表明溶液颜色由红色逐渐变为紫色,最终变为蓝色. AuNPs表面有大量带负电荷的柠檬酸根离子,会稳定AuNPs防止其聚集[31]. LZ(pI 11.1)在pH 10.0 的PBS溶液中带正电荷. 当20 μL重悬的AuNPs溶液加入到80 μL LZ溶液中时,带正电的LZ会通过静电作用诱导带负电的AuNPs发生聚集. 聚集的AuNPs的最大吸收峰将会向长波方向移动,因此溶液颜色由红色变为蓝色.

图3 不同浓度LZ加入AuNPs溶液的紫外可见光谱及照片
Figure 3 UV-vis spectra and corresponding photographs of AuNPs solutions after addition of different concentrations of LZ
2.3 优化比色法检测LZ的实验条件
对AuNPs比色法检测LZ的实验条件进行考察和优化.
首先探讨AuNPs与LZ孵育时间的影响(图4),检测溶液为20 mmol/L PBS(pH 10.0),LZ为100 nmol/L,LZ溶液体积为80 μL,AuNPs溶液体积为20 μL. 当孵育时间为30 s时,A625/A525值达稳定,进一步延长时间,A625/A525基本不变,由此表明LZ可通过静电作用诱导AuNPs快速发生聚集,因此,孵育时间30 s作为随后的实验条件.

图4 孵育时间对AuNPs比色法检测LZ的影响(n=3)
Figure 4 Effect of incubation time on the detection of LZ by AuNPs (n=3)
其次,探讨检测溶液的pH对比色法检测LZ的影响(图5),检测溶液为20 mmol/L PBS,孵育时间为30 s,LZ为100 nmol/L,LZ溶液体积为80 μL,AuNPs溶液体积为20 μL.A625/A525在溶液pH 4.0~10.0之间基本保持稳定,当溶液pH超过10.0时,A625/A525发生明显下降. 这个结果进一步表明LZ通过静电相互作用诱导AuNPs聚集,因为在pH 4.0~10.0之间AuNPs带负电荷,而LZ带正电荷. 为了提高AuNPs比色法对LZ检测的选择性,选择pH 10.0作为检测的条件,因为在pH 10.0的条件下,等电点小于10的蛋白会带负电荷,因此可以消除这些蛋白对LZ的检测干扰.
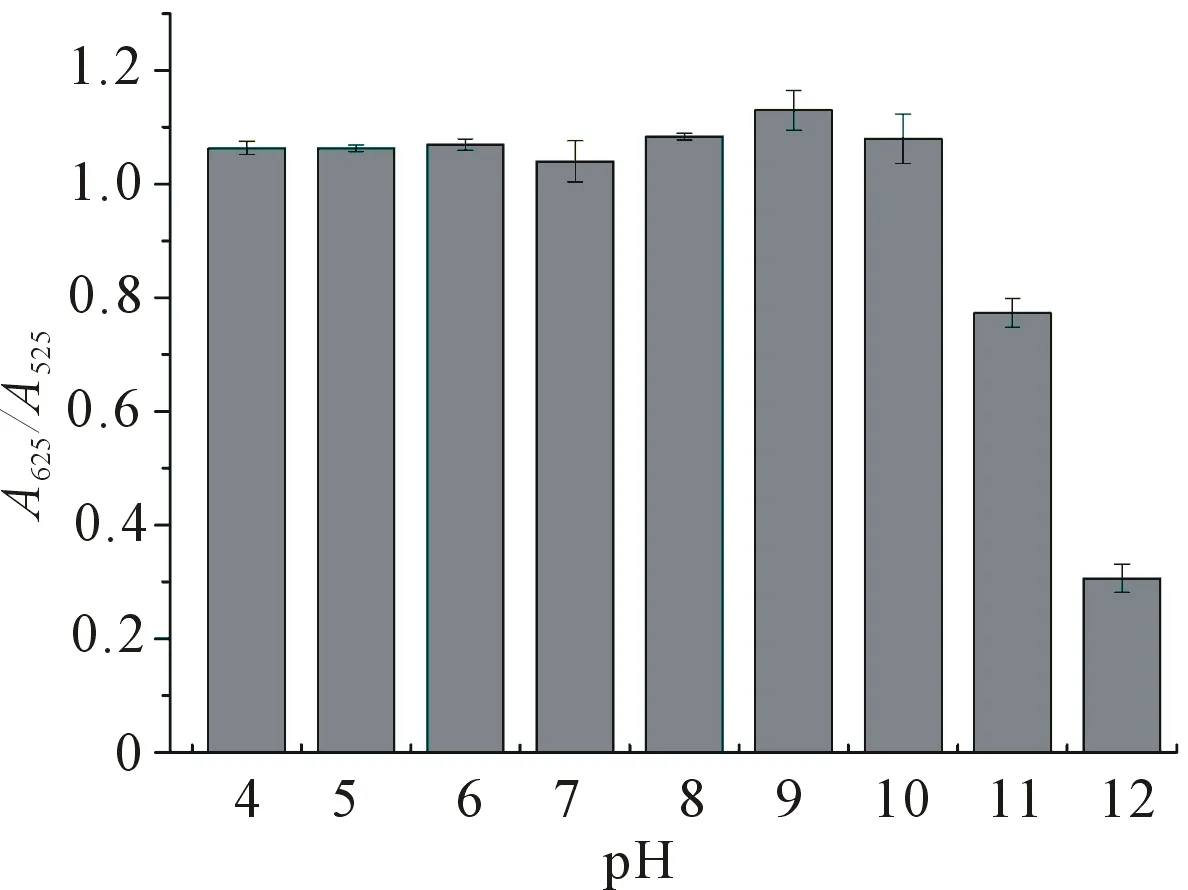
图5 溶液pH对AuNPs比色法检测LZ的影响(n=3)
然后,探讨PBS(pH 10.0)溶液的浓度对比色法检测LZ影响(图6),检测溶液pH 10.0,孵育时间为30 s,AuNPs溶液体积为20 μL,PBS溶液(从i到m)分别为10、20、30、40和50 mmol/L.

图6 PBS浓度对AuNPs比色检测LZ的影响(n=3)
Figure 6 Effect of concentration of phosphate solution on the detection of LZ by AuNPs (n=3)
当PBS低于20 mmol/L时,A625/A525没有明显的变化,但超过20 mmol/L时,A625/A525明显增加,表明AuNPs会逐渐发生聚集,溶液由红色逐渐变为蓝色,该实验结果表明高浓度的磷酸根离子会诱导AuNPs聚集. 因此,选择20 mmol/L PBS(pH 10.0)作为检测溶液.
最后,探讨AuNPs的体积对比色法检测LZ的影响(图7),检测溶液为20 mmol/L PBS(pH 10.0),孵育时间为30 s,总体积为100 μL,LZ为80 nmol/L. 在保证总体积100 μL、LZ为80 nmol/L的条件下,通过加入不同体积的AuNPs(0.48 nmol/L)来调节AuNPs的量. 当AuNPs的体积超过20 μL时,A625/A525的比值达到稳定. 因此,选择20 μL AuNPs(0.48 nmol/L)作为AuNPs的加入量.
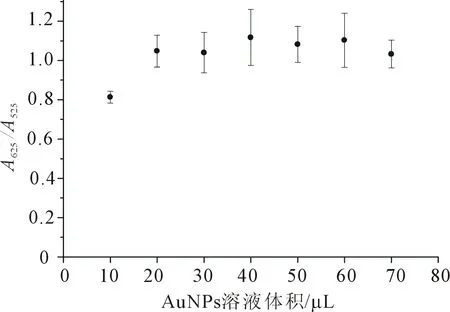
图7 AuNPs的量对检测LZ的影响(n=3)
2.4 AuNPs比色法对LZ检测的选择性
α-Cas、β-Cas、κ-Cas、α-Lac、β-Lg、BSA、OVA、BHb、Con A、Rnase A、Cyc作为对比蛋白来研究AuNPs对LZ检测的选择性(图8),检测溶液为20 mmol/L PBS(pH 10.0),孵育时间为30 s,各蛋白浓度为100 nmol/L,各蛋白溶液体积为80 μL;AuNPs溶液体积为20 μL,蛋白种类(1~13)包括空白、LZ、α-Cas、β-Cas、κ-Cas、α-Lac、β-Lg、BSA、OVA、BHb、Con A、Rnase A、Cyc等.
当将AuNPs溶液(20 μL)加入到LZ溶液(100 nmol/L,80 μL)中时,AuNPs迅速发生聚集,颜色由红色变为蓝色,当将AuNPs溶液加入到其他蛋白溶液时,AuNPs并没有发生聚集,因此溶液颜色没有发生变化,只有LZ导致A625/A525比值明显增加,该结果表明AuNPs在碱性条件下(20 mmol/L PBS,pH 10.0)对LZ表现出一定的选择性. 在pH 10.0的条件下,高等电点的LZ携带正电荷,Cyc基本不带电荷,而其它低等电点的蛋白携带负电荷,AuNPs在该条件下携带负电荷,因此,依据静电相互作用的机理,LZ会诱导柠檬酸根离子包覆的AuNPs发生聚集.
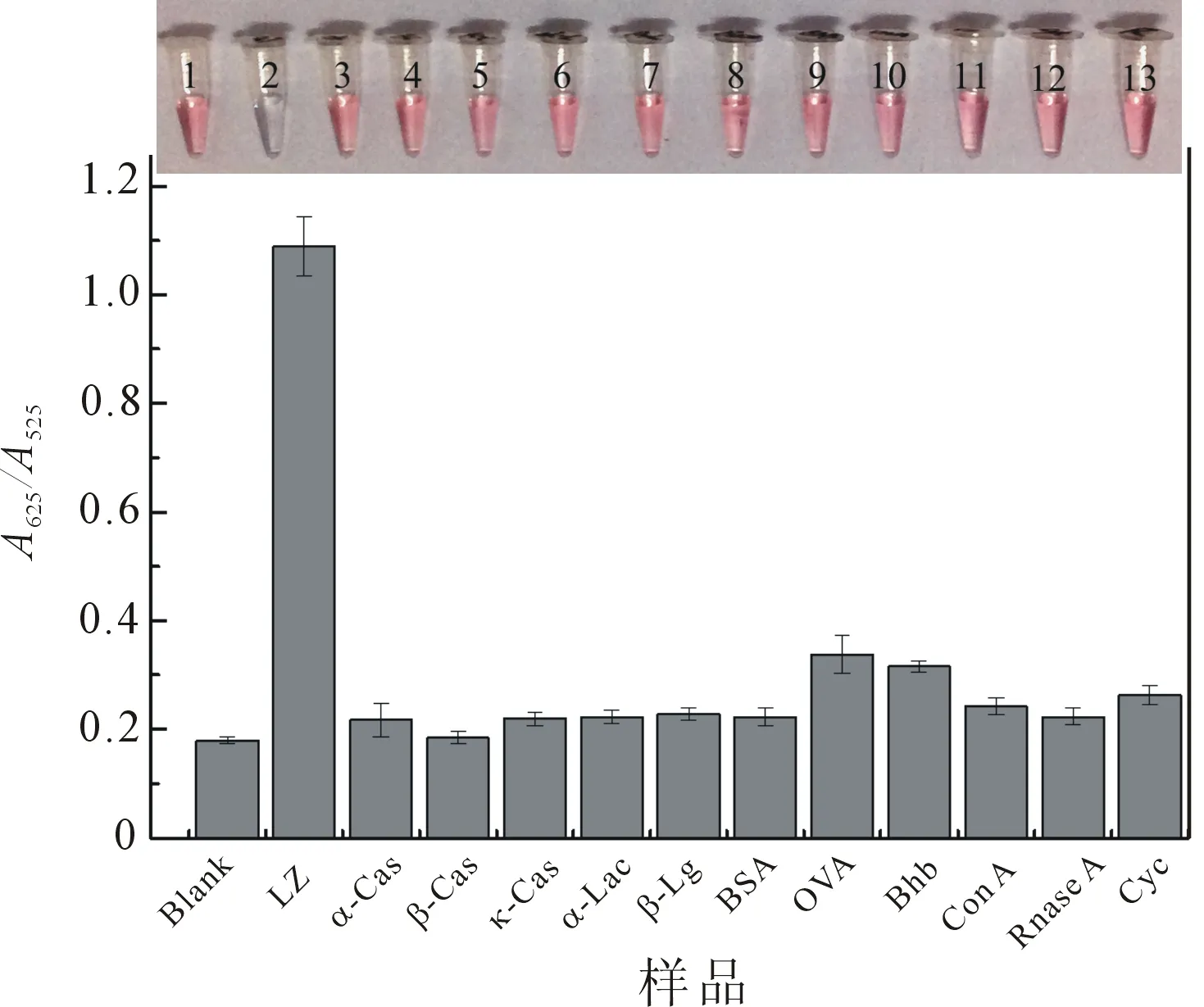
图8 12种蛋白加入到AuNPs溶液后的吸光度比率及相应照片(n=3)
Figure 8 Absorption ratios of AuNPs solutions after addition of 12 kinds of proteins and corresponding photographs (n=3)
2.5 LZ检测的灵敏度
随着LZ由10 nmol/L增加到100 nmol/L,AuNPs在625 nm处的吸光度逐渐增大(图3),在525 nm处吸光度明显下降. 绘制吸光度比值(A625/A525)与LZ物质的量浓度(c)的线性相关图,得到线性方程A625/A525=0.009 0c+ 0.14 (R=0.994 5),LZ的最低检测限为10 nmol/L.
2.6 真实样品检测
将所建立的方法对鸡蛋清中的LZ进行了检测(图9),检测溶液为20 mmol/L PBS(pH 10.0),孵育30 s,经稀释的蛋清提取液体积为80 μL,AuNPs溶液体积为20 μL.
由于AuNPs比色法对样品基体的离子强度和pH非常敏感,因此,首先用PSS-MNPs作为吸附剂的磁固相萃取方法[30]对鸡蛋清进行了前处理,然后用所建立的AuNPs比色法对蛋清中的LZ进行检测. 当将AuNPs溶液(0.48 nmol/L,20L)加入处理后的蛋清溶液后,AuNPs溶液的颜色由红色变为蓝紫色. 蛋清中LZ的浓度通过测定为0.21 mmol/L(即3.02 g/L),所测得结果与已经报道的蛋清中的LZ浓度基本一致[14].
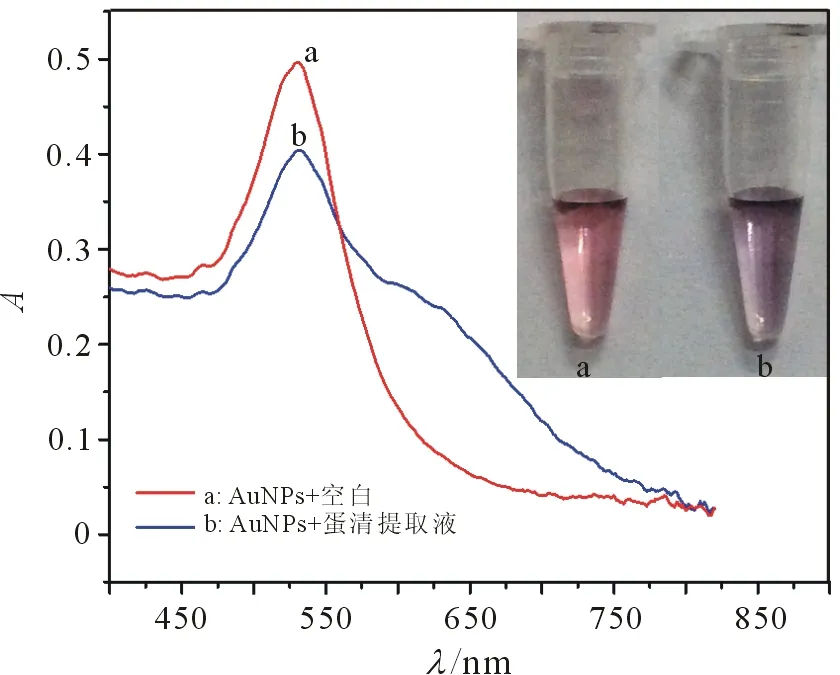
图9 AuNPs比色法检测蛋清提取物紫外可见吸收光谱、照片
3 结论
采用30 nm AuNPs通过比色法对LZ进行了快速检测. 带正电的LZ能够在碱性条件下(20 mmol/L PBS,pH 10.0)通过静电作用诱导带负电的AuNPs发生聚集,使其颜色由红色变为蓝色. 在pH 10.0条件下,AuNPs对LZ表现出良好的选择性. 通过与已报道[24-27]的AuNPs比色法检测LZ进行比较,如表1所示,该方法更加简单快速,无需对AuNPs进行进一步的修饰,而且不需要加入其它的诱导剂. 该方法与磁固相萃取方法相结合成功用于检测蛋清中的LZ.

表1 不同AuNPs比色法检测LZ的对比
[1] FLEMING A,ALLISON V D. Observations on a bacteriolytic substance (“Lysozyme”) found in secretions and tissues[J]. British Journal of Experimental Pathology,1922,3(5):252-260.
[2] ALDERTON G,WABD W H,FEVOLD H L. Isolation of lysozyme from egg white[J]. Journal of Biological Chemistry,1944,157(1):43-58.
[3] LÖNNERDAL B. Bioactive proteins in breast milk[J]. Journal of Paediatrics & Child Health,2013,49(S1):1-7.[4] MASSCHALCK B,MICHIELS C W. Antimicrobial properties of lysozyme in relation to foodborne vegetative bacteria[J]. Critical Reviews in Microbiology,2008,29(3):191-214.[5] MAHANTA S,PAUL S,SRIVASTAVA A,et al. Stable self-assembled nanostructured hen egg white lysozyme exhibits strong anti-proliferative activity against breast can-cer cells[J]. Colloids & Surfaces B: Biointerfaces,2015,130:237-245.
[6] HELAL R,MELZIG M F. In vitro effects of selected saponins on the production and release of lysozyme activity of human monocytic and epithelial cell lines[J]. Scientia Pharmaceutica,2011,79(2):337-349.
[7] CHARERNSRIWILAIWAT N,OPANASOPIT P,ROJANARATA T,et al. Lysozyme-loaded,electrospun chitosan-based nanofiber mats for wound healing[J]. International Journal of Pharmaceutics,2012,427(2): 379-384.
[8] HUGHEY V L,WILGER P A,JOHNSON E A. Antibacterial activity of hen egg white lysozyme against lysteria monocytogenes scott A in foods[J]. Applied & Environmental Microbiology,1989,55(3):631-638.
[9] GAO Y C,ZHANG G,KRENTZ S,et al. Inhibition of spoilage lactic acid bacteria by lysozyme during wine alcoholic fermentation[J]. Australian Journal of Grape & Wine Research,2008,8(1):76-83.
[10]SHUGAR D. The measurement of lysozyme activity and the ultra-violet inactivation of lysozyme[J]. Biochimica Et Biophysica Acta,1952,8(3):302-309.
[11]KERKAERT B,MESTDAGH F,DE MEULENAER B. Detection of hen’s egg white lysozyme in food: comparison between a sensitive HPLC and a commercial ELISA method[J]. Food Chemistry,2010,120:580-584.
[12]BRASCA M,MORANDI S,SILVETTI T,et al. Different analytical approaches in assessing antibacterial activity and the purity of commercial lysozyme preparations for dairy application[J]. Molecules,2013,18(5):6008-6020.
[13]BROUWER J,VAN LEEUWEN-HERBERTS T,OTTING-VAN DE RUIT M. Determination of lysozyme in serum,urine,cerebrospinal fluid and feces by enzyme immunoassay[J]. Clinica Chimica Acta,1984,142(1): 21-30.
[15]HSIEH Y L,CHEN T H,LIU C Y. Capillary electrochromatographic separation of proteins on a column coated with titanium dioxide nanoparticles[J]. Electrophoresis,2006,27(21):4288-4294.
[16]CHEN Z,LI L,ZHAO H,et al. Electrochemical impedance spectroscopy detection of lysozyme based on electrodeposited gold nanoparticles[J]. Talanta,2011,83(5):1501-1506.
[17]RECHBERGER W,HOHENAU A,LEITNER A,et al. Optical properties of two interacting gold nanoparticles[J]. Optics Communications,2003,220(1/2/3):137-141.
[18]BERLINA A N,SHARMA A K,ZHERDEV A V,et al. Colorimetric determination of lead using gold nanoparticles[J]. Analytical Letters,2015,48(5):766-782.
[19]LIU B,TAN H,CHEN Y. Visual detection of silver(I) ions by a chromogenic reaction catalyzed by gold nanoparticles[J]. Microchimica Acta,2013,180(5/6): 331-339.
[20]HE L,LUO Y,ZHI W,et al. Colorime-tric sensing of tetracyclines in milk based on the assembly of cationic conjugated polymer-aggregated gold nanoparticles[J]. Food Analytical Methods,2013,6(6):1704-1711.
[21]YUN W,LI H,CHEN S,et al. Aptamer-based rapid visual biosensing of melamine in whole milk[J]. European Food Research & Technology,2014,238(6):989-995.
[22]LEPOITEVIN M,LEMOUEL M,BECHELANY M,et al. Gold nanoparticles for the bare-eye based and spectrophotometric detection of proteins,polynucleotides and DNA[J]. Microchimica Acta,2014,182(5/6):1223-1229.
[23]DU J,XIA Z M. Interactions of Gold nanoparticles and lysozyme by fluorescence quenching method[J]. Analytical Letters,2012,45(15):2236-2245.
[24]HUANG H,ZHANG Q,LUO J,et al. Sensitive colorime-tric detection of lysozyme in human serum using peptide-capped gold nanoparticles[J]. Analytical Methods,2012,4(11):3874-3878.
[25]CHEN Y M,YU C J,CHENG T L,et al. Colorimetric detection of lysozyme based on electrostatic interaction with human serum albumin-modified gold nanoparticles[J]. Langmuir,2008,24(7):3654-3660.
[26]SU J,ZHOU W,XIANG Y,et al. Target-induced charge reduction of aptamers for visual detection of lysozyme based on positively charged gold nanoparticles[J]. Che-mical Communications,2013,49(69):7659-7661.
[27]WANG X,XU Y,CHEN Y,et al. The gold-nanoparticle-based surface plasmon resonance light scattering and visual DNA aptasensor for lysozyme[J]. Analytical & Bioanalytical Chemistry,2011,400(7):2085-2091.
[28]FRENS G. Controlled nucleation for the regulation of the particle size in monodisperse gold suspensions[J]. Nature Physical Science,1973,241:20-22.
[29]HAISS W,THANH N T,AVEYARD J,et al. Determination of size and concentration of gold nanoparticles from UV-vis spectra[J]. Analytical Chemistry,2007,79(11):4215-4221.
[30]CHEN J,LIN Y,JIA L. Preparation of anionic polyelectrolyte modified magnetic nanoparticles for rapid and efficient separation of lysozyme from egg white[J]. Journal of Chromatography A,2015,1388:43-51.
[31]ZHAO W,BROOK M A,LI Y. Design of gold nanoparticle-based colorimetric biosensing assays[J]. Chembiochem A European Journal of Chemical Biology,2008,9(15):2363-2371.
【中文责编:成文 英文责编:李海航】
Colorimetric Detection of Lysozyme in Egg White Using Gold Nanoparticles in Combination with Magnetic Solid Phase Extraction
JIA Li*, MA Xiangdong, YAO Xin, WANG Yu
(Ministry of Education Key Laboratory of Laser Life Science & Institute of Laser Life Science,College of Biophotonics, South China Normal University, Guangzhou 510631, China)
A simple colorimetric method for rapid lysozyme (LZ) detection using citrate-capped gold nanoparticles without any further surface modification was developed in this work. The well-dispersed gold nanoparticles in aqueous solution were induced to aggregate in the presence of LZ, which led to a visible color change from red to blue. The concentration of LZ can be determined by monitoring with bare eye or a UV-vis spectrometer. The linearity was observed between the absorbance ratio (A625/A525) and the LZ concentration in the range of 10 to 100 nmol/L. The lowest detectable concentration of LZ was 10 nmol/L. The feasibility of the developed method was evaluated by determination of LZ in egg white in combination with magnetic solid phase extraction.
colorimetric detection; gold nanoparticles; lysozyme; magnetic solid phase extraction
2016-05-20 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(21175048);广东省自然科学基金项目(2015A030311013)
O648
A
1000-5463(2016)06-0092-07
*通讯作者:贾丽,教授,Email: jiali@scnu.edu.cn.
