DNA调控的银纳米簇的合成及应用进展
2016-12-12梁国海周小明
梁国海, 周小明
(华南师范大学生物光子学研究院,激光生命科学教育部重点实验室, 广州 510631)
DNA调控的银纳米簇的合成及应用进展
梁国海, 周小明*
(华南师范大学生物光子学研究院,激光生命科学教育部重点实验室, 广州 510631)
荧光银纳米簇具有独特的物理及化学性质,凭借合成简便、荧光强度大、量子产率高、抗光漂白能力强、荧光发射波长可调及生物相容性好等优势,近年来在生物检测、成像分析等领域受到了越来越广泛的关注. 文章基于DNA调控荧光银纳米簇的合成方法研究,综述了关于DNA序列、长度、二级结构等对银纳米簇荧光性质的影响规律,并详细介绍荧光银纳米簇在分析检测和生物成像应用方面的最新进展. 相信随着荧光纳米簇材料的应用优势逐步凸显,该领域的研究将吸引更广泛的关注,并推动相关交叉学科的进展.
银纳米簇; 荧光; DNA; 检测
先进的光学纳米探针对于生物组织的光学成像、疾病的诊断和治疗具有巨大的促进作用[1-4]. 荧光纳米簇由于其独特的光电学及化学性质,近年来在生物检测和成像分析领域受到广泛关注. 荧光纳米簇(如Au、Ag和Cu)由数个至数十个原子构成,直径通常小于2 nm,由于尺寸接近电子的费米能级,能带发生分裂,并且自由电子受纳米簇的空间限制产生不连续的电子能级跃迁,通过电子转换呈现出不同于原子和纳米颗粒的光电学和化学性质[5]. 目前此类材料已发展为一类新型的荧光物质. 其中,银纳米簇(Silver Nanoclusters,AgNCs)具有易于合成、荧光量子产率高、荧光发射波长可调等优点,并已成为纳米簇领域里发展前景最好的材料之一. 与有机荧光分子相比,AgNCs兼具抗光漂白性强、生物相容性好等特点,在分析检测、生物成像、生物标记等方面被广泛研究.
目前AgNCs的合成主要采取模板辅助合成方法,用作模板的分子包括:聚合物(聚乙烯亚胺、聚乙烯吡咯烷酮、聚酰胺-胺树状分子等)、DNA、多肽和蛋白[6]. 其中,由于DNA设计灵活、合成方便,为最常用的AgNCs合成模板. 并且随着大量的合成工作的开展,人们发现DNA的长度及序列对于AgNCs的性质有显著影响,通过设计特定序列的DNA作为模板分子可合成稳定性差异明显、可发射不同波长荧光的AgNCs(图1)[7].

图1 AgNCs的形成以及合成条件对其荧光性质的影响[7]
本文主要总结不同DNA模板合成AgNCs的方法以及不同DNA模板对AgNCs发光性能影响的规律,综述了AgNCs在生物分析、成像等方面的最新进展.
1 DNA调控的银纳米簇的合成
1.1 单链DNA合成AgNCs
2004年,PETTY等[8]利用含有12个碱基的单链DNA(5’-AGGTCGCCGCCC-3’)合成了DNA-AgNCs. 研究发现Ag+倾向于优先与杂环碱基结合,而不是DNA的磷酸骨架. AgNCs结合在胞嘧啶(Cytosine,C)的N3位置,当其尺寸足够小时,DNA-AgNCs将表现出较好的荧光性质. 每条DNA链上结合的Ag+个数从1到4不等,导致其荧光波长和强度的差异. RITCHIE等[9]采用含12个胞嘧啶的DNA链(5’-CCCCCCCCCCCC-3’)为模板制备高荧光亮度的AgNCs,得到的纳米簇可在485、525以及665 nm波长处产生多个荧光发射峰,随着放置时间的延长,红色荧光(665 nm)将逐渐转变为绿色荧光(500 nm),并且此转变过程可通过加入还原剂逆转,说明之前的转变是一个氧化过程. 之后,RICHARDS等[10]为了考察C碱基位置及数量对纳米簇荧光性能的影响,选择5种不同序列的DNA为模板合成AgNCs,得到了5种不同荧光性能(波长为485~705 nm,从蓝光到近红外荧光)的DNA-AgNCs,他们通过一系列对照实验推断DNA 5’和3’端三联胞嘧啶(CCC)的存在有利于稳定DNA-AgNCs,而DNA骨架内部3个C-G碱基对和2个T-A碱基对的存在不利于C- Ag+-C的形成.
此外,人们研究了具有不同二级结构的DNA(如发夹结构,i-motify,G-四链体结构)在合成AgNCs方面的应用. GWINN课题组[11]利用具有发夹结构的C-环合成了DNA-AgNCs. 他们发现当以具有C-环或G-环的发夹型DNA合成AgNCs时,纳米簇表现出强烈的荧光;然而以包含A-环或T-环的DNA作为模板时,AgNCs在可见波长范围荧光很弱. 且当发夹环中C碱基的数量从3增加到12时,在全C-环中AgNCs能够形成,当环中包含7个C碱基时,生成的DNA-AgNCs荧光强度达到最大值,当C碱基超过7个时荧光无明显增强. 随着DNA长度增加,DNA-AgNCs的最大发射波长将不断红移. CHOI等[12]分别以发夹型DNA(5’-CGCGCCCCCCCCC-CCCCGCG-3’)和直链DNA(C12)为模板合成AgNCs,前者荧光强度比后者高9倍. 在此基础上,O’NEILL等[13]巧妙设计了发夹型DNA序列,使其可结合至DNA自组装纳米管上,从而实现AgNCs在DNA纳米管上的有序可控分布.
i-motify DNA是富含胞嘧啶,并通过C-C+形成碱基夹层的核酸结构,其结构有利于AgNCs的形成. SENGUPTA等[14]利用含有C4 i-motify的 DNA序列(TA2C4)4和(C4A2)3C4为模板合成了发射红色和绿色荧光的AgNCs,它们分别在弱酸性或弱碱性溶液中具有最强的荧光亮度. 此结果证明了DNA序列和合成条件显著影响此类纳米簇的结构和性质.
G-四链体由富含鸟嘌呤G的核苷酸构成,在一定的离子强度和酸碱环境中可形成稳定的、高度有序的四链体结构. AI等[15]通过特定的G-四链体结构序列(AS1411)合成了双发射的DNA-AgNCs,并证明了AS1411保留其自身的G-四链体结构. 正是由于这种分子间G-四链体结构高度的稳定性,发射红色荧光的DNA-AgNCs显示出了高度的热稳定性.
LI等[16]基于大量实验结果,总结出DNA的二级结构对DNA-AgNCs的结构和光学性质具有如下影响规律:(1)DNA的二级结构决定Ag+与DNA模板的结合常数,结合力的强弱顺序为:富C卷曲单链DNA >i-motif>双链DNA>G-quadruplex.(2)DNA的二级结构决定AgNCs的荧光稳定性,以结合常数最高的富C卷曲单链(40.2×105mol/L)合成AgNCs的荧光稳定性高(>300 h);而以结合常数较低的DNA(0.64×105mol/L)合成DNA-AgNCs的荧光稳定性仅为55 h.
1.2 双链DNA合成AgNCs
和单链DNA相比,双链DNA(dsDNA)具有更加刚性的结构和更加明确的构象,为设计AgNCs特定的结合位点提供了可能. 然而完全互补的dsDNA不能为AgNCs的键合提供足够的空间,加入Ag+后几乎没有荧光. 因此dsDNA缺陷是形成dsDNA-AgNCs的必要条件[7],如含有错配碱基的DNA(mismtach)、空缺位点碱基(AP)、空位位点碱基(Gap)或者凸起位点碱基(Bulge).
碱基错配是一种常见的DNA缺陷. dsDNA上碱基的错配提供了Ag+的结合位点,有利于AgNCs在双链DNA上的形成. 通过在G-C位置上引入单一错配碱基对,HUANG等[17]以dsDNA为模板合成了荧光AgNCs(图2),他们发现与错配DNA的相互作用降低了AgNCs的荧光强度,并且错配位置上包含T和A碱基的DNA链引起AgNCs荧光强度降低的幅度明显高于包含G和C碱基的DNA链.

图2 通过碱基错配位点调控AgNCs在dsDNA上的形成和结合位置[17]
Figure 2 Schematic representation of the site-specific DNA-programmed growth of fluorescent AgNCs for DNA detection[17]
在dsDNA上设计凸起的富C环,是人为控制AgNCs结合位点的有效途径. 例如,GUO等[18]构建了一段包含富C环凸起的dsDNA模板,并成功得到发射明亮黄色荧光的AgNCs,并发现纳米簇的荧光亮度对相邻DNA序列十分敏感,甚至可起到识别单碱基错配的功能(图3).
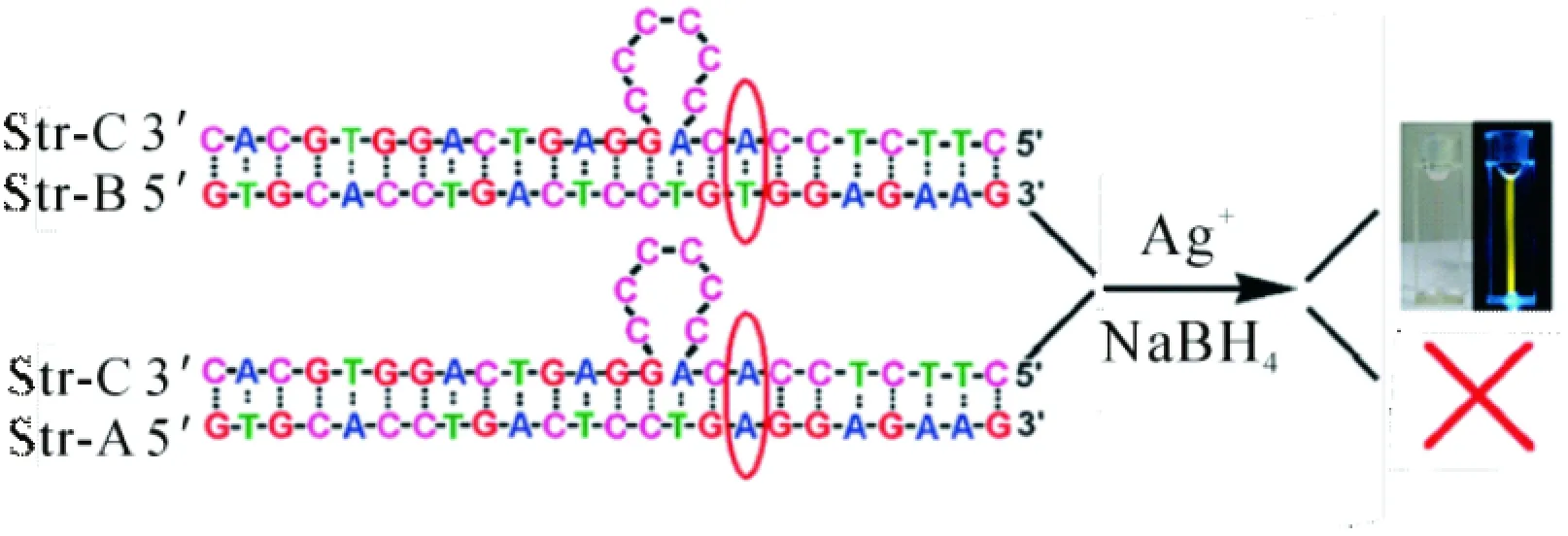
图3 以富C凸起环为模板合成AgNCs及其对相邻碱基的识别作用[18]
Figure 3 The generation of silver nanodots sometimes is sensitive to a single mutated nucleotide in a double stranded DNA[18]
另一种常见的DNA缺陷是脱嘧啶位点,这一现象在移除DNA上损伤或错误碱基的过程中,通过DNA糖基化酶自发快速发生. DNA骨架中靠近AgNCs键合位点的侧翼碱基能够引起DNA-AgNCs荧光特性的变化. 研究人员以存在脱嘧啶位点的dsDNA为模板合成了荧光AgNCs[19],如果在空缺位侧翼两端都是碱基G,那么AgNCs的荧光很强;反之如果侧翼一端或两端不是碱基G,那么观察不到DNA-AgNCs荧光发射现象. 研究表明,合成的AgNCs的尺寸与Ag+浓度无关,荧光强度强烈依赖于DNA中碱基堆积方向[20].
1.3 DNA调控AgNCs荧光特性的趋势
以DNA为模板合成得到的AgNCs具有高荧光量子产率的优势,并且通过简单改变DNA的序列及长度,可使AgNCs的荧光发射波长在可见至近红外区域调控(表1).
尽管缺少传统方法指导DNA-AgNCs的准确合成,但根据大量的实验结果,人们发现DNA-AgNCs的荧光性质受DNA模板的序列、长度和环境因素(如温度、pH、离子强度等)的影响显著,并逐渐总结出以下规律:(1)由于胞嘧啶C和Ag+的高亲和力,富C单链DNA有助于DNA-AgNCs的合成;(2)随着DNA链长度增加,DNA-AgNCs量子产率和稳定性增强,且最大荧光发射波长有红移趋势;(3)与DNA结合的AgNCs原子数影响DNA-AgNCs的荧光性质,且当Ag+数量少于6,这种影响会更明显.

表1 DNA模板序列及合成的DNA-AgNCs的荧光性质
这些由实验观察得到的趋势为新型DNA-AgNCs的设计与合成提供了参考,但如前所述,关于DNA模板的序列、长度和构型对AgNCs荧光性质的影响,目前仍缺乏更多可靠的规律,因此往往需要研究者通过大量的探索性及条件优化实验才能得到荧光强度和发光波长合适的DNA-AgNCs.
2 DNA-AgNCs在分析检测中的应用
由于DNA-AgNCs具有强烈的荧光亮度并且其荧光强度受到DNA序列、结构和环境因素显著影响的特点,近年来,DNA-AgNCs已经成为一种新型的荧光纳米探针,用于对重金属离子、有机小分子、DNA和蛋白的检测,并进一步应用于生物成像.
2.1 重金属离子的检测
通过荧光法检测重金属离子一般采用有机小分子探针,但有机荧光分子探针的设计合成过程较为复杂,容易污染环境,且对人体有害. 而DNA-AgNCs的合成过程十分简便、绿色环保、无生物毒性,因此可更好地应用于环境中重金属离子的检测,并且具有在生物体内检测金属离子的应用潜力.
重金属离子,特别是Hg2+和Cu2+,严重威胁着人类身体健康和生态环境. 例如,Hg2+与DNA有强烈的键合作用,可造成大脑和神经系统的损伤. 基于Hg2+与Ag+之间的5d10-4d10作用导致AgNCs荧光淬灭的原理[31],DNA-AgNCs可用于检测Hg2+. Hg2+的存在削弱了AgNCs与DNA模板之间的相互作用,导致纳米簇荧光淬灭,例如,VOSCH等[25]开发了一种以5’-CCCTTCCTTCCTTCCAACCAACCC-3’(DNATAr2)结合的AgNCs(DNATAr2-AgNCs)进行高灵敏、高选择性检测Hg2+的方法. DNATAr2-AgNCs的最大发射波长为607 nm,量子产率为61%,对Hg2+的检测限为0.9 nmol/L. 在2.5~50 nmol/L范围内,荧光淬灭比 (IF0-IF)/IF0与Hg2+的浓度呈现出非常好的线性关系. 此外,他们发现DNA-AgNCs的荧光可在Cu2+的存在下显著增强,据此建立了针对Cu2+的荧光“点亮”(Turn on)型检测方法,检测限为8 nmol/L,并成功对池塘水和土壤中的Cu2+实施定量检测[32]. SU等[33]则利用DNA-Cu/AgNCs和3-MPA(巯基丙酸)发展了一种间接检测Cu2+的方法,检测限为2.7 nmol/L. MPA减弱了DNA与Cu/AgNCs的结合,导致荧光淬灭. Cu2+的加入加速了MPA氧化形成二硫化物,从而使DNA-Cu/AgNCs的荧光恢复. 随着Cu2+浓度由5 nmol/L增加到200 nmol/L,荧光强度随之增加. 在其它高浓度(50 μmol/L)金属离子(Zn2+、Cd2+、Pb2+、Mg2+、Mn2+、Sr2+、Hg2+、Ni2+、Co2+、Ca2+等)的存在下,这种探针可对Cu2+选择性响应.
2.2 有机小分子的检测
有机小分子与DNA之间的特定相互作用,引起DNA构像发生变化,从而导致DNA-AgNCs荧光改变,根据此原理,人们设计了一系列可对特定小分子进行高灵敏度定量检测的方案. 例如,以5’-AACCCCTAACCCCT-3’为模板合成的DNA-AgNCs可用于检测ATP[34]. DNA-AgNCs具有非常好的荧光特性,荧光强度和发射波长与溶液pH和ATP浓度有关. 当pH为3.0和11.0时,ATP浓度对DNA-AgNCs的荧光具有显著影响. pH为3.0时,随着ATP浓度由10 μmol/L增加到50 μmol/L,发射波长从525 nm移至585 nm;pH为11.0时,随着ATP浓度增加,DNA-AgNCs在510 nm处的荧光强度增强. 基于可卡因和适配体之间强烈的作用力,ZHOU等[35]合成了DNA-AgNCs用于检测可卡因,检测限为0.1 μmol/L. 2个DNA片段与可卡因结合形成稳定的结构,使荧光AgNCs得以形成. 为了提高可卡因检测的灵敏度(2 nmol/L),研究者进一步采用了剪切酶辅助的信号放大方法[36],在可卡因存在时,剪切酶将DNA切成2个短序列,从而辅助荧光AgNCs的形成. 生物巯基化合物(Biothiols),如半胱氨酸(Cys)、高半胱氨酸(Hcy)和谷胱甘肽(GSH)对于维持细胞功能和人体生理机能具有重要意义,体内巯基化合物浓度的改变与多种疾病的发生相关[37],因此准确检测此类化合物具有显著的生物学和医学价值. HAN等[38]发现生物巯基化合物可显著淬灭DNA-AgNCs的荧光,因此以DNA-AgNCs为探针,他们成功对人血清中的生物巯基化合物进行定量检测.
2.3 核酸检测
核酸检测对于疾病诊断、致病菌识别、基因治疗等领域均有重要意义,随着AgNCs合成技术的不断提高,近年来人们提出多种基于AgNCs的核酸检测方法. YEH等[39]在2010年首先发现当发光暗淡的DNA-AgNCs与富G或富T的DNA足够接近时,其荧光将大幅提升(图4A),其中,当与富G增强序列接近时,纳米簇的荧光可提升500倍,并且荧光提升比例受纳米簇的合成模板DNA的序列及长度影响显著[40],他们称这种结合富G增强序列实现荧光响应的探针为“纳米簇信标”(NanoCluster Beacon,NCB),通过NCB他们实现了对流感病毒DNA的荧光“点亮”型检测[39].
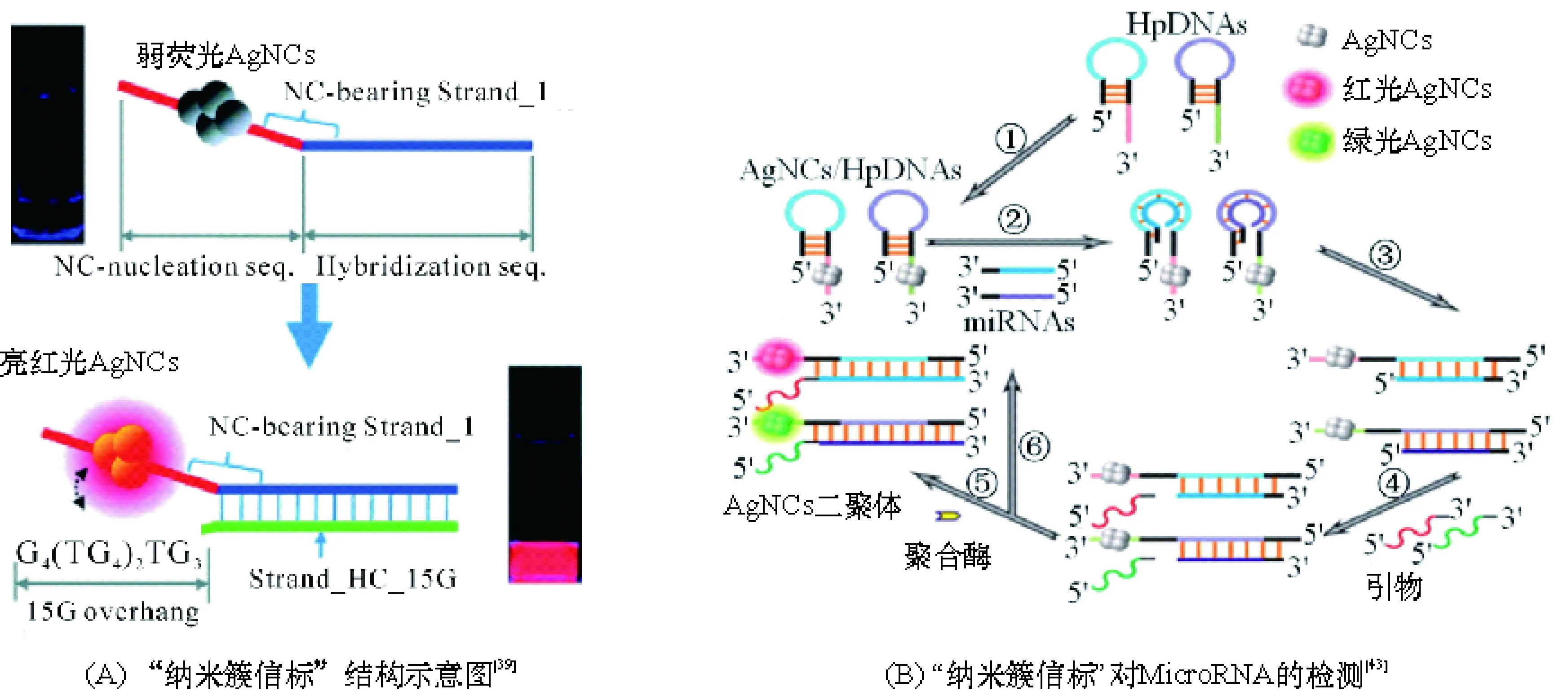
图4 “纳米簇信标”结构及其对MicroRNA的检测
之后,YEH等[41]进一步发现NCB与目标DNA的结合形式和位置甚至可影响纳米簇的荧光发射波长(最大发射波长可移动60~70 nm),据此他们通过简单观察AgNCs荧光颜色的改变实现了DNA单碱基突变的识别. ZHANG等[42]则把NCB与Exo III酶切放大技术相结合,显著提高了检测DNA的灵敏度. ZHANG等[43]首先以发夹DNA为模板合成DNA-AgNCs探针,并通过NCB探针对MicroRNA的特异性进行检测. 该发夹DNA可特异性识别并结合MicroRNA,当发夹打开时,一段富G引物DNA可与DNA-AgNCs结合,引发链置换扩增,并使DNA-AgNCs荧光大幅提高,根据荧光强度对目标MicroRNA(miR-16-3p和miR-19b-5p)定量检测(图4B).
除NCB探针外,人们通过结合有机淬灭基团或纳米材料,构建了一系列对核酸响应的DNA-AgNCs探针. 例如,ENKIN等[44]通过探针DNA分别与DNA-AgNCs和淬灭基团修饰的DNA交联,使AgNCs与淬灭基团靠近,从而使荧光淬灭;当样品中出现目标DNA时,目标DNA与探针DNA交联,使AgNCs与淬灭基团分离,荧光得以恢复. 根据上述原理,他们对Werner综合症和HIV的核酸进行了荧光“点亮”型检测(图5A). 最近,QI等[45]以抗肿瘤药物mitoxantrone(MTX)淬灭DNA-AgNCs,然后通过HIV反式激活反应区域(TAR)RNA或Rev应答因子(RRE)RNA“抢夺”MTX,使DNA-AgNCs荧光恢复,从而实现对TAR RNA和RRE RNA的定量检测. 利用氧化石墨烯(Graphene Oxide,GO)强烈淬灭DNA-AgNCs荧光的特性,TAO等[46]和LIU等[47]分别构建了GO负载DNA-AgNCs的探针,当加入目标DNA或蛋白时,DNA-AgNCs与目标结合,从而脱离GO表面,其荧光得到恢复,根据荧光强度实现对核酸或蛋白的定量检测(图5B). 该方法充分应用了DNA合成AgNCs并吸附在GO表面的性质,无需对DNA进行荧光标记,检测成本有效降低.

图5 “点亮”型DNA-AgNCs探针对核酸及蛋白质的定量检测
另外,结合信号放大技术,以DNA-AgNCs为检测探针可以构建高灵敏度的核酸检测方法. 例如,LIU等[48]采用等温循环放大技术对miRNA进行高灵敏度检测,仅在目标miRNA存在时等温循环扩增才能发生,再以扩增产物为模板合成AgNCs,以AgNCs的荧光信号作为定量检测信号,对miRNA的检测限可达10-18mol/L. YE等[49]则把滚环扩增(Rolling Circle Amplification,RCA)技术与NCB探针相结合,通过RCA产物分别与DNA-AgNCs和富G增强链配对结合,使AgNCs与富G增强链靠近,荧光亮度显著提升,此方法对DNA的检测范围为6~300 pmol/L,检测限低至0.84 pmol/L.
2.4 蛋白质检测
蛋白质在细胞分裂,信号和凋亡方面发挥着重
要作用[50-51]. 许多重要的蛋白的浓度非常低(通常是nmol/L或更低水平),这使得生物样品中蛋白的检测非常具有挑战性. 除抗体外,特定构型的适配体(小分子DNA和RNA)与蛋白之间具有特异性的键合能力[52]. 利用适配体合成的DNA-AgNCs可以实现蛋白质的高灵敏、高选择性检测[53-55]. SHARMA等[22]报道了一种利用适配体功能化的DNA-AgNCs进行凝血酶检测的方法. 加入凝血酶时,凝血酶与DNA-AgNCs模板中的核酸适配体片段DNA特异性结合,AgNCs的微环境被改变,引起荧光淬灭,该方法检测限达到1 nmol/L. 此外,研究还构建了“点亮”模式进行凝血酶荧光检测[56],该方法有效消除了背景信号的干扰,对凝血酶的检测更灵敏、选择性更好.
3 生物成像
与传统的成像方式相比,利用超小尺寸的荧光纳米簇进行成像具有很多优势,如荧光发射性质优越、良好的生物相容性、检测灵敏度高等. 这些优势使得金属纳米簇逐渐成为更有价值的生物成像和荧光探针的替代物. 目前,金属纳米簇在生物成像方面的应用已有大量研究,其中DNA-AgNCs具有合成简便以及性质可调等优点,在生物成像方面具有明显的应用价值. LI[54]以AS1411适配体为模板合成了对MCF-7细胞核特异性标记的DNA-AgNCs. AS1411通过形成G-四链体结构可与核仁素(nucleolin)高效结合,从而携带AgNCs进入MCF-7细胞(人乳腺癌细胞)(图6A). 研究发现适配体AS1411中T5片段和成核序列的存在对AgNCs的荧光发射性能具有重要作用. 此外,AS1411-AgNCs复合结构对肿瘤细胞的活力比AS1411具有更显著的抑制作用. 除AS1411外,DNA序列Sgc8c同样可用于细胞识别,通过高效结合细胞膜表面分泌物PTK7,可对CCRF-CEM细胞(人急性淋巴白血病细胞)进行特异性识别和结合. SUN[53]以CCRF-CEM肿瘤细胞的适配体Sgc8c为DNA模板合成了AgNCs. 功能化的AgNCs对CCRF-CEM细胞具有显著的靶向结合效果,进入细胞后可到达细胞核. 他们利用流式细胞仪和共聚焦荧光显微镜实现了对肿瘤细胞的检测. YIN等[57]也开展了以Sgc8c为模板合成AgNCs并对CCRF-CEM细胞进行识别的研究工作,他们系统地分析了连接富C序列(用于合成并结合AgNCs)和Sgc8c序列(靶向作用)的碱基类型和数量对纳米簇荧光亮度的影响,发现以6个腺嘌呤作为连接序列时,荧光亮度最高. 之后,他们把NCB技术引入到生物成像应用当中,设计了一段结构巧妙的DNA序列用于合成AgNCs,该DNA还包含Sgc8c序列和富G增强序列,当Sgc8c通过形成G-四链体结合至CCRF-CEM细胞表面时,DNA结构发生改变,富G增强序列与AgNCs靠近,使荧光大幅增强,从而实现对目标细胞的荧光“点亮”检测(图6B)[58].
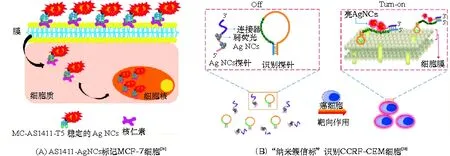
图6 DNA-AgNCs在细胞识别和标记中的应用
4 结论与展望
以DNA为模板合成的荧光AgNCs具有显著的性能优势:荧光发射波长可调(可见光-近红外)、荧光量子产率高、生物相容性好,还可通过设计DNA序列赋予AgNCs不同功能. 人们利用DNA-AgNCs成功对重金属离子、有机小分子、核酸、蛋白以及细胞等不同生物和环境样品进行分析的结果显示DNA-AgNCs在传感分析和细胞成像领域具有显著的应用潜力.
然而,根据大量的文献结果,目前仍然存在以下几方面问题阻碍着DNA-AgNCs相关材料的研究和应用:(1)合成成本较高. 以DNA为模板合成AgNCs时,一般需要DNA的浓度为mmol量级,因此合成成本高于半导体量子点、碳量子点、金纳米簇等荧光材料,不适合大量制备;(2)关于DNA序列与AgNCs荧光发射波长和亮度之间的关系还不明确;(3)DNA-AgNCs的结构还未被精确解析,因此其结构与荧光性质之间的关系也未有明确的结论;(4)在某些条件下DNA-AgNCs的稳定性较差. 如高盐浓度、高温或者在pH小于5.0或大于8.0时,结构和荧光性质容易发生显著改变,这是阻碍DNA-AgNCs在检测和生物标记方面广泛应用的最重要因素.
为了解决上述存在的问题,并进一步提升DNA-AgNCs的应用价值,需要在相关领域开展更深入的研究. 例如,基于DNA-Cu/AgNCs和DNA-Au/AgNCs具有更高荧光亮度和稳定性的实验结果,可考虑以DNA为模板构建掺杂不同金属元素的AgNCs,有望获得荧光亮度与稳定性有进一步提升的纳米簇;而在合成时引入其它与Ag+具有高亲和力的分子,使其结合至AgNCs表面,同样是提升纳米簇稳定性的有价值的研究方向. 最后,通过借鉴在核酸研究领域已取得的成果,设计巧妙的DNA序列作为模板合成AgNCs,DNA-AgNCs及相关材料有望完成更多分析检测、成像标记甚至疾病治疗的任务.
[1] ROSI N L,MIRKIN C. A nanostructures in biodiagnostics[J]. Chemical Reviews,2005,105(4):1547-1562.
[2] MICHALET X,PINAUD F F,BENTOLILA L A,et al. Quantum dots for live cells,in vivo imaging,and diagnostics[J]. Science,2005,307(5709):538-544.
[3] WANG F,LIU X. Recent advances in the chemistry of lanthanide-doped upconversion nanocrystals[J]. Chemical Society Reviews,2009,38(4):976-989.
[4] 詹求强,张欣,李心,等. 几种先进的光学纳米探针在光学生物诊疗中的应用[J]. 激光生物学报,2015,24(3):207-219.
ZHAN Q Q,ZHANG X,Li X,et al. Using some nanoparticles as optical probes for optical bioimaging[J]. Acta Laser Biology Sinica,2015,24(3):207-219.
[5] ZHENG J,ZHOU C,YU M,et al. Different sized luminescent gold nanoparticles[J]. Nanoscale,2012,4(14):4073-4083.
[6] CHOI S,DICKSON R M,YU J. Developing luminescent silver nanodots for biological applications[J]. Chemical Society Reviews,2012,41(5):1867-1891.
[7] YUAN Z,CHEN Y C,LI H W,et al. Fluorescent silver nanoclusters stabilized by DNA scaffolds[J]. Chemical Communications,2014,50(69):9800-9815.
[8] PETTY J T,ZHENG J,HUD N V,et al. DNA-templated Ag nanocluster formation[J]. Journal of the American Chemical Society,2004,126(16):5207-5212.
[9] RITCHIE C M,JOHNSEN K R,KISER J R,et al. Ag nanocluster formation using a cytosine oligonucleotide template[J]. The Journal of Physical Chemistry C,2007,111(1):175-181.
[10]RICHARDS C I,CHOI S,HSIANG J C,et al. Oligonucleotide-stabilized Ag nanocluster fluorophores[J]. Journal of the American Chemical Society,2008,130(15):5038-5039.
[11]GWINN E G,O’NEILL P R,GUERRERO A J,et al. Sequence-dependent fluorescence of DNA-hosted silver nanoclusters[J]. Advanced Materials,2008,20(2):279-283.
[12]CHOI S,YU J,PATEL S A,et al. Tailoring silver nanodots for intracellular staining[J]. Photochemical & Photobiological Sciences,2011,10(1):109-115.
[13]O’NEILL P R,YOUNG K,SCHIFFELS D,et al. Few-atom fluorescent silver clusters assemble at programmed sites on DNA nanotubes[J]. Nano Letters,2012,12(11):5464-5469.
[14]SENGUPTA B,SPRINGER K,BUCKMAN J G,et al. DNA Templates for fluorescent silver clusters and I-Motif folding[J]. The Journal of Physical Chemistry C,2009,113(45):19518-19524.
[15]AI J,GUO W,LI B,et al. DNA G-quadruplex-templated formation of the fluorescent silver nanocluster and its application to bioimaging[J]. Talanta,2012,88:450-455.
[16]LI W,LIU L,FU Y,et al. Effects of polymorphic DNA on the fluorescent properties of silver nanoclusters[J]. Photochemical & Photobiological Sciences,2013,12(10):1864-1872.
[17]HUANG Z,PU F,HU D,et al. Site-specific DNA-programmed growth of fluorescent and functional silver nanoclusters[J]. Chemistry:A European Journal,2011,17(13):3774-3780.
[18]GUO W,YUAN J,DONG Q,et al. Highly sequence-dependent formation of fluorescent silver nanoclusters in hybridized DNA duplexes for single nucleotide mutation identification[J]. Journal of the American Chemical Society,2010,132(3):932-934.
[19]KUN M,QINGHUA C,GUIYING L,et al. DNA abasic site-directed formation of fluorescent silver nanoclusters for selective nucleobase recognition[J]. Nanotechnology,2011,22(30):Art 305502,6pp.
[20]MA K,SHAO Y,CUI Q,et al. Base-stacking-determined fluorescence emission of DNA abasic site-templated silver nanoclusters[J]. Langmuir,2012,28(43):15313-15322.
[21]CHOI S,YU J,PATEL S A,et al. Tailoring silver nano-dots for intracellular staining[J]. Photochemical & Photobiological Sciences,2011,10(1):109-115.
[22]SHARMA J,YEH H C,YOO H,et al. Silver nanocluster aptamers:in situ generation of intrinsically fluorescent recognition ligands for protein detection[J]. Chemical Communications,2011,47(8):2294-2296.
[23]Zhao T T,Chen Q Y,Zeng C,et al. Multi-DNA-Ag nanoclusters:reassembly mechanism and sensing the change of HIF in cells[J]. Journal of Materials Chemistry B,2013,1(36):4678-4683.
[24]VOSCH T,ANTOKU Y,HSIANG J C,et al. Strongly emissive individual DNA-encapsulated Ag nanoclusters as single-molecule fluorophores[J]. The Proceedings of the National Academy of Sciences of the United States of America, 2007,104(31):12616-12621.
[25]LAN G Y,CHEN W Y,CHANG H T. Control of synthesis and optical properties of DNA templated silver nanoclusters by varying DNA length and sequence[J]. RSC Advances,2011,1(5):802-807.
[26]PETTY J T,FAN C,STORY S P,et al. DNA encapsulation of 10 silver atoms producing a bright,modulatable,near-infrared-emitting cluster[J]. The Journal of Physical Chemistry Letters,2010,1(17):2524-2529.
[27]PETTY J T,STORY S P,HSIANG J C,et al. DNA-templated molecular silver fluorophores[J]. The Journal of Physical Chemistry Letters,2013,4(7):1148-1155.
[28]PETTY J T,FAN C,STORY S P,et al. Optically enhanced,near-IR,silver cluster emission altered by single base changes in the DNA template[J]. Journal of Physical Chemistry B,2011,115(24):7996-8003.
[29]O’NEILL P R,VELAZQUEZ L R,DUNN D G,et al. Hairpins with poly-C loops stabilize four types of fluorescent Agn:DNA[J]. Journal of Physical Chemistry C,2009,113(11):4229-4233.
[30]SCHULTZ D,GARDNER K,OEMRAWSINGH S S R,et al. Evidence for rod-shaped DNA-stabilized silver nanocluster emitters[J]. Advanced Materials,2013,25(20):2797-2803.
[31]YUAN X,YEOW T J,ZHANG Q,et al. Highly luminescent Ag+nanoclusters for Hg2+ion detection[J]. Nanoscale,2012,4(6):1968-1971.
[32]LAN G Y,HUANG C C,CHANG H T. Silver nanoclusters as fluorescent probes for selective and sensitive detection of copper ions[J]. Chemical Communications,2010,46(8):1257-1259.
[33]SU Y T,LAN G Y,CHEN W Y,et al. Detection of copper ions through recovery of the fluorescence of DNA-templated copper/silver nanoclusters in the presence of mercaptopropionic acid.[J]. Analytical Chemistry,2010,82(20):8566-8572.
[34]LEE J D,CANG J,CHEN Y C,et al. Detection of adenosine 5′-triphosphate by fluorescence variation of oligonucleotide-templated silver nanoclusters[J]. Biosensors & Bioelectronics,2014,58:266-271.
[35]ZHOU Z,DU Y,DONG S. DNA-Ag nanoclusters as fluorescence probe for turn-on aptamer sensor of small molecules[J]. Biosensors and Bioelectronics,2011,28(1):33-37.
[36]ZHANG K,WANG K,ZHU X,et al. Label-free and ultrasensitive fluorescence detection of cocaine based on a strategy that utilizes DNA-templated silver nanoclusters and the nicking endonuclease-assisted signal amplification method[J]. Chemical Communications,2014,50(2):180-182.
[37]ZHU J,SONG X,GAO L,et al. A highly selective sensor of cysteine with tunable sensitivity and detection window based on dual-emission Ag nanoclusters[J]. Biosensors & Bioelectronics,2014,53:71-75.
[38]HAN B,WANG E. Oligonucleotide-stabilized fluorescent silver nanoclusters for sensitive detection of biothiols in biological fluids[J]. Biosensors and Bioelectronics,2011,26(5):2585-2589.
[39]YEH H C,SHARMA J,HAN J J,et al. A DNA-silver nanocluster probe that fluoresces upon hybridization[J]. Nano Letters,2010,10(8):3106-3110.
[40]OBLIOSCA J M,BABIN M C,LIU C,et al. A complementary palette of nanocluster beacons[J]. ACS Nano,2014,8(10):10150-10160.
[41]YEH H C,SHARMA J,SHIH I M,et al. A fluorescence light-up Ag nanocluster probe that discriminates single-nucleotide variants by emission color[J]. Journal of the American Chemical Society,2012,134(28):11550-11558.
[42]ZHANG L,ZHU J,ZHOU Z,et al. A new approach to light up DNA/Ag nanocluster-based beacons for bioanalysis[J]. Chemical Science,2013,4(10):4004-4010.
[43]ZHANG J,LI C,ZHI X,et al. Hairpin DNA-templated silver nanoclusters as novel beacons in strand displacement amplification for microRNA detection[J]. Analytical Chemistry,2016,88(2):1294-1302.
[44]ENKIN N,WANG F,SHARON E,et al. Multiplexed analysis of genes using nucleic acid-stabilized silver-nanocluster quantum dots[J]. ACS Nano,2014,8(11):11666-11673.
[45]QI L,HUO Y,WANG H,et al. Fluorescent DNA-protected silver nanoclusters for ligand-HIV RNA interaction assay[J]. Analytical Chemistry,2015,87(21):11078-11083.
[46]TAO Y,LIN Y,HUANG Z,et al. DNA-templated silver nanoclusters-graphene oxide nanohybrid materials:a platform for label-free and sensitive fluorescence turn-on detection of multiple nucleic acid targets[J]. Analyst,2012,137(11):2588-2592.
[47]LIU X,WANG F,AIZEN R,et al. Graphene oxide/nucleic-acid-stabilized silver nanoclusters:functional hybrid materials for optical aptamer sensing and multiplexed analysis of pathogenic DNAs[J]. Journal of the American Chemical Society,2013,135(32):11832-11839.
[48]LIU Y Q,ZHANG M,YIN B C,et al. Attomolar ultrasensitive microRNA detection by DNA-scaffolded silver-nanocluster probe based on isothermal amplification[J]. Analytical Chemistry,2012,84(12):5165-5169.
[49]YE T,CHEN J,LIU Y,et al. Periodic fluorescent silver clusters assembled by rolling circle amplification and their sensor application[J]. ACS Applied Materials & Interfaces,2014,6(18):16091-16096.
[50]HEMERT M J V,STEENSMA H Y,HEUSDEN G P H V. 14-3-3 proteins:key regulators of cell division,signalling and apoptosis[J]. Bioessays News & Reviews in Molecular Cellular & Developmental Biology,2001,23(10):936-946.
[51]CULURGIONI S,MAPELLI M. Going vertical:functional role and working principles of the protein Inscuteable in asymmetric cell divisions[J]. Cellular & Molecular Life Sciences Cmls,2013,70(21):4039-4046.
[52]ILIUK A B,HU L,TAO W A. Aptamer in bioanalytical applications[J]. Analytical Chemistry,2011,83(12):4440-4452.
[53]SUN Z,WANG Y,WEI Y,et al. Ag cluster-aptamer hybrid:specifically marking the nucleus of live cells[J]. Chemical Communications,2011,47(43):11960-11962.
[54]LI J,ZHONG X,CHENG F,et al. One-pot synthesis of aptamer-functionalized silver nanoclusters for cell-type-specific imaging[J]. Analytical Chemistry,2012,84(9):4140-4146.
[55]YIN J,HE X,WANG K,et al. One-step engineering of silver nanoclusters-aptamer assemblies as luminescent labels to target tumor cells[J]. Nanoscale,2012,4(1):110-112.
[56]LI J,ZHONG X,ZHANG H,et al. Binding-induced fluo-rescence turn-on assay using aptamer-functionalized silver nanocluster DNA probes[J]. Analytical Chemistry,2012,84(12):5170-5174.
[57]YIN J,HE X,WANG K,et al. One-step engineering of silver nanoclusters-aptamer assemblies as luminescent labels to target tumor cells[J]. Nanoscale,2012,4(1):110-112.
[58]YIN J,HE X,WANG K,et al. Label-free and turn-on aptamer strategy for cancer cells detection based on a DNA-silver nanocluster fluorescence upon recognition-induced hybridization[J]. Analytical Chemistry,2013,85(24):12011-12019.
【中文责编:成文 英文责编:李海航】
Review: Synthesis and Biological Applications of DNA-Protected Silver Nanoclusters
LIANG Guohai, ZHOU Xiaoming*
(MOE Key Laboratory of Laser Life Science, College of Biophotonics, South China Normal University, Guangzhou 510631, China)
Fluorescent silver nanoclusters are finding ever-expanding roles as probes and biolabels due to their extraordinary physical and chemical characteristics, including facile synthesis, good quantum yields, high photostability, tunable fluorescence emission, and good biocompatibility. Great efforts have been devoted to the exploration of creating DNA templated silver nanoclusters (DNA-AgNCs) in recent years. This review focuses on the recent advances in the synthesis of DNA-AgNCs, and explores the connection between the chemical/photophysical properties of DNA-AgNCs and the sequence, length, and secondary structure of DNA scaffolds. After that, some successful examples of using DNA-AgNCs in biological detection and imaging will be presented. It is expected that the rapidly growing interest in metal nanocluster-based biomedical applications will certainly not only stimulate research in this highly active field, but also inspire broader concerns across various disciplines.
fluorescent silver nanoclusters; fluorescence; DNA; biological detection
2016-05-03 《华南师范大学学报(自然科学版)》网址:http://journal.scnu.edu.cn/n
国家自然科学基金项目(21475048); 广东省自然科学杰出青年科学基金(2014A030306008);广东省特支计划(2014TQ01R559); 华南师范大学青年教师科研培育基金项目(671074)
O611.4
A
1000-5463(2016)06-0073-10
*通讯作者:周小明,特聘研究员,Email:zhouxm@scnu.edu.cn.
