抗菌脂肽提取物对鸡源大肠杆菌02抑制作用的研究
2016-12-12冯大兴
冯大兴
(辽宁省畜产品安全监察所,辽宁 沈阳 110003)
抗菌脂肽提取物对鸡源大肠杆菌02抑制作用的研究
冯大兴
(辽宁省畜产品安全监察所,辽宁沈阳110003)
为了解抗菌脂肽提取物对鸡源大肠杆菌O2是否具有抑制作用,使抗菌脂肽作为肉鸡饲养中抗生素替代品提供科学依据,本试验通过测定抗菌脂肽提取物对鸡源大肠杆菌O2生长曲线的影响,观测抗菌脂肽提取物对鸡源大肠杆菌O2细胞膜通透性的影响、对鸡源大肠杆菌O2显微特征的影响以及对鸡源大肠杆菌O2新陈代谢的影响等方法研究抗菌脂肽提取物是否对鸡源大肠杆菌O2具有抑制作用。结果表明,抗菌脂肽提取物对鸡源大肠杆菌O2具有抑制作用,作用机理可能与其对菌体细胞膜及细胞壁结构的破坏性有关。
抗菌脂肽;鸡源大肠杆菌;抑制;细胞膜
中国是世界上最大的肉鸡生产国,具有庞大的消费市场,近年来,随着肉鸡生产的集约化以及规模化程度不断提高,大量的抗生素被用作抗菌促生长剂广泛添加在肉鸡饲料中,此为导致肉鸡肠道菌群破坏和体内药物残留以及耐药性菌株产生的主要原因。所以,寻找适用于饲料工业生产的安全环保、促生长且无残留的新型的添加剂势在必行。对于抗菌脂肽的研究主要集中于抗菌脂肽抗菌抑菌和作为药物添加剂在畜禽病防治当中的作用,在家禽养殖中的应用,尤其是对肉鸡生产性能和免疫机能作用效果方面的研究较少。枯草芽孢杆菌可以产生抗菌脂肽,其抗菌脂肽分子量小、脂溶性强且抗菌谱广,对很多种病毒和细菌以及某些寄生虫病均有很好的抑制作用[1-3]。
鸡源大肠杆菌是我国家禽养殖过程中主要病原菌之一,本试验通过测定添加抗菌脂肽提取物对鸡源大肠杆菌O2生长曲线的影响、观测抗菌脂肽提取物对鸡源大肠杆菌O2细胞膜通透性的影响等方法来研究抗菌脂肽提取物对鸡源大肠杆菌O2的抑制作用,为抗菌脂肽作为抗生素替代品在肉鸡饲料中的应用提供科学依据。
1 材料与方法
1.1材料
1.1.1菌株试验菌株:枯草芽孢杆菌S2,由中国微生物菌株保藏中心提供;指示菌株:鸡源大肠杆菌O2。
1.1.2培养基LB培养基(用于种子培养)、Landy培养基(发酵用)、营养琼脂培养基、营养肉汤培养基、LB固体培养基。
1.2方法
1.2.1种子菌液培养将保存的枯草芽孢杆菌S2菌株转接至LB平板上,32℃培养20 h;用接种环取活化的单菌落,接种于装有50 mL LB培养液的250 mL三角瓶中,32℃,180 r/min条件下培养20 h,4℃冰箱保存、备用。
1.2.2发酵液的制备将鸡源大肠杆菌O2转种至LB平板上,37℃培养20 h;用接种环取活化的单菌落,接种于装有50 mL LB培养液的250 mL三角瓶中,37℃,180 r/min条件下培养20 h,并通过平板计数方式确定每毫升培养液中鸡源大肠杆菌O2菌数,4℃冰箱保存备用。
1.2.3枯草芽孢杆菌S2菌株脂肽的制备取枯草芽孢杆菌S2菌株接种到装有500 mL Landy培养液的3 000 mL三角瓶中,接种量为5%,32℃,180 r/ min条件下培养30 h;取发酵30 h后的S2发酵液,10 000 r/min离心,弃去菌体,加入3%的大孔吸附树脂XAD-16,室温置于摇床震荡,120 r/min,24 h。吸附后的树脂用蒸馏水清洗至树脂表面无抗菌脂肽发酵液残留,然后置于200 mL具塞三角瓶中,加入60 mL无水乙醇,室温下,置于摇床(120 r/min)振荡洗脱24 h,然后减压干燥,即为抗菌脂肽粗提物。
1.2.4抑菌质量浓度最小值(M IC)测定采用倍比稀释法进行测定。用LB液体培养基将抗菌脂肽粗提物倍比稀释,分成8个梯度。取培养液的时期很关键,应当在鸡源大肠杆菌O2对数生长期。将其菌体浓度稀释,数值应为106CFU/mL,依次添加在不同质量浓度的抗菌脂肽LB液体培养基中,在37℃,转数为150 r/min条件下培养,20 h后观察鸡源大肠杆菌的培育状况,以鸡源大肠杆菌O2不能培育为标准,它在最小稀释浓度情况下,抗菌脂肽质量浓度即抗菌脂肽粗提物MIC(最小抑菌浓度)。
1.2.5抗菌脂肽对鸡源大肠杆菌O2生长曲线影响测定取活化状态的鸡源大肠杆菌O2液体菌种,按5%接种量接种于LB培养基中,试验共5组,培养液体积均为100 mL,在37℃,转数为180 r/min条件下培养,在不同的培养时间,分别取样和加入不同浓度的抗菌脂肽,测定OD600nm值,绘制生长曲线。分组见表1。
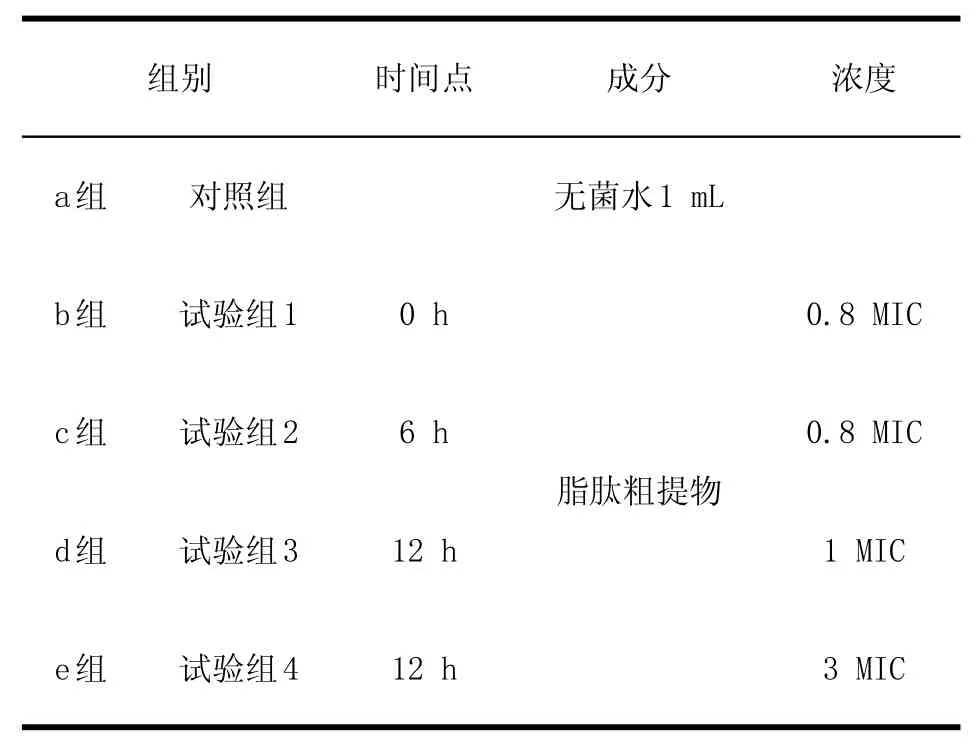
表1 脂肽对鸡源大肠杆菌生长曲线影响分组Table1 The effects of antim icrobial peptides in Fow l Escherichia coli grow th curve treatm ents
1.2.6抗菌脂肽对鸡源大肠杆菌O2细胞膜通透性的影响观测将鸡源大肠杆菌O2培养到对数生长期,可以使用LB液体培养基,用离心的方法收集菌体,转速为5 000 r/min,时间为10 min,然后用灭菌生理盐水洗涤3次,最后用生理盐水稀释,将菌体浓度调节到107CFU/mL。将菌悬液稀释,再加入抗菌脂肽,终浓度达到1 MIC。在37℃,100 r/min的振荡器中培养,依次在0、15、30、45、60、75、90、105和120 min取出菌悬液5 mL。用纤维素酯微孔膜过滤,其规格为0.22μm,然后用紫外分光光度计在260 nm处测定其吸光值,绘制吸光度变化曲线图。
1.2.7抗菌脂肽对鸡源大肠杆菌O2显微特征影响的观测培养鸡源大肠杆菌O2种子液,在对数生长期时,按5%接种量接种至LB培养基中,试验共3组,培养液体积均为100 mL,分为2个处理组和1个对照组,分别添加脂肽粗提物和水,处理方式见表2。37℃150 r/min条件下培养,在培养3 h及4 h后分别取样,按照以下说明的操作方法,制备扫描及透射电镜标本。
1.2.7.1制备扫描电镜标本将处理组1和处理组2与对照组培养的鸡源大肠杆菌O2菌液用戊二醛(2.5%)固定2 h后涂片,pH 7.2的磷酸盐缓冲液洗涤3次,待其自然风干,将标本保存在高真空蒸发器中,喷金镀膜,置扫描电子显微镜下观察,拍照。
1.2.7.2制备透射电镜标本分别对3组培养的鸡源大肠杆菌O2菌液用戊二醛(2.5%)固定2 h后离心取菌体,pH 7.2的磷酸盐缓冲液重复洗涤3次。然后用29%、51%、76%、94%乙醇顺序脱水1次,时间为10 min,再用无水乙醇脱水2次,时间为10 min,进行包埋,59℃聚合50 h,使用超薄切片机切片,切片放在无载膜铜网上(400目),用醋酸双氧铀染29 min,再用柠檬酸铅进行复染29 min,用蒸馏水冲洗,38℃烘干,在透射电子显微镜下观察和拍照。1.2.8抗菌脂肽对鸡源大肠杆菌代谢活力影响确定试验条件:确定甲瓒(INT)的最大吸收波长、氯化碘硝基四唑紫(INT)的最佳反应浓度以及最佳反应时间;将鸡源大肠杆菌培养至对数生长期,在转速为4 999 r/min,时间为10 min的条件下离心收集菌体。反复3次洗涤,使用的是灭菌生理盐水洗涤,然后用无菌生理盐水稀释,调整菌体浓度到108CFU/mL,分装于6~7个无菌试管中,依次加入抗菌脂肽,并使其终浓度达到0.125、0.25、0.5、0.75、1.0、1.25 mg/mL,在温度为38℃恒温培养60 min,10 000 r/min离心5 min,收集菌体,再用灭菌生理盐水反复洗涤3次,用生理盐水将细菌浓度调节到108CFU/mL,添加终浓度为1 mmol/L的氯化碘硝基四唑紫(INT),并于37℃下作用55 min,然后测定630 nm处吸光值,判断不同浓度抗菌脂肽对鸡源大肠杆菌在不同时间孵育下菌体细菌代谢活力的影响。
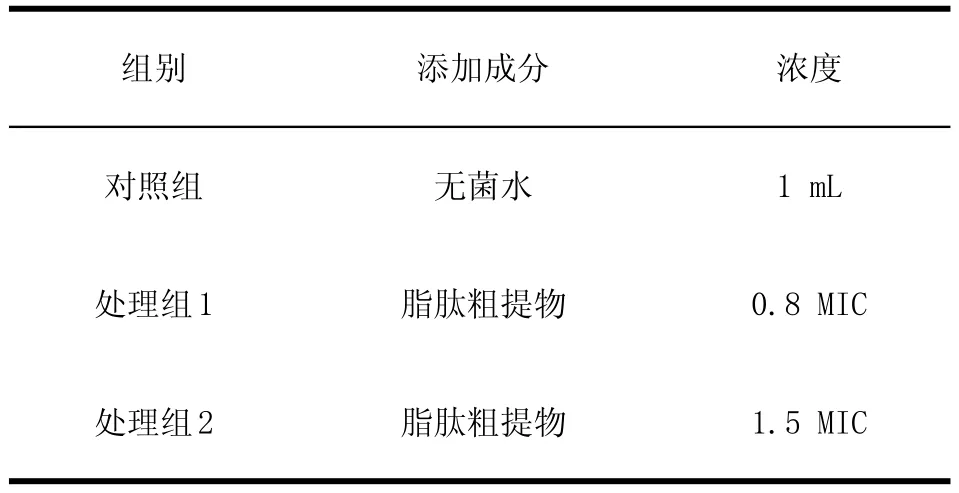
表2 抗菌脂肽对鸡源大肠杆菌O2的分组处理Table2 The effects of antim icrobial peptides in Fowl Escherichia coli O2treatments
2 结果与分析
2.1MIC测定结果通过倍比稀释法,观察抗菌脂肽粗提物对鸡源大肠杆菌O2的抑制效果(表3),结果显示,其MIC(最小抑制浓度)为0.5 mg/mL。
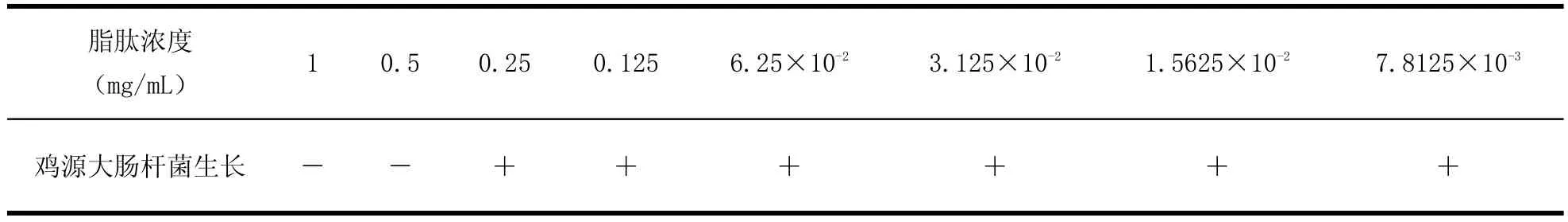
表3 抗菌脂肽对鸡源大肠杆菌的最小抑制浓度Table3 The effect of antim icrobia l peptides on Fow l Escherichia coli M IC
2.2抗菌脂肽对鸡源大肠杆菌O2生长曲线影响观察S2菌株产生的抗菌脂肽化合物粗提物对鸡源大肠杆菌生长曲线的影响(图1),结果显示,在细菌培养0 h及6 h时分别加入0.8 MIC抗菌脂肽,对鸡源大肠杆菌O2的生长有抑制作用;6 h后,鸡源大肠杆菌O2处于培育的高峰期,而且细菌浓度很高,加入抗菌脂肽,抗菌脂肽的抑制作用就会大大降低。在对数期末(12 h)加入抗菌脂肽,OD540nm不会持续变小。另外,伴随添加的脂肽浓度由1.0 MIC增加到3.0 MIC时,OD540nm减小幅度增大;当菌体浓度较大时,抗菌脂肽的溶菌作用随其浓度的增加而增强。说明抗菌脂肽化合物对鸡源大肠杆菌O2具有明显的抑菌效果,其效果存在浓度依赖效应。
2.3抗菌脂肽对鸡源大肠杆菌O2菌体细胞膜通透性的影响通过对添加了抗菌脂肽化合物的鸡源大肠杆菌O2培养上清液260 nm处紫外吸收值结果观察(图2),得知随着抗菌脂肽粗提物作用时间不断延长,在260 nm处菌体悬液的吸光值逐渐升高;也就是说,菌体细胞浆内大分子物质能够透过细胞膜泄漏到菌悬液中,导致培养上清液260 nm处紫外吸收值增大。说明抗菌脂肽化合物可以导致鸡源大肠杆菌O2菌体细胞膜通透性增大。
2.4抗菌脂肽对鸡源大肠杆菌O2显微特征的影响通过扫描电镜照片观察(图3),结果显示,对照组鸡源大肠杆菌菌体表面光滑、菌体边缘整齐、轮廓清晰,呈均匀典型完整的短杆状(图a);而低浓度脂肽处理组菌体表面粗糙、凹凸不平,边缘不整齐,有的菌体细胞有一个小孔洞出现(图b);高浓度脂肽处理组菌体表面破损严重、轮廓模糊,菌体出现断裂、残缺,异常菌体形态增多(图c、d)。说明抗菌脂肽能够导致鸡源大肠杆菌O2的正常形态细胞壁、细胞膜结构发生异常改变,对正常菌体结构产生破坏,导致胞浆内大分子物质外泄而产生溶菌作用。
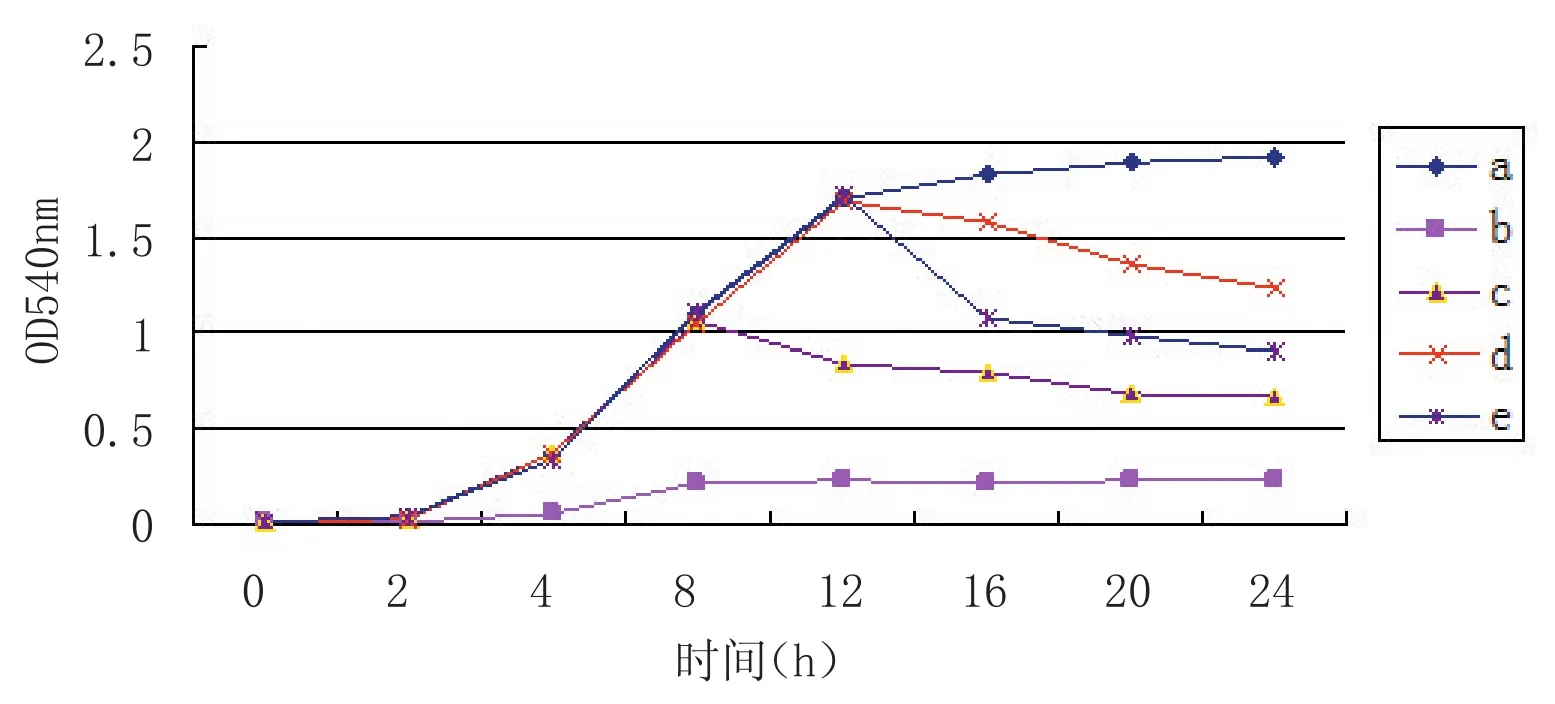
图1 抗菌脂肽粗提物对鸡源大肠杆菌O2生长曲线的影响Fig.1 The effects of antim icrobial peptides in Fow l Escherichia coli grow th curve
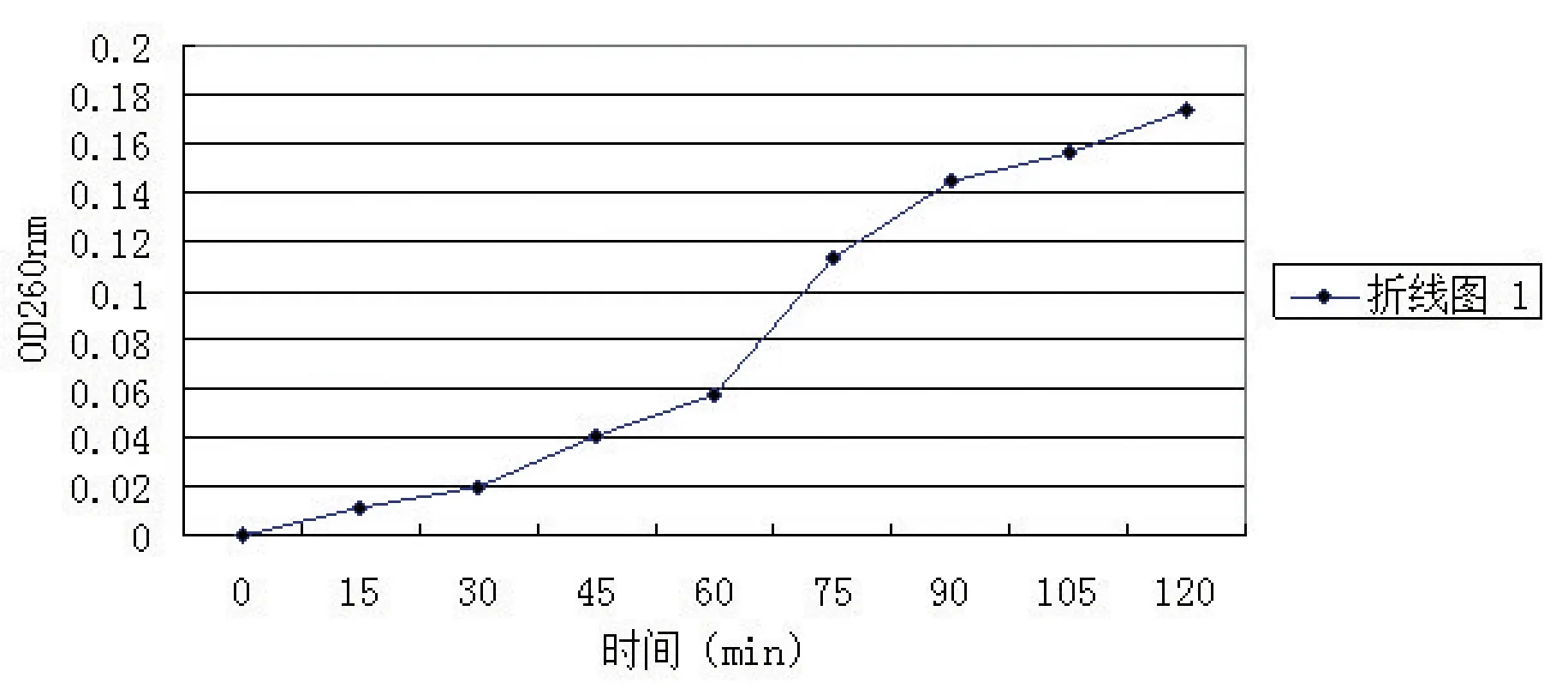
图2 添加抗菌脂肽粗提物的鸡源大肠杆菌培养物上清液260 nm的吸光值Fig.2 260 nm absorbance values on antim icrobial peptides crude extractings of 260nm ow l Escherichia coli culture supernatant
通过透射电镜照片观察(图4),可以看出,对照组菌体边缘清晰、平整、密度高、透射度低,无缺陷和断裂现象(图a)。而试验组则可以明显的看到菌体表面密度不匀、粗糙不平,菌体边缘整齐度差、密度低、透射度高(图b、c、d、e、f),有的细胞已经有一个小孔洞,胞壁缺陷、菌体残缺不全。这些结果进一步说明脂肽化合物能够导致鸡源大肠杆菌细胞壁破裂或者孔洞形成,导致内容物泄漏,细胞代谢无法正常进行,最终导致细菌细胞的死亡。
2.5抗菌脂肽对鸡源大肠杆菌O2新陈代谢的影响根据某种脱氢酶对鸡源大肠杆菌O2的活细胞作用,并能够生成一种活化的[H]+,而次活化的[H]+能够将INT(氯化碘硝基四唑紫)中的四唑还原,形成一种甲瓒的物质,利用这种甲瓒生成的速率来推测和判断菌体细胞的代谢活力。产生[H]+(氢离子)增多说明菌体细胞活力越强,还原产生的甲瓒物质越多,颜色越红;反之,产生[H]+(氢离子)越少说明菌体细胞活力越弱、还原产生的甲赞物质越少,颜色越浅,则OD630nm值越小。
确定甲瓒物质的最大吸收波长为630 nm(图5),确定INT(氯化碘硝基四唑紫)最佳浓度为l mm,最佳反应时间为55 min(图6)。
鸡源大肠杆菌O2菌体细胞代谢活力的观察结果(图7)显示,随着抗菌脂肽化合物质量浓度的增加,其对鸡源大肠杆菌O2菌体细胞代谢活力的抑制作用逐渐增强;当抗菌脂肽质量浓度达到0.5 MIC以上时,其对鸡源大肠杆菌O2菌体细胞代谢活力的抑制作用非常显著。说明随着抗菌脂肽化合物作用于鸡源大肠杆菌O2菌体细胞,造成了细胞膜通透性增大,细胞内部一些大分子物质发生了泄漏,使菌体细胞代谢受阻,活力下降。

图3 鸡源大肠杆菌O2扫描电镜照片Fig.3 The scanning electron m icroscope of Fow l Escherichia co li O2
3 讨论
根据前期试验数据显示,枯草芽孢杆菌S2菌株在24 h和48 h的发酵的代谢产物对细菌(G+、G-)抑菌圈差异明显,而且24 h时的抑菌效果明显好于48 h;又根据本次试验结束,30 h之前产生的抗菌脂肽化合物主要是以sur factins(表面活性素类),这与报道的sur factins(表面活性素类)脂肽具有较好的抗菌效果相吻合,表明S2菌株产生的抗菌脂肽在不同发酵阶段存在类型、浓度上的差异,或者与发酵培养基成分有直接关系。因此,关于S2菌株的进一步优化、发酵工艺筛选、稳定性及抗菌效果的提升改造等的研究,对工业化生产及在畜牧上的应用具有重要的现实意义。
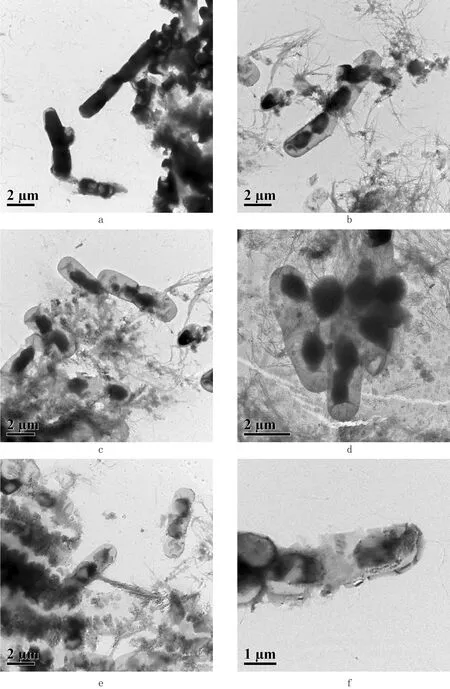
图4 鸡源大肠杆菌O2透射电镜照片Fig.4 The transm ission electron m icroscope of Fow l Escherichia coli O2
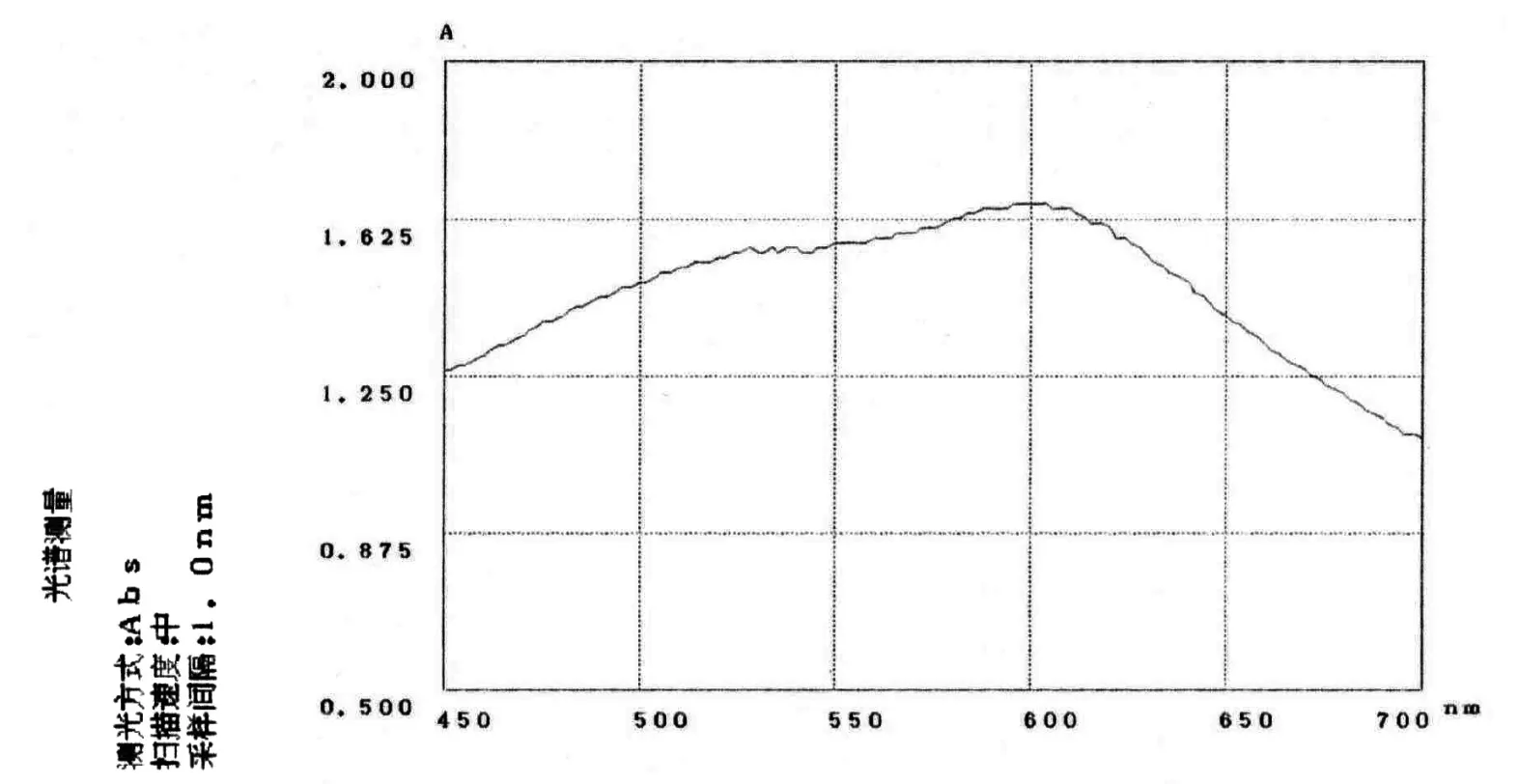
图5 甲瓒的全波长扫描图Fig.5 The full wavelength scanning of INT
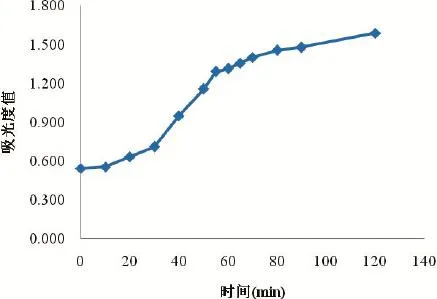
图6 INT(氯化碘硝基四唑紫)最佳反应时间Fig.6 The optimal reaction time of INT
本试验初步探讨了抗菌脂肽粗提物对鸡源大肠杆菌O2的抑制机理,在确定抗菌脂肽对鸡源大肠杆菌O2的MIC的基础上,通过抗菌脂肽对鸡源大肠杆菌O2的生长曲线、菌体细胞膜通透性、菌体显微结构、菌体细胞代谢活力等诸多方面干扰的试验证实鸡源大肠杆菌对抗菌脂肽有很强的敏感性,抑菌浓度最小值为0.5μg/mL。抑制细菌生长是抗菌物质对细菌的作用之一,还有一方面就是杀灭细菌。杀菌作用方式又能分为2种,一种是杀菌不能溶菌,另一种就是杀菌且能溶菌[4]。抑制细菌的的生长曲线也分为2种,抑菌和杀菌但不能溶菌的抗菌物质可以使细菌停止生长,生长曲线变为停止生长曲线,但也不会下滑,维持在一个恒定的浑浊度;而杀菌且能溶菌的抗菌物质能造成菌体悬液浑浊度下降,生长曲线下滑,抗菌脂肽属于既能杀菌且能溶菌的抗菌物质。
根据“桶板模型理论”,抗菌肽或抗菌脂肽插入质膜内并垂直于细孢膜方向,在细胞膜上相木桶样排列,其疏水侧链朝向外部的脂质环境,极性侧链面向内构成跨膜孔道,这些孔道足以使胞质大分子物质外漏而导致细胞死亡。通过抗菌脂肽对鸡源大肠杆菌O2菌体细胞结构的作用效果说明,在该抗菌脂肽的作用下,增大了鸡源大肠杆菌菌体细胞膜通透性,很多离子、大分子蛋白质从细胞内丢失,这种现象表明其抗菌作用是使其在菌体细胞膜上表面引起膜电荷改变,造成膜结构紊乱,形成孔道造成细胞内物质泄漏,使细菌的渗透压失衡,最终使细胞死亡[5-6]。
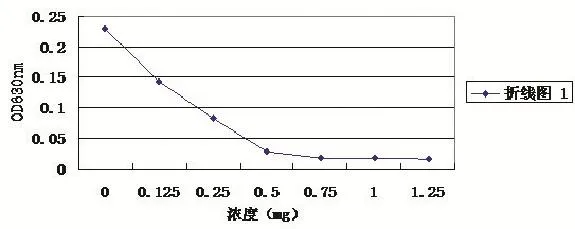
图7 不同浓度的抗菌脂肽对鸡源大肠杆菌O2代谢活力的影响Fig.7 The e ffects o f different concentrations antim icrobia l peptides on Fow l Escherichia co lim etabo lic activity
扫描、透射电镜显微的结构照片显示表明,这种抗菌脂肽能够使鸡源大肠杆菌O2细胞壁破裂、细胞膜通透性增加,主要表现为细胞膜形成孔洞导致细胞内一些物质泄漏,从而使细胞的正常代谢无法进行,使细胞生长受到抑制;严重的出现菌体断裂,进而导致死亡,起到了抑菌、杀菌和溶菌效果[7]。这一试验结果为如何更好的利用该脂肽、提高其杀菌效果提供了研究基础和理论依据。
相关研究表明[8],某些脂肽抑制部分蛋白质的合成、可与细菌染色体DNA相互作用导致DNA正常结构的改变,可能会进一步导致DNA的复制、转录、表达功能受抑制。而S2脂肽能否抑制部分菌体蛋白质的合成、能否进入到鸡源大肠杆菌细胞核内与细菌染色体DNA发生相互作用还有待进一步研究,从而全面评价脂肽对鸡源大肠杆菌的抑杀作用。
[1]刘向阳,杨世忠,牟伯中.微生物脂肽的结构[J].生物技术通报,2005(4):18-27.
[2]陈萍,冯芬,杨恬,等.脂肽类抗生素及其作用机制[J].微生物学杂志,2015,35(5):89-93.
[3]冯大兴.抗菌脂肽分离纯化的研究[J].现代畜牧兽医,2015(11):9-14.
[4]Yoshida S.,Hl radate S.,TsulamotoT.,et al. Antimicrobial activity of cul ture fi l t rate of Bacil lus amylol iquefaciens RC-2 isolated f rom mulber ry leaves[J].phytoathology,2001,91:181-187.
[5]Yu G Y.,Sinclair J.,Har tman G,et al.Production of iturin A by Bacil lus amylol ique faciens suppressing Rhizoctonia solani[J].Soi l Biol Biochem,2002,34:955-963.
[6]Chae G P.,Makoto S.,Hiroshi K.Suppressive ef fect of Bacil lus subti l is and its productson phytopathogenic microorganisms[J].J Ferment Bioeng,1990,69:l-7.
[7]丁立孝.脂肽生物表面活性剂的发酵生产及其结构性质研究[D].杭州:浙江大学博士学位论文,2004.
[8]Koumoutsi A.,Chen X.,Henne A.,et al.St ructural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cycl ic l ipopeptides in Baci l lus amylol iquefaciens strain FZB42[J].J Bacteriol, 2004,186:1084-1096.
Research on the inhibition effects ofantim icrobial lipopeptide extracton Fow lescherichia coliO2
Feng Daxing
(Animal product safety monitoring Institute ofLiaoning Pravince,LiaoningShenyang110003)
In order to understand the inhibition ef fects of antimicrobial l ipopeptide ext ract on Fowl escherichia col i,which could provide a scienti fic basis as antibiotics al ternatives in broi ler,In this experiment,we added the antibacterial l ipopeptide extractive to measure the growth curve,the cel l membrane permeabi l ity the microscopic characteristics and the metabl ism of the Fowl escherichia col i.The resul ts showed that the antimicrobial l ipopeptide ext racts inhibits the Fowl escherichia col i which may be related to the cel l membrane and cel l wal l structural integrity of bacteria.
Antimicrobial peptides;Fowl Escherichia col i;Inhibition;Cel l membrane
S859.79
B
1672-9692(2016)02-0041-08
2016-01-03
冯大兴(1985-)男,硕士,畜牧师,研究方向为兽药、饲料、畜产品质量安全。
